На что делятся атомы
Основы строения атома. Просто о сложном
Все в мире состоит из атомов. Но откуда они взялись, и из чего состоят сами? Сегодня отвечаем на эти простые и фундаментальные вопросы. Ведь многие люди, живущие на планете, говорят, что не понимают строения атомов, из которых сами и состоят.
Естественно, уважаемый читатель понимает, что в данной статье мы стараемся изложить все на максимально простом и интересном уровне, поэтому не «грузим» научными терминами. Тем, кто хочет изучить вопрос на более профессиональном уровне, советуем читать специализированную литературу. Тем не менее, сведения данной статьи могут сослужить хорошую службу в учебе и просто сделать Вас более эрудированными.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, которая является носителем его свойств. Иными словами, это мельчайшая частица того или иного вещества, которая может вступать в химические реакции.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
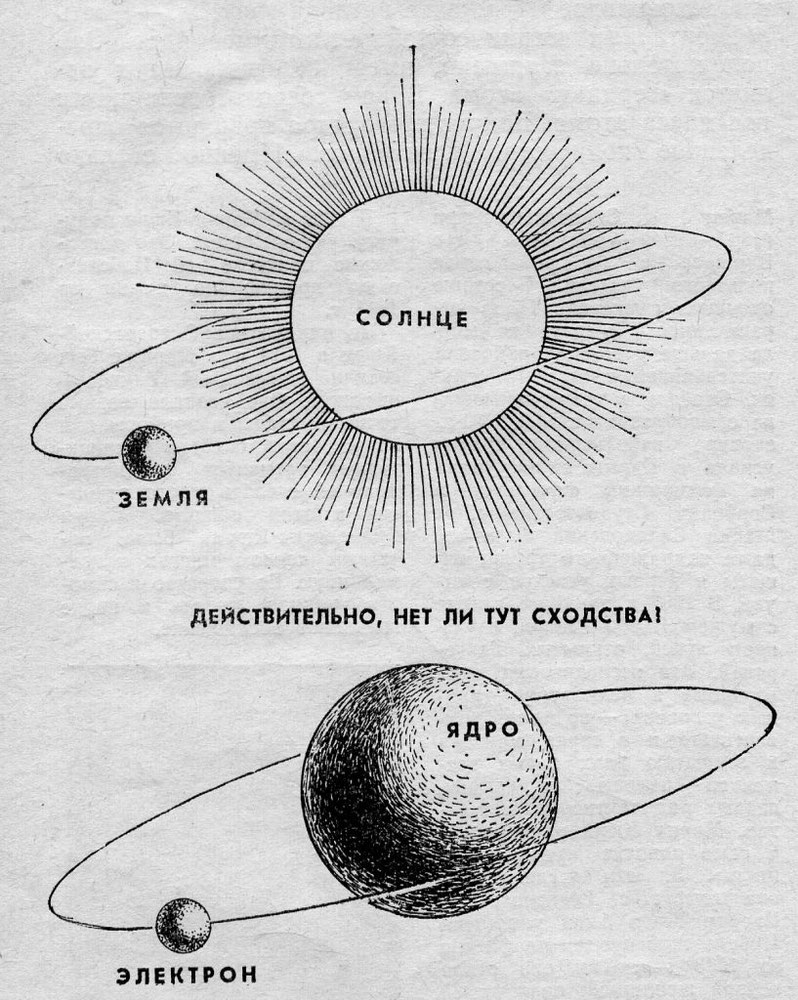
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
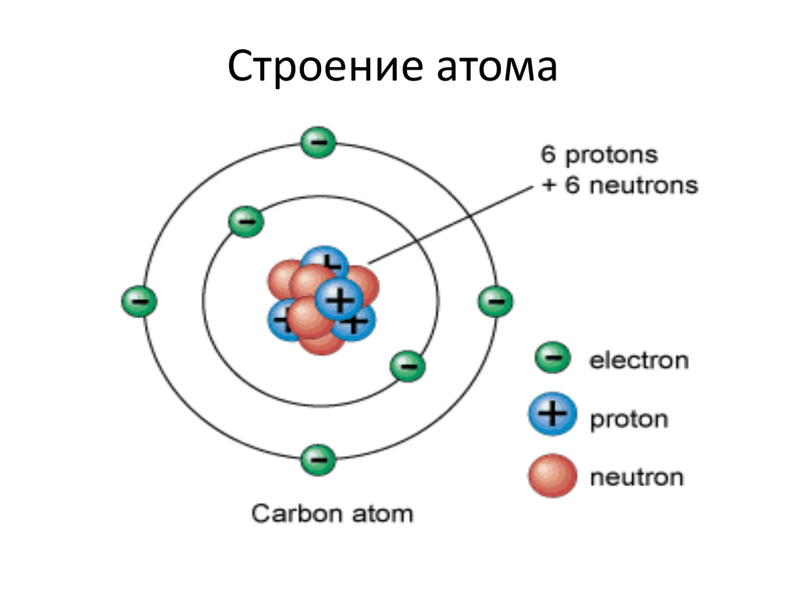
Ниже приведем элементарную схему строения атома углерода.
Схема строения атома
Свойства атомов
Масса
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие «моль». 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Размер
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?
Если предсавить атом в виде стадиона, ядро будет размером с вишню в центре поля
Откуда взялись атомы?
В самом начале формирования Вселенной никаких атомов не было и подавно, существовали лишь элементарные частицы, под воздействием огромных температур взаимодействующие между собой. Как сказал бы поэт, это был настоящий апофеоз частиц. В первые три минуты существования Вселенной, из-за понижения температуры и совпадения еще целой кучи факторов, запустился процесс первичного нуклеосинтеза, когда из элементарных частиц появились первые элементы: водород, гелий, литий и дейтерий (тяжелый водород). Именно из этих элементов образовались первые звезды, в недрах которых проходили термоядерные реакции, в результате которых водород и гелий «сгорали», образуя более тяжелые элементы. Если звезда была достаточно большой, то свою жизнь она заканчивала так называемым взрывом «сверхновой», в результате которого атомы выбрасывались в окружающее пространство. Так и получилась вся таблица Менделеева.
Так что, можно сказать, что все атомы, из которых мы состоим, когда-то были частью древних звезд.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Именно благодаря сильному взаимодействию, которое проявляется в масштабах атомных ядер и отвечает за притяжение между нуклонами, атом и является таким «крепким орешком».
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.
Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь. Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства.
Атомы: строительные блоки молекул
Если молекулы – основные структуры, задействованные в химии – это слова, из которых состоят все окружающие нас материалы, тогда атомы – это буквы, строительные блоки молекул. Слова бывают разной длины, и типичная молекула тоже может содержать несколько атомов, или несколько сотен, или даже сто тысяч атомов. Молекула столовой соли NaCl состоит из двух атомов, натрия Na и хлора Cl. Молекула воды H2O содержит два атома водорода и один кислорода. Молекула столового сахара C12H22O11 содержит 12 атомов углерода, 11 кислорода и 22 водорода, организованных определённым образом.
Откуда нам известно о существовании атомов? Иногда их можно «видеть», так же, как мы видим молекулы, которые они могут формировать. Не глазами, но более продвинутыми устройствами. Один из методов использует сканирующий туннельный микроскоп, способный показывать атомы в кристалле или даже передвигать их по одному. Другой метод использует нашу возможность захвата ионов (немного изменённых атомов – подробности ниже).
На фото – три иона, пойманных одновременно. На них падает свет, они поглощают его и снова испускают. Повторно испущенный свет можно обнаружить, благодаря чему мы можем увидеть, где находятся ионы – примерно так отражение света от небольшого, но яркого бриллианта может помочь нам найти его.
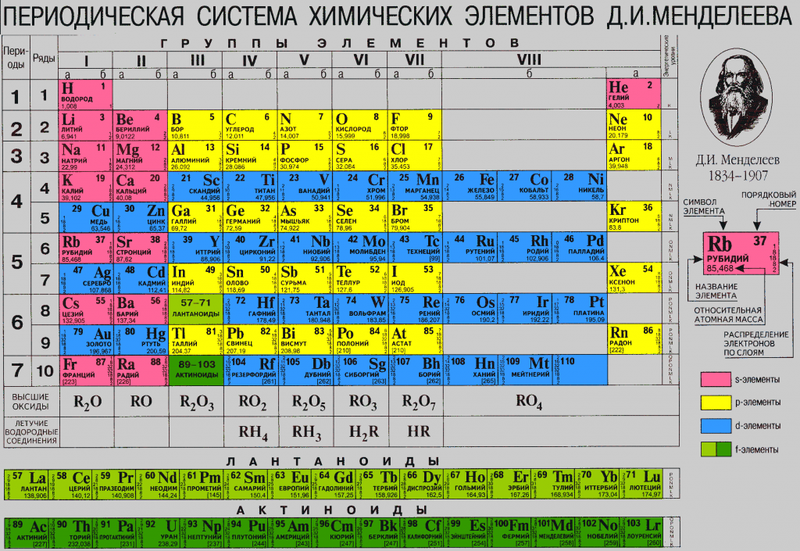
Сколько же типов атомов существует? Типы называются «химическими элементами» и точное их количество зависит от того, как их считать. Но допустим, что атомный алфавит состоит из примерно сотни химических элементов, а к тонкостям подсчёта вернёмся позже. Так же, как мы могли назначить буквам алфавита от А до Я номера от 1 до 33, каждому элементу назначается не только имя, но и атомный номер (обозначается «Z»). Самые простые атомы – у водорода, их атомный номер = 1. Самые сложные в изобилии встречаются в природе, это уран с атомным номером 92. Другие – кислород (8), азот (7), кальций (20), криптон (36), лантан (57), платина (78). Полный список ищите в периодической системе элементов Менделеева. У каждого элемента своя химия – то, как он ведёт себя внутри молекул – примерно так, как у каждой буквы есть свои правила, по которым она может встречаться в словах.
Вопросы, которые можно задать об атомах:
1. Из чего состоят атомы?
2. В чём смысл атомного номера?
3. Каков главный источник различий в химическом поведении атомов разных элементов?
4. До какой степени разные атомы одного элемента схожи между собой?
5. Как части атома удерживаются вместе?
6. Почему атомы удерживаются вместе и образуют молекулы?
Оказывается, на все эти вопросы лучше всего отвечать, начав с первого: из чего состоят атомы? Атомы состоят из того, что обычно называют «субатомными частицами» (к сожалению, этот термин некорректен, поскольку у этих «частиц» есть некоторые свойства, частицам не присущие). Конкретнее, атомы состоят из набора небольших и очень лёгких электронов, окружающих крохотное, но тяжёлое атомное ядро, в котором содержится большая часть массы атома. Ядро состоит из других «частиц», в свою очередь также состоящих из других «частиц», и мы до них ещё доберёмся.
Рисованный атом
Частенько мы видим изображения атомов, нарисованные на книгах по химии, на рекламках и предупреждающих знаках. Пример – рис. 1. Он передаёт очень грубую идею того, как устроен атом: снаружи у него есть определённое количество электронов (синие), и они вращаются вокруг центрального атомного ядра. Ядро – это скопление протонов (красные) и нейтронов (белые).
Теперь мы можем ответить на 2-й вопрос: что означает атомное число Z? Это просто количество протонов в ядре. У кислорода атомный номер 8, и у него в ядре 8 протонов.
В простейших условиях атомное число также равняется количеству электронов атома. С количеством нейтронов всё сложнее, мы вернёмся к этому позже. У электронов отрицательный электрический заряд (-е), а у протонов – положительный (+е). Нейтроны нейтральны, электрического заряда у них нет. Когда количество электронов и протонов совпадает, их заряды взаимно уничтожаются, и у атома электрического заряда не наблюдается – такой атом нейтрален.
Но нет ничего необычного – к примеру, в процессе формирования молекул – если атом приобретёт или потеряет один или несколько внешних, валентных электронов. В этом случае электрические заряды электронов и протонов не уничтожаются, и получившийся заряженный атом называют ионом.
Более реалистичный атом
Хотя рис. 1 примерно описывает архитектуру атома – электроны действительно находятся снаружи, а ядро, состоящее из протонов и нейтронов, в середине – он совершенно не передаёт реальную форму и суть атома, поскольку он выполнен не в масштабе, а мы живём в квантовом мире, в котором объекты ведут себя так, что их сложно нарисовать или представить.
С проблемой масштаба можно разобраться, нарисовав более точное (хотя всё ещё несовершенное) изображение, рис. 2.

Рис 2. Атом – по большей части пуст (серая область). По нему быстро движутся электроны (голубые точки, нарисованы не в масштабе, а гораздо больше). В центре находится тяжёлое ядро (красные и белые точки, нарисованы больше, чем в масштабе).
Вот, что я попытался передать этим изображением. Во-первых, электроны очень, очень малы, настолько малы, что мы так и не смогли измерить их размер – может статься, что они точечные и не имеют размера, но они точно не больше, чем 1/100 000 000 от диаметра атома. Во-вторых, ядра (и протоны с нейтронами, их составляющие) также крайне малы, хотя они и больше, чем электроны. Их размер измерен, и он примерно в 10 000 – 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре – большие дома, находящиеся в центре деревни, а электроны – далеко разбросанные фермерские домики. На большей части сельской местности растут зерновые культуры и нет домов. И хотя территория, считающаяся частью деревни, может быть большой, реально занимаемая домами площадь очень мала.
Но эта аналогия не полная, поскольку электроны, в отличие от фермерских домиков, очень быстро двигаются по серому региону на картинке и вокруг ядра со скоростями порядка 1% от скорости света. Покрываемая ими территория обычно не сферическая, а более сложной формы, кроме того не все электроны перемещаются по одной и той же территории.
Но, как я вас предупреждал, рис. 2 тоже не точный. Во-первых, нужно было бы нарисовать ядро в тысячи раз меньше, а электроны – в миллионы раз меньше, только тогда их не было бы видно. Если бы атом был размером с вашу спальню, то его ядро было бы размером с пылинку. По сравнению со своими компонентами, атомы огромны! В каком-то смысле большую часть атома составляет пустота!
Во-вторых, изображение не передаёт мутную природу квантовой механики. Уравнения квантовой механики описывают и предсказывают поведение молекул, атомов и субатомных частиц, и эти уравнения говорят нам, что у этих частиц могут быть очень странные и неинтуитивные свойства. Хотя электроны в каком-то смысле точечные (допустим, если вы захотите столкнуть два электрона друг с другом, то обнаружите, что можете сдвинуть их вместе на сколь угодно малое расстояние, и они ничем не выдадут своей внутренней структуры, если она вообще есть), есть возможность сделать так, что они, будучи оставленными в покое, будут распространяться как волна и заполнят всё серое пространство на рис. 2. Если это звучит странно, это не оттого, что вы чего-то не поняли: это странно и об этом тяжело думать. Я-то уж точно не знаю, как нарисовать атом, чтобы не вводить вас в заблуждение, и эксперты всё ещё спорят о том, как лучше всего о нём думать. Так что пока просто примите это как странный факт.
Размер электрона слишком мал для измерения, и его масса настолько мала, что электрон может распространиться по всему атому. А вот у ядра есть вполне измеренный и известный размер, а его масса так велика – больше 99,9% массы всего атома – что оно вообще не распределяется в пространстве. Ядро сидит в середине серой области.
Атом и его химия
Лучший приходящий мне в голову способ описать атом: большая часть массы атома содержится в ядре, находящемся в его центре, вокруг которого распределились чрезвычайно мелкие электроны гораздо меньшей массы, причём сделали это совершенно не так, как ведут себя частицы, заполнив всю серую область рис. 2.
Небольшой размер ядра по отношению к полному размеру атома, и то, что оно обычно находится в его центре, объясняет, почему оно играет относительно слабую роль в химии. Химия происходит – то есть, формируются и меняются молекулы – когда атомы приближаются друг к другу, а это происходит, когда внешние, валентные электроны одного атома близко подходят к внешним электронам другого – когда край серой области одного атома приближается к краю серой области другого. В химических процессах атомное ядро остаётся в центрах атомов, и никогда не приближается к другим ядрам. Основная роль ядра – обеспечение положительного заряда, удерживающего электроны, и большей части массы (определяющей, как сложно другим объектам передвигать этот атом).
Это отвечает на 3-й вопрос: химию атома в основном определяют подробности, связанные с его внешними электронами. Эти детали можно узнать (сложным способом, через уравнения квантовой механики), исходя из атомного номера Z.
Вместо того, чтобы заняться химией – темой, которой хватит на целый курс – мы перейдём на уровень ниже, к субатомным частицам, по пути отвечая на другие вопросы. Перечислим вопросы, с которыми мы разобрались, и вопросы, которые ещё предстоит изучить.
1. Из чего состоят атомы? Снаружи – электроны, в центре – атомное ядро (из протонов и нейтронов).
2. В чём смысл атомного номера? Это количество протонов в ядре атома, которое, в обычных условиях равно количеству электронов, его окружающих.
3. Каков главный источник различий в химическом поведении атомов разных элементов? Свойства внешних электронов, определяемые общим количеством электронов у каждого элемента, к примеру, атомным номером.
4. До какой степени разные атомы одного элемента схожи между собой? Обсудим это в статье про изотопы.
5. Как части атома удерживаются вместе? Обсудим это в статье о роли электрических сил и квантовой механики.
6. Почему атомы удерживаются вместе и образуют молекулы? Обсудим это в статье о роли электронов и электрических сил в построении молекул из атомов.
А вот вам ещё вопрос, который мог возникнуть при изучении рис. 2:
Если атом – по большей части пуст, почему объекты кажутся твёрдыми? Почему нельзя протянуть руку через экран компьютера, если экран состоит из атомов, по большей части пустых?
Строение атома
История открытия. Демокрит. Начала атомистики
Уже в древности философы задумывались, из чего же состоит природа вокруг них. Демокрит первым из античных ученых предположил, что все в мире состоит из крошечных неделимых частиц. Эту частицу он назвал атом, что в переводе с греческого означает «неделимый».
К сожалению, возможности ученых в те времена были весьма ограничены. Каких-либо приборов, позволяющих исследовать строение вещества, у них не было. Но значение Демокрита в зарождении атомистики невозможно сбросить со счетов истории.
Атомно-молекулярное учение. Строение атома
Практически до середины XVIII века, пока М.В. Ломоносов не принес в химию количественные эксперименты, учение об атомах оставалось лишь прерогативой философских размышлений. Михаил Васильевич считал, что лишь знание физических законов поможет правильно истолковать результаты химических опытов.
В своих исследованиях ученый выделил в веществе крупные частицы — «корпускулы», и мелкие — «элементы», или как мы называем их сейчас — атомы.
Ломоносов считал, что каждая молекула по своему составу идентична всему веществу, а также, что различные по химическому строению элементы имеют и разные по составу молекулы. Ученый предполагал, что вещества имеют особенности не только из-за отличий в составе молекул, но и благодаря различному расположению атомов в молекуле.
Следующий шаг в изучении атомов сделал английский естествоиспытатель Джон Дальтон. Проводя различные эксперименты с растворением газов в жидкостях, ученый открыл главное физическое качество атомов: эти мельчайшие частицы имеют вес. Но поскольку атом до сих пор никто не видел, Дальтон назвал вес частицы относительным. Он установил, что самым легким элементом является водород и предложил его вес принять за единицу.
Открытие Дальтона стало прорывом в химии. Ведь теперь к любому химическому соединению можно было подойти с измерительным прибором. Это исследование позволило приблизиться к современной записи химических формул и уравнений. И именно Дальтон придумал первые обозначения для известных химических элементов.
До конца XIX века, несмотря на все старания ученых, химическое строение атома по-прежнему оставалось лишь гипотезой.Ученым не хватало оборудования, чтобы постичь тайну мельчайшей частицы.
Открытие Дальтона дало толчок дальнейшим опытам, в ходе которых ученые вычислили относительную атомную массу разнообразных химических элементов, что позволило их классифицировать, а Д.И.Менделееву – сформулировать периодический закон и представить научному миру Периодическую систему химических элементов.
Протоны и нейтроны
Обнаружение катодных лучей немецким ученым-физиком Юлиусом Плюккером в 1859 году и создание прототипа электронной трубки Ульямом Круксом в 1879 году положили новый виток исследованиям в атомистике.
Однако потребовалось еще несколько десятков лет, чтобы строение атомов химических элементов приоткрыло свои тайны. на заре XX века в одном журнале появились две публикации, которые пытались объяснить структуру атома. Одна из публикаций принадлежала английскому ученому Д.Д. Томсону, автором другой был японский физик Хантаро Нагаока.
При создании своей атомной структуры Нагаока использовал разработанную Максвеллом в 1856 году теорию устойчивости колец Сатурна. Японский ученый был убежден, что опираясь на «сатурнианскую» модель ядра в будущих исследованиях, можно прояснить все основные свойства материи.
Исследователь ошибся, однако два постулата его теории впоследствии подтвердились:
Томсон выдвинул гипотезу о том, что атом напоминает шарообразную, электронейтральную сферу диаметром около 10 –10 м, где положительный заряд равномерно распределен по всей структуре атома, а электроны хаотично расположены в этом поле. Поэтому, можно сказать, что атом напоминает микроскопическую булочку с изюмом.
Опыты продолжались в разных странах. В лаборатории Резерфорда проходили испытания, которые смогли доказать, что в центре атома расположено крупное ядро с диаметром около —10 —15 м, в котором содержится более 99,95 % его массы, а заряд его положительный.
В 1932 году и Джеймс Чедвик обнаружил нейтрон — третий недостающий элемент атома.
Атомное взаимодействие обеспечивает тесную связь протонам и нейтронам в ядре атома. Протоны и нейтроны имеют общее название — нуклоны. Ученые считают, что их характеристики достаточно подобны, чтобы отнести эти частицы к одному семейству, как биологи относят в один вид собак и волков.
Казалось бы, вот оно – тайна ядра разгадана. Но нет, в современной физике считается, что нуклоны состоят из еще более мелких частиц, которые называют кварками, и кварковая модель является ведущей в современной науке.
Эксперименты по исследованию атома и его ядра не прекращаются, и в 2010 году международная группа физиков при исследовании протонов в мюонном водороде установила, что размер радиуса протона меньше на 4%, чем считалось до этого.
Так в фундаментальную физику ворвалась загадка протонного радиуса, почему измерение одной и той же величины в обычном и в мюонном водороде дает разные результаты — и, несмотря на усилия сотен специалистов, она до сих пор не решена.
Изотопы
Работая в лаборатории Резерфорда, Фредерик Содди экспериментально установил, что встречаются атомы одного химического элемента с различной атомной массой. А поскольку к этому времени уже было известно, что количество протонов для ядра постоянно, соответственно, отличались они количеством нейтронов.
Содди предложил термин изотоп (от греческих слов изос — «равный» и топос — «место») для обозначения веществ, идентичных по химическим свойствам, но отличающихся атомной массой и определенными физическими свойствами.
При графической записи изотоп выглядит как знак химического элемента, которому он соответствует. А что бы обозначить разницу, в массовом числе используют индекс слева вверху: ( 12 C, 222 Rn)
Протий, дейтерий, и тритий — исторические собственные названия изотопов водорода.
Электронное строение атома
Исследование таинственного микромира продолжается. Изучение движения электронов и внутриатомных взаимодействий выделилось в отдельную область физики — квантовую механику. Главный постулат квантовой механики — все волны обладают свойствами частиц, а микрочастицы имеют волновую природу.
В макромире физическое тело всегда находится в какой-то конкретной точке пространства. Даже если вы сфотографируете летящую муху и на фотографии она будет в виде черной полосы, вы все равно будете уверены, что в конкретный момент времени она была в определенном месте.
В мире атома все иначе. Легкий подвижный электрон находится одновременно во всех точках околоядерного пространства. Если провести аналогию с макромиром, больше всего это напомнит неплотный клубок мягкой пушистой шерсти.
И именно эта зона пространства, где существует вероятность встретить электрон, называется электронным облаком. Плотность электронного облака неравномерна.
В электронном облаке выделяют зону, где вероятность встречи с электроном более 90% — эта область обозначена как атомная или электронная орбиталь.
Все электроны в атоме обладают определенной энергией. Чтобы описать состояние электрона, ученые используют квантовые числа. Всего их четыре. Целое число n, которое определяет энергию электронов на конкретном энергетическом уровне, называют главным квантовым числом.
На одной электронной оболочке находятся атомные орбитали с единым значением главного квантового числа n.
У невозбужденного атома электроны расположены на орбиталях 4-х видов: s, p, d и f.
Но почему нельзя было обозначить буквами по алфавиту a, b, c? Все не так просто, для обозначения атомных орбиталей ученые решили использовать начальные буквы от прилагательных, описывающих спектральные линии в атомных спектрах:
Чтобы графически представить расположение электронов на уровнях и подуровнях атомной оболочки, ученые ввели электронные формулы. Это такие численно-буквенные комбинации, где подуровень обозначен строчной латинской литерой, а цифровой индекс вверху справа обозначает количество электронов на подуровне.
Несмотря на свои способности быть одновременно в любой точке пространства, электроны при заполнении орбиталей соблюдают определенный порядок:
У этого правила есть еще одно мнемоническое название — правило троллейбуса. Расположение электронов напоминает рассадку в общественном транспорте. Если есть свободные места и человек входит один, он сядет на свободное сиденье, и только если нет свободных сидений, подсядет к кому-то на свободное место.
Итак, подведем выводы, на которые ученым понадобилось более сотни лет опытов, исследований, научных дискуссий и даже трагедий.
Чтобы проверить насколько хорошо усвоен материал, предлагаем вашему вниманию тест на тему «Строение атома» для 8-11 классов: