На что распадается кремниевая кислота
Кремниевая кислота
Кремниевая кислота
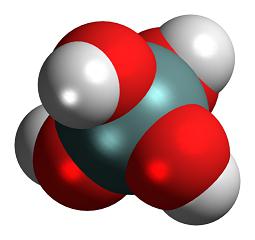
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
Особенности получения и применения кремниевой кислоты
Кремниевая кислота — что это такое, формула
Конечный продукт получения кремниевой кислоты представляет собой студенистую массу, которая содержит воду, или коллоидный раствор (золь). Кислота в процессе нагревания достаточно легко распадается на оксид кремния (IV) и воду, как и угольная. Данный процесс протекает очень быстро.
H 2 S i O 3 S i O 2 + H 2 O
Химическая формула кремниевой кислоты:
При анализе данной формулы можно заключить, что молекула кремниевой кислоты состоит из:
Исходя из химической формулы соединения, рассчитывают характеристику молекулярной массы кремниевой кислоты:
Молярная масса кремниевой кислоты составляет 78 г/моль.
Структурная формула кремниевой кислоты демонстрирует характер связей между атомами внутри молекулы соединения:
Кремниевая кислота представляет собой слабую двухосновную кислоту и обладает способностью диссоциировать на ионы в водном растворе ступенчато и обратимо, согласно следующим ионным уравнениям:
Кремниевая кислота включает в состав тетраэдрические структурные звенья (в каждом таком звене атом кремния расположен в центральной точке тетраэдра, а в вершинах находятся атомы кислорода). При объединении в цепочки структурные звенья формируют поликремниевые кислоты с более высокой степенью устойчивости:
Классификация кремниевых кислот:
Соответствующие кремниевым кислотам соли носят название силикатов. В качестве примеров можно привести метасиликаты, ортосиликаты и другие соединения.
Химические и физические свойства
Все поликремниевые кислоты отличаются плохой растворимостью в воде. Образование коллоидного раствора протекает, согласно общей схеме реакции:
Ортокремниевая кислота, которая образовалась в результате химической реакции, может вступать в реакции поликонденсации:
2 H 4 S i O 4 → ( H O ) 3 S i O S i ( O H ) 3 + H 2 O 2 H 4 S i O 4 → ( H O ) 3 S i O S i ( O H ) 3 + H 2 O
Конечным результатом являются сложные линейные, разветвленные и смешанные структуры.
Изоэлектрическая точка поликремниевых кислот соответствует интервалу pH 2,0-3,0, в котором скорость реакции поликонденсации характеризуется минимальным значением.
Кремниевые кислоты относятся к слабым:
Кремниевые кислоты реагируют с растворами и расплавами щелочей. В результате образуются силикаты, к примеру:
H 2 S i O 3 + 2 K O H → K 2 S i O 3 + 2 H 2 O H 2 S i O 3 + 2 K O H → K 2 S i O 3 + 2 H 2 O
H 2 S i O 3 + 6 H F → H 2 S i F 6 + 3 H 2 O → S i F 4 ↑ + ( 2 H F + 3 H 2 O ) H 2 S i O 3 + 6 H F → H 2 S i F 6 + 3 H 2 O → S i F 4 ↑ + ( 2 H F + 3 H 2 O )
Ортокремниевая кислота при наличии катализаторов на основе щелочи (как правило, NaOH) формирует ортосиликаты-эфиры, которые в общем случае характеризуются видом:
Особенности получения и применения кремниевой кислоты
Kремниевые кислоты получают с помощью взаимодействия сильных кислот с растворимыми силикатами натрия или калия, при этом сильные неорганические кислоты вытесняют кремниевые из растворов их солей:
N a 2 S i O 3 + 2 H C l → H 2 S i O 3 ↓ + 2 N a C l N a 2 S i O 3 + 2 H C l → H 2 S i O 3 ↓ + 2 N a C l
Получить соединения в виде кремниевых кислот можно с помощью другого способа, который представляет собой гидролиз хлорсиланов:
S i H 2 C l 2 + 3 H 2 O → H 2 S i O 3 + 2 H C l + 2 H 2 O S i H 2 C l 2 + 3 H 2 O → H 2 S i O 3 + 2 H C l + 2 H 2 O
Гидрозоли кремниевых кислот используют в качестве наполнителей и связующих веществ в производстве изделий из керамики и разнообразных покрытий. Данные материалы играют роль носителей катализаторов и светочувствительных слоев в фотоматериалах. Их используют, как сырье в производстве следующих видов продукции:
Влияние на организм человека: польза и вред
Кремниевая кислота является неорганическим соединением, которое имеет большое значение в осуществлении метаболических процессов организма:
Кремниевая кислота играет важную роль в метаболизме. Организм человека во взрослом возрасте содержит до 1-2 грамм кремния. Самой высокой концентрацией элемента обладают:
По мере старения организма содержание кремния может снижаться на фоне атеросклероза и опухолевых заболеваний. Данный процесс оказывает негативное влияние на состояние всех внутренних органов и систем.
Польза кремниевой кислоты для организма человека заключается в следующем:
Кремниевую кислоту содержат многие растительные продукты. Самой высокой концентрацией вещества обладают культурные растения с повышенным содержанием клетчатки:
Рацион питания, в котором присутствуют богатые кремнием продукты, восполняет баланс кремниевой кислоты частично. С пищей человек потребляет примерно 1 мг вещества. Норма потребления вещества составляет 5-10 мг ежедневно.
Кремниевая кислота является безопасной биологической добавкой. В том случае, когда человек рационально употребляет ее в пищу, наблюдается положительный эффект. При длительном приеме вещества в больших дозах развиваются следующие осложнения:
Медицинские препараты, содержащие кремний, не рекомендованы к употреблению людям, которые страдают диабетом. Причиной такого ограничения являются риски падения уровня сахара в крови. Кремниевая кислота способна усиливать реакции определенных лекарственных средств, в том числе, диуретиков, БАДов хрома. В связи с этим, перед приемом добавок необходимо проконсультироваться с лечащим специалистом.
Кремниевая кислота: свойства и применение
Неорганические вещества делятся на три касса: кислоты, гидроксиды и соли. К разряду первых относится такое вещество, как кремниевая кислота. Ее молекула состоит из двух атомов гидрогена, одного — силиция и трех — оксигена.
Физические свойства
Кремниевая кислота — это практически нерастворимое в воде вещество. При взаимодействии с Н2О оно образует коллоидный раствор, но не диссоциирует. Это очень неустойчивое химическое соединение, которое может распадаться даже при нормальных условиях.
С чем реагирует кремниевая кислота?
Данное химическое соединение является не очень активным — это слабая кислота. Ее свойства выражены неярко. Однако она все же обладает почти всеми особенностями, которые присущи кислотам. Слабость данного вещества проявляется в том, что оно, в отличие от других соединений данного класса, не окрашивает индикаторы. Если, к примеру, под воздействием других кислот метилоранж станет розовым, а лакмус — красным, то при взаимодействии с кремниевой они оба не изменят свой цвет. Также оно неспособно разъедать ткани или вызывать ожоги на коже, как другие кислоты. Это очень неустойчивое вещество — частичное разложение кремниевой кислоты может произойти даже при невысокой температуре. Но для того чтобы эта реакция произошла в полной мере, используют нагревание данного соединения. Вследствие такого рода реакции образуется вода и оксид кремния, который широко используется в промышленности, а также очень распространен в природе в виде песка и разнообразных минералов, к примеру, кварца. При распаде одной молекулы кремниевой кислоты можно получить одну молекулу воды и одну — оксида. Как и все кислоты, кремниевая может давать соли. Для этого к ней нужно добавить металл, который в ряду активности стоит левее, чем водород. При этом произойдет реакция замещения, при которой образуется определенный силикат, а также выделяется водород в виде газа. Например, при взаимодействии одной молекулы кремниевой кислоты с двумя молекулами натрия образуется одна натрий силиката и одна водорода.
А при реакции одной молекулы кислоты с одной кальция получается одна кальций силиката и одна водорода. Также для получения силикатов можно использовать реакцию растворения кремниевой кислоты в щелочах. Для этого чаще всего используется калий или натрий гидроксид. При таком взаимодействии из одной молекулы кислоты и двух щелочи можно получить одну молекулу силиката и две — воды. Вещества, образующиеся при химических реакциях, в которых может участвовать данное соединение, широко применяются в различных сферах промышленности.
Получение в лабораторных условиях
Чаще всего кремниевую кислоту добывают путем добавления к силикату натрия хлорной (соляной) кислоты. Для проведения реакции вещества нужно смешать в таких пропорциях, чтобы на одну молекулу соли приходилось две молекулы кислоты, при этом получится, что на две молекулы образовавшегося натрий гидроксида будет приходиться одна кремниевой кислоты.
Использование в промышленности
Применение кремниевой кислоты сводится к тому, что она выступает в роли адсорбента — поглотителя других веществ. При добывании данного химического соединения при помощи смешивания силиката натрия и соляной кислоты образуется студенистая масса, высушив которую, можно получить так называемый силикагель, который и используют в промышленности. Также данное вещество применяется в медицине. Кроме того, ее используют в химической отрасли для получения таких соединений, как оксид кремния и различные силикаты.
Кремниевая кислота в организме человека
Силикаты, оксид кремния — их применение
Сырьем для получения данных веществ служит кремниевая кислота. Данные химические соединения разнообразны по своим физическим свойствам и используются в разных целях. Некоторые из них встречаются в природе в виде драгоценных и полудрагоценных камней. К примеру, изумруд, гранат и топаз — это силикаты. Оксид кремния распространен в виде песка и кварца. Данное вещество чаще всего используется в промышленности для производства стекла, которое является силикатом.
Его химическая структура состоит из молекул кальция, оксигена, натрия и силиция. Добывают стекло путем соединения таких веществ, как оксид кремния, карбонат кальция и натрия. Такого рода реакция может произойти только под воздействием высокой температуры. В ее результате получают стекло, в строение которого входят молекулы оксидов силиция, кальция и натрия, а также углекислый газ. Для получения стекла карбонаты натрия и кальция и оксид кремния смешивают в таких пропорциях, чтобы на шесть молекул последнего приходилось по одной двух первых веществ. Для окрашивания его в разные цвета используют такие вещества: кобальт — для придания синей окраски, железо — коричневой, манган — лилово-красной, хром — зеленой.
Скажите свойства кремниевой кислоты! пожалуйста!
Кремниевые кислоты. SiO2 является ангидридом ряда кремниевых кислот, состав которых можно выразить общей формулой xSiO2 × yH2O, где х и у — целые числа:
1) х = 1, у = 1: SiO2 × H2O, т. е. H2SiO3 — метакремниевая кислота;
2) х = 1, у = 2: SiO2 × 2H2O, т. е. H4SiO4 — ортокремниевая кислота;
SiO2 является ангидридом ряда кремниевых кислот, состав которых можно выразить общей формулой xSiO2 × yH2O, где х и у — целые числа:
1) х = 1, у = 1: SiO2 × H2O, т. е. H2SiO3 — метакремниевая кислота;
2) х = 1, у = 2: SiO2 × 2H2O, т. е. H4SiO4 — ортокремниевая кислота;
= 1, у = 1: SiO2 × H2O, т. е. H2SiO3 — метакремниевая кислота;
2) х = 1, у = 2: SiO2 × 2H2O, т. е. H4SiO4 — ортокремниевая кислота;
2) х = 1, у = 2: SiO2 × 2H2O, т. е. H4SiO4 — ортокремниевая кислота;
Состав такого соединения можно выразить формулой (H2SiO3)n. Однако обычно кремниевую кислоту изображают формулой H2SiO3. H2SiO3 — кислота очень слабая, в воде мало растворима. При нагревании легко распадается аналогично угольной кислоте:
(H2SiO3)n. Однако обычно кремниевую кислоту изображают формулой
H2SiO3. H2SiO3 — кислота очень слабая, в воде мало растворима. При нагревании легко распадается аналогично угольной кислоте:
Все кремниевые кислоты очень слабые (слабее угольной).
1. При нагревании она разлагается на диоксид и воду:
2. Взаимодействует с растворами щелочей, образуя соли-силикаты:
Кремниевая кислота. Свойства, производство, применение и цена кремниевой кислоты
Их общее обозначение: — nSiO2*mH2O. Кремниевая кислота, формула которой записывается H2SiO3, это метакремниевая. Есть, так же, ортокремниевое соединение. Его запись: — H4SiO4.
Следом идет дикремниевая кислота с формулой H2Si2O5. Остается упомянуть пирокремниевое соединения. Его формула: — H6Si2O7. Не смотря на разность в записях, вещества объединены общими свойствами. С них и начнем.
Свойства кремниевой кислоты
Однако, раствор кремниевой кислоты получить сложно. Получается коллоидная форма жидкости. Это промежуточная стадия между истинным раствором и суспензией. Частицы взвеси в коллоидной среде укладываются в размеры от 1-го до 100-та нанометров. Получаемый раствор именуется гель кремниевой кислоты.
Героиня статьи во все своих проявлениях, настолько слаба, что не разъедает ткани тела. Вот уксусную кислоту выльешь на слизистые, так ожог обеспечен. «Кремниевый душ» безопасен.
Кремниевую кислоту легко разрушить. Достаточно нагреть вещество и оно распадется на воду и диоксид силициума. Запускается реакция еще при комнатной температуре. Просто, так же, проходит взаимодействие со щелочами. В ходе реакции тоже выделяется вода. Но, главный продукт взаимодействия – соль кремниевой кислоты.
Производство кремниевой кислоты
Компануясь, частицы взвеси образуют более масштабные формы. Процесс называется коагуляцией. Студенистую массу осушают и используют. Зачем и где? Об этом поговорим в следующей главе.
Применение кремниевой кислоты
Силикагель кислоты безводен и порист. Пор минимум 100 м 3 /г, а максимум – 700. В химическом плане силикагель инертен. Поэтому, вещество стало популярным абсорбентом.
Хотя, вкус вещества важен не всегда. В промышленности, к примеру, интересны лишь абсорбирующие качества. Силикагель используют для захвата водяных паров. Это необходимо, к примеру, при консервации оборудования. На нем не должно остаться влаги. Иначе, ряд деталей подвергнется коррозии.
Терять ценное сырье не выгодно. Поэтому, улетевшие соединения захватывают силикагелем. Остается нагреть его. В условиях жара гель легко возвращает абсорбированные компоненты.
Абсорбция силикагеля избирательна. Так, парафины и нафтены осушенный раствор не втягивает. Поэтому, удается отделить от них полезные непредельные углеводороды и ароматические составы.
Пользуются «услугами» геля кремниевой кислоты и фармацевты. Они абсорбируют антибиотики, находящиеся в культуральной жидкости. Так именуют питательный раствор, где лекарства взращиваются.
Силикагель нашел применение даже в ядерной отрасли. Там осушенный раствор кремниевой кислоты используется в виде ионов. Так удается разделить изотопы радиоактивных веществ.
Даже столовое серебро «благодарно» соседству с силикагелем. Вилки и ложки из сплавов аргентума темнеют из-за окисления. Оно вызвано контактом с влагой. Поэтому, к столовому серебру кладут пакетики с гелем кремниевой кислоты и так хранят. Проблема снята. Темный налет на изделиях не появится.
Силикагель, так же, используют для хранения семян. Зимой сложно оставить их сухими. Впитывая влагу, семена портятся или прорастают раньше времени. Силикагель заберет подпитку у зерен, сохранив их до весны.
Напоследок заметим, что гель кремниевой кислоты выручает путешественников, тех, кто не успевает высушить одежду. Запах прелых вещей неприятен. Поэтому, прогладив наряды утюгом без пара, стоит положить рядом с ними силикагель. Одежда быстрее высохнет и не будет пахнуть.
Цена кремниевой кислоты
Кремниевая вода оценивается поставщиками примерно в 250 рублей за литр. Силикагель продают по граммовке. Так, полкило можно купить за 100-150 рублей. Если брать килограммами, предлагают мешки.
Это и служит индикатором. Продавцы и промышленники, понимают, что настало время защищать товар или оборудование, иначе, они пострадают от паров. За пропитку кобальтом доплачивают примерно 1 000 рублей за 25-килограммовый мешок.