На что распадается nh4
Соли аммония: получение и химические свойства
Соли аммония
Способы получения солей аммония
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Химические свойства солей аммония
NH4Cl ⇄ NH4 + + Cl –
Соли аммония реагируют с щелочами с образованием аммиака.
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Аммоний
Существует также короткоживущий свободный радикал аммония с формулой NH4 [7] (см. Свободный аммоний).
Содержание
Диссоциация солей аммония
При диссоциации солей аммония в водных растворах образуется катион аммония, например:
Свойства солей аммония
Большинство солей аммония — бесцветные кристаллические вещества, хорошо растворимые в воде и легко разлагающиеся при нагревании с выделением газов.
Аммониевые соли летучих кислот при нагревании разлагаются, выделяя газообразные продукты, которые при охлаждении вновь образуют соль:
Если соль образована нелетучей кислотой, то нагреванием можно удалить NH3:
Реакция для обнаружения аммония
Реакция для обнаружения аммония — выделение аммиака при действии едких щелочей на соли аммония:
Широко используется для спектрофотометрического количественного анализа также реакция с реактивом Несслера.
Свободный аммоний
При попытке получения в свободном виде аммоний распадается на аммиак и водород. Однако при определенных условиях возможно выделение очень нестабильного свободного аммония NH4. Впервые он был получен при восстановлении раствора хлорида аммония амальгамой натрия в виде тестообразной массы, выделяющей водород и аммиак. В дальнейшем его удалось получить в жидком аммиаке. Если действовать NH4I на синий раствор металлического натрия в жидком аммиаке, то он обесцвечивается вследствие реакции по схеме:
Так как выделение водорода при этом не наблюдается и образовавшаяся бесцветная жидкость легко присоединяет иод (предположительно – по схеме: 2NH4 + I2 = 2NH4I), весьма вероятно, что в ней содержится свободный радикал – NH4. Заметное разложение последнего с выделением водорода начинает идти лишь выше минус 40 °C. [3]
Замещённые соединения аммония
Органические
Атомы водорода в аммонии могут быть замещены на органические радикалы. Существуют соединения одно-, двух-, трёх- и даже четырёхзамещённого аммония. Гидроксиды четырёхзамещённого аммония (например, гидроксид тетраметиламмония) могут быть выделены в свободном состоянии и являются намного более сильными щелочами, чем сам аммоний и его производные меньшей степени замещения.
Неорганические
См. также
Литература
Примечания
Полезное
Смотреть что такое «Аммоний» в других словарях:
АММОНИЙ — АММОНИЙ ( Αμμώνιος), сын Гермия (между 435 445 между 517 526, Александрия) представитель Александрийской школы неоплатонизма, преподаватель философии, не пренебрегавший геометрией и астрономией. Комментарии Аммония к Аристотелю пользовались… … Философская энциклопедия
АММОНИЙ — (лат. ammonium от греч. ammoniakon). Металлическое вещество, составляющее основание аммиака, представляет соединение 1 атома азота с 4 атомами водорода. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. АММОНИЙ лат.… … Словарь иностранных слов русского языка
Аммоний — я, муж. Стар. редк.Отч.: Аммониевич, Аммониевна.Производные: Моня.Происхождение: (От др. евр. ’amon искусный мастер, художник.)Именины: 23 янв., 8 февр., 10 сент., 14 сент., 17 сент., 17 окт. Словарь личных имён. Аммоний Посвященный Амону, егип.… … Словарь личных имен
АММОНИЙ — АММОНИЙ, аммония, мн. нет, муж. (см. аммониак). 1. Соединение азота и водорода, не встречающееся в свободном состоянии, а лишь как составная часть сложных соединений, напр. в нашатыре (хлористый аммоний) и др. (хим.). 2. То же, что углекислый… … Толковый словарь Ушакова
аммоний — нашатырь Словарь русских синонимов. аммоний сущ., кол во синонимов: 2 • нашатырь (6) • удо … Словарь синонимов
АММОНИЙ — NH4+, однозарядный катион. Входит в состав нитрата аммония NH4NO3, сульфата аммония. (NH4)2SO4 и др. солей аммония … Большой Энциклопедический словарь
АММОНИЙ — АММОНИЙ, я, муж. Не существующее в свободном виде соединение атомов азота и водорода, обладающее химическими свойствами металлов. | прил. аммониевый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Аммоний — (NH+4) неорганический радикал; входит в молекулы многих химических соединений, в свободном виде не существует. Широко применяют соли А. (аммониевые соли). Гидроксид А. (гидроокись А.) NH4OH образуется при растворении аммиака в воде … Российская энциклопедия по охране труда
АММОНИЙ — АММОНИЙ, NH4, хим. радикал, не получающийся в свободном состоянии. Впервые Ампер (1817 г.) и затем Берцелиус указали, что соединение аммиака с водой следует рассматривать как водную окись металлоподоб ного соединения, как «сложный… … Большая медицинская энциклопедия
На что распадается nh4

Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
I. Строение молекулы аммиака
II. Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
III. Получение аммиака
В лаборатории
В промышленности
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH4OH ↔ NH3↑ + H2O
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода)
IV. Химические свойства аммиака
Для аммиака характерны реакции:
1. Реакции с изменением степени окисления атома азота (реакции окисления)
NH3 – сильный восстановитель
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
V. Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3. Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
VI. Соли аммония
1. Составление формул солей аммония
Соли аммония — это сложные вещества, в состав которых входят ионы аммония NH4+, соединённые с кислотными остатками.
2. Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
3. Получение
1 способ: Аммиак + кислота: NH3 + HNO3 → NH4NO3
2 способ: Аммиачная вода + кислота: 2NH4OH + H2SO4 → (NH4)2SO4+ 2Н2O
4. Химические свойства

1. Сильные электролиты (диссоциируют в водных растворах полностью)
2. Взаимодействие с кислотами (реакция обмена)
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
CO3 2- + 2H + → Н2O + CO2
Взаимодействие с солями (реакция обмена)
(NH4)2SO4 + Ba(NO3)2 → BaSO4↓ + 2NH4NO3
Ba 2+ + SO4 2- → BaSO4↓
Спецефические свойства
1. Разложение при нагревании
a) если кислота летучая: NH4Cl → NH3 + HCl (при нагревании)
NH4HCO3 → NH3 + Н2O + CO2

б) если анион проявляет окислительные свойства: NH4NO3 → N2O + 2Н2O (при нагревании)
(NH4)2Cr2O7 → N2 + Cr2O3 + 4Н2O (при нагревании)

При нагревании со щелочами выделяется газ аммиак
NH4Cl + NaOH → NaCl + NH3 + Н2O (при нагревании)

3. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O → NH4OH + HCl
NH4 + + Н2O → NH4OH + H +
5. Применение
VII. Закрепление
Задание №1. Заполните таблицу – запишите молекулярные, полные и краткие ионные уравнения для следующих солей аммония:
Химические свойства, общие с другими солями
Хлорид аммония
| Хлорид аммония | |
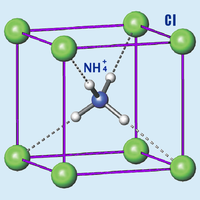 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид аммония |
| Химическая формула | NH4Cl |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кубические кристаллы |
| Отн. молек. масса | 53,49 а. е. м. |
| Молярная масса | 53,49 г/моль |
| Плотность | 1,527 г/см³ |
| Термические свойства | |
| Температура плавления | возгонка при 337,6 °C |
| Энтальпия образования (ст. усл.) | -314,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | (при 20 °C) 37,2 г/100 мл |
| Классификация | |
| Рег. номер CAS | [12125-02-9] |
Хлорид аммония (хлористый аммоний, техническое название — нашатырь) NH4Cl — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Содержание
Свойства
Растворимость безводного NH4Cl (в г/100 г воды) при температуре| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NH4Cl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Применение
Примечание
Не следует путать нашатырь (хлорид аммония) с нашатырным спиртом — раствором аммиака в воде.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Хлорид аммония» в других словарях:
хлорид аммония — хлористый аммоний … Cловарь химических синонимов I
АММОНИЯ ХЛОРИД — (NH4Cl), аммониевая соль соляной кислоты. В прошлом его называли нашатырем. Хлорид аммония твердое тело белого цвета, отличается летучестью, высокой растворимостью; его получают путем реакции между аммиаком и хлоридом водорода. Применяется в… … Научно-технический энциклопедический словарь
АММОНИЯ СОЛИ — хим. соед., содержащие однозарядный катион аммония NН+4, напр. хлорид аммония NH4Cl, нитрат аммония NH4NН3 … Естествознание. Энциклопедический словарь
АММОНИЯ ХЛОРИД — Ammonii chloridum. Синонимы: аммоний хлористый, нашатырь, амохлор, ацидамон и др. Свойства. Белый кристаллический, слегка гигроскопический порошок, без запаха, холодящий, солоноватый на вкус; улетучивается при накаливании (NH4CL). Легко раствори … Отечественные ветеринарные препараты
Хлорид бериллия — Общие Систематическое наименование Хлорид бериллия Химическая формула BeСl2 Эмпирическая формула BeСl2 Физические свойства Состояние ( … Википедия
Хлорид магния — Хлорид магния … Википедия
Хлорид хрома(III) — Хлорид хрома(III) … Википедия
Хлорид хрома(IV) — Общие Систематическое наименование Хлорид хрома(IV) Традиционные названия Хлористый хром Химическая формула CrCl4 Физические свойства Состояние … Википедия








