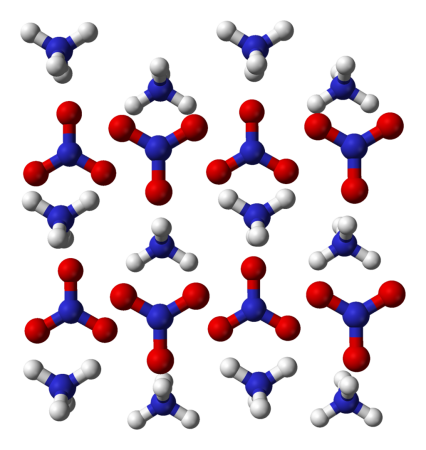
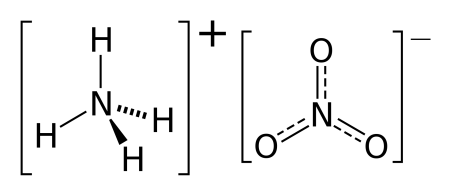На что распадается нитрат аммония
Нитрат аммония
Характеристики и физические свойства нитрата аммония
Он хорошо растворяется в воде (гидролизуется по катиону). Кристаллогидратов не образует.
Рис. 1. Нитрат аммония. Внешний вид.
Таблица 1. Физические свойства нитрата аммония.
Плотность (20 o С), г/см 3
Температура плавления, o С
Температура кипения, o С
Температура разложения, o С
Растворимость в воде (20 o С), г/100 мл
Получение нитрата аммония
Нитрат аммония имеет большое промышленное значения. Для его получения наиболее часто используют следующие методы:
— реакция взаимодействия безводного аммиака с азотной кислотой
Химические свойства нитрата аммония
Нитрат аммония — это средняя соль, образованная слабым основанием – гидроксидом аммония (NH4OH) и сильной кислотой – азотной (HNO3).Гидролизуется по катиону. Характер среды водного раствора нитрата аммиака кислый. Уравнение гидролиза будет выглядеть следующим образом:
Нитрат аммония разлагается концентрированными щелочами:
В ОВР может проявлять свойства как слабого окислителя, так и слабого восстановителя:
Нитрат аммония разлагается при нагревании:
Применение нитрата аммония
Примеры решения задач
| Задание | Какой объем оксида азота (I) выделится в ходе реакции разложения нитрата аммония, если в неё вступило 15 г соли? |
| Решение | Оксида азота (I) выделяется при разложении нитрата аммония только в случае нагревания соли до температуры, не превышающей 200 o С. Запишем уравнение реакции: |
Рассчитаем количество нитрата аммония, вступившего в реакцию (молярная масса равна 80 г/моль):
Согласно уравнению, n(NH4NO3) : n(N2O) = 1:1, значит,
Тогда, объем выделяющегося оксида азота (I) будет равен:
V (N2O) = 0,2 × 22,4 = 4,48 л.
| Задание | Какой объем азота выделится в ходе реакции разложения нитрата аммония, если в неё вступило 25 г соли? |
| Решение | Азот выделяется при разложении нитрата аммония только в случае нагревания соли до температуры выше 200 o С. Запишем уравнение реакции: |
Рассчитаем количество нитрата аммония, вступившего в реакцию (молярная масса равна 80 г/моль):
Тогда, объем выделяющегося оксида азота (I) будет равен:
Нитрат аммония
| Нитрат аммония | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Нитрат аммония |
| Химическая формула | NH4NO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдый |
| Отн. молек. масса | 80,04 а. е. м. |
| Молярная масса | 80,04 г/моль |
| Плотность | 1,725 (IV модификация) г/см³ |
| Термические свойства | |
| Температура плавления | 169,6 °C |
| Температура кипения | 235 °C |
| Температура разложения | |
| Химические свойства | |
| Растворимость в воде | 20 °C — 190 г/100 мл |
| Классификация | |
| Рег. номер CAS | 6484-52-2 |
Нитра́т аммо́ния (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году.
Содержание
Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при повышенном давлении — 235 °C. Молекулярная масса 80,04 а. е. м.. Скорость детонации 2570 м/с.
Растворимость
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 25 | 212 |
| 50 | 346 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём (
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
А также амфотерный метод.
Химические свойства
Реакции разложения
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
| Система | Диапазон температур (°C) | Состояние | Изменение объёма (%) |
|---|---|---|---|
| — | > 169.6 | жидкость | |
| I | 169.6 — 125.2 | кубическая | +2.1 |
| II | 125.5 — 84.2 | тетрагональная | −1.3 |
| III | 84.2 — 32.3 | α-ромбическая | +3.6 |
| IV | 32.3 — −16.8 | β-ромбическая | −2.9 |
| V | ПрименениеВзрывчатые веществаНаиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси: УдобренияБо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений. Аварии и взрывыДополнительная информацияМировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот. Реакции разложенияПри выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются. Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции. Разложение оксидовПри нагревании разлагаются оксиды тяжелых металлов: 2HgO = 2Hg + O2 Разложение гидроксидовКак правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду: 2LiOH = Li2O + H2O Гидроксиды других щелочных металлов при нагревании не разлагаются. Гидроксиды серебра (I) и меди (I) неустойчивы: 2AgOH = Ag2O + H2O 2CuOH = Cu2O + H2O Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду. В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду: Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются: Разложение кислотПри нагревании разлагаются нерастворимые кислоты. Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования: В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды. Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо: При нагревании выше 100 о С продукты распада несколько отличаются: Азотная кислота под действием света или при нагревании частично обратимо разлагается: Разложение солейРазложение хлоридовХлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются. Хлорид серебра (I) разлагается под действием света: 2AgCl → Ag + Cl2 Хлорид аммония при нагревании выше 340 о С разлагается: Разложение нитратовНитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода. Видеоопыт разложения нитрата калия можно посмотреть здесь. Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С: При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода: Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода: Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода: Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды: При более высокой температуре образуются азот и кислород: Разложение карбонатов и гидрокарбонатовКарбонаты натрия и калия плавятся при нагревании. Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ: Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак: Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду: Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду: Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду: При нагревании до 1200 о С образуются оксиды: Разложение сульфатовСульфаты щелочных металлов при нагревании не разлагаются. Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода: Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода: Разложение фосфатов, гидрофосфатов и дигидрофосфатовЭти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов: Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония). Разложение сульфитовСульфиты щелочных металлов разлагаются до сульфидов и сульфатов: Разложение солей аммонияНекоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония: Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония: Видеоопыт разложения нитрита аммония можно посмотреть здесь. Разложение перманганата калияРазложение хлората и перхлората калияХлорат калия при нагревании разлагается до перхлората и хлорида: 4KClO3 → 3KClO4 + KCl При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород: 2KClO3 → 2KCl + 3O2 Перхлорат калия при нагревании разлагается до хлорида и кислорода: Нитрат аммония | ||
| Систематическое наименование | Нитрат аммония | ||
| Хим. формула | NH4NO3 | ||
| Состояние | твёрдый | ||
| Молярная масса | 80,04 г/моль | ||
| Плотность | 1,725 (IV модификация) | ||
| Т. плав. | 169,6 °C | ||
| Т. кип. | 235 °C | ||
| Т. разл. | 210 °C | ||
| Растворимость в воде | 20 °C — 190 г/100 мл | ||
| ГОСТ | ГОСТ 14702-79 | ||
| Рег. номер CAS | 6484-52-2 | ||
| PubChem | 22985 | ||
| Рег. номер EINECS | 229-347-8 | ||
| SMILES | |||
| RTECS | BR9050000 | ||
| ChEBI | 63038 | ||
| ChemSpider | 21511 | ||
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |||
Нитрат аммония (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году. Используется в качестве компонента взрывчатых веществ и как азотное удобрение.
Содержание
Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при пониженном давлении — 235 °C. Молекулярная масса 80,04 а. е.м. Скорость детонации 2570 м/с.
Растворимость
Растворимость в воде:
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 10 | 150 |
| 25 | 212 |
| 50 | 346 |
| 80 | 599 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Также соль растворима в аммиаке, пиридине, метаноле, этаноле.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём получить практически невозможно.
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
А также амфотерный метод.
Химические свойства
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
| Система | Диапазон температур (°C) | Состояние | Изменение объёма (%) | |
|---|---|---|---|---|
| — | > 169.6 | жидкость | ||
| I | 169.6 — 125.2 | кубическая | −2.13 | |
| II | 125.5 — 84.2 | тетрагональная | −1.33 | |
| III | 84.2 — 32.3 | α-ромбическая | +0.8 | |
| IV | 32.3 — −16.8 | β-ромбическая | −3.3 | |
| V | −50 — −16.8 | тетрагональная | +1.65 | |
| VI | существует при высоких давлениях | |||
| VII | 170 | |||
| VIII | существует при высоких давлениях | |||
| IX | существует при высоких давлениях |
Фазовый переход от IV к III при 32,3 °C приносит неприятности производителям удобрений, потому как изменения плотности приводят к разрушению частиц при хранении и применении. Это особенно важно в тропических странах, где нитрат аммония испытывает циклические изменения, приводящие к разрушению гранул, слёживанию, повышенному пылению и риску возникновения взрыва.
Применение
Удобрения
Бо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений. Для предотвращения создания взрывчатых веществ на основе нитрата аммония в удобрения, доступные в широкой продаже, добавляют компоненты, снижающие взрывоопасность и детонационные свойства чистого нитрата аммония, такие как мел (карбонат кальция).
В Австралии, Китае, Афганистане, Ирландии и некоторых других странах свободная продажа нитрата аммония даже в виде удобрений запрещена или ограничена. После террористического акта в Оклахома-Сити ограничения на продажу и хранение нитрата аммония были введены в некоторых штатах США.
Взрывчатые вещества
Наиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси:
Безопасный состав
Дополнительная информация
Мировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот.