На что распадаются жиры в организме
Как мы толстеем?
В лишнем весе обвиняются то углеводы, то жиры, то отдельные продукты вплоть до картофеля, творога или фруктов. По интернету ходят страшилки: если мы позавтракали крупой, но не пошли заниматься и не отработали углеводы, они отложатся в жир. Или что углеводы и жиры нельзя есть вместе, потому что одно идет на энергию, а второе за ненадобностью — в жир. Как на самом деле мы толстеем?
Мы толстеем, когда получаем с едой больше энергии, чем успеваем тратить. И с этой точки зрения, не важно, какими именно продуктами мы превысили норму калорий. Тем не менее, разные макронутриенты (белки, жиры, углеводы) делают нас толще при избытке калорий разными механизмами.
Пищеварение и усвоение
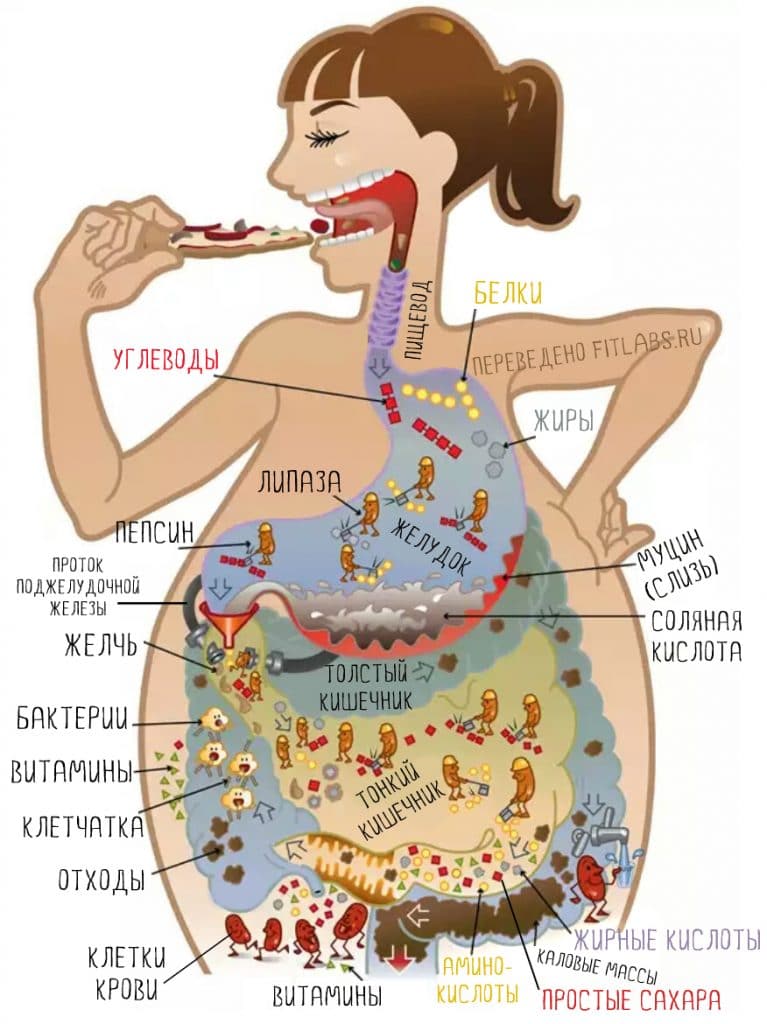
Вся еда попадает в желудок, а затем в тонкий кишечника, где усваивается большая ее часть. То, что не будет усвоено в кишечнике, покинет организм естественным путем.
Но пищеварительная эффективность в организме человека высока. Жиры усваиваются на 97% (если вы съедите 100 грамм чистого жира, усвоятся 97 грамм). Животные белки — на 90-95%, а растительные — на 80%. Усвоение углеводов зависит от содержания клетчатки. Но мало кто ест ее так много, чтобы это как-то повлияло.
Люди усваивают еду по-разному, но разница — не более 100 калорий в день. Конечно, в случае болезней ЖКТ все совсем по-другому, но мы здесь это не рассматриваем.
Что происходит с питательными веществами
Что происходит после того, как питательные вещества попали в кровоток? Есть всего два варианта развития событий: либо они сгорят (будут использованы в качестве энергии) или отправится на хранение. Вообще, есть и третий вариант: при некоторых заболеваниях (диабет, инсулин-резистентность) питательные вещества могут остаться плавать в крови, вызывая проблемы с сосудами, либо, в конечном итоге, будут выводится из организма с мочой. Но для здорового человека этими вещами можно пренебречь.
Окисление — сжигание вещества для производства энергии. Это может произойти в печени, в скелетных мышцах и некоторых других местах. Все четыре макроэлемента (белки, жиры, углеводы и спирт) могут стать энергией.
Углеводы могут быть сохранены в виде гликогена печени и мышц. В редких случаях они превращаются в жир.
Основное место хранения жира в теле — жировые клетки (адипоциты). Больше всего их — под кожей. Небольшая часть адипоцитов (а у людей с ожирением — большая) окружает внутренние органы. Такой жир называется висцеральным. Совсем немного жира хранится в мышцах, но он на внешний вид не влияет.
Хранилищем белков в организме можно считать все мышцы тела. Аминокислоты белков используются для самых разных целей — синтез и обновление клеток, ферментов, гормонов и прочего. И если они не поступают с едой, то распадаются белки тела.
Как оказалось, есть связь между размером «хранилища» того или иного вещества и способностью организма использовать его для энергии сразу после еды.
Чем больше потенциальный размер «хранилища» питательного вещества в организме и чем лучше способность организма запасать его, тем меньше это вещество используется для энергии после еды.
И наоборот: чем меньше запасов питательного вещества в теле и чем хуже способность организма его запасать, тем легче вещество сгорает после поступления внутрь.
Норма жиров в день у любого человека очень скромная по сравнению с тем, сколько жира потенциально он может запасти.
Когда вы едите жиры, организм не использует их в качестве энергии сразу же, даже на диете. Единственное исключение — когда съедается большое количество жира за раз (около 80 грамм), но даже тогда эффект довольно мягкий. Ежедневно весь пищевой жир откладывается в жировые клетки. Но если вы на диете, то жир из запасов достается, чтобы обеспечить организм недостающей энергией.
Углеводы
В отличие от жиров, размер хранилища углеводов не сильно отличается от их нормы ежедневного потребления. Обычный человек способен запасти 350-450 г гликогена. Мужчины — больше, женщины — меньше. Если возьмем питание на 2700 калорий и стандартные рекомендованные 60% углеводов, это как раз 400 грамм. По этой причине, тело хорошо умеет использовать углеводы для получения энергии.
Как выясняется, окисление жиров напрямую зависит от количества углеводов. Когда вы едите больше углеводов, вы сжигаете больше углеводов и меньше — жиров; ешьте меньше углеводов и вы сжигаете меньше углеводов и больше — жиров.
Белок
Запасы белка в теле — около 10-15 кг, что довольно много по сравнению со средней суточной нормой белка. Даже если человек ест 200-300 г в день, это по-прежнему гораздо меньше того, что тело может хранить.
Скорость окисления белка меняется в ответ на его поступление. Когда мы едим больше белка, тело использует больше белка в качестве энергии. Когда мы едим меньше белка, снижается и его окисление. Эти изменения происходят не сразу (как с углеводами), а занимает 3-9 дней.
Алкоголь
Четвертый макронутриент — спирт. Но для него никакого хранилища не предусмотрено. Организм воспринимает спирт как «метаболический токсин» или «яд», поэтому окисление спирта сразу после поступления — первоочередная задача. Это означает уменьшение окисления других питательных веществ, употребляемых с алкоголем).
Суммарно
Ежедневно весь пищевой жир откладывается в жировые клетки после еды — он не остается плавать в крови и не сгорает сразу после еды. Но если вы на диете, жир из запасов достается, чтобы обеспечить организм недостающей энергией.
Таким образом, каждый день жир откладывается и расходуется. Мы толстеем, если жира откладывается больше, чем тратится. Мы худеем, если организм расходует больше жира, чем успевает откладывать. А это определяется общим дефицитом калорий в течение дня.
Углеводы редко превращаются в жир и хранятся таким образом. Это довольно энергозатратный процесс называется де ново липогенез (de novo lipogenesis). Чтобы углеводы начали превращаться в жир, нужно их хроническое переедание — порядка 700–900 граммов чистых углеводов в день на протяжении нескольких дней. Тогда запасы гликогена будут заполнены, калории — превышены, и углеводам не останется ничего другого, кроме как быть отложенными. Но это не нормальная ситуация для большинства людей.
Таким образом, углеводы не делают человека толще напрямую и не превращаются в жир. Но когда вы едите больше углеводов, вы сжигаете больше углеводов и меньше — жира. Так что переизбыток калорий за счет углеводов влияет на лишний вес косвенно, не давая сжигать жир.
То же самое и с белками. Белок не превращается в жир напрямую. Но если есть много белка, тело будет использовать его для получения энергии, поэтому жиры пойдут в запасы, там и останутся. Так что превышение калорий за счет белка тоже делает челрвека толще, просто не напрямую, а через снижение окисления других нутриентов.
Возьмем человека, который ест строго на свою норму калорий, то есть не набирает вес и не худеет. Что произойдет с 500 калориями из жиров, углеводов и белков, которые он съест сверх нормы? Вот что происходит:
При переизбытке калорий все три варианта делают человека толще, но механизмы разные. Жир откладывается напрямую, а белки и углеводы используются в качестве энергии, блокируя использование в качестве энергии жиров.
Почему бы не перестать есть жиры, раз углеводы и белки редко откладываются в жир?
Есть еще один случай, когда углеводы превращаются в жир через де ново липогенез. Это происходит, когда калории из жиров опускаются ниже 10% от общего количества поступающих в течение дня калорий. Например, когда при питании на 2500 мы едим менее 250 калорий из жиров (менее 27 грамм жира).
Так что если у вас переизбыток калорий, но вы решили не есть жиры (которые легче всего откладываются в жир), вы все равно потолстеете: когда количество жиров слишком маленькое, организм начинает превращать углеводы в жиры.
Если человек ест больше своей нормы, он толстеет вне зависимости от манипуляций макронутриентами.
про расщепление жиров
Куда уходит жир при похудении?
Наши представления об этом — полная чушь. Даже врачи и диетологи в этом мало что смыслят.
1) жир превращается в энергию,
2) жир выводится с фекалиями,
3) жир превращается в мышцы,
4) жир выводится с потом и мочой.
А куда он реально девается?
Превращение в энергию похоже на истину, ведь при сгорании жира выделяется тепло. Но куда деваются углерод, кислород и водород — эти кирпичики, из которых сделан жир?
Версия про фекалии не просто дурно пахнет. Её сторонники не знают азов физиологии, из крови обратно в кишечник практически ничего не выделяется. И если бы жиры снова поступали в просвет кишечника, это приводило бы к конфузу — недержанию стула. Так бывает при приёме лекарств, блокирующих всасывание жиров.
Если бы жир превращался в мышцы, это была бы мечта культуристов. Но мышцы — это белок, в котором обязательно должен быть азот, а в некоторых аминокислотах есть ещё сера. В жирах этих элементов нет. К сожалению, сжигание жира и наращивание мышечной массы — это два разных процесса.
Версия о том, что жир выводится с потом, кажется вероятной и наглядной. Ведь, сгоняя лишние килограммы, мы сильно потеем, но через потовые железы в основном выходят вода и соли — и никогда жиры.
Так что же реально происходит с жиром, когда мы худеем? Об этом рассказывает и президент Российской диабетической ассоциации Михаил Богомолов: «Механизм разрушения жиров универсальный. На первом этапе каждая молекула жира под действием ферментов распадается на две составные части — на 3 молекулы жирных кислот и 1 молекулу глицерина. Они выходят из жировых клеток в кровь и разносятся по организму, попадая в разные клетки. Но просто так сгореть жирные кислоты не могут, они должны попасть в митохондрии — это такие ТЭЦ клеток, в которых вырабатывается энергия. В них и происходит сгорание жирных кислот. Слово „сгорание“ уместно, потому что, как и при любом процессе горения, здесь происходит окисление топлива до углекислого газа и воды. Жирные кислоты, а заодно и глицерин, выступая в качестве топлива, точно так же должны распасться до этих веществ под действием кислорода. Но есть отличия. Горение идёт очень быстро, а окисление жирных кислот медленно — без огня и поэтапно, с выделением небольших количеств энергии.
Важно подчеркнуть, что это окисление требует большого количества кислорода. Поэтому, когда человек худеет, важно не только мало есть, но и много двигаться. Лишь физическая нагрузка может обеспечить приток кислорода, достаточный для нормального процесса сжигания жира.
К сожалению, так бывает нечасто, поэтому значительная часть жирных кислот сгорает не до конца. Из них образуются так называемые кетоновые тела. Это целая группа разных веществ, вызывающих в организме закисление (ацидоз). Когда их много, появляются головокружение, тошнота и даже рвота. Врачам известно, что при быстром снижении веса так бывает, поэтому они рекомендуют в таких ситуациях щелочные минеральные воды, витамины группы В и Е. Потребность в последнем сильно возрастает, и его можно принимать до 800 мг в день, он необходим для защиты от свободных радикалов, в избытке образующихся при окислении. Поэтому процесс потери лишних килограммов всегда сопровождается сильным окислительным стрессом и, чтобы ослабить его разрушительное действие на митохондрии, надо много витамина Е.
Что же происходит с кетоновыми телами?
Они выходят в кровь и выводятся через почки или кожу, придавая моче и поту запах ацетона, или через лёгкие, привнося в выдыхаемый воздух ароматы гнилых яблок. То есть некоторая часть остатков жира выводится этими путями. А судьба остальных конечных продуктов распада жиров, думаю, многим и так понятна. Ведь это вода и углекислый газ. Кто не знает, что этот газ выделяется через лёгкие при дыхании, обмениваясь на кислород. Вода, получившаяся при распаде жиров, смешивается с водой организма и участвует в массе биохимических реакций. Все они происходят в присутствии воды, а избыток её выводится с мочой, потом и через лёгкие в виде паров воды. Вот такими путями жир при похудании покидает тело, и кишечник тут ни при чём. В мускулатуру жир тоже не превращается, но мышцы играют большую роль в его сгорании. Ведь в мышечных клетках больше всего митохондрий, и большая часть жирных кислот распадается именно в них».
Жировые клетки (адипоциты) — главные хранители жира в организме и одни из самых необычных клеток. Их количество в течение жизни неизменно — все они заложены при рождении. Меняется только содержание жира в них. При большом избытке веса они превращаются в огромные шары, накачанные жиром. А ядро и другие органеллы оказываются прижатыми изнутри к мембране клетки. Когда человек худеет, они как бы сдуваются. И у тех, кто периодически сидит на диетах, а потом позволяет себе лишнее, эти циклы повторяются многократно.
Куда девается жир, когда мы худеем?
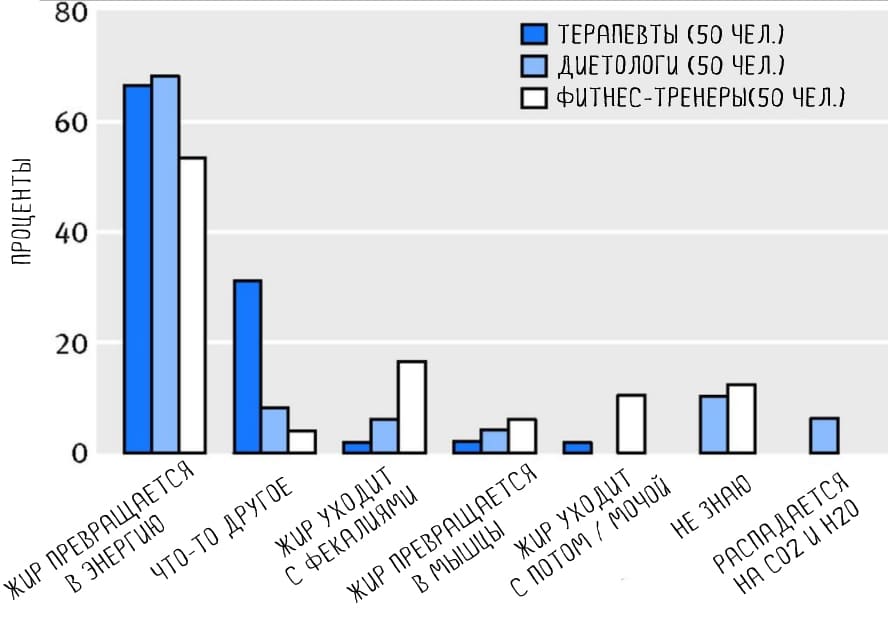
Куда девается жир, когда человек худеет? Одни думают, что он выходит на поверхность кожи с потом, поэтому тренируются в пищевой пленке и поясах с эффектом сауны. Другие считают, что жир превращается в мышцы. Но выяснилось, что судьбу жира плохо представляют себе не только простые худеющие, но и терапевты, диетологи и фитнес-тренеры. Профессор Andrew J Brown и ученый Ruben Meerman опросили в общей сложности 150 представителей этих профессий и опубликовали результаты в журнале British Medical Journal.
Несмотря на рост интереса к теме похудения, до сих пор не все представляют, что происходит с жиром. Если убрать самые мифологические варианты ответов, больше половины специалистов из каждой группы — диетологов, терапевтов и фитнес-тренеров — ответили, что жир превращается в энергию, хотя это нарушает закон сохранения массы вещества. Авторы предположили, что это результат известной мантры «Чтобы худеть, надо тратить больше энергии, чем потреблять». Такой результат показал большие пробелы в школьном образовании.
В 1748 году Ломоносов обосновал закон сохранения массы вещества, который звучит так: “Вес всех веществ, вступающих в реакцию, равен весу всех продуктов реакции”. Масса не может исчезнуть в никуда и превратиться в энергию. Сколько массы было на входе, столько остается и на выходе.
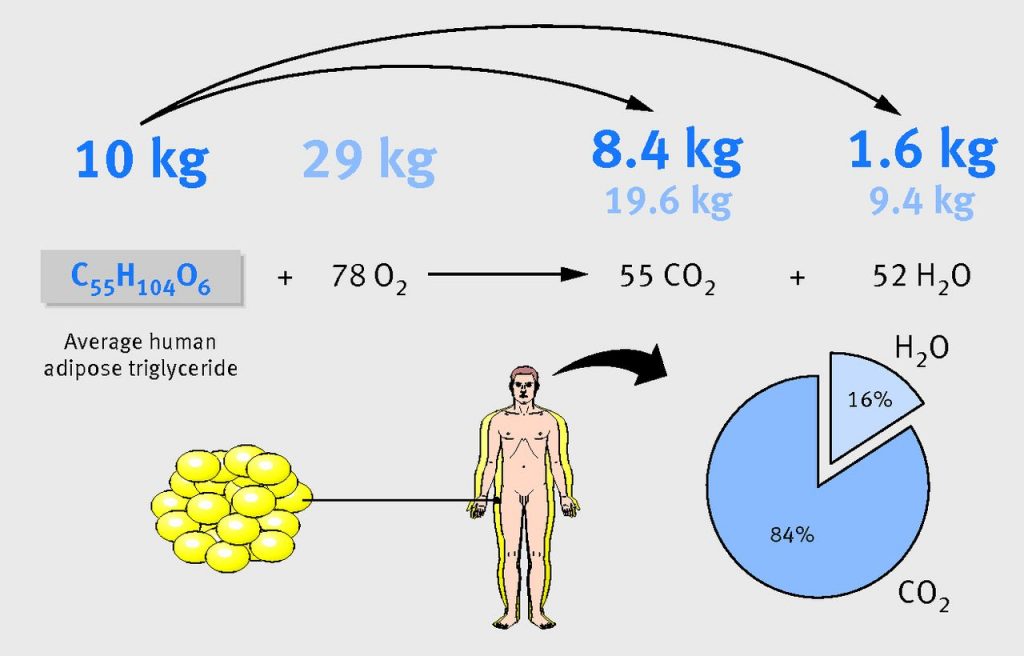
Когда мы едим больше нормы, лишние углеводы и белки превращаются в триглицериды и хранятся в жировых клетках. Лишний жир в еде не нуждается ни в каких превращениях и так же хранится в адипоцитах. Молекула жирной кислоты состоит из атомов углерода — С, водорода — Н и кислорода — О, и формула ее выглядит так: C55H104O6. Для того, чтобы жир «сгорел», ему нужен кислород.
При сжигании жира происходит его окисление, реакция с кислородом. То же самое с небольшими поправками происходит при сжигании дров, бумаги и вообще примерно любых органических соединений. В случае с дровами высокая температура нужна, чтобы кислород начал реагировать с молекулами дерева. В живой клетке поднести к молекуле спичку нельзя, поэтому окисление катализируют специальные белки, но принцип один и тот же.
Александра Брутер, сотрудник Института молекулярной биологии РАН
Процесс окисления одной молекулы жира состоит из множества сложных этапов под действием окислительных ферментов, но в целом, он выглядит так:
Вся эта сложная для обычного человека химия говорит лишь о следующем: под действием кислорода молекула жира распадается на углекислый газ и воду с освобождением энергии. Жир не превращается в энергию. Энергия запасена в химических связях между атомами в молекуле. Когда молекула распадается, энергия, которая держала атомы, высвобождается. Ее и использует организм.
Освободившиеся атомы соединяются с кислородом — так получается углекислый газ и вода. Именно в них превращается жир. Углекислый газ покидает тело с дыханием, вода уходит с мочой, потом и так же через дыхание. Таким образом, через легкие выводится бОльшая часть бывшего жира. В каком-то смысле легкие — основной жировыводящий орган.
Чтобы похудеть на 10 кг жира, нужно вдохнуть 29 кг кислорода, выдохнуть 28 кг углекислого газа и вывести из организма разными способами 11 литров воды.
Нужно ли для похудения больше дышать?
Вывод, который напрашивается: если для похудения нужен кислород, нужно больше/глубже/чаще дышать, чтобы худеть быстрее? Существуют даже дыхательно-похудательные методики тренировок, обещающие скорейшее похудение — знаменитый бодифлекс, например.
В реальности это так не работает. Энергия из жира берется ровно в том количестве, которое нужно организму, то есть — по потребностям. Кислород — одно из условий сгорания жира, но это не пусковой крючок к его извлечению из жировых клеток. А процесс похудения начинается именно с этого: жир сначала нужно достать из клеток, и отвечают за это гормоны. Сигнал им дает центральная нервная система, которая видит недостаток энергии. Усиленное дыхание приводит только к гипервентиляции, головокружениям, учащенному сердцебиению, а иногда и к обморокам.
Выводы
Жир не выходит на поверхность кожи с потом, поэтому занятия в пищевой пленке и костюме-сауне бессмысленны и опасны. Жир не превращается в мышцы, такого механизма в организме нет.
Но жир не превращается и в энергию — это нарушает закон сохранения массы вещества. Энергия запасена в химических связях между атомами в молекуле. Когда молекула распадается, энергия, которая держала атомы, высвобождается. Ее и использует организм. Освободившиеся атомы соединяются с кислородом — так получается углекислый газ и вода. Именно в них превращается жир и уходит из организма.
ЖИРОВОЙ ОБМЕН
ЖИРОВОЙ ОБМЕН — совокупность процессов превращений нейтральных жиров (триглицеридов) в организме животных и человека. К этим процессам относятся: 1) переваривание и всасывание жиров и продуктов их распада в жел.-киш. тракте; 2) промежуточный обмен жиров и жирных к-т в организме; 3) выделение жиров и продуктов их обмена из организма. Нарушения Жирового обмена различной этиологии служат причиной развития многих патологических состояний.
В состав тканей животных и растений входят нейтральные жиры (см.) и жироподобные соединения (липоиды), объединенные общим названием липиды (см.), поэтому понятия «жировой обмен» и «липидный обмен» часто понимаются как синонимы.
Начало изучения Жирового обмена относится к 1823 г., когда Шеврель (М. Chevreul) раскрыл химическую природу триглицеридов (см.), которые оказались сложными эфирами жирных кислот (см.) и глицерина (см.). Это открытие послужило стимулом к проведению исследований по изучению хим. состава различных жиров, в т. ч. жиров животного происхождения. В середине 19 в. было установлено наличие расщепляющего (липазного) действия желудочного и панкреатического соков на жиры. Позднее А. Н. Лебедев доказал возможность отложения в жировой ткани животных неизмененного чужеродного жира. В 1904 г. Ф. Кнооп создал оригинальную теорию окисления жирных кислот.
Значительные успехи в изучении обмена жиров и промежуточных продуктов их метаболизма, в первую очередь жирных к-т, были достигнуты во второй половине 20 в. в связи с широким использованием меченых атомов и общим прогрессом в развитии биохимии.
Содержание
Переваривание и всасывание жиров
Расщепление жиров в желудочно-кишечном тракте
В организм взрослого человека с пищей ежесуточно поступает в среднем 70 г жиров животного и растительного происхождения. В полости рта жиры не подвергаются никаким изменениям, т. к. слюна не содержит расщепляющих жиры ферментов. Частичное расщепление жиров на глицерин (или моно- и диглицериды) и жирные к-ты начинается в желудке. Однако расщепление жиров в желудке протекает с небольшой скоростью, что объясняется следующими причинами. Во-первых, в желудочном соке взрослого человека и млекопитающих активность липазы (см.) крайне невысока. Во-вторых, величина pH желудочного сока далека от оптимальной для действия этого фермента (оптимальное значение pH для желудочной липазы находится в пределах 5,5—7,5). В-третьих, в желудке отсутствуют условия для эмульгирования жиров, а липаза может активно гидролизовать только жир, находящийся в форме жировой эмульсии. Поэтому у взрослых людей неэмульгированные жиры, составляющие основную массу пищевого жира, проходят через желудок без особых изменений.
Вместе с тем гидролитическое расщепление жиров в полости желудка играет важную роль в процессе пищеварения у детей, особенно у детей грудного возраста. Умеренная кислотность желудочного сока у детей грудного возраста (pH ок. 5,0) способствует перевариванию эмульгированного жира молока желудочной липазой. Кроме того, при длительном употреблении молока в качестве основного продукта питания возможно адаптивное усиление синтеза желудочной липазы у детей грудного возраста.
В 70-х гг. 20 в. Скау (R. Scow) было установлено, что слизистая оболочка верхней части пищевода грудного ребенка секретирует свою собственную липазу в ответ на сосательные движения ребенка при кормлении грудью. Возможно, что именно эта липаза и проявляет свое действие в желудке детей грудного возраста.
Несмотря на то, что расщепление жиров в желудке взрослого человека невелико, оно в какой-то степени облегчает последующее переваривание жиров в кишечнике. Во-первых, в желудке происходит частичное разрушение липопротеидных комплексов мембран клеток пищи, что делает жиры более доступными для последующего воздействия на них липазы панкреатического сока. Во-вторых, даже незначительное по объему расщепление жиров в желудке приводит к появлению свободных жирных к-т, которые, не подвергаясь всасыванию в желудке, поступают в кишечник и там способствуют эмульгированию жиров.
Основная часть пищевых жиров подвергается расщеплению в верхних отделах тонкого кишечника при действии липазы панкреатического сока. Панкреатическая липаза (КФ 3.1.1.3) проявляет оптимум действия при pH ок. 8,0 и расщепляет субстраты, находящиеся в эмульгированном состоянии (действие ее на растворенные субстраты значительно слабее). Фермент катализирует гидролиз эфирных связей в молекуле триглицерида, в альфа-положениях, в результате чего образуются две молекулы жирных к-т и бета-моноглицерид. В качестве промежуточных продуктов липолиза образуются альфа-, бета-диглицериды (схема 1):
В кишечном соке содержится липаза, катализирующая гидролитическое расщепление моноглицеридов и не действующая на ди- и триглицериды. Ее активность, однако, невысока, поэтому практически основными продуктами, образующимися в кишечнике при расщеплении пищевых жиров, являются жирные к-ты и бета-моноглицериды. Что касается глицерина, то при расщеплении триглицеридов в кишечнике он образуется в небольших количествах.
Эмульгирование жиров зависит от ряда факторов. Наиболее сильным эмульгирующим действием обладают желчные кислоты (см.), попадающие в двенадцатиперстную кишку с желчью (см.) в виде натриевых солей соответствующих конъюгатов, гл. обр. гликохолеата и таурохолеата. В двенадцатиперстную кишку вместе с пищевой массой заносится нек-рое количество желудочного сока, содержащего соляную к-ту, к-рая в двенадцатиперстной кишке нейтрализуется в основном бикарбонатами, содержащимися в панкреатическом и кишечном соках и желчи. Образующиеся при разложении бикарбонатов пузырьки углекислого газа разрыхляют пищевую кашицу и способствуют более полному перемешиванию ее с пищеварительными соками. Одновременно начинается эмульгирование жира. Соли желчных к-т адсорбируются в присутствии небольших количеств свободных жирных к-т и моноглицеридов на поверхности капелек жира в виде тончайшей пленки, препятствующей слиянию этих капелек. Кроме того, соли желчных к-т, уменьшая поверхностное натяжение на поверхности раздела двух фаз — воды и жира, способствуют расчленению больших капелек жира на меньшие. Создаются условия для образования тонкой и устойчивой жировой эмульсии с размером частиц 0,5 мкм и меньше. В результате эмульгирования резко увеличивается поверхность жиров, что облегчает взаимодействие их с липазой, т. е. ускоряет ферментативный гидролиз, а также всасывание (см.).
Всасывание жиров в кишечнике
Всасывание жиров, как и других липидов (см.), происходит в проксимальной части тонкого кишечника. Тонко эмульгированные жиры могут частично всасываться через стенку кишечника без предварительного гидролиза. В этом случае фактором, лимитирующим этот процесс, по-видимому, является величина жировых капелек эмульсии, к-рая не должна превышать 0,5 мкм. Однако основная часть жира всасывается лишь после расщепления его панкреатической липазой на жирные к-ты и моноглицериды. Всасывание этих соединений происходит при участии желчи. В желчи содержатся соли желчных к-т, фосфатиды (см.) и холестерин примерно в соотношении 12,5 : 2,5 : 1,0. Жирные к-ты и моноглицериды образуют с этими компонентами желчи мицеллы, состоящие из солей желчных к-т, фосфатидов, холестерина, жирных к-т и моноглицеридов. Эти мицеллы могут связывать дополнительные количества неэтерифицированного холестерина, а также жирорастворимые витамины (A, D, Е и К). Структура мицелл такова, что их гидрофобное ядро, состоящее из липидов, оказывается окруженным снаружи гидрофильной оболочкой из желчных к-т и фосфатидов. Размеры мицелл примерно в 100 раз меньше самых мелких эмульгированных жировых капель. Благодаря таким мелким размерам и наличию наружной гидрофильной оболочки мицеллы в водной среде находятся в виде р-ра, называемого мицеллярным. Жировые мицеллы рассматриваются как своеобразный комплекс липидов и продуктов их распада в кишечнике с желчными к-тами и другими компонентами желчи, обеспечивающий растворимость липидов и продуктов их распада в водной среде (так наз. мицеллярная солюбилизация липидов) и их всасывание в кишечную стенку.
Относительно механизма всасывания жировых мицелл единой точки зрения нет. Признается возможность непосредственного проникновения мицелл в эпителиальные клетки ворсинок слизистой оболочки тонкого кишечника целой частицей путем так наз. мицеллярной диффузии без затраты энергии. В клетках ворсинок происходит распад мицеллярного комплекса, при этом желчные к-ты сразу же поступают в кровь и с током крови через систему воротной вены доставляются в печень, где снова поступают в желчь. С другой точки зрения, проникновение жировых мицелл внутрь эпителиальных клеток частично или полностью осуществляется путем пиноцитоза (см.). Допускается также возможность перехода только липидных ингредиентов (молекулярная диффузия липидов) из жировых мицелл внутрь эпителиальных клеток при соприкосновении мицелл с поверхностью слизистой оболочки ворсинок кишечника. При этом соли желчных к-т не проникают внутрь клеток, а остаются в просвете кишечника и подвергаются обратному всасыванию, гл. обр. в подвздошной кишке. Некоторые исследователи считают, что вместо мицеллярной диффузии может иметь место активная передача мицеллами липидов на акцепторы клеточных мембран ворсинок слизистой оболочки кишечника, а затем уже переход липидов внутрь клеток.
Каков бы ни был механизм всасывания липидов внутрь кишечной стенки, исключительно важное значение при этом имеет энтерогепатическая циркуляция желчных кислот, обеспечивающая всасывание больших количеств жирных к-т и моноглицеридов (50—70, а иногда и более 100 г) при относительно невысоком общем пуле желчных к-т (2,8—3,5 г).
Как уже упоминалось, при переваривании жиров образуются небольшие количества глицерина. Будучи хорошо растворимым в воде, глицерин легко всасывается в тонком кишечнике. Частично он подвергается превращению в альфа-глицерофосфат в эпителиальных клетках кишечника, частично поступает в кровяное русло. Жирные к-ты с короткой углеродной цепью (менее 10 С-атомов) также легко всасываются в кишечнике и поступают в кровь воротной вены, минуя какие-либо превращения в кишечной стенке.
Ресинтез жиров в стенке кишечника и переход жиров в лимфатическую систему и кровь
Проникшие в цитоплазму эпителиальных клеток слизистой оболочки ворсинок тонкого кишечника свободные жирные к-ты и моноглицериды задерживаются в эндоплазматическом ретикулуме. Здесь из жирных к-т образуется их активная форма — ацил-КоА и происходит ацилирование моноглицеридов с образованием сначала диглицеридов, а затем триглицеридов. Т. о., продукты расщепления пищевых жиров, образовавшиеся в кишечнике и поступившие в его стенку, используются для ресинтеза жиров.
Биол, смысл этого процесса сводится к тому, что в стенке кишечника синтезируются жиры, специфичные для данного вида животного и отличающиеся по своей природе от пищевого жира. В известной степени это обеспечивается тем, что в синтезе триглицеридов и фосфатидов в кишечной стенке принимают участие наряду с экзогенными и эндогенные жирные к-ты, синтезированные заново или «модифицированные», напр, путем удлинения углеродной цепи, а также доставленные в клетки кишечной стенки из кровяного русла или синтезированные в печени и попавшие сначала в кишечник в составе фосфатидов желчи, а затем проникшие в эпителиальные клетки кишечника в составе липидных мицелл. Кроме того, в клетках кишечника происходит своеобразное перераспределение общего пула жирных к-т; напр., жирная к-та экзогенного триглицерид-ного происхождения может быть использована для этерификации холестерина как экзогенного, так и эндогенного происхождения; жирная к-та, ранее входившая в состав фосфатидов, может быть использована для ресинтеза триглицеридов и наоборот и т. д.
Наконец, в эпителиальных клетках тонкого кишечника содержатся ферменты — моноглицеридлипаза, расщепляющая моноглицерид на глицерин и жирную к-ту, и глицеролкиназа (КФ 2.7.1.30), катализирующая превращение глицерина, образовавшегося в ходе предыдущей реакции или всосавшегося из кишечника, в альфа-глицерофосфат. альфа-Глицерофосфат, взаимодействуя с жирнокислотным ацил-КоА, участвует в образовании фосфатидной к-ты, к-рая в стенке кишечника используется гл. обр. для ресинтеза фосфатидов, но частично может быть использована и для ресинтеза триглицеридов, в которых все три жирнокислотных остатка являются в таком случае заново синтезированными.
Однако способность организма к синтезу в клетках стенки кишечника жира, специфичного для данного вида животного, все же ограничена. А. Н. Лебедевым показано, напр., что при скармливании голодавшим собакам больших количеств чужеродного жира (напр., растительного масла) часть его обнаруживается в жировых тканях животного в неизмененном виде. Жировые депо, по-видимому, являются единственной тканью, где могут откладываться чужеродные жиры (этим пользуются в животноводстве при откорме на сало животных, напр, свиней; качество жира, образующегося при откорме, зависит от состава задаваемых кормов). Что касается жира, откладывающегося или вступающего в обмен в клетках других органов и тканей, то состав его отличается высокой специфичностью и мало зависит от пищевых жиров.
Механизм ресинтеза триглицеридов и фосфатидов в клетках стенки кишечника в общих чертах идентичен их биосинтезу в других тканях.
Образование хиломикронов и транспорт триглицеридов
Ресинтезированные в клетках кишечной стенки триглицериды и фосфатиды, а также поступивший в эти клетки из полости кишечника холестерин, который частично там этерифицируется, соединяются внутри цистерн гладкого эндоплазматического ретикулума с небольшим количеством белка и образуют относительно стабильные комплексные частицы — хиломикроны. Хиломикроны содержат ок. 2% белка, 84—87% триглицеридов, 4—7% фосфатидов и от 2 до 5% холестерина. Размер частиц хиломикронов колеблется от 120 до 1100 нм. Благодаря большим размерам частиц хиломикроны не способны проникать из эндотелиальных клеток кишечника в кровеносные капилляры и диффундируют в лимф, систему кишечника, а из последней— в грудной лимф, проток. Из грудного лимф, протока хиломикроны поступают в кровь. Т. о., благодаря хиломикронам осуществляется транспорт экзогенных триглицеридов, холестерина и, частично, фосфатидов из кишечника через лимф, систему в кровь.
Через 2 часа после приема пищи, содержащей жиры, развивается так наз. алиментарная гиперлипемия (см. Липемия), характеризующаяся в первую очередь повышением концентрации триглицеридов в крови и появлением в ней хиломикронов. После приема слишком жирной пищи плазма крови принимает молочный цвет, что объясняется появлением в ней большого количества хиломикронов. Пик алиментарной гиперлипемии приходится на период между 4—6 час. после приема жирной пищи. Через 10— 12 час. содержание жира в сыворотке крови возвращается к норме. К этому же времени у здоровых людей из плазмы крови полностью исчезают хиломикроны. В связи с этим взятие крови для исследования содержания в ней липидов должно проводиться натощак спустя 14 час. после приема пищи.
Печень и жировая ткань играют наиболее важную роль в дальнейшей судьбе хиломикронов. Т. к. эндотелиальный слой синусоидов печени имеет большие отверстия, хиломикроны свободно диффундируют из плазмы крови в межклеточные пространства печени. По мнению одних исследователей, при контакте хиломикронов с оболочкой паренхиматозных клеток последние захватывают только триглицериды хиломикронов; по мнению других, в паренхиматозные клетки попадают продукты гидролиза триглицеридов хиломикронов — глицерин и жирные к-ты. Поэтому допускают, что гидролиз триглицеридов хиломикронов имеет место как внутри печеночных клеток, так и снаружи, на их поверхности.
В клетках печени имеются ферментные системы, катализирующие превращение глицерина в альфа-глицерофосфат, а неэтерифицированных жирных к-т (НЭЖК)— в соответствующие ацилы КоА. Последние либо окисляются в печени с выделением энергии, либо используются для синтеза триглицеридов и фосфатидов. Синтезированные триглицериды и частично фосфатиды используются для образования липопротеидов очень низкой плотности (пре-бета-липопротеидов), которые секретируются печенью и поступают в кровь. Липопротеиды очень низкой плотности являются главной транспортной формой эндогенных триглицеридов и переносят за сутки в организме человека от 25 до 50 г триглицеридов. Хиломикроны из-за больших размеров не способны проникать в клетки жировой ткани, поэтому триглицеридная часть хиломикронов подвергается гидролизу на поверхности эндотелия капилляров жировой ткани при действии фермента липопротеидлипазы. Локализация этого фермента тесно связана с поверхностью эндотелия капилляров. При действии липопротеидлипазы на триглицериды хиломикронов (а также на триглицериды пре-бета-лииопротеидов) происходит образование жирных к-т и глицерина. Часть жирных к-т проходит внутрь жировых клеток, а часть связывается с альбуминами сыворотки крови и уносится с ее током. С током крови покидают капиллярную сеть жировой ткани глицерин, а также частицы хиломикронов и пре-бета-липопротеидов, оставшиеся после расщепления их триглицеридного компонента и получившие название «ремнантов». Ремнанты задерживаются в печени и подвергаются распаду.
После проникновения в жировые клетки жирные к-ты превращаются в метаболически активные формы (ацил-КоА) и вступают в реакцию с альфа-глицерофосфатом, образующимся в жировой ткани из глюкозы. В результате этого взаимодействия ресинтезируются триглицериды, которые пополняют общий запас триглицеридов жировой ткани.
Расщепление триглицеридов хиломикронов в кровеносных капиллярах жировой ткани и печени приводит к фактическому исчезновению самих хиломикронов и сопровождается «просветлением» плазмы крови, т. е. она теряет молочный цвет. Просветление ускоряется гепарином. Предполагается, что гепарин активирует солюбилизацию липопротеидлипазы и ее действие. При некоторых заболеваниях отмечается пониженная активность липопротеидлипазы, в результате чего в крови постоянно определяются большие количества хиломикронов (хиломикронемия).
Промежуточный обмен жиров
Промежуточный обмен жиров включает в себя следующие процессы: мобилизацию жирных к-т из жировых депо и их окисление (бета-окисление — см. Жирные кислоты), биосинтез жирных к-т и триглицеридов и превращение непредельных жирных к-т.
Мобилизация жирных кислот (липолиз жира жировой ткани)
В жировой ткани человека содержится большое количество жира, преимущественно в виде триглицеридов, которые выполняют в обмене жиров такую же функцию, как гликоген печени в обмене углеводов. Эти соединения представляют собой запасные вещества, которые могут потребляться при голодании, физ. работе и других состояниях организма, требующих затраты энергии. Запасы этих веществ пополняются после потребления пищи, и они, т. о., являются своеобразным буфером в процессах накопления и использования энергии в организме.
Значение триглицеридов жировой ткани как энергетического резерва убедительно подтверждается следующими цифрами. Организм здорового человека содержит ок. 15 кг триглицеридов (140 000 ккал) и только 0,35 кг гликогена (1410 ккал). Гликоген, две трети запасов к-рого находится в мышцах, используется организмом при кратковременных и внезапно возникающих нагрузках. Что касается триглицеридов жировой ткани, то при средней энергетической потребности взрослого человека в 3500 ккал в сутки 15 кг жира теоретически достаточно, чтобы обеспечить энергией 40-дневную потребность организма.
Триглицериды жировой ткани подвергаются липолизу под действием липаз. В жировой ткани содержится несколько липаз, из которых наибольшее значение имеют так наз. гормоночувствительная липаза (триглицеридлипаза), диглицерид-липаза и моноглицеридлипаза. Гормоночувствительная липаза находится в жировой ткани в неактивной форме и активируется под влиянием циклического 3′,5′-АМФ (аденозинмонофосфата). Последний образуется из АТФ при участии аденилатциклазы. Воздействие гормона (или гормонов) направлено на первичный клеточный рецептор, который, связывая гормон, модифицирует свою структуру и в такой форме активирует пусковой фермент липолиза— аденилатциклазу. Образовавшийся в результате этих реакций циклич. 3′,5′-АМФ активирует фермент протеинкиназу (КФ 2.7.1.37), который в свою очередь активирует путем фосфорилирования липазу, превращая ее тем самым из неактивной формы в активную (схема 2).
При действии на триглицериды активированной таким сложным путем триглицеридлипазы, а затем при действии на промежуточные продукты липолиза ди- и моноглицерид-липаз образуются конечные продукты — глицерин и НЭЖК, которые из жировой ткани поступают в кровяное русло (глицерин — в свободном виде; НЭЖК — в виде комплекса с альбуминами плазмы крови). В действительности же судьба НЭЖК в самой жировой ткани во многом зависит от содержания в последней глюкозы или, более точно, от интенсивности протекающего в ней гликолиза (см.). Это объясняется тем, что образующийся в ходе гликолиза диоксиацетонфосфат частично восстанавливается при действии глицерофосфатдегидрогеназы в альфа-глицерофосфат, который в свою очередь вступает в реакцию с жирными к-тами, в результате чего снова образуются триглицериды.
Ресинтезированные триглицериды остаются в жировой ткани, способствуя, т. о., сохранению ее общих запасов. Такое состояние имеет место у сытых животных. При голодании, когда содержание глюкозы в жировой ткани понижено и образуются лишь незначительные количества альфа-глицерофосфата, освободившиеся в ходе липолиза НЭЖК не могут быть использованы жировой тканью для ресинтеза триглицеридов и поэтому они быстро покидают эту ткань. Т. о., активация гликолиза в жировой ткани является фактором, способствующим накоплению в ней триглицеридов, а угнетение гликолиза, наоборот, способствует их удалению.
Во всех случаях усиление липолиза в жировой ткани сопровождается нарастанием концентрации свободных жирных к-т в крови. Комплекс альбумин — свободные жирные к-ты содержит 99% белка и всего 1% жирных к-т. Несмотря на такое относительно низкое содержание жирных к-т в этом комплексе, их транспорт осуществляется в больших размерах: в организме человека за сутки переносится от 50 до 150 г жирных к-т. Это объясняется высокой скоростью обновления комплекса (период его полураспада ок. 5 мин.).
Связанные с альбуминами жирные к-ты попадают с током крови в органы и ткани, где подвергаются бета-окислению (см. Жирные кислоты), а затем окислению в цикле Трикарбоновых к-т (см. Трикарбоновых кислот цикл). Ок. 30% жирных к-т задерживается в печени уже при однократном прохождении через нее крови, где часть их используется для синтеза триглицеридов. Ресинтезированные триглицериды идут на образование пре-бета-липопротеидов. Нек-рое количество жирных к-т окисляется в печени до кетоновых тел (см.)— ацетоуксусной и бета-оксимасляной к-т. Кетоновые тела, не подвергаясь дальнейшим превращениям в печени, попадают с током крови в другие органы и ткани (мышцы, сердце и др.), где окисляются до CO2 и H2O. Небольшая часть мобилизованных жирных к-т используется в различных тканях для этерификации холестерина, синтеза фосфатидов, сфинголипидов и других соединений.
Биосинтез триглицеридов
Триглицериды синтезируются во многих органах и тканях, но наиболее важную роль в этом отношении играют печень, стенка кишечника и жировая ткань. Путь биосинтеза триглицеридов протекает через образование альфа-глицерофосфата как промежуточного соединения.
В стенке кишечника и почках, где активность глицеролкиназы (КФ 2.7.1.30) высока, альфа-глицерофосфат образуется непосредственно путем фосфорилирования глицерина при участии АТФ. В жировой ткани и мышцах вследствие чрезвычайно низкой активности этого фермента путь образования альфа-глицерофосфата связан с гликолизом (или гликогенолизом). В печени имеют место оба пути образования альфа-глицерофосфата. альфа-Глицерофосфат реагирует с двумя молекулами активированных жирных к-т, в результате чего образуется фосфатидная к-та:
Фосфатидная к-та, одно время считавшаяся гипотетическим промежуточным соединением в биосинтезе триглицеридов и фосфатидов, обнаружена во многих тканях. В печени, напр., на ее долю приходится ок. 1% всех фосфатидов. Фосфатидная к-та при действии фосфатазы фосфатидной к-ты (фосфатидатфосфатазы; КФ 3.1.3.4.) теряет фосфорную к-ту и превращается в альфа,бета-диглицерид:
альфа,бета-Диглицерид является главным конечным субстратом в синтезе триглицеридов, а также фосфатидов в большинстве органов и тканей, за исключением кишечной стенки. Завершающая реакция протекает путем взаимодействия диглицерида с активированной жирной к-той (ацил-КоА):
Выделение жиров и продуктов их обмена из организма
В норме количество нейтральных жиров и жирных к-т, выделяющихся из организма человека в неизмененном виде, не превышает 5% от количества жира, принятого с пищей. При этом основной путь выведения жира и жирных к-т осуществляется через кожу с секретами сальных и потовых желез. В секрете потовых желез содержатся гл. обр. водорастворимые жирные к-ты с короткой углеродной цепью; в секрете сальных желез преобладают нейтральные жиры, эфиры холестерина с высшими жирными к-тами и свободные высшие жирные к-ты, прогоркание которых обусловливает неприятный запах этих секретов. Небольшое количество жира выделяется в составе отторгающихся клеток эпидермиса.
При заболеваниях кожи, сопровождающихся усиленной секрецией сальных желез (себорея, псориаз, угри и др.) или усиленным ороговением и слущиванием эпителиальных клеток, выведение жира и жирных к-т через кожу значительно увеличивается.
В процессе переваривания жиров в жел.-киш. тракте всасыванию подвергается ок. 98% жирных к-т, входящих в состав пищевых жиров, и практически весь образовавшийся глицерин. Оставшаяся небольшая часть жирных к-т выделяется с фекалиями в неизмененном виде или жеподвергается воздействию микробной флоры кишечника. При этом происходит восстановление непредельных жирных к-т, образование оксикислот, к-т с разветвленной боковой цепью и т. п. В целом за сутки у человека с фекалиями выделяется ок. 5 г жирных к-т, причем не менее чем половина их имеет полностью микробное происхождение. С мочой выделяется небольшое количество короткоцепочечных жирных к-т (уксусная, масляная, валериановая), а также бета-оксимасляная и ацетоуксусная к-ты. Количество последних в суточной моче составляет от 3 до 15 мг. Появление высших жирных к-т в моче наблюдается при липоидном нефрозе, переломах трубчатых костей, при заболеваниях мочевых путей, сопровождающихся усиленным слущиванием эпителия, и при состояниях, связанных с появлением в моче альбумина (альбуминурия).
Регуляция жирового обмена
Ж. о. находится под регулирующим влиянием ц. н. с., к-рое осуществляется непосредственным направлением импульсов к жировым тканям или к железам внутренней секреции. Участие высших отделов ц. н. с. в регуляции Ж. о. наглядно иллюстрируется экспериментами, в которых повреждение гипоталамической области мозга вызывало у животных развитие ожирения.
Влияние ц. н. с., как было установлено еще исследованиями И. П. Павлова и его сотрудников, проявляется уже на этапе расщепления и всасывания жиров в жел.-киш. тракте путем воздействия на количество секретируемых пищеварительных соков и на содержание в них в зависимости от состава пищи различных ферментов, в т. ч. и липаз. Денервация изолированных оперативным путем участков жел.-киш. тракта, а также состояние наркоза приводят к замедлению расщепления и всасывания жиров.
Нейрогормональное влияние на Ж. о. в первую очередь связано с регулированием процесса мобилизации жирных к-т из жировых депо (табл.) Хорошо известно, что при эмоциональных стрессах в крови резко повышается содержание НЭЖК. Этот феномен объясняется резким увеличением выброса в кровь катехоламинов и активацией последними аденилатциклазы в жировой ткани. В конечном итоге происходит активация липолиза и освобождение НЭЖК. Длительно продолжающийся отрицательный эмоциональный стресс может вызвать таким путем заметное похудание. Жировая ткань, кроме того, иннервируется волокнами симпатической нервной системы, и возбуждение этих волокон сопровождается выделением норадреналина непосредственно в жировую ткань и активацией в ней липолиза. Вот почему денервация жировой ткани приводит к накоплению в ней жира. Через активацию или угнетение липолиза осуществляется действие на Ж. о. и многих других гормонов — глюкокортикоидов (см. Глюкокортикоидные гормоны), глюкагона (см.), АКТГ (см. Адренокортикотропный гормон), липомобилизующего фактора гипофиза (см. Липотропные факторы гипофиза), тироксина (см.), а также реализуется влияние различных физиол, состояний организма (голодание, охлаждение и др.).
Таблица. Влияние некоторых факторов на мобилизацию жирных кислот из жировой ткани
Предполагаемый механизм действия
Катехоламины, глюкагон, тироксин, глюкокортикоиды
Ускорение синтеза аденилатциклазы и гормоночувствительной липазы
Ослабление действия катехоламинов на аденилатциклазу; угнетение аденилатциклазы
Торможение освобождения жирных к-т в результате активации гликолиза в жировой ткани; угнетение аденилатциклазы
Стресс, физическая нагрузка, голодание, охлаждение
Стимуляция секреции катехоламинов и угнетение секреции инсулина
Как уже отмечалось, увеличение концентрации глюкозы в жировой ткани и повышение скорости гликолиза угнетают липолиз. К этому следует добавить, что повышение концентрации глюкозы в крови стимулирует секрецию инсулина, являющегося ингибитором аденилатциклазы, что также приводит к угнетению липолиза. Т. о., когда в организм поступает достаточное количество углеводов и скорость их расщепления высока, мобилизация НЭЖК и их окисление идут с пониженной скоростью. Как только запасы углеводов истощаются и снижается интенсивность гликолиза, происходит усиление липолиза, в результате чего ткани получают повышенные количества жирных к-т для окисления. Вместе с тем повышение содержания длинноцепочечных жирных к-т вызывает понижение интенсивности утилизации и окисления глюкозы, напр, в мышцах. Все это свидетельствует о том, что Ж. о. и углеводный обмен (см.)— главные энергообразующие процессы в животном организме — настолько тесно связаны друг с другом, что многие факторы, влияющие на один обмен, прямо или косвенно сказываются на течении другого.
Говоря о гормональном влиянии на Ж. о., следует отметить активирующее влияние гормона щитовидной железы на окисление жирных к-т, а также стимулирующее действие инсулина на синтез жиров из углеводов. Гиперфункция щитовидной железы сопровождается похуданием и уменьшением запасного жира, гипофункция — нередко ожирением. Удаление половых желез (кастрация) вызывает у животных и часто у человека избыточное отложение жира.
Немаловажное значение в регуляции Ж. о. имеет характер питания. Длительное избыточное потребление пищи, богатой жирами и углеводами, приводит к значительному отложению жира, и в этом случае никакие регуляторные механизмы не могут предотвратить этот процесс. При недостатке в пище липотропных веществ (см.), в частности фосфатидов или веществ, входящих в их состав (холина, инозита), а также метионина (см.) наблюдается избыточное отложение жира в печени («жировая печень»). Появление «жировой печени» объясняется скорее всего тем, что в отсутствие фосфатидов печень не может утилизировать триглицериды для образования липопротеидов. В поджелудочной железе обнаружено вещество липокаин (см.), введение к-рого предотвращает развитие «жировой печени».
Нарушения жирового обмена
Нарушение всасывания жиров
Одной из причин пониженного всасывания жиров в тонком кишечнике может быть недостаточно полное их расщепление либо вследствие пониженной секреции панкреатического сока (недостаток панкреатической липазы), либо вследствие пониженного выделения желчи (недостаток желчных к-т для эмульгирования жира и образования жировых мицелл). Второй, наиболее частой причиной пониженного всасывания жира является нарушение функции кишечного эпителия, наблюдаемое при энтеритах, гиповитаминозах, недостаточности коры надпочечников и некоторых других патол, состояниях. В этом случае бета-моноглицериды и жирные к-ты, образовавшиеся в полости кишечника, не могут нормально всасываться из-за повреждения эпителиального покрова кишечника.
Нарушение всасывания жиров наблюдается при панкреатитах различной этиологии, закупорке желчевыводящих путей, массивной резекции тонкого кишечника, а также при осложнениях после хирургического вмешательства, при резекциях желудка и пищевода. В последнем случае причину нарушения всасывания жиров связывают с перерезкой волокон блуждающего нерва, приводящей к понижению тонуса желчного пузыря и замедленному поступлению желчи в кишечник. Пониженное всасывание жира отмечается при гипогаммаглобулинемиях, болезни спру (см.), болезни Уиппла (см. Интестинальная липодистрофия), при лучевой болезни, а иногда и при лучевой терапии.
Нарушение всасывания жира в тонком кишечнике приводит к появлению большого количества жира и жирных к-т в кале — стеаторее (см.). При длительном нарушении всасывания жира наблюдается пониженное поступление в организм жирорастворимых витаминов.
Нарушение процессов перехода жира из крови в ткани
При недостаточной активности липопротеидлипазы наблюдается нарушение перехода жирных к-т из хиломикронов и липопротеидов низкой плотности (пре-бета-липопротеидов) плазмы крови в жировые депо. Наиболее резко это нарушение представлено при I типе гиперлипопротеинемии [по классификации Фредриксона (D. S. Fredrickson) с сотр.]. Этот тип гиперлипопротеинемии, называемый также «индуцированной жирами липемией» или гиперхиломикронемией, характеризуется тем, что вследствие полного отсутствия активности липопротеидлипазы наследственного характера триглицериды плазмы крови не могут подвергаться расщеплению и накапливаются в крови. Плазма крови в таких случаях имеет молочный цвет из-за чрезвычайно высокого содержания хиломикронов, а при ее стоянии всплывает сливкообразный слой хиломикронов. Наиболее эффективное лечение этого заболевания заключается в замене природных жиров синтетическими, содержащими короткоцепочечные жирные к-ты с 8—10 углеродными атомами, всасывающимися из кишечника непосредственно в кровь без предварительного образования хиломикронов. При V типе гиперлипопротеинемии, называемом также «смешанной гиперлипемией», вследствие пониженной активности липопротеидлипазы в крови накапливаются вместе с хиломикронами пре-бета-липопротеиды. Внутривенное введение гепарина, являющегося активатором липопротеидлипазы, больным с V типом гиперлипопротеинемии приводит к просветлению плазмы крови (при I типе введение гепарина не дает эффекта). При V типе гиперлипопротеинемии назначается диета с низким содержанием жиров и ограниченным содержанием углеводов.
При нарушении процесса превращения пре-бета-липопротеидов в бета-липопротеиды в крови накапливаются так наз. патологические «флотирующие» бета-липопротеиды (III тип гиперлипопротеинемии). Для больных с III типом гиперлипопротеинемии характерна пониженная толерантность к углеводам: нагрузка углеводами приводит к стойкому увеличению содержания триглицеридов и пре-бета-липопротеидов в крови. Характерно частое сочетание этого типа гиперлипопротеинемии с диабетом.
Избыточное накопление жира в жировой ткани
У практически здоровых людей, особенно среднего и пожилого возраста, нередко наблюдается избыточное отложение жира в подкожной жировой клетчатке и других жировых тканях. Причиной такого отложения жира является излишнее потребление пищи, общая калорийность к-рой превышает энергетические затраты организма. Избыточное отложение жира часто наблюдается при переходе от физически активной деятельности к малоподвижному образу жизни, когда сохраняется прежний уровень возбудимости пищевого центра и прежний аппетит, а энерготраты организма значительно снижаются. Патол. ожирение (см.) наблюдается в тех случаях, когда отдельно или в комплексе действуют следующие факторы: 1) пониженная активность жировой ткани в отношении мобилизации жира и повышенная активность ее в отношении отложения жира, 2) усиленный переход углеводов в жиры, 3) повышенная возбудимость пищевого центра, 4) пониженная по сравнению с нормой мышечная подвижность. Понижение активности жировой ткани в отношении мобилизации жира наблюдается, напр., при поражениях гипоталамических центров, когда ослабляются импульсы, идущие в жировую ткань по симпатическим путям и ускоряющие липолиз триглицеридов. Торможение мобилизации жира из его депо имеет также место при ослаблении функции щитовидной железы и гипофиза, гормоны которых (тироксин, тиреотропный и соматотропный гормоны, липомобилизующий фактор гипофиза) активируют липолиз. Пониженная функция половых желез приводит к избыточному отложению жира, особенно если она сопровождается нарушением деятельности гипофиза, гипоталамических центров и понижением мышечной активности (см. Адипозо-генитальная дистрофия; Иценко—Кушинга болезнь; Лоренса—Муна—Бидля синдром). Усиление перехода углеводов в жиры и отложение их в жировой ткани имеет место при повышенной секреции АКТГ, глюкокортикоидов и инсулина. Гиперсекреция инсулина является главным фактором в развитии так наз. наследственно-конституционного ожирения.
Необычное отложение жира может наблюдаться в отдельных участках жировой ткани, в т. ч. располагающихся по зонам распространения нервных волокон определенных сегментов ц. н. с., что указывает на то, что подобное отложение жира или, наоборот, атрофия подкожной жировой ткани связаны с изменением трофической функции нервной системы как в центральных его отделах, так и периферических (см. Деркума болезнь, Липоматоз, Липодистрофия, Маделунга синдром).
Недостаточное отложение жира в жировой ткани (исхудание) развивается вследствие угнетения возбудимости пищевого центра (см. Анорексия), понижения всасывания жиров и углеводов (напр., при энтеритах), преобладания процессов мобилизации жира из жировой ткани над его отложением и при длительном голодании.
Нарушение образования жира из углеводов может наблюдаться при поражениях вегетативных (трофических) центров гипофизарно-диэнцефалической системы, а также коры надпочечников. Такие нарушения лежат в основе прогрессирующего истощения при болезни Симмондса (см. Гипофизарная кахексия) и аддисоновой болезни (см.).
Жировая инфильтрация печени
Накопление жира в печеночных паренхиматозных клетках часто является реакцией печени на различные заболевания, токсические воздействия и повреждения. С биохим, точки зрения накопление жира в печени происходит тогда, когда скорость образования в ней триглицеридов превышает скорость их утилизации (липолиз триглицеридов и последующее окисление жирных к-т, включение триглицеридов в пре-бета-липопротеиды и их секреция в кровяное русло).
Жировая инфильтрация печени наблюдается при диабете, ожирении, белковой недостаточности, при отравлении четыреххлористым углеродом, фосфором, алкоголем и при недостаточности липотропных веществ.
Одним из наиболее распространенных нарушений Ж. о. у человека является кетоз — повышенное образование в организме, накопление в тканях и крови и выделение с мочой кетоновых тел.
Жировой обмен при лучевом поражении
В результате радиоактивного облучения в различных тканях организма Ж. о. претерпевает выраженные изменения, которые имеют и качественные и временные особенности, зависящие от вида ткани. Поражение при облучении тонкого кишечника приводит к уменьшению содержания липопротеидов, фосфолипидов, жирных к-т и холестерина в слизистой оболочке, что обусловлено наряду с деструкцией клеток подавлением синтеза липидов. Активность гидролитических ферментов в слизистой оболочке тонкой кишки понижается, в результате чего снижается интенсивность расщепления жиров и всасывания триглицеридов; всасывание жирных к-т угнетается в меньшей степени. В зависимости от условий питания содержание липидов в печени увеличивается или остается нормальным, но в любом случае усиливается синтез общих липидов и их отдельных фракций — триглицеридов, фосфолипидов, жирных к-т и холестерина. При этом происходит угнетение синтеза жиров, сопряженного с гликолизом (или гликогенолизом) и активация синтеза жиров из уксусной к-ты.
В результате изменений Ж. о. после облучения в печени, как правило, развивается гиперлипемия (после неспецифической реакции). В ранние сроки после облучения гиперлипемия обусловлена увеличением содержания триглицеридов, фосфолипидов, холестерина и его эфиров, а в более поздние — и жирных к-т. В основе механизма пострадиационной гиперлипемии лежит не столько мобилизация липидов из периферических депо, сколько усиление их биосинтеза в печени. Механизм переноса липидов из крови в ткани после облучения не изменяется. Стимуляция биосинтеза жиров в печени из уксусной к-ты не является результатом прямого воздействия облучения на печень, а первично обусловлена пострадиационной деструкцией радиочувствительных тканей, катаболиты к-рой, гл. обр. лактат и аминокислоты, поступая в избытке в печень, индуцируют глюконеогенез, что сопряжено с угнетением гликолиза и соответственно синтеза липидов из глюкозы и усилением синтеза липидов из уксусной к-ты в результате активизации ферментной системы, катализирующей биосинтез жирных к-т.
В первые дни после облучения в жировой ткани усиливается синтез липидов из глюкозы и ее метаболитов, что также связано с активизацией глюконеогенеза и последующей гипергликемией и увеличением содержания инсулина в крови. В более поздние сроки после облучения синтез жиров в жировой ткани понижается и сменяется мобилизацией жиров. Указанные изменения Ж. о. начинают развиваться через несколько часов после облучения, вскоре достигают максимума и остаются на этом уровне в течение нескольких дней. У большинства экспериментальных животных эти нарушения Ж. о., вызванные облучением, нивелируются в течение недели, за исключением мобилизации липидов из депо, к-рая продолжается еще нек-рое время, и имеют количественные и качественные видовые особенности. В лимфоидной ткани (тимус и селезенка) через несколько часов после облучения увеличивается концентрация общих липидов и жирных к-т, а также стимулируется синтез холестерина и общих липидов. В эти же сроки в костном мозге наблюдается увеличение содержания жирных к-т, содержание же липидов возрастает позднее; на протяжении недели после облучения в костном мозге происходит синусоидальное увеличение и уменьшение концентрации насыщенных и ненасыщенных жирных к-т при нормальном общем содержании жирных к-т в сыворотке крови. Увеличение содержания липидов в костном мозге обусловлено усилением их биосинтеза преимущественно в кроветворных, а не в жировых клетках. Наряду с повышением интенсивности синтеза липидов в костном мозге после первоначального усиления отмечается резкое и длительное торможение окисления жирных к-т до CO2 и H2O, к-рое продолжается и после восстановления нормального клеточного состава костного мозга. В радиорезистентных тканях (головной мозг, почки, легкие, скелетные мышцы и мышцы сердца) существенных изменений в Ж. о. не происходит. Активизация синтеза холестерина в надпочечниках связана с развивающейся после облучения стрессовой реакцией и усилением биосинтеза кортикостероидов из холестерина.
Жировой обмен у детей
Состав триглицеридов в жировой ткани новорожденного отличен от материнского, т. к. человеческий плод синтезирует индивидуальноспецифические жиры из НЭЖК и глюкозы, поступающих трансплацентарно или с током пуповинной крови.
Доля жира в теле новорожденного зависит от его веса при рождении: при весе 1500 г она составляет примерно 3%, 2500 г — 8%, а 3500 г — 16% (норма). Жировая ткань ребенка содержит большее по сравнению с жировой тканью взрослого человека количество ди-глицеридов, воды, гликогена, ДНК, фосфолипидов и меньшее — нейтральных жиров, ненасыщенных жирных к-т с длинной углеродной цепью, холестерина; характерно также снижение величины коэффициента холестерин/фосфолипиды. С возрастом эти особенности постепенно нивелируются.
Гистол, и анатомической особенностью жировой ткани новорожденных является наличие скоплений бурого жира (до 8% от веса тела) вокруг органов, между лопатками, позади грудины, вокруг шеи, вдоль позвоночника. Этот жир играет роль своеобразного терморегулятора в силу высокой теплопродукции, обеспечиваемой большим содержанием в митохондриях цитохромов. Гипоксемические и железодефицитные состояния у детей (пневмонии, анемии, интоксикации) сопровождаются истощением бурого жира, резким снижением теплопродукции, что может способствовать легкому возникновению переохлаждения новорожденного.
У ребенка всех возрастов выше, чем у взрослых, способность синтезировать и накапливать жир, интенсивнее окисление жирных к-т, активнее процесс включения 14C-глюкозы в жирные к-ты и триглицериды клеток жировой ткани, более высока концентрация КоА. По мере роста и развития ребенка эти различия стираются.
Липолитическая активность сыворотки крови у детей стабильна, мало отличается от активности липаз в сыворотке крови взрослых, но степень торможения липолиза глюкозой с возрастом увеличивается, а активация адреналином уменьшается.
В первые часы жизни ребенка наблюдаются значительные изменения величины соотношения НЭЖК и глицерина сыворотки крови; у грудного ребенка она ниже, чем у взрослых. При недоношенности и гипотрофии величина этого соотношения резко уменьшается; в крови снижается и содержание высших ненасыщенных жирных к-т относительно общего количества ненасыщенных жирных к-т, что объясняется замедленностью обменных процессов.
В крови новорожденных сравнительно низка концентрация липидов и липопротеидов. Так, среднее содержание общего холестерина составляет ок. 70 мг%, а триглицеридов ок. 40 мг%. При низком содержании всех классов липопротеидов характерно сравнительно высокое относительное содержание альфа-липопротеидов. Концентрация НЭЖК в крови новорожденных может быть ниже или выше по сравнению с концентрацией НЭЖК в крови матери,— это зависит от веса новорожденного, его доношенности или недоношенности, состояния питания (нормо-, гипо- или паратрофия); она подвержена более значительным, чем у взрослых, колебаниям под влиянием количества и качества пищи (углеводистая и жирная пища повышает концентрацию НЭЖК, белковая — снижает) и различных заболеваний. Физ. и психические нагрузки, голодание, гормоны коры надпочечников, гипофиза, щитовидной железы способствуют более легкому повышению концентрации НЭЖК, а введение глюкозы, инсулина и белка — такому же снижению концентрации НЭЖК в крови у детей (по сравнению со взрослыми).
У новорожденных детей отмечается преобладание НЭЖК над этерифицированными жирными к-тами (ЭЖК), у грудных детей и детей более старшего возраста это соотношение обратное, как и у взрослых; остальные показатели липидного обмена также приближаются к аналогичным показателям у взрослых.
У новорожденных детей и детей раннего возраста расщепление и всасывание жиров имеет ряд особенностей. Они обусловлены функциональной незрелостью печеночных клеток и проявляются относительным недостатком желчных к-т, лимитированным вследствие этого эмульгированием жиров в кишечнике и нарушением их переноса через эпителий слизистой оболочки. Поэтому у детей чаще, чем у взрослых, встречаются диареи, связанные с расстройством переваривания и всасывания липидов.
Концентрация хиломикронов нарастает пропорционально степени зрелости ребенка: у недоношенных их число в 1 мм 2 счетной камеры составляет 1400, у доношенных— 7800. Это тоже является причиной более легкого развития нарушений липидного обмена у недоношенных детей.
Лабильность функционального состояния систем регуляции Ж. о., свойственная ребенку, ведет (особенно у недоношенных детей и у детей с гипотрофиями или паратрофиями) к более стойким и выраженным, чем у взрослых, изменениям состава липидов крови (дислипидемии) при воспалительных и аллергических заболеваниях кожи, инфекциях, интоксикациях, расстройствах пищеварения, повышенной чувствительности к аллергенам, при нарушениях роста и развития. У детей чаще наблюдается гиперлипемия, обусловленная адаптационным усилением мобилизации депонированных жиров, к-рое у недоношенных детей и детей с гипотрофиями вызывает такое быстрое и глубокое истощение энергоресурсов, что это может угрожать жизни больного. Эти особенности должны учитываться при назначении таким детям комплексной терапии (искусственное насыщение питательными веществами, смесями, близкими по составу к грудному молоку, глюкозой и физиологически активными препаратами: АТФ, витамином С и витаминами группы В, ферментами, ускоряющими переваривание и всасывание жиров и углеводов, анаболическими гормонами).
Не все нарушения липидного состава крови у детей носят вторичный характер. С целью ранней диагностики возможных первичных наследственных дислипидемий у ребенка всякая гиперлипемия и другие выявленные изменения Ж. о. требуют тщательного анализа этиол, факторов, учета семейного анамнеза, точной идентификации характера изменений, сопоставления их с клиникой и другими обменными и гормональными показателями. См. также Гаргоилизм, Гиперхолестеринемия, Гоше болезнь, Липемия, Липидозы, Ниманна-Пика болезнь, Сфинголипидозы, Хенда-Шюллера-Крисчена болезнь.
Изменения жирового обмена в процессе старения
Нарушения Ж. о. при старении проявляются прежде всего в повышении общего содержания жира в организме. В старости снижается абсолютная скорость накопления жира, но относительный его прирост (в процентах к сухому весу) выше, чем в молодом возрасте. Общее содержание жира увеличивается и в тканях (в жировых депо, печени, скелетной мускулатуре, селезенке и др.), и в крови (у мужчин 60— 74 лет до 472,5 ± 27,6 мг%, у женщин этого же возраста до 517,9 ± 26,6 мг%). В старости, по данным большинства исследователей, увеличивается содержание общего холестерина в крови (см. Гиперхолестеринемия), максимальная его концентрация в крови (260 мг%) наблюдается у мужчин в 40—50 лет, а у женщин приблизительно на 10 лет позже. Повышение концентрации общего холестерина происходит как за счет его свободной, так и за счет эфирносвязанной фракций, содержание его увеличивается в стенках аорты, в межреберных и межпозвоночных хрящах, в головном мозге, печени, почках, селезенке, в сердечной и скелетных мышцах. В коже концентрация холестерина снижается, а в легких и надпочечниках остается на прежнем уровне. Не установлена прямая зависимость между концентрацией холестерина в крови и содержанием его в тканях. С возрастом холестерин накапливается и в субклеточных структурах (ядрах, митохондриях, микросомах), что может приводить к снижению проницаемости клеточных мембран и тем самым — к нарушению процессов обмена веществ.
Верещагин А. Г. Биохимия триглицеридов, М., 1972, библиогр.; Габуния Р. И. Метод радиометрии всего тела в клинической диагностике, М., 1975, библиогр.; Геронтология и гериатрия, 1971, Ежегодник, под ред. Д. Ф. Чеботарева, с. 82, Киев, 1971; Климов А. Н. и Никульчева Н.Г. Типы гиперлипопротеинемий, их связь с атеросклерозом и лечение, Кардиология, т. 12, № 6, с. 133, 1972, библиогр.; Коровина Н. А., Барышков Ю. А. и Вельтищев Ю.Е. О физиологии и патологии липидного обмена у детей, Педиатрия, № 2, с. 74, 1967, библиогр.; Лейтес G. М. Физиология и патология жировой ткани, М., 1954; Липиды — структура, биосинтез, превращения и функции, под ред. С. Е. Северина, М., 1977; Мороз Б.Б. и Кендыш И. Н. Радиобиологический эффект и эндокринные факторы, М., 1975, библиогр.; Ныос-холм Э. и Старт К. Регуляция метаболизма, пер. с англ., с. 346, М., 1977; Рачев Л., Тодоров Й. и Статева Ст. Обмен веществ в детском возрасте, пер. с болг., София, 1967, библиогр.; Экспериментальный атеросклероз и возраст, под ред. H. Н. Горева, М., 1972, библиогр.; Adipose tissue, ed. by B. Jeanrenaud a. D. Hepp, Stuttgart a. o., 1970; Biochemical problems of lipids, ed. by A. C. Frazer, Amsterdam a. o., 1963; Blood lipids and lipoproteins, quantitation, composition and metabolism, ed. by G. J. Nelson, N. Y. a. o., 1972; Current trends in the biochemistry of lipids, International symposium on lipids, ed. by J. Ganguly a. R. M. S. Smellie, L.—N. Y., 1972; Intestinal absorption in man, ed. by I. Me Colia. G. E. G. Sladen, L., 1975; Jackson R. L., Morrisett J. D. a. Gotto A. M. Lipoprotein structure and metabolism, Physiol. Rev., v. 56, p. 259, 1976, bibliogr.; KingK. C, a. o. Sources of fatty acid in the newborn, Pediatrics, v. 47, Suppl. 2, p. 192, 1971; Lipid metabolism, ed. bv S. J. Wakil, N. Y.—L., 1970; Masoro E. J. Physiological chemistry of lipids in mammals, Philadelphia a. o., 1968; Scow R. O., Вlanchette-Mackie E. J. a. Smith L. C. Role of capillary endothelium in the clearance of chylomicrons, Circulat. Res., v. 39, p. 149, 1976; Searcу R. L. Lipopathies, Springfield, 1971.
A. H. Климов; Л. H. Богацкая (геронт.), А. В. Картелишев (пед.), И. Н. Кендыш (рад. био.).