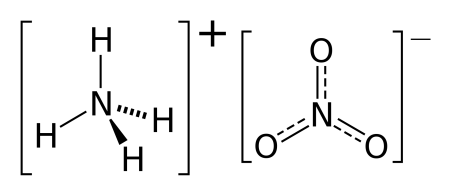На что разлагается нитрат аммония
Нитрат аммония
Характеристики и физические свойства нитрата аммония
Он хорошо растворяется в воде (гидролизуется по катиону). Кристаллогидратов не образует.
Рис. 1. Нитрат аммония. Внешний вид.
Таблица 1. Физические свойства нитрата аммония.
Плотность (20 o С), г/см 3
Температура плавления, o С
Температура кипения, o С
Температура разложения, o С
Растворимость в воде (20 o С), г/100 мл
Получение нитрата аммония
Нитрат аммония имеет большое промышленное значения. Для его получения наиболее часто используют следующие методы:
— реакция взаимодействия безводного аммиака с азотной кислотой
Химические свойства нитрата аммония
Нитрат аммония — это средняя соль, образованная слабым основанием – гидроксидом аммония (NH4OH) и сильной кислотой – азотной (HNO3).Гидролизуется по катиону. Характер среды водного раствора нитрата аммиака кислый. Уравнение гидролиза будет выглядеть следующим образом:
Нитрат аммония разлагается концентрированными щелочами:
В ОВР может проявлять свойства как слабого окислителя, так и слабого восстановителя:
Нитрат аммония разлагается при нагревании:
Применение нитрата аммония
Примеры решения задач
| Задание | Какой объем оксида азота (I) выделится в ходе реакции разложения нитрата аммония, если в неё вступило 15 г соли? |
| Решение | Оксида азота (I) выделяется при разложении нитрата аммония только в случае нагревания соли до температуры, не превышающей 200 o С. Запишем уравнение реакции: |
Рассчитаем количество нитрата аммония, вступившего в реакцию (молярная масса равна 80 г/моль):
Согласно уравнению, n(NH4NO3) : n(N2O) = 1:1, значит,
Тогда, объем выделяющегося оксида азота (I) будет равен:
V (N2O) = 0,2 × 22,4 = 4,48 л.
ОтветОбъем оксида азота (I) равен 4,48 л.| Задание | Какой объем азота выделится в ходе реакции разложения нитрата аммония, если в неё вступило 25 г соли? |
| Решение | Азот выделяется при разложении нитрата аммония только в случае нагревания соли до температуры выше 200 o С. Запишем уравнение реакции: |
Рассчитаем количество нитрата аммония, вступившего в реакцию (молярная масса равна 80 г/моль):
Тогда, объем выделяющегося оксида азота (I) будет равен:
Нитрат аммония
210 °C
| Нитрат аммония | |
 | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Нитрат аммония |
| Химическая формула | NH4NO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдый |
| Отн. молек. масса | 80,04 а. е. м. |
| Молярная масса | 80,04 г/моль |
| Плотность | 1,725 (IV модификация) г/см³ |
| Термические свойства | |
| Температура плавления | 169,6 °C |
| Температура кипения | 235 °C |
| Температура разложения | |
| Химические свойства | |
| Растворимость в воде | 20 °C — 190 г/100 мл |
| Классификация | |
| Рег. номер CAS | 6484-52-2 |
Нитра́т аммо́ния (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году.
Содержание
Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при повышенном давлении — 235 °C. Молекулярная масса 80,04 а. е. м.. Скорость детонации 2570 м/с.
Растворимость
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 25 | 212 |
| 50 | 346 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём (
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
А также амфотерный метод.
Химические свойства
Реакции разложения
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
Кристаллические (=)состояния нитрата аммония| Система | Диапазон температур (°C) | Состояние | Изменение объёма (%) |
|---|---|---|---|
| — | > 169.6 | жидкость | |
| I | 169.6 — 125.2 | кубическая | +2.1 |
| II | 125.5 — 84.2 | тетрагональная | −1.3 |
| III | 84.2 — 32.3 | α-ромбическая | +3.6 |
| IV | 32.3 — −16.8 | β-ромбическая | −2.9 |
| V | ПрименениеВзрывчатые веществаНаиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси: УдобренияБо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений. Аварии и взрывыДополнительная информацияМировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот. Термическое разложение нитрата аммония, его огне — и взрывоопасностьВзрывоопасность нитрата аммония возрастает в присутствии минеральных кислот л легко окисляющихся материалов, таких как органические вещества и некоторые металлы, особенно в порошкообразном состоянии (например, алюминий, цинк, свинец, сурьма, висмут, никель, медь, кадмий). В большинстве случаев в присутствии этих металлов (особенно кадмия и меди) образуется неустойчивый, легко разлагающийся нитрит аммония. При увеличении размера частиц и повышении влажности взрывоопасность аммиачной селитры значительно уменьшается. Влажная соль, содержащая более 3% воды, не взрывает даже при взрыве детонатора 58’5Э. При нагревании нитрат аммония начинает разлагаться согласно уравнению: Это разложение становится заметным выше 150°, но, даже при 165°, потеря в весе аммиачной селитры не превосходит 6% за сутки. При более высоких температурах нитрат аммония разлагается интенсивно по следующим реакциям 67: при 200—270′ (Теплоты этих реакций даны для 18° и для газообразного состояния продуктов реакции.) Последнее уравнение соответствует взрывному разложению NH4N03. Термическое разложение NH4N03 может происходить одновременно по нескольким реакциям, причем одна из них может доминировать над другими. Термический распад азотной кислоты обусловливает появление в газообразных продуктах разложения аммиачной селитры N0 и NO2. По-видимому, выделяющиеся в результате термического распада азотной кислоты N02 и Н20 являются катализаторами дальнейшего разложения NH4NO368. Термическое разложение расплавленной аммиачной селитры ускоряется также в присутствии соединений Сг6+, Сг3+, Сг2+ и др. 69. Таким образом, чистую аммиачную селитру следует безусловно отнести к классу потенциально взрывчатых веществ. С другой стороны, легкую воспламеняемость и взрываемость аммиачной селитры, находящейся в непроветриваемых закрытых помещениях, можно объяснить не повышением общего давления, что является вторичной причиной, а накоплением продуктов медленного разложения селитры. Самопроизвольное разложение аммиачной селитры в присутствии способных окисляться, например, органических веществ является автокаталитическнм. Такое разложение может привести к воспламенению и взрыву. Автокатализ вызывается главным образом образующейся при разложении NH4N03 двуокисью азота, а также, но в меньшей мере, водяным паром. Последнее обстоятельство указывает на недопустимость тушения воспламенившейся селитры водяным паром. Стабилизаторами, предотвращающими самопроизвольное разложение аммиачной селитры, могут быть вещества, связывающие образующиеся при ее разложении азотную кислоту и NO2, или выделяющие при взаимодействии с NH4N03 аммиак. Последний нейтрализует азотную кислоту и восстанавливает окислы азота до элементарного азота. Стабилизаторами являются, например, карбамид (0,05—0,1% от веса селитры)70-73, карбонат кальция или магния (5%), хлориды, уротропин и др.67. TOC o «1-3» h z В аммиачной селитре. 1 сульфате аммония. 1,3 кальциевой селитре. 1,5 Состав аммиачной селитры приведен в табл. 89. Состав аммиачной селитры (в %) Нитратного й аммиачного азота в сухом веществе в пересчете: Добавок в сухом веществе: Фосфатов (Р205), не Менее. Нлн нитратов Са н Mg (СаО), не менее Не растворимых веществ: В соляной кислоте, не более. Мельче 1 мм, не более. Жирных кислот и парафина. Кислотность (на HNO3), Не более. Нитрат аммония | NH 4 NO 3 | |
| Молярная масса | 80,043 г / моль | ||
| Внешность | бесцветный | ||
| Плотность | 1,725 г / см 3 (20 ° C) | ||
| Температура плавления | 169,6 ° С (337,3 ° F, 442,8 К) | ||
| Точка кипения | ок. 210 ° С (410 ° F, 483 К) разлагается | ||
| Эндотермический 118 г / 100 мл (0 ° C) 150 г / 100 мл (20 ° C) 297 г / 100 мл (40 ° C) 410 г / 100 мл (60 ° C) 576 г / 100 мл (80 ° C) ) 1024 г / 100 мл (100 ° C) [1] | |||
| тригональный | |||
| Взрывоопасные данные | |||
| Чувствительность к ударам | очень низкий | ||
| Чувствительность к трению | очень низкий | ||
| Скорость детонации | 2500 м / с | ||
| Опасности | |||
| Основные опасности | Взрывчатое вещество, окислитель | ||
| Пиктограммы GHS | |||
| Сигнальное слово GHS | Опасность | ||
Многие страны постепенно отказываются от его использования в потребительских приложениях из-за опасений по поводу его возможности неправильного использования. [6] С начала 20 века в результате случайных взрывов нитрата аммония погибли тысячи людей. СодержаниеВозникновение [ править ]Производство, реакции и кристаллические фазы [ править ]Промышленное производство нитрата аммония влечет за собой кислотно-щелочную реакцию с аммиаком с азотной кислотой : [10] Ca (NO 3 ) 2 + 2 NH 3 + CO 2 + H 2 O → 2 NH 4 NO 3 + CaCO 3 Нитрат аммония также может быть получен посредством реакций метатезиса : (NH 4 ) 2 SO 4 + Ba (NO 3 ) 2 → 2 NH 4 NO 3 + BaSO 4 NH 4 Cl + AgNO 3 → NH 4 NO 3 + AgCl Реакции [ править ]Твердый нитрат аммония разлагается при нагревании. При температуре ниже 300 ° C в результате разложения в основном образуются закись азота и вода: При более высоких температурах преобладает следующая реакция. [11] Кристаллические фазы [ править ]Наблюдается ряд кристаллических фаз нитрата аммония. Следующее происходит при атмосферном давлении. Обе формы от β-ромбической до α-ромбической потенциально присутствуют при температуре окружающей среды во многих частях мира, но имеют разницу в плотности на 3,6%. В результате этот фазовый переход и сопутствующее изменение объема с практическим следствием того, что нитрат аммония, образующийся в качестве топлива твердого ракетного двигателя, образует трещины. По этой причине был исследован стабилизированный фазой нитрат аммония (PSAN), который включает галогениды металлов в качестве стабилизаторов. [14] Приложения [ править ]Удобрение [ править ]Взрывчатые вещества [ править ]Нитрат аммония входит в состав некоторых взрывчатых веществ. Примеры взрывчатых веществ, содержащих нитрат аммония, включают: Смесь с мазутом [ править ]Терроризм [ править ]Ниша использует [ править ]Безопасность, обращение и хранение [ править ]Существуют многочисленные инструкции по безопасности при хранении и обращении с нитратом аммония. Данные о здоровье и безопасности показаны в паспортах безопасности, которые можно получить у поставщиков и от различных правительств. [21] [22] [23] Чистая нитрат аммония не горит, но как сильный окислитель поддерживает и ускоряет горение органических (и некоторых неорганических) материалов. [21] [24] [25] Не хранить рядом с горючими веществами. Хотя нитрат аммония стабилен при температуре и давлении окружающей среды во многих условиях, он может взорваться от сильного инициирующего заряда. Его нельзя хранить рядом с взрывчатыми веществами или взрывчатыми веществами. Расплавленный нитрат аммония очень чувствителен к ударам и детонации, особенно если он загрязняется несовместимыми материалами, такими как горючие, легковоспламеняющиеся жидкости, кислоты, хлораты, хлориды, сера, металлы, древесный уголь и опилки. [26] [21] Нитрат аммония имеет критическую относительную влажность 59,4%, выше которой он будет поглощать влагу из атмосферы. Поэтому важно хранить нитрат аммония в плотно закрытой таре. В противном случае он может слиться в большую твердую массу. Нитрат аммония может поглощать достаточно влаги для разжижения. Смешивание нитрата аммония с некоторыми другими удобрениями может снизить критическую относительную влажность. [29] Возможность использования материала в качестве взрывчатого вещества побудила принять меры регулирования. Например, в Австралии в августе 2005 года вступили в силу Положения об опасных грузах, призванные обеспечить лицензирование обращения с такими веществами. [30] Лицензии предоставляются только заявителям (отрасли) с соответствующими мерами безопасности для предотвращения любого неправомерного использования. [31] Также могут быть рассмотрены дополнительные виды использования, например, в образовательных и исследовательских целях, но не для индивидуального использования. Сотрудники тех, у кого есть лицензии на работу с этим веществом, по-прежнему должны находиться под надзором уполномоченного персонала и должны пройти проверку безопасности и национальной полиции перед выдачей лицензии. Опасности для здоровья [ править ]Катастрофы [ править ]Нитрат аммония может взорваться по двум причинам: Нитрат аммония | |||
| Систематическое наименование | Нитрат аммония | ||
| Хим. формула | NH4NO3 | ||
| Состояние | твёрдый | ||
| Молярная масса | 80,04 г/моль | ||
| Плотность | 1,725 (IV модификация) | ||
| Т. плав. | 169,6 °C | ||
| Т. кип. | 235 °C | ||
| Т. разл. | 210 °C | ||
| Растворимость в воде | 20 °C — 190 г/100 мл | ||
| ГОСТ | ГОСТ 14702-79 | ||
| Рег. номер CAS | 6484-52-2 | ||
| PubChem | 22985 | ||
| Рег. номер EINECS | 229-347-8 | ||
| SMILES | |||
| RTECS | BR9050000 | ||
| ChEBI | 63038 | ||
| ChemSpider | 21511 | ||
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |||
Нитрат аммония (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году. Используется в качестве компонента взрывчатых веществ и как азотное удобрение.
Содержание
Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при пониженном давлении — 235 °C. Молекулярная масса 80,04 а. е.м. Скорость детонации 2570 м/с.
Растворимость
Растворимость в воде:
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 10 | 150 |
| 25 | 212 |
| 50 | 346 |
| 80 | 599 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Также соль растворима в аммиаке, пиридине, метаноле, этаноле.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём получить практически невозможно.
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
А также амфотерный метод.
Химические свойства
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
Кристаллические состояния нитрата аммония| Система | Диапазон температур (°C) | Состояние | Изменение объёма (%) | |
|---|---|---|---|---|
| — | > 169.6 | жидкость | ||
| I | 169.6 — 125.2 | кубическая | −2.13 | |
| II | 125.5 — 84.2 | тетрагональная | −1.33 | |
| III | 84.2 — 32.3 | α-ромбическая | +0.8 | |
| IV | 32.3 — −16.8 | β-ромбическая | −3.3 | |
| V | −50 — −16.8 | тетрагональная | +1.65 | |
| VI | существует при высоких давлениях | |||
| VII | 170 | |||
| VIII | существует при высоких давлениях | |||
| IX | существует при высоких давлениях |
Фазовый переход от IV к III при 32,3 °C приносит неприятности производителям удобрений, потому как изменения плотности приводят к разрушению частиц при хранении и применении. Это особенно важно в тропических странах, где нитрат аммония испытывает циклические изменения, приводящие к разрушению гранул, слёживанию, повышенному пылению и риску возникновения взрыва.
Применение
Удобрения
Бо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений. Для предотвращения создания взрывчатых веществ на основе нитрата аммония в удобрения, доступные в широкой продаже, добавляют компоненты, снижающие взрывоопасность и детонационные свойства чистого нитрата аммония, такие как мел (карбонат кальция).
В Австралии, Китае, Афганистане, Ирландии и некоторых других странах свободная продажа нитрата аммония даже в виде удобрений запрещена или ограничена. После террористического акта в Оклахома-Сити ограничения на продажу и хранение нитрата аммония были введены в некоторых штатах США.
Взрывчатые вещества
Наиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси:
Безопасный состав
Дополнительная информация
Мировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот.