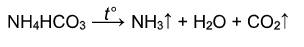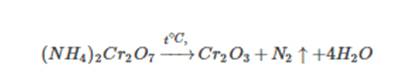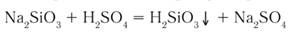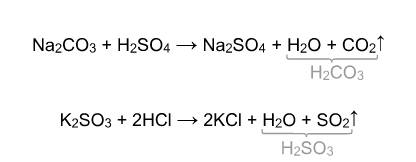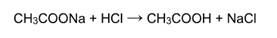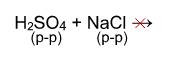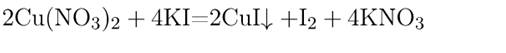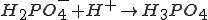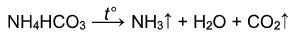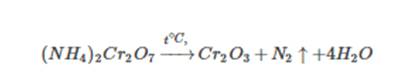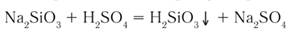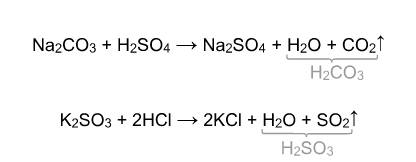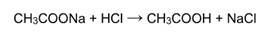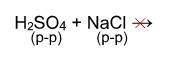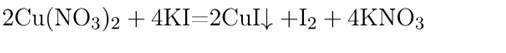На что разлагается соль
Термическое разложение основных солей



Соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl 
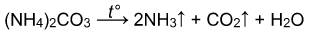
Соли аммония разлагаются с выделением аммиака:
Исключение составляют нитрат и нитрит аммония:
Также хромат аммония:
4KClO3 – без кат ®KCl + 3KClO4
2KClO3 – MnO 2 кат ®2KCl + 3O2
4) Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
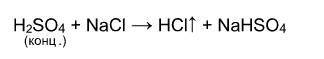
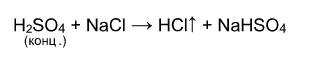
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Основные соли при действии кислот переходят в средние:
Средние соли, образованные многоосновными кислотами, при взаимодействии с ними образуют кислые соли:
5) Взаимодействие со щелочами. Со щелочами реагируют соли, катионам которых соответствуют нерастворимые основания.
6) Взаимодействие друг с другом. Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO3 + NaCl ® AgCl¯ + NaNO3 Ag + + Cl – ® AgCl¯.
Совместный гидролиз по катиону и аниону протекает с образованием нерастворимого гидроксида и слабой кислоты: 2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 6NaCl + 3CO2,
7) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
Cu+2FeCl3=CuCl2+2FeCl2 (как исключение окислительно-восстановительная реакция)
8) Электролиз (разложение под действием постоянного электрического тока). Соли подвергаются электролизу в растворах и расплавах:
2NaCl + 2H2O 
2NaClрасплав 
9) Взаимодействие с кислотными оксидами.
Na2CO3 + SiO2 
Кислые соли термически неустойчивы и при нагревании разлагаются с образованием средних солей:
Для кислых солей характерны реакции нейтрализации со щелочами:
KHSO4 + KOH 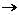
Ca(HCO3)2 + 2HCI 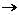
NaH2PO4 + H2SO4 = Na2SO4 + H3PO4 идет из-за образования недиссоциированной фосфорной кислоты. B ионном виде :
Основные соли при диссоциации дают катионы металла, анионы кислотного остатка и ионы ОН — :
Основные соли – продукты неполного замещения гидроксильных групп соответствующего основания на кислотные остатки.
Основные соли, также, как и кислые, термически неустойчивы и при нагревании разлагаются:
Для основных солей характерны реакции нейтрализации с кислотами:
MgOHCI + HCI 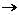
| Кислородосодержащие кислоты хлора | Соли |
| HСlO – хлорноватистая кислота | KСlO – гипохлорит калия |
| HСlO2 – хлористая кислота | KСlO2 – хлорит калия |
| HClO3 – хлорноватая кислота | KСlO3 – хлорат калия |
| HClO4 – хлорная кислота | KClO4 – перхлорат калия |
Особые реакции
BaS + 4 Br2 + 4 H2O = 8 HBr↑ + BaSO4↓
Реакции разложения
При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Разложение солей
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
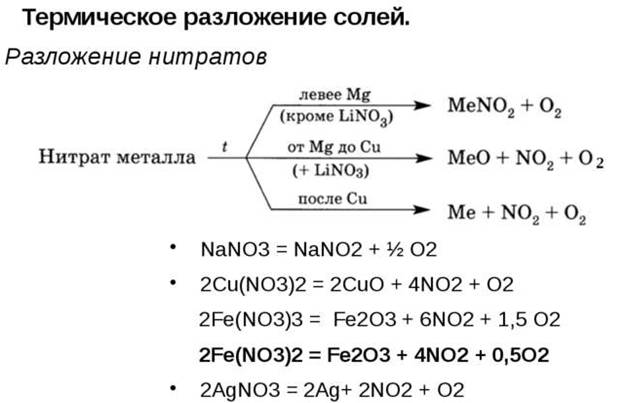
Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
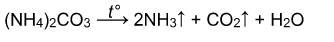
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
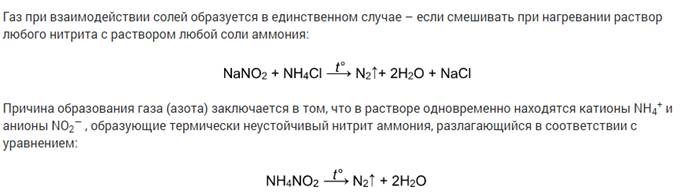
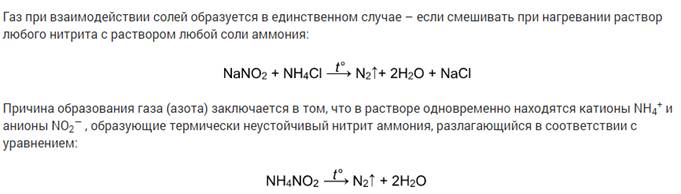
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Разложение перманганата калия
Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Термическое разложение основных солей
Химические свойства солей
1) Диссоциация. Средние, двойные и смешанные соли диссоциируют одноступенчато. У кислых и основных солей диссоциация происходит ступенчато.
[Cu(NH3)4]SO4 

2) Взаимодействие с индикаторами. В результате гидролиза в растворах солей накапливаются ионы Н + (кислая среда) или ионы ОН – (щелочная среда). Гидролизу подвергаются растворимые соли, образованные хотя бы одним слабым электролитом. Растворы таких солей взаимодействуют с индикаторами:
индикатор + Н + (ОН – )
AlCl3 + H2O 

ИЗМЕНЕНИЕ ОКРАСКИ
КИСЛОТНО-ОСНОВНЫХ ИНДИКАТОРОВ
В ЗАВИСИМОСТИ ОТ pH РАСТВОРА
| Название | Окраска индикатора в среде | ||
| AlCl3 (гидролиз по катиону ) Кислая среда [H + ] > [OH-] рН [H+] рН > 7 | |||
| Лакмус | красный | фиолетовый | синий |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Метилоранж | розовый | оранжевый | желтый |
3) Разложение при нагревании.
Многие соли устойчивы при нагревании, однако, соли аммония, некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются.
При разложении карбонатов образуются оксид металла и углекислый газ:
СаСO3 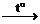
Если оксид металла неустойчив, то карбонат разлагается на металл, углекислый газ и кислород:
Термическое разложение кислых солей с образованием средней соли
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Термическое разложение основных солей
Соли бескислородных кислот при нагревании могут распадаться на простые вещества:
2AgCl 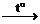
Соли аммония разлагаются с выделением аммиака:
Исключение составляют нитрат и нитрит аммония:
Также хромат аммония:
4KClO3 – без кат ®KCl + 3KClO4
2KClO3 – MnO 2 кат ®2KCl + 3O2
4) Взаимодействие с кислотами: Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок.
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Основные соли при действии кислот переходят в средние:
Средние соли, образованные многоосновными кислотами, при взаимодействии с ними образуют кислые соли:
5) Взаимодействие со щелочами. Со щелочами реагируют соли, катионам которых соответствуют нерастворимые основания.
6) Взаимодействие друг с другом. Реакция происходит, если взаимодействуют растворимые соли и при этом образуется осадок.
AgNO3 + NaCl ® AgCl¯ + NaNO3 Ag + + Cl – ® AgCl¯.
Совместный гидролиз по катиону и аниону протекает с образованием нерастворимого гидроксида и слабой кислоты: 2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 6NaCl + 3CO2,
7) Взаимодействие с металлами. Каждый предыдущий металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
Cu+2FeCl3=CuCl2+2FeCl2 (как исключение окислительно-восстановительная реакция)
8) Электролиз (разложение под действием постоянного электрического тока). Соли подвергаются электролизу в растворах и расплавах:
2NaCl + 2H2O 
2NaClрасплав 
9) Взаимодействие с кислотными оксидами.
Na2CO3 + SiO2 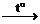
Кислые соли термически неустойчивы и при нагревании разлагаются с образованием средних солей:
Для кислых солей характерны реакции нейтрализации со щелочами:
KHSO4 + KOH 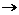
Ca(HCO3)2 + 2HCI 
NaH2PO4 + H2SO4 = Na2SO4 + H3PO4 идет из-за образования недиссоциированной фосфорной кислоты. B ионном виде :
Основные соли при диссоциации дают катионы металла, анионы кислотного остатка и ионы ОН — :
Основные соли – продукты неполного замещения гидроксильных групп соответствующего основания на кислотные остатки.
Основные соли, также, как и кислые, термически неустойчивы и при нагревании разлагаются:
Для основных солей характерны реакции нейтрализации с кислотами:
MgOHCI + HCI 
| Кислородосодержащие кислоты хлора | Соли |
| HСlO – хлорноватистая кислота | KСlO – гипохлорит калия |
| HСlO2 – хлористая кислота | KСlO2 – хлорит калия |
| HClO3 – хлорноватая кислота | KСlO3 – хлорат калия |
| HClO4 – хлорная кислота | KClO4 – перхлорат калия |
Особые реакции
BaS + 4 Br2 + 4 H2O = 8 HBr↑ + BaSO4↓