На что влияет костный мозг
Омолаживающий орган
Одно из главных устремлений медицины как науки – это сделать так, чтобы человек омолодился. Существует много различных теорий относительно того, как стать моложе, но к этому вопросу нужно подходить с научной точки зрения.
Чем старше человек становится, тем медленнее протекает процесс регенерации клеток в его организме. Этот процесс обновления осуществляется благодаря определённому органу. Можно ли в таком случае назвать этот орган «омолаживающим»? Давайте разберёмся.
Секрет омоложения
Сразу же приоткроем завесу тайны относительно этого «волшебного органа» – это костный мозг. Это тот орган, который буквально позволяет нам омолаживаться. Основная его функция – это регенерация клеток организма, а основная особенность, способствующая этому – наличие стволовых клеток. Костный мозг напрямую влияет на продолжительность жизни человека и его уязвимость к заболеваниям.
Все знают про этот орган, но не всем известны его безграничные возможности. И когда речь заходит об омоложении, мало кто обращает внимания на костный мозг в данном контексте.
Важно понимать, что все регенераторные способности нашего организма начинаются с костного мозга. Наш организм постоянно обновляет за счёт клеток, которые продуцируются костным мозгом, и именно о костном мозге мы должны заботиться, если хотим поддерживать свой организм в оптимальном состоянии и не болеть.
Стволовые клетки
Кровь человека состоит из эритроцитов, лейкоцитов и тромбоцитов. Они в свою очередь вырастают из родительских клеток, которые именуются стволовыми клетками. Они делятся на два вида:
Стволовая клетка способна генерировать около миллиона клеток-потомков. Когда кровяные клетки созревают в костном мозге, они становятся частью кровеносной системы. Кроме лимфоцитов – они после созревания становятся полностью рабочими клетками и уходят в лимфатическую систему (селезёнка, миндалины и т. д.).
Созревшие клетки крови имеют непродолжительный период жизни – около 8-12 дней. Исключение составляют лишь эритроциты, чей срок жизни достигает 4 месяцев. Из-за этого организм потребляет невероятно большое количество крови. В течение дня в человеческом организме погибает несколько миллиардов клеток.
Поэтому задача костного мозга в целом и стволовых клеток в частности – создавать новые клетки на смену погибшим, чтобы организм мог питаться ими и выполнять свои естественные функции.
Строение костного мозга
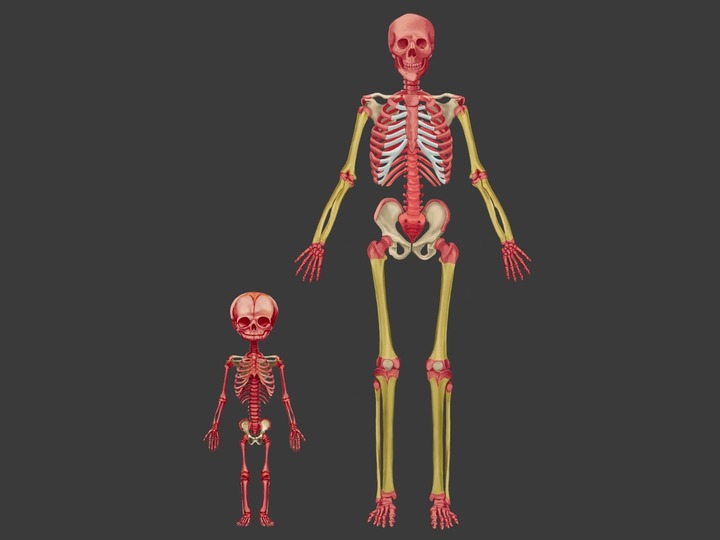
Костный мозг – это питательная губчатая ткань, которая располагается в полостях костей и составляет около 4.6% всей массы тела человека. Он состоит из двух частей:
Давайте рассмотрим детальнее каждую из этих составляющих.
Красный костный мозг
Красный (он же кроветворный) костный мозг – это та часть костного мозга, которая отвечает за то, чтобы в нашем теле постоянно образовывались новые клетки, вследствие чего внутренние органы будут обновляться. С течением возраста скорость этого обновления, и, соответственно, производства новых стволовых клеток, снижается. В итоге красный костный мозг уменьшается в объёме и его замещает жёлтый костный мозг.
Красный костный мозг расположен у человека внутри следующих костей:
Состоит он из двух тканей:
Красный костный мозг развивается на начальных периодах развития эмбриона, когда хрящевой скелет только начинает образовываться (происходит это примерно на седьмой неделе). В это время в его костях образуется полость, которую заполняет костный мозг. Он состоит из следующих частей:
Затем начинают появляться специальные гемопоэтические клетки и формироваться вокруг сосудов. Когда человек рождается, его костные полости заполнены красным костным мозгов (который с возрастом вытесняет жёлтый костный мозг).
Такое вытеснение не является вырождением костного мозга или какой-то аномалией – это естественный процесс, который протекает с возрастом. Однако это не значит, что данный процесс нельзя повернуть в обратную сторону и сделать так, чтобы жёлтый костный мозг постепенно заменялся красным.
Жёлтый костный мозг
Жёлтый (он же недеятельный) костный мозг – это скопление жировой ткани в костях человека, в состав которой входит множество адипоцитов (жировых клеток). Он выполняет следующие функции:
Субстанция, именуемая жёлтым костным мозгом, получила своё название благодаря жёлтому цвету, обеспеченному липохромами.
Чем моложе человек, тем больше баланс красного и жёлтого костного мозга у него склоняется к первому. У ребёнка до трёх лет жёлтого костного мозга почти нет, у человека к 25-ти годам этот баланс составляет примерно 50/50, а далее, с течением возраста, жёлтый костный мозг начинает постепенно вытеснять красный.
Травматизация
Интересной особенностью организма является то, что когда он получает травмы, в процессе которых происходит потеря крови, жёлтый костный мозг даёт возможность красному костному мозгу увеличить свою продуктивность (то есть увеличиться в объёме). Поэтому постоянная микротравматизация способствует тому, что наш красный костный мозг поддерживается за счёт ресурсов, которые производит жёлтый костный мозг, причём поддерживается в хорошем функциональном состоянии.
Но вы вряд ли захотите периодически пускать кровь и подвергать себя травмам, чтобы обеспечить более продуктивную работу красного костного мозга за счёт жёлтого. Делать это не обязательно, ведь существует множество других методов стимуляции нужного участка костного мозга.
Смотрите в видео совет от доктора Шишонина:
Подписывайтесь на доктора Шишонина в инстаграм и получайте больше полезных советов по здоровью:
Миелома: признаки, симптомы, лечение и прогнозы
Миелома или миеломная болезнь – это избыток в организме неправильных, измененных плазмоцитов – клеток, производящих антитела – белки, защищающие организм от бактерий и вирусов. Они вытесняют нормальные клетки крови, накапливаются в костном мозге Костный мозг – это мягкая внутренняя часть некоторых костей, в которой вырастают все клетки крови. и формируют опухоль, повреждающую кости и почки, а также нарушающую работу иммунной системы.
Как развивается миелома?
Заболевание начинается с появления в организме измененных клеток иммунной системы. В норме в ней присутствует несколько типов клеток, в том числе:
В результате влияния различных факторов, в том числе ожирения, наследственных особенностей, генетических заболеваний или случайных сбоев плазматические клетки мутируют – изменяются. После чего начинают бесконтрольно расти, размножаться и нарушать нормальное кроветворение – создание эритроцитов, лейкоцитов и тромбоцитов. Кроме того, они вырабатывают антитела – особый белок М-протеин, или парапротеин, который не способен участвовать в работе иммунной системы и защищать организм. Со временем их становится больше, они превращаются в опухоль – плазмоцитому, или во множественную миелому – несколько подобных новообразований в различных частях тела.
Неправильные клетки скапливаются в органах, включая почки и печень, из-за чего снижается выделение разжижающих кровь соединений, а обмен веществ в тканях нарушается. Разрушают они и кости, из которых выходит кальций, что приводит к тяжелым последствиям – от переломов и болей до развития комы – бессознательного состояния.
Причина развития миеломы
Врачи и ученые не знают точных причин ее возникновения – им известны только факторы, повышающие вероятность этого события:
Наличие других заболеваний плазматических клеток также повышает риски. К ним относятся:
Симптомы и признаки миеломы
Как правило, на ранних этапах заболевание выявляют редко, поскольку оно обычно не беспокоит своего обладателя до того момента, пока поражения не станут довольно серьезными. Симптомы миеломы могут выглядеть следующим образом:
Проблемы с костями:
Низкие показатели крови:
Гиперкальциемия – высокий уровень кальция в крови из-за его выхода из костей:
Повреждение нервной системы. Ослабленные кости позвоночника могут стать хрупкими, разрушиться и давить на нервы, вызывая:
Некоторые белки, вырабатываемые клетками миеломы, токсичны – ядовиты для нервов. Их поражение также способно привести к слабости, онемению и ощущению покалывания.
У некоторых пациентов избыток этих веществ приводит к «загустению» крови – повышению ее вязкости. Такое состояние замедляет приток этой жизненно важной жидкости к мозгу и может вызвать головокружения, нарушения сознания и развитие симптомов инсульта Инсульт – это острое нарушение кровообращения в головном мозге – слабость мышц на одной стороне тела и невнятная речь.
Кроме того, измененные белки повреждают почки. На ранних этапах заболевания никаких симптомов это не вызывает, но признаки их поражения можно увидеть по анализам крови или мочи. Когда эти органы начинают отказывать, они перестают выводить лишние соль и жидкость, а также продукты жизнедеятельности тела, что приводит к слабости, зуду, затрудненному дыханию и отечности ног.
Больные миеломой нередко страдают от различных инфекций, чаще всего от пневмонии – воспаления легких, обычно плохо реагируют на лечение и долго восстанавливаются.
Диагностика миеломы
Обследование – очень важный процесс для любого пациента, поскольку в его ходе врачи не просто выявляют заболевание. Они выясняют, насколько серьезно успел пострадать организм и представляют примерные прогнозы пациента, что позволяет им подбирать самую подходящую в каждом конкретном случае терапию.
Полную диагностику миеломы можно пройти в онкологическом центре «Лапино-2».
У нас есть самое современное оборудование, собственная лаборатория и все необходимые специалисты – кандидаты и доктора медицинских наук с огромным опытом работы.
В нашем центре нет очередей, все процедуры проводятся вовремя, а выполненные у нас исследования не приходится переделывать – их результатам доверяют все лечебные учреждения.
Обследование начинается с анализов крови и мочи и измерения в них количества:
Для выявления измененных плазматических клеток в костном мозге врачи проводят биопсию – забирают небольшое его количество с помощью иглы и передают образец на исследование в лабораторию.
Рентген – помогает обнаруживать разрушение костей. С той же целью проводится компьютерная томография, КТ – в ходе сканирования специальный аппарат создает четкое изображение и позволяет подробно изучать повреждения частей скелета.
Позитронно-эмиссионная томография, ПЭТ. Исследование проводится после приема пациентом небольшой дозы радиоактивного сахара, способного накапливаться в опасных клетках. Метод не дает четкой «картинки» внутренних органов, но позволяет обнаруживать любые очаги заболевания во всех областях тела.
Стадии миеломы
Сразу после выявления заболевания врачи определяют его стадию – выясняют, насколько серьезно успел пострадать организм. Данная информация необходима им для представления примерных прогнозов пациента и подбора самого подходящего для него лечения.
Стадирование миеломы проводится на основе 4 факторов:
Всего врачи выделяют 3 стадии миеломы:
I: Уровень альбумина 3,5 грамм/децилитр 1 децилитр = 100 кубических сантиметров, или 1/10 литра или выше, b2-микроглобулина менее 3,5 мг/л, ЛДГ в норме, цитогенетические изменения стандартного риска.
II: Ко второму этапу заболевания причисляют все состояния, показатели которых нельзя отнести к I или III стадии.
III: Уровень b2-микроглобулина составляет 5,5 мг/л или более, цитогенетические аномалии высокого риска, и/или высокий ЛДГ.
Лечение миеломы
Борьба с миеломой – сложная задача, требующая участия множества докторов различных специальностей: онколога, химиотерапевта, невролога, уролога и других. Чем больше информации о состоянии организма и течении заболевания они получают друг от друга, тем больше факторов им удается учесть.
В онкологическом центре «Лапино-2» проводится полная диагностика и любое лечение миеломы.
Каждый случай мы рассматриваем индивидуально – все наши пациенты получают терапию, назначенную по решению консилиума врачей, кандидатов и докторов медицинских наук с большим опытом работы. Такой подход позволяет нам подбирать наилучшие варианты воздействия на измененные клетки и наносить минимум вреда здоровым тканям.
Мы используем только самое современное оборудование и оригинальные препараты, дающие предсказуемый результат.
С нами вам не придется терять время – обследование и лечение у нас проводятся без очереди и задержек, точно в срок.
Для лечения миеломы врачи применяют несколько методов:
Медикаментозная терапия
Химиотерапия – разрушение или предотвращение роста измененных клеток с помощью специальных препаратов. К ним относят: Циклофосфамид, Этопозид, Доксорубицин, Мелфалан и Бендамустин. Они попадают в кровоток и достигают почти всех участков дела, воздействуя на любые очаги заболевания.
Кортикостероиды – мощные противовоспалительные средства, такие как Дексаметазон и Преднизолон, являются важной частью терапии. Их можно использовать как отдельно, так и в сочетании с другими лекарствами.
Иммуномодуляторы – вещества, которые воздействуют на собственную иммунную систему человека и помогают ей бороться с заболеванием: Леналидомид и Помалидомид.
Ингибиторы протеасом – не позволяют расщепляться белкам, необходимым для деления клеток: Бортезомиб, Карфилзомиб и Иксазомиб.
Ингибиторы гистондеацетилазы, такие как Панобиностат – влияют на активность определенных генов в клетках.
Моноклональные антитела: вещества, искусственно разработанные для атаки на конкретную цель – например, белки на поверхности миеломных клеток. К ним относят Даратумумаб и Элотузумаб.
Бисфосфонаты – лекарства, которые замедляют процесс ослабления костей и уменьшают возникающие в них боли: Памидронат. золедроновая кислота и Деносумаб.
Трансплантация стволовых клеток – пересадка костного мозга, клетки которого могут становиться красными кровяными тельцами, переносящими кислород по телу, лейкоцитами, помогающими бороться с инфекциями, и тромбоцитами, останавливающими кровотечения. Сначала пациенту назначают высокодозную химиотерапию, уничтожающую поврежденный костный мозг, после чего вводят новые, здоровые кроветворные клетки.
Трансплантация бывает аутологичной – с использованием заранее собранного собственного материала, или аллогенной – с применением клеток другого человека – донора.
Поддерживающая терапия
ВВИГ – внутривенное введение нормальных антител – белков иммуноглобулинов, необходимых для борьбы с инфекцией.
Эритропоэтин – препарат, повышающий количество эритроцитов, переносящих кислород от легких к другим тканям.
Плазмаферез – процедура, позволяющая удалять миеломные белки и снижать вязкость крови.
7 курс химиотерапии при редком заболевании- миелома.
Прогноз и выживаемость при миеломе
Прогнозы каждого человека индивидуальны и зависят от большого количества факторов, таких как общее состояние здоровья, возраст, тип и этап заболевания, а также ответ на терапию.
Врачи представляют примерные перспективы, ориентируясь на специальный показатель – «пятилетнюю выживаемость». Он представляет из себя статистические данные о проценте оставшихся в живых пациентов спустя 5 или более лет с даты постановки диагноза. Никаких данных о шансах конкретного больного он не дает и не учитывает ничего, кроме стадии.
Для данного типа онкологии цифры выглядят следующим образом:
Что еще влияет на прогноз?
Как устроено донорство костного мозга: мифы, страхи, побочные эффекты
Олеся Остапчук СПИД.ЦЕНТР
Костный мозг достают из спины? Донор рискует своим здоровьем? Врачи относятся к донору хуже, чем к пациенту? По данным ВЦИОМ, 61 % россиян ничего не слышали о донорстве костного мозга, а каждый второй респондент считает процедуру опасной. И тем не менее трансплантация устойчивого к вирусу косного мозга остается самой перспективной технологией полной элиминации ВИЧ. СПИД.ЦЕНТР подготовил подробный разбор мифов о донорстве косного мозга, поговорив с онкологом-гематологом, консультантом «Фонда борьбы с лейкемией» Сергеем Семочкиным и донором костного мозга Ириной.
Что такое костный мозг и где он вообще расположен?
Это кроветворная ткань, которая находится в крупных костях человека. В костном мозге есть гемопоэтические (кроветворные) стволовые клетки (ГСК), когда они делятся и созревают — образуются все виды клеток крови: эритроциты, лейкоциты, тромбоциты. ГСК — отправная точка для процесса кроветворения в организме. Процесс их деления практически ничем не ограничен: из небольшого числа ГСК может появиться множество «дочерних» клеток, они будут делиться дальше, созревать, а из них образовываться другие клетки крови.
Из-за такой способности ГСК к делению, они чувствительны к цитостатической химиотерапии и облучению. Поэтому процесс кроветворения может нарушиться во время лечения онкологических заболеваний (у людей, проходящих высокодозную химиотерапию, как правило, этот процесс останавливается). Если ввести такому пациенту подходящие ГСК, они смогут заселить костный мозг пациента своими «дочерними» клетками и восстановить кроветворение. Соответственно, цель врачей — собрать достаточное количество ГСК у здорового человека (донора) и пересадить их больному (реципиенту).
А как его достают? Большим шприцем из позвоночника?
Костный мозг — не спинной, поэтому никто не будет выкачивать у доноров стволовых клеток жидкость из позвоночника. Собрать клетки можно двумя способами. Первый и самый распространенный — взять их из крови. В таком случае донору предварительно на протяжении нескольких дней вводят подкожно препарат — стволовые факторы роста, что стимулирует выход ГСК из костного мозга в кровь.
Сам забор клеток из крови очень похож на обычное донорство компонентов крови, например, тромбоцитов. Человека сажают в кресло, из вены берут кровь, она фильтруется в аппарате. Дальше машина забирает себе стволовые клетки, а все остальное возвращает обратно донору. Процесс длится несколько часов.
Во втором случае берут не кровь, а сам костный мозг. Для этого донору делают общую анестезию, шприцем прокалывают тазовую кость и берут литр смеси костного мозга и крови (это не более 5 % всего костного мозга). После из взятой смеси выделяют стволовые клетки. Операция длится примерно полчаса, а донор в этом случае около двух дней проводит в стационаре. После процедуры могут быть болезненные ощущения, которые снимаются обезболивающими.
Второй вариант используется существенно реже, когда врачам не удается собрать периферические, то есть циркулирующие в крови, ГСК. Поскольку он сложнее, соглашаются на него в основном родственники нуждающегося в трансплантации. Впрочем, донор сам может выбрать способ забора клеток.
По данным американской компании Be The Match, которая курирует самый большой регистр (банк) доноров костного мозга в мире, хирургическое вмешательство для забора стволовых клеток требуется в 23 % случаев. По другим цифрам — американского Института юстиции — хирургическая процедура делается в 30 %, а в 70 % — стволовые клетки забирают через кровь.
Любой ли костный мозг подойдет больному или он чем-то отличается?
Нет, костный мозг у каждого свой. Найти себе донора с подходящими стволовыми клетками сложнее, чем с кровью. Иногда среди родственников пациента может оказаться потенциальный донор костного мозга, но так бывает только в 50 % случаев. Если среди родных нет никого подходящего, нужно искать человека с таким же HLA-генотипом (это цифровой показатель генов, он отвечает за тканевую совместимость).
Найти донора можно через регистры (банки) доноров костного мозга. В них содержатся данные людей, прошедших фенотипирование — исследование клеток и генотипа — и согласившихся стать донорами ГСК.
А как выглядят банки костного мозга?
Это не огромные больницы с генетическими материалами, а электронные базы, компьютерная сеть, в которой хранится информация о генотипе потенциальных доноров и больных. Система определяет, насколько совместимы донор и реципиент.
Совместимость у всех разная. У каждой клетки человека есть свой набор рецепторов — главный комплекс гистосовместимости. Рецепторы находятся на поверхности клетки, и по ним можно определить информацию о белках, которые находятся внутри. Так клетки собственной иммунной системы могут вовремя определять нарушения среды внутри клетки и устранять их или сигнализировать о них. До какого-то момента иммунная система способна таким образом распознавать наличие опухоли.
по теме
Лечение
Зафиксирован второй случай излечения от ВИЧ. На самом деле он третий
Для трансплантации необязательна совместимость групп и резус-факторов крови, важнее именно генетическая совместимость. Среди идеально подходящего неродственного донора и родственного донора, совпадающего не по всем пунктам, врачи выберут, скорее всего, последнего, потому что с ним ниже вероятность отказа от донации.
Порой больному подходят сразу 50-70 доноров, но бывает, что «генетический близнец» в регистре вовсе не находится. В последнем случае можно попробовать организовать донорские акции, чтобы больше людей прошли типирование, но в любом случае, если подходящего донора нет в банке, помочь пациенту не получится. Каждый год не менее трех тысяч людей умирают, потому что не смогли найти себе подходящего донора.
Пациент и донор с одним и тем же этническим происхождением вероятнее подойдут друг другу. Чем больше людей проходит типирование, тем больше в регистрах разных генетических данных, а значит, выше вероятность совместимости пациента и донора.
По данным американской компании Be The Match, больше всего проблем с поиском донора костного мозга у темнокожих людей, индейцев, уроженцев Аляски, азиатов, коренных гавайцев и других жителей островов Тихого океана, латиноамериканцев и метисов. Американский Институт юстиции сообщает, что афроамериканцы, у которых нет родственного донора, находят себе подходящего только в 25 % случаев, при этом, если донора нашли, в 80 % случаев это единственный вариант в реестре. Для азиатов этот показатель равен 40 %, для латиноамериканцев — 45 %, для европейцев — 75 %. Конкретный процент для метисов в статистике не приводится, но институт уточняет, что для них ситуация гораздо хуже.
Зачем нужны доноры костного мозга?
Трансплантация костного мозга ежегодно требуется более чем 5 тысячам россиян, из них 4214 пересадок нужны взрослым и 900 — детям. В России нет общего регистра данных для доноров, каждый банк считает своих доноров сам. По словам онколога-гематолога Сергея Семочкина, самый большой банк стволовых клеток в России находится в Кирове в центре «Росплазма». В нем зарегистрировано 35 787 человек.
Еще один большой реестр доноров костного мозга в нашей стране находится в ведении «Русфонда» — Национальный регистр доноров костного мозга имени Васи Перевощикова. Он существует с 2013 года и объединяет 12 региональных российских регистров и один казахский. На 31 октября 2019 года в нем состояли 29 178 доноров костного мозга.
Во всемирном банке костного мозга (Bone Marrow Donors Worldwide) зарегистрировано 35,6 миллиона человек. Однако найти там совместимого с россиянином донора сложно — в нашей стране много национальностей и генетических сочетаний, которых нет больше нигде в мире. Вероятность, что русский человек найдет подходящего донора в отечественном регистре, выше, чем в зарубежных.
Семочкин приводит пример, что зачастую кавказцы не могут найти своего «генетического двойника» в европейской базе. Но у них больше детей в семье, поэтому выше вероятность найти родственного донора. Огромная проблема с поиском доноров и у малочисленных этносов, например, жителей Крайнего Севера. Как правило, найти донора им не удается.
Единственное решение проблемы — вступление в национальный регистр как можно большего количества людей разных национальностей. Как объясняет Семочкин, затраты на трансплантацию клеток и все остальные процедуры российского пациента с российским же донором не превышают 160 000 рублей. В то же время процедуры и трансплантация с донором из европейского банка требуют порядка 20 000 евро. Государство не может выделить такие деньги, у пациентов их тоже, как правило, нет — финансирование ложится на благотворительные фонды.
Как стать донором?
В России стать донором может любой здоровый гражданин РФ без хронических заболеваний в возрасте от 18 до 45 лет, в некоторых случаях — до 50 лет. Возраст имеет значение: чем моложе донор, тем выше концентрация клеток в трансплантате и их «качество».
Студентка магистратуры МГИМО Ирина стала донором костного мозга в конце октября этого года. До этого она с 18 лет регулярно сдавала кровь и тромбоциты в донорских организациях. Три года назад она прочитала колонку Валерия Панюшкина «Встреча» о том, как познакомились донор и реципиент, и окончательно решила сдать костный мозг.
Первый шаг — сдача крови на типирование. Это можно сделать в любой из крупных частных медицинских лабораторий или в лабораториях некоторых медицинских центров или регистров. Посмотреть полный список центров, позволяющих попасть в банк «Русфонда», можно здесь.
Ирина выбрала Национальный медицинский исследовательский центр гематологии. Там она сдала около 10 миллилитров крови на типирование и подписала соглашение о вступлении в регистр. Оно ни к чему не обязывает донора — можно отказаться в любой момент. Но это важно для реципиента — за 10 дней до пересадки стволовых клеток проводится высокодозная химиотерапия, которая полностью уничтожает кроветворную и иммунную системы. Поэтому отказ в последнюю минуту может быть губителен для того, кто ждет трансплантации.
Через полтора месяца после типирования на электронную почту Ирины пришло сообщение, что с анализами все в порядке и ее занесли в регистр.
по теме
Лечение
«В поисках исцеления». Что нового было на конференции CROI-2019?
«Я тогда почувствовала большую ответственность. Стояла на перекрестке и думала: а вдруг меня сейчас собьет машина, и я не смогу сдать. Меня это не то чтобы особо напрягало, но я стала отвечать на все звонки с незнакомых номеров, мало ли», — вспоминает она.
Через два года Ирине в мессенджер с неизвестного номера написали, что она подошла пациенту (из России), позвали на расширенное типирование, а также сдать анализы на ВИЧ и гепатит. Результаты анализов она ждала еще пять дней, параллельно врачи обследовали остальных подходящих доноров. Ответ прислали также в мессенджере: совместимость Ирины с пациентом 9 из 10, а у другого донора 10 из 10, врачи выбрали его.
Спустя полгода ей снова позвонили, оказалось, что пересадка так и не состоялась, а донор все еще был нужен. Она приехала в центр гематологии, поговорила с врачом, сдала кровь на биохимию, ВИЧ, сифилис, сделала флюорографию и ЭКГ. Через несколько дней позвали на уколы. Количество уколов зависит от веса донора, в среднем, делают 1-2 укола в день на протяжении трех дней. Ирине назначили дважды в день. Родителям она не стала говорить про свое донорство — не поняли бы. Поэтому приходилось прятать шприцы с лекарством в упаковках от зубной пасты в холодильнике.
По словам девушки, побочные эффекты были незначительные: на второй день появилась небольшая ломота в костях, «будто провела ночь в неудобной кровати», на третий — ощущение «тяжелой головы». Все это время врачи были на связи. Медицинские организации одинаково заботятся и о доноре, и о реципиенте: с момента прохождения необходимых для сдачи процедур донор формально числится как пациент при госпитализации, даже если не лежит в больнице, а сидит дома, как Ирина.
Можно ли донору знакомиться с реципиентом?
Да, но через два года и только если обе стороны согласны. За два года станет понятно, смог ли костный мозг донора прижиться у реципиента. В некоторых европейских странах и США этот срок составляет один год. А в Испании донорам и реципиентам запрещено видеться на протяжении всей жизни. Анонимность обеспечивает безопасность. Если они познакомятся сразу после донации, а через месяц костный мозг не приживется, то родственники больного могут «отомстить» донору, обвинить его в чем-то, в чем он не виноват. Анонимность позволяет избежать этого. С другой стороны такая мера позволяет избегать шантажирования родственников реципиента и вымогательства у них денег.
Донорство костного мозга проводится безвозмездно, можно узнать лишь пол и возраст больного, а также передать что-то анонимное в знак поддержки. Ирина передала открытку, на которой изображены руки, держащие кофейную чашку, на фоне гор. «Я там написала: поправляйся, я в тебя верю. Никакую информацию о себе нельзя указывать, мне даже сказали писать в настоящем времени, чтобы не было окончаний прошедшего времени, по которым можно определить род», — рассказывает Ирина.
Потенциальную встречу с реципиентом девушка не представляет. По количеству взятых у нее стволовых клеток и предполагаемой массе тела, она считает, что ее реципиент — мужчина средних лет. «Я не хочу, чтобы он чувствовал себя обязанным, да и о чем мы будем разговаривать? Я бы хотела, чтобы эта встреча произошла на каком-то мероприятии, в медицинском центре, например. Так мне было бы легче».
Трудно ли восстановиться после донорства костного мозга?
Пообщаться с корреспондентом Ирина смогла уже через пару дней после донации: «Мне важно, чтобы мои друзья и другие люди видели, что я сдала костный мозг и со мной все нормально. Я не лежу после этого в реанимации».
Донор отдает малую часть своего костного мозга — 5 % стволовых клеток здорового человека достаточно для восстановления кроветворения у больного. Потеря части стволовых клеток никак не ощущается, а их объем полностью восстанавливается в течение семи-десяти дней. Оставшиеся в крови донора ГСК самостоятельно обратно всасываются в костный мозг. Повторное донорство возможно уже через три месяца после забора клеток, то есть сдать костный мозг можно несколько раз за жизнь.
На каком уровне находится трансплантация стволовых клеток в России?
По словам Сергея Семочкина, сама российская система пересадки костного мозга очень хорошая, но проблема в нехватке учреждений, делающих трансплантацию, в России их — единицы. Недостаточно учреждений, квалифицированных сотрудников, нет государственного финансирования. После трансплантации реципиент должен еще несколько лет — минимум два года — получать терапию на подавление иммунных реакций. Например, если пациент из региона, а костный мозг ему пересаживали в Санкт-Петербурге, то дальнейшее ведение пациента должно проходить в его регионе. Но это сложно, объясняет Семочкин, врачей в регионах к этому не готовят, они не понимают, что делать. В итоге люди вынуждены постоянно обращаться в федеральный центр, а это тормозит трансплантацию следующих пациентов.