На что влияет жесткая вода
Управление Роспотребнадзора по Республике Марий Эл
Управление Роспотребнадзора по Республике Марий Эл
Влияние жесткой воды на здоровье человека
Влияние жесткой воды на здоровье человека
Человек на 70-80% состоит из воды, которая является основным растворителем. С помощью нее в организме переносятся кислород, ферменты, гормоны, соли. В связи с этим особенно важным становится химический состав воды: чем больше в ней посторонних примесей, тем хуже она растворяет полезные вещества.
Абсолютно чистая вода в природе не встречается. Соприкасаясь с другими макро- и микроэлементами, она обогащается различными минералами, в частности, солями кальция и магния. Именно их содержанием обусловлено такое свойство, как жесткость: чем больше в воде солей кальция и магния, тем она жестче.
В нашей стране жесткость воды выражается в миллиграммах-эквивалентах на литр (мг-экв/л). Очень мягкая вода – до 1,5 мг-экв/л, мягкая – от 1,5 до 4 мг-экв/л, вода средней жесткости – от 4 до 8 мг-экв/л, жесткая – от 8 до 12 мг-экв/л и очень жесткая – более 12 мг-экв/л. Допустимый предел жесткости воды для централизованного водоснабжения – 7 мг-экв/л.
Доказано, что жесткая вода негативно влияет на организм. При взаимодействии с мылом образуются «мыльные шлаки», которые не смываются с кожи, разрушают естественную жировую пленку, защищающую от старения и неблагоприятных климатических факторов, забивают поры, образуют на волосах микроскопическую корку, тем самым вызывая сыпь, зуд, сухость, перхоть, шелушение. Кожа не только преждевременно стареет, но и становится чувствительной к раздражениям и расположенной к аллергическим реакциям.
Высокая жесткость ухудшает органолептические свойства питьевой воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения. Соли кальция и магния, соединяясь с животными белками, которые мы получаем из еды, оседают на стенках пищевода, желудка, кишечника, осложняют их перистальтику (сокращение), вызывают дисбактериоз, нарушают работу ферментов и в конечном итоге отравляют организм. Постоянное употребление воды с повышенной жесткостью приводит к снижению моторики желудка и накоплению солей в организме.
От воды, переполненной ионами кальция и магния, чрезмерно страдает сердечно-сосудистая система. Продолжительное использование жесткой воды чревато возникновением заболеваний суставов (артритов, полиартритов), образованием камней в почках и желчных путях.
Кроме того, что жесткая вода отрицательно влияет на здоровье, еще приносит много неприятностей в быту. Она нежелательная для мытья посуды и стирки – посуда тускнеет, а ткани быстро изнашиваются. Огромный вред наносится бытовой технике: бойлерам, стиральным и посудомоечным машинам, электрочайникам и кофеваркам. Соли кальция и магния, осаждаясь на нагревательных элементах, образуют твердые известковые отложения (накипь) и довольно скоро выводят оборудование из строя.
Следы жесткой воды видны невооруженным глазом: появляется белый налет на трубах, сантехнике, в системе отопления, бытовой технике, увеличивается расход моющих средств, «сворачивается» мыло при мытье и стирке, образуются пенообразные шлаки на коже и поверхностях.
Питьевая вода на отдельных территориях Республики Марий Эл отличается природным повышенным содержанием жесткости. Нестандартные пробы по показателю общей жесткости обнаруживаются санитарными врачами в рамках социально-гигиенического мониторинга, в ходе контрольно-надзорных мероприятий и рассмотрения обращений граждан.
Проводить очистку воды перед подачей населению должны соответствующие ресурсоснабжающие организации.
С жалобами на ненадлежащее качество питьевой воды можно обращаться в Управление Роспотребнадзора по Республике Марий Эл.
Жесткая вода
Это вода, в которой в большом количестве находятся растворенные соли, щелочноземельных металлов. В основном на жесткость воды влияют кальций и магний, соединения которых и являются основными солями жесткости.
Жесткость определяет не только возможность использования воды в питьевых целях, но и ее применение в бытовых или промышленных нуждах.
По вкусу жесткую воду отличить очень легко – он крайне горькая. Иногда встречающийся горький вкус родниковой воды обусловлен именно наличием солей жесткости.
По внешнему виду можно узнать после кипячения. В этом случае соли выпадают в осадок, которой легко виден на дне любого сосуда.
Классификация воды по жетскости
В России жесткость воды измеряют в градусах жесткости, но она так же может быть выражена в объемной доле или массовым числом.
Официально принятая единица измерения, которая используется в системе СИ (международная система единиц) – моль на кубический метр. Но на практике не используют перечисленные единицы измерения, предпочитая миллиэквивалент на литр (мг-экв./л).
По уровню жесткости воду делят на четыре типа:
Эта классификация называется американской и при оценке жесткости воды используется чаще всего.
Подобная классификация есть и в градусах жесткости, но представляет она только 3 типа воды:
Нормы жесткости воды
Нормы жесткости воды в России и мире сильно отличаются друг от друга. В России разрешена вода, жесткость которой не превышает порог в 7 миллиэквивалентов на литр, то есть, не запрещается подавать населению очень жесткую воду.
Те же показатели в Европе не могут быть больше 1,2 миллиэквивалентов на литр. Это значит, что европейцы пьют мягкую воду, жесткость которой почти в шесть раз меньше установленной в России.
Типы жесткости воды по восприимчивости к термообработке.
Первый тип – временная жесткость, когда помимо кальция и магния, в воде обнаруживаются гидрокарбонатные анионы. Ее так же называют карбонатной. Она легко удаляется при кипячении воды и никак не влияет на организм человека.
Второй тип – постоянная жесткость, еще называемая некарбонатной жесткостью. Она обусловлена наличием соединений кальция и магния, образованных в результате взаимодействия с сильными кислотами, например, серной или азотной. Такая жесткость не удаляется при кипячении воды, потому что не соли подобного типа не распадаются под воздействием температуры.
Общая жесткость воды вычисляется путем суммирования показателей карбонатной и некарбонатной жесткости.
Самые высокие показатели жесткости из-за обилия растворенных солей определяют в морской и океанической воде. Жесткость поверхностных вод обычно в несколько раз меньше грунтовых вод и влаги из подземных источников.
Вред, наносимый жесткой водой
Рассмотрем негативное воздействие чрезмерно жесткой воды на организм человека, бытовую технику и коммуникации. Чем выше параметр жесткости, тем сильнее будет значение каждого вида вредного воздействия.
Вред для здоровья человека и домашних питомцев
Вред, наносимый жесткой водой технике и предметам быта
Вредные последствия воды с повышенной жесткостью для коммуникаций
В домашних условиях наиболее рациональный способ уменьшение жесткости воды – использование фильтров, которые очистят воду для питья и приготовления пищи от избытка солей. В идеале, воду для любого использования дома нужно фильтровать.
Но при этом, не нужно забывать, что показатель жесткости должен равняться определенному среднему значению. Слишком мягкая вода также не несет никакой пользы. Она повышает риск развития сердечно сосудистых заболеваний у человека, вымывает соли из организма, вызывая быстрое развитие рахита и истончение костей. В коммуникационных системах мягкая вода вызывает коррозию металлических труб.
Жесткость воды — единицы измерения и способы умягчения
Жесткость воды – это количество растворимых и нерастворимых солей, в основном кальция и магния, присутствующих в природной воде. Чем их больше, тем выше жесткость. Из-за переизбытка солей образуются шлаки в системе водоснабжения, быстро выходят из строя приборы, сантехника, гидрооборудование.
Для точного определения жесткости воды, (количество растворенных солей жесткости, концентрации железа, серы, магния, кальция и тд.) делаются лабораторные исследования (например в СЭС) методом химического анализа или с применением специальных приборов. В домашних условиях жесткость воды определяется с помощью тест-полосок или тестеров.
Обычная вода состоит не только из атомов водорода и кислорода, в ней так же присутствует большое количество различных примесей. Именно наличие примесей определяет жесткость воды, а единицы измерения (°Ж — градус жёсткости) показывает, насколько этот показатель превышает допустимые нормы.

О том, как определить уровень жесткости водопроводной воды, а также о методах борьбы с большим содержанием примесей будет подробно рассказано в данной статье.
Жёсткая и мягкая вода — в чём разница
На количество соли в воде влияет наличия растворённых в ней элементов кальция и магния. Значительно повысить этот показатель может также наличие гидрата железа, содержание которого в артезианских водах бывает избыточным.
В том случае, когда таких примесей содержится незначительное количество, её называют «мягкой». Этот показатель обычно разделяется на 3 категории:

В большинстве случаев она может получиться и в результате длительного кипячения или добавления специальных химических реагентов.
Средняя — встречается наиболее часто в водопроводных системах, а также в родниковой и артезианской воде.
Жёсткая — к данной категории относится морская, океанская, а также вода вытекающая из пластов породы богатой минеральными отложениями. В ней может быть растворено большое количество солей. Если брать в процентном соотношении, то соленость может достигать до 33% от общего объема.
Рассмотрим разновидности жёсткости
Этот показатель принято разделять на следующие категории.
Для того чтобы точно определить этот показатель, необходимо знать какими единицами измерения это можно сделать.
Единицы измерения жёсткости
Для правильного подсчёта уровня жёсткости необходимо определить концентрацию катионов кальция и магния. В настоящее время этот показатель определяется в следующих единицах измерения:
Следует отметить, что в нашей стране выражение общей жёсткости моль/м3 стало использоваться только с 1952 года. До этого времени расчёты осуществлялись в градусах, которые были равны современному немецкому градусу.
С 2014 года в России действует международный стандарт подсчёта жёсткости, который выражается в градусах (°Ж). Один градус равен 1/2 миллимоля на литр жидкости, поэтому подсчитать уровень концентрации вещества в жидкости не составит большого труда.
Причины появления жёсткости воды

При необходимости снизить концентрацию ионов калия и магния, можно применить различные методы уменьшения количества солевых примесей.
Методы устранения жёсткости
Для борьбы с чрезмерным содержанием солей применяются следующие методы:
Любой из предложенных способов умягчения воды позволяет справиться с высоким уровнем этого показателя, но для очистки от солей питьевой воды химический способ обычно не применяется.
Как влияет жёсткость на качество воды
Жёсткость питьевой воды влияет, прежде всего, на её вкусовые качества. Порог вкуса ионов кальция находящихся в питьевой воде составляет 2-6 мг-экв/л. Порог вкуса для ионов магния значительно ниже, поэтому самой приятной на вкус питьевой водой считается та, в которой этот показатель равен от 1,6 до 3 мг-экв/л.
В некоторых случаях вода с жёсткостью до 10 мг-экв/л может использоваться в качестве питьевой, но длительное её употребление может негативно влиять на здоровье человека. Слишком жёсткая вода нежелательна для применения в устройствах нагрева жидкости. Электрические чайники, бойлеры, стиральные и посудомоечные машины обязательно имеют в своей конструкции ТЭН, который в кратчайшие сроки «обрастает» отложениями, и процесс нагрева жидкости осуществляется менее эффективно.
Длительная эксплуатация электро нагревателя со значительным слоем накипи приводит к перегреву элемента и выходу его из строя. К счастью, для очистки от накипи достаточно растворить 2 пакетика лимонной кислоты в 1 литре воды и хорошо прокипятить чайник или любой другой водонагреватель. После чего следует тщательно промыть прибор и использовать его далее по назначению.
Не мытьем — так питьем: польза и вред жесткой воды
Что такое жесткая вода и как ее смягчают в промышленных масштабах, почему контуры капель отмывать сложнее, чем середину, вредна ли жесткая вода для здоровья, какую роль в неприятностях из-за жесткой воды играет мыло и с какой водой получается самый вкусный кофе, читайте в материале Indicator.Ru.
Жесткой водой называют воду с большим содержанием растворенных солей. Из-за нее образуется накипь на чайнике и налет («мыльный камень») на сантехнике, в ней хуже пенятся мыло, порошок или шампунь. Некоторые люди жалуются, что от такой воды их кожа становится сухой и раздраженной, другие начинают страдать от перхоти. Рассказываем, как и почему это происходит и вредно ли пить жесткую воду.
Что такое жесткость воды и откуда она берется
В той воде, которую мы пьем или которой моемся, содержится не только водород и кислород. В зависимости от происхождения в ней растворены самые разные химические вещества. Чаще всего среди них встречаются соли магния и кальция, даже в процентном соотношении их больше, чем всех остальных. Собственно, тот показатель, который мы называем жесткостью, обычно выражается в милиграммах карбоната кальция (CaСО3) на литр воды. Согласно данным Всемирной организации здравоохранения (ВОЗ), вода с содержанием карбоната кальция ниже 60 мг/л считается мягкой, от 60 до 120 мг/л — средней жесткости, от 120 до 180 мг/л — жесткой, выше 180 мг/л — очень жесткой. Иногда жесткость измеряется также в градусах жесткости, которые в разных странах рассчитываются по-разному (для любопытных — онлайн-счетчик для перевода из одной системы в другую).
Жесткость водопроводной воды может сильно колебаться в зависимости от сезона. Например, в дождливое время или при таянии большого количества снега соли понемногу разбавляются, а во время засухи при испарении воды концентрация растворенных веществ, соответственно, растет. Различают два вида жесткости. Первая, временная, связана с гидрокарбонатами кальция и магния (Са(НСО3)2, Mg(НСО3)2). Постоянную жесткость воде придают другие соли, в основном хлориды и сульфаты кальция и магния (CaSO4, CaCl2, MgSO4, MgCl2).
Жесткость воде могут добавлять соли алюминия, бария, железа, марганца, цинка, стронция и других поливалентных металлов, то есть тех, чьи атомы могут образовать не одну, а две и более связей. В воду все они попадают из осадочных пород, и, поскольку очень распространенные представители этого класса: известняк и мел — состоят из карбоната кальция, неудивительно, почему именно кальция в воде так много. Ионы магния вода вымывает из другой осадочной породы — доломита.
Доломит (слева) и известняк (справа)
Kluka/Wikimedia Commons, tailcat/Flickr, Indicator.Ru
Перечисленные названия элементов звучат как минимум не очень пугающе (кроме разве что стронция). Кальций необходим для поддержания плотности костей, а без магния в организме человека не смогут работать примерно 350 белков, которые участвуют во множестве реакций в клетке. Польза различных видов минеральной воды, о которых мы рассказывали в отдельной статье, также в большинстве случаев обусловлена растворенными в ней минералами. Что же на самом деле — можно ли пить жесткую воду или делать это все-таки не стоит?
Польза кальция, магия магния
В день человек должен потреблять около 1000 мг кальция и 200-400 мг магния. Если представить, что вы ежедневно выпиваете два литра жесткой воды (или жидкости, произведенной на основе этой воды, бульона), то количество полученных таким образом кальция и магния составит 5-20% от нормы. Специалисты ВОЗ приводят данные эпидемиологических исследований (так называют изучение частоты заболеваний на большой популяции), которые показывают, что недостаток кальция может привести к образованию камней в почках.
Другие исследования говорят, что жесткость питьевой воды снижает риск гипертонии и смертность от сердечно-сосудистых заболеваний. Например, согласно статье 1981 года, в городах Великобритании с мягкой питьевой водой смертность от сердечно-сосудистых заболеваний на 10-15% выше, чем в городах, где вода средней жесткости (около 170 мг/л). Дальнейшее повышение концентрации заметно на статистику не влияет. Похожий эффект описан в статье 2003 года французских ученых, в исследовании ученых из Швеции и других работах. Как отмечают авторы того же документа ВОЗ, некоторые клинические испытания показывают, что прием большого количества пищевых добавок с кальцием, напротив, повышает риск образования камней в почках. Возможно, все зависит от того, в какой форме человек принимает его: с добавками или с водой и пищей.
А вот гиперкальциемия (превышение содержания кальция в организме) случается гораздо реже, чем нехватка этого элемента. Дело в том, что лишний кальций у здоровых людей выводится через почки, и только нарушение функций почек может поставить здоровье человека под угрозу. История с магнием похожа: маловероятно, чтобы избыточное количество этого элемента приносило вред человеку со здоровыми почками. Лишь иногда употребление более 250 мг магния в день (для такого количества пришлось бы выпить пять-десять литров очень жесткой воды) производит на здорового человека слабительный эффект, но к нему организм через некоторое время адаптируется.
Исследователи статистики часто приходят к выводу, что чем выше жесткость воды, тем ниже смертность от сердечно-сосудистых заболеваний, однако эксперименты эту зависимость не подтверждают. Не до конца понятно, как трактовать разночтения. Возможно, часть противоположных результатов можно объяснить тем, те ученые, которые изучали большое количество людей, обычно не учитывают, сколько кальция и магния участники их исследований могли получить другими путями, не из воды. Поэтому дозировку ионов в питьевой воде для «полезной» жесткости подобрать пока не выходит, тем более что разным людям в зависимости от пола, возраста и массы тела нужно разное количество кальция и магния.
Обратная сторона медали
Положительные эффекты питья жесткой воды недостаточно подтверждены, но это по крайней мере не вредит, даже наоборот. Человек, пьющий только дистиллированную воду, лишает себя целого набора полезных макро– и микроэлементов.
А вот если мыться жесткой водой, это может вызвать шелушение кожи и иногда даже атопический дерматит. Одно из возможных объяснений заключается в том, что в жесткой воде мы используем больше мыла, поскольку оно хуже пенится. Мало того, что мыло само по себе сушит кожу, жесткая вода при взаимодействии с ним образует соли, которые трудно смываются и могут вызывать раздражение у людей с чувствительной кожей.
Неудивительно, что у новорожденных, проводящих первые три месяца жизни в регионах с жесткой водой, согласно исследованию в Journal of Allergy and Clinical Immunology, на 87% возрастает риск экземы. До этого похожие исследования проводили на детях из США, Испании и Японии. Правда, согласно все тому же документу ВОЗ, умягчители воды мало влияют на ситуацию, так что дело, вероятно, не только в воде, но и в предрасположенности самих пациентов. Немного повышают этот риск мутации в гене белка филаггрина, отвечающего за защитные барьерные функции кожи.
Так что наш вывод будет немного парадоксальным: мыться жесткой водой может быть неприятно или даже вредно, а вот пить ее, возможно, даже полезно. К тому же, согласно недавнему пресс-релизу Американского химического общества, с жесткой водой вкус кофе получается получается более насыщенным, так как кофеин связывается с магнием во время варки.
При этом жесткая вода может вредить системам водоснабжения, заставлять белье после стирки «стоять колом» (как и в случае с кожей, это происходит из-за взаимодействия ионов с молекулами моющих средств). Кроме того, у нее может быть довольно неприятный привкус — именно поэтому (а не из-за ее вреда для здоровья) придумано множество способов «смягчения» воды. Временную жесткость можно убрать, просто прокипятив воду: гидрокарбонаты после кипячения станут накипью. С постоянной жесткостью бороться сложнее, для этого часто используются химические методы. Здесь главная цель — найти вещество, которое при реакции с растворенными соединениями даст выпадающую в осадок соль. Такими реагентами чаще всего становятся гашеная известь Ca(OH)2 или кальцинированная сода Na2CO3 (ее еще называют бельевой содой, так как ее добавляют во время стирки, чтобы сохранить мягкость ткани даже в жесткой воде). В обоих случаях на выходе получается нерастворимый карбонат кальция, который можно удалить кипячением.
При больших масштабах в дело идет и Na3PO4 — тогда образуются нерастворимые ортофосфаты кальция и магния, которые легко отфильтровать. Еще один способ, катионирование, основан на добавлении специальных гранул, которые привносят в воду ионы натрия или водорода, забирая кальций, магний, железо и марганец. Для более тщательной очистки жесткую воду пропускают через специальные мембраны, подвергают действию электрического поля (электродиализ) или дистиллируют — превращают в пар.
Жесткость воды: воздействие на здоровье и сантехнику
Введение
Жесткость воды — одно из важнейших свойств, имеющее большое значение при водопользовании. Если в воде находятся ионы металлов, образующие с мылом нерастворимые соли жирных кислот, то в такой воде затрудняется образование пены при стирке белья или мытье рук, в результате чего возникает ощущение жесткости. Жесткость воды пагубно сказывается на трубопроводах тепловых сетей, приводя к образованию накипи. По этой причине в воду приходится добавлять специальные «смягчающие» химикаты.
Жесткость воды обусловлена присутствием растворимых и малорастворимых солей-минералов, главным образом кальция (Са2+) и магния (Mg2+). Кроме указанных, к солям жесткости относят также соли стронция (Sr 2+ ), цинка (Zn 2+ ) и др., однако в поверхностных и грунтовых природных водах из перечисленных катионов в заметных концентрациях присутствуют только кальций и магний.
Суммарная жесткость воды, то есть общее содержание растворимых солей кальция и магния, получила название «общей жесткости». Ввиду того, что солями жесткости являются соли разных катионов, имеющие разную молекулярную массу, концентрация солей жесткости, или жесткость воды, измеряется в единицах эквивалентной концентрации — количеством г-экв/л или мг-экв/л.
При жесткости до 4 миллиграмм эквивалент/литр вода считается мягкой; от 4 до 8 миллиграмм эквивалент/литр — средней жесткости; от 8 до 12 миллиграмм эквивалент/литр — жесткой; более 12 миллиграмм эквивалент/литр — очень жесткой.
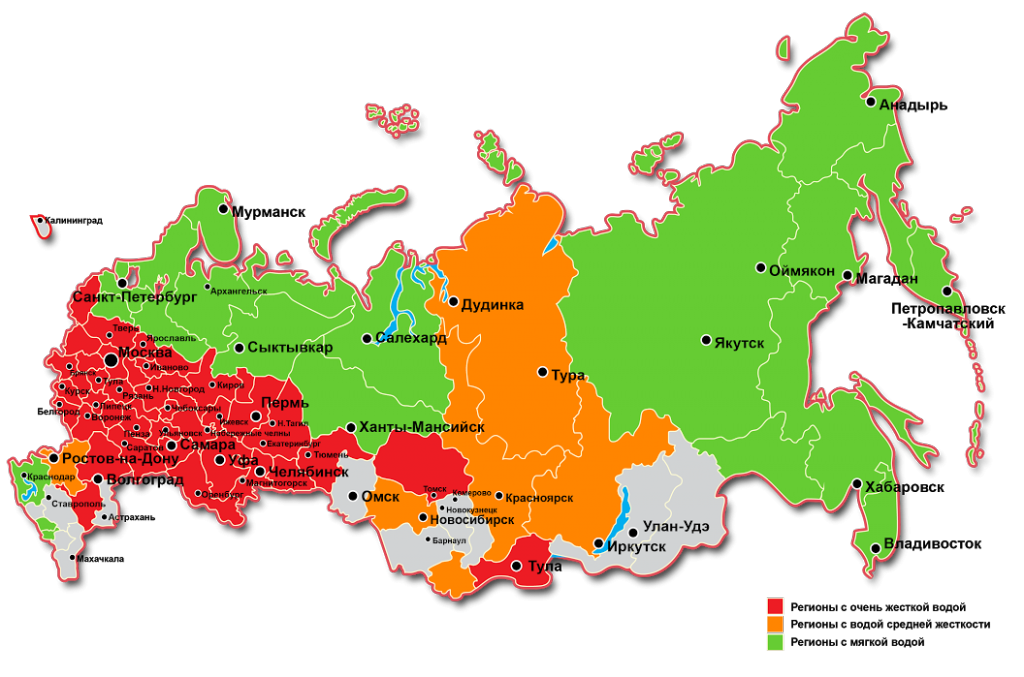
В различных регионах России жесткость поверхностных и грунтовых вод отличается: преимущественно мягкие воды географически приурочены к районам севера Европейской части России, а также Восточной Сибири. В центре и на юге Европейской части России, а также в южных регионах Западной Сибири вода преимущественно жесткая. В естественных условиях ионы кальция, магния и других щелочноземельных металлов, обусловливающих жесткость, поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и других процессов растворения и химического выветривания горных пород. Источником этих ионов являются также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий. Различные типы пород, залегающих на территории водосборов, а также взаимосвязанные с ними свойства почвенного покрова непосредственно обуславливают различия в жесткости вод в регионах нашей страны.
Воздействие жесткости на организм
Поиск причинно-следственных связей между жесткостью воды и сердечно-сосудистой патологией был результативным. В ряде исследований установлена статистически достоверная, хотя и не тесная, обратная корреляционная связь между жесткостью воды и частотой инфаркта миокарда. Поскольку в других, не менее тщательно выполненных исследованиях, такой связи не было установлено, считается, что патогенетическим агентом могли быть не сами соли жесткости, а коррелирующие с ними какие-либо другие микроэлементы. Что касается других проявлений вредного влияния жестких вод, то статистическими исследованиями установлено и экспериментально подтверждено их влияние на частоту возникновения мочекаменной болезни. В этом случае не идет речи о прямой детерминированности степени жесткости воды и заболеваний мочекаменной болезнью. Решающую роль играют другие сопутствующие факторы, в частности состояние минерального обмена конкретного человека, потребляющего жесткую воду. Высокое содержание в питьевой воде солей кальция и магния является фактором риска мочекаменной болезни.
Воздействие жесткости на сантехнику
Воздействие повышенной жесткости воды на контактирующие с ней приборы и сантехнику приводят к следующим последствиям:
Жёсткость воды из-за образующихся отложений негативно влияет на котельное оборудование. В России введены строгие требования к качеству воды по жёсткости для котлов ТЭЦ, электростанций, промышленных водонагревателей. Поэтому умягчение воды (водоподготовка) является в этом случае обязательным условием.
Способы умягчения воды
Умягчение воды может быть осуществлено следующими основными способами:
Нередко представляется целесообразным комбинировать эти способы, удаляя часть солей жесткости реагентным способом, а остаток их — катионированием, либо применять реагентный способ в комбинации с термическим способом умягчения воды.
Из реагентных способов умягчения наиболее распространен известково-содовый способ. Сущность его состоит в переводе растворенных в воде солей Са 2+ и Mg 2+ в малорастворимые СаСОз и Mg(OH)2, выпадающие в осадок.
Катионитовый способ умягчения воды заключается в фильтровании жесткой воды через мелкозернистую загрузку некоторых веществ (сульфоуголь, искусственные смолы). Эти вещества обладают способностью обменивать катионы содержащегося в них натрия Na + или водорода Н + на катионы кальция Са 2+ или магния Mg 2+ солей жесткости, растворенных в воде. Таким образом, различают процесс Na-катионирования и Н-катионирования.
Когда обменная способность катионитового фильтра исчерпана, производят регенерацию катионитовой загрузки. Na-катионитовые фильтры регенерируются раствором поваренной соли NaCl, а Н-катионитовые — растворами серной H2SO4 или соляной HCl кислот.
Вода после Na-катионитовых фильтров обычно имеет повышенную щелочность (рН>7), а после Н-катионитовых — повышенную кислотность (рН