На колоноскопии обнаружили опухоль что делать
На колоноскопии обнаружили опухоль что делать
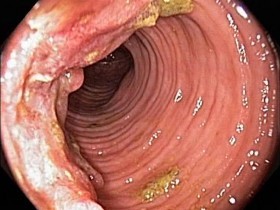
Если при колоноскопии обнаруживают измененный участок слизистой оболочки, вызывающий у врача подозрение на рак, следует выполнить биопсию с гистологическим исследованием и показать пациента хирургу. Такой подход кажется не сложным, и он действительно прост. Возможны исключения, но они, как всегда, подтверждают правило: патоморфологи иногда не могут поставить диагноз по присланному биопсийному материалу; хирургам может быть необходим больший объем информации, чем просто заключение «рак толстой кишки», а врач-эндоскопист думает лишь о локальном иссечении измененного участка. Вообще трудность состоит не в том, чтобы диагностировать типичный рак, а в том, чтобы заметить особенности в каждом случае.
Спорадическая форма рака толстой кишки развивается в результате злокачественной трансформации аденомы. Рак толстой кишки, соответствующий степени Т1, часто бывает случайной находкой и диагностируется при гистологическом исследовании удаленного полипа. Если врач уверен в полноте удаления аденомы (R0), опухоль по своим особенностям соответствует категории низкого риска (G1, G2, отсутствие прорастания в кровеносные сосуды), то от последующей онкологической резекции можно воздержаться. В некоторых случаях заподозрить рак можно по макроскопической картине полипа, в частности локальному изменению текстуры поверхности, наличию изъязвлений.
Текстура поверхности полипозных опухолей может оказаться однородной, что может послужить основанием для врача-эндоскописта удалить «полип». Если полип внешне не вызывает подозрений на рак, можно попытаться подвигать его с помощью щипцов, чтобы проверить, нет ли необычного уплотнения ткани, указывающего на возможную злокачественную трансформацию.
Рак на далеко зашедших стадиях вызывает стеноз кишки, инфильтрируя ее по всей окружности или только ее части, что затрудняет проведение эндоскопа через пораженный участок. Чтобы оценить, в каком состоянии находится часть толстой кишки, расположенная проксимальнее опухоли, исследование надо проводить с помощью тонкого колоноскопа или даже гастроскопа.
Не всегда по макроскопической картине можно однозначно судить о природе опухоли. Трудности возникают особенно в тех случаях, когда опухоль располагается за перегибами кишки и при центральном расположении эндоскопа недоступна для осмотра.
Особенности локализации и нестенозирующий процесс могут сначала затруднить дифференциальную диагностику. Окончательный диагноз в этих случаях ставят при участии патоморфолога.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение рака толстого кишечника
Толстый кишечник – конечный участок желудочно-кишечного тракта, протяженностью от 1,5 до 2-х метров. В медицине его принято разделять на отдельные сегменты: восходящая и поперечная ободочные кишки, слепая кишка с аппендиксом, сигмовидная кишка, нисходящая ободочная кишка, прямая кишка.
Рак толстого кишечника – это патологическое состояние, при котором на слизистой оболочке кишечных стенок развивается злокачественная опухоль. Она состоит из перерожденных клеток и имеет склонность к быстрому росту. Чаще всего новообразование располагается в слепом, сигмовидном или прямом отделах.
В группе риска находятся люди пожилого возраста. К сожалению, согласно статистическим данным, ежегодно количество заболевших возрастает, несмотря на развитие медицины и появление новых методов лечения рака толстого кишечника на 3, 4 стадиях.
Причины рака толстого кишечника:
Симптомы заболевания
При раке толстого кишечника симптомы начинают проявляться на второй стадии развития болезни и со временем только усугубляются. Среди них выделяют:
Общими проявлениями онкологического заболевания считаются головные боли, сонливость, повышенная раздражительность, апатия, общая слабость.
У женщин иногда наблюдаются слизистые и кровянистые выделения из влагалища, нарушения менструального цикла.
На последних фазах развития рака толстого кишечника признаки полной интоксикации организма проявляются из-за длительных нарушений в работе пищеварительного тракта.
Интервальный колоректальный рак
Ранее понятие интервальных колоректальных раков уже упоминалось в этой статье. А сегодня рассмотрим подробнее это понятие.
Интервальный колоректальный рак определяется как диагностируемый колоректальный рак в течение 60 месяцев после колоноскопии, на которой не было обнаружено рака. При этом стоит учитывать, что 5 лет – это “среднее время выявления.” Важно предотвратить развитие интервального рака.
Чаще всего оно встречается у женщин, у лиц преклонного возраста, имеется в семейном анамнезе колоректального рака, сопровождается сопутствующими заболеваниями, дивертикулезом и выявляемость зависит от опытности эндоскописта. Образование рака толстой кишки в большой степени зависит от наличия сидящих зубчатых аденом/полипов (sessile serrated adenomas/polyps (SSA/Ps).
Однако, некоторые исследования определили колоректальный рак как диагностированный не позднее 36 месяцев после предшествующей колоноскопии.
ВВЕДЕНИЕ
Колоректальный рак является третьим наиболее распространенным злокачественным новообразованием в мире, с самым высоким уровнем заболеваемости 45,7 на 100 000 в Австралии и Новой Зеландии. Большинство колоректальных раков развиваются из аденоматозных полипов в период времени, когда аденома/полип уже есть, но еще не диагностированы. Этот интервал называется «время потенциального выявления» (т. е. время между возможностью выявить аденому/полип при скрининговой колоноскопии и клиническим проявлением этих аденом/полипов).
Вся слизистая оболочка прямой и толстой кишки может быть обследована с помощью колоноскопии; таким образом, колоноскопия может быть использована для обнаружения и одновременного удаления предраковых аденом, прежде чем они станут инвазивными видами рака (т. е. не пригодными для эндоскопического удаления).
Несмотря на то, что многие врачи считают колоноскопию лучшим методом диагностики для обнаружения колоректального рака, есть некоторые вопросы относительно того, действительно ли это самая идеальная процедура для использования. В нескольких исследованиях сообщалось, что от 5% до 8% всех колоректальных раков были диагностированы у пациентов, перенесших колоноскопию за 3-5 лет до диагноза. Эти виды рака обычно называют интервальными или постколоноскопическими. Раковые опухоли получили название “интервальные”, так как диагноз обычно ставился в промежутках между колоноскопиями.
Общая распространенность интервальных колоректальных раков варьирует от 1,8% до 9,0%.
Из объединенного анализа исследователи выявили – средняя распространенность составила 3,7%. Иными словами, 1 из 27 колоректальных раков были классифицированы как интервальные. Однако, когда эту формулу распространили на раки, которые диагностируются в течение 60 месяцев после предшествующей колоноскопии, то распространенность колоректального рака увеличилась до 4,3%.
Что касается местоположения, то распространенность проксимальных интервальных раков, расположенных от слепой кишки до селезеночного изгиба, составила 6,5% по сравнению с 2,9% для интервальных раков в левой половине толстой и прямой кишки. Интервальный рак в 2,4 раза чаще поражал правые отделы толстой кишки — купол слепой кишки, восходящую кишку, печеночный изгиб.
Основные причины, по которым интервальные раки чаще встречаются в правых отделах, не очевидны. Однако можно предложить четыре возможные причины.
Несколько исследований обнаружило, что интервальные колоректальные раки чаще встречаются у женщин, чем у мужчин. Для объяснения такой тенденции у женщин было предложено несколько причин.
Поскольку колоректальные новообразования у женщин чаще встречаются в проксимальной ободочной кишке, их часто можно пропустить при колоноскопических обследованиях. В течение первых 3 лет сразу после предшествующей отрицательной колоноскопии, не было никакой половой разницы с точки зрения риска развития колоректального рака. Тем не менее, после первых трех лет риск был ниже у женщин, чем у мужчин. Такие результаты показывают, что женщины могут быть подвержены риску пропущенного обнаружения новообразований на предыдущих колоноскопиях. Поэтому эндоскописты должны проявлять особую осторожность во время обследования у женщин во избежание пропущенного выявления очагов поражения.
ФАКТОРЫ РИСКА
ЭТИОЛОГИЯ
Как правило, интервальные колоректальные раки классифицируются как пропущенные поражения, неадекватная колоноскопия, неполная резекция и новые раковые заболевания (de novo). Определения каждой подгруппы следующие:
ПРОГНОЗ
В исследовании ученые обнаружили аналогичные показатели выживаемости между интервальным и спорадическим колоректальным раком при метастазах опухолей (23% против 24%), локализованной стадии при диагностике и 5-летней выживаемости (41% против 43%). Однако в одном исследовании выживаемость пациентов авторы обнаружили статистически значимое преимущество выживаемости для интервального колоректального рака по сравнению с выявленными колоректальным раком в целом и для запущенных стадий (стадий 3-4). Причины, лежащие в основе наблюдаемого преимущества интервального рака в выживаемости, не ясны.
Yu Mi Lee and Kyu Chan Huh. Clinical and Biological Features of Interval Colorectal Cancer, Clin Endosc. 2017 May; 50(3): 254–260.
Рак прямой кишки
Рак прямой кишки – что это такое?
Это злокачественное онкологическое заболевание происходит из эпителия прямой кишки. Этой опухоли присущи характерные черты любого злокачественного образования – быстрый рост, прорастание в соседние ткани, метастазирование.
Подвержены болезни мужчины и женщины в равной степени. Рост числа заболевших отмечается с 45 лет, а пик заболеваемости приходится на 75-летних.
О заболевании
Слизистая оболочки конечного участка толстой кишки покрыта цилиндрическим эпителием с большим количеством желез. Их клетки продуцируют слизь. Под влиянием факторов риска появляются патологические клетки с бесконтрольным делением и утратой механизма апоптоза – запрограммированной гибели. Постепенно из них формируется опухоль прямой кишки.
Предположительно установлены причины рака прямой кишки:
Виды рака прямой кишки
Тип опухоли определяется ее локализацией:
Характер роста опухоли может быть:
По гистологической картине новообразование бывает:
Симптомы рака прямой кишки, первые признаки
Обсуждение проблем прямой кишки для многих людей является чем-то постыдным. Поэтому первые признаки патологии часто остаются без должного внимания. Начальные симптомы рака прямой кишки – изменения характера стула. Появляется частая смена запора и диареи, меняется форма кала. Он становится значительно тоньше, чем раньше. Беспокоят чувство неполной дефекации, неприятные ощущения, повышенное образование газов.
Развитие опухолевого процесса вызывает отдаленные признаки рака прямой кишки:
На начальных стадиях проявления болезни может не быть. При выявлении анемии неизвестного происхождения стоит искать причину скрытого кровотечения. Возможно, это рак.
Поздние стадии характеризуются поражением других органов:
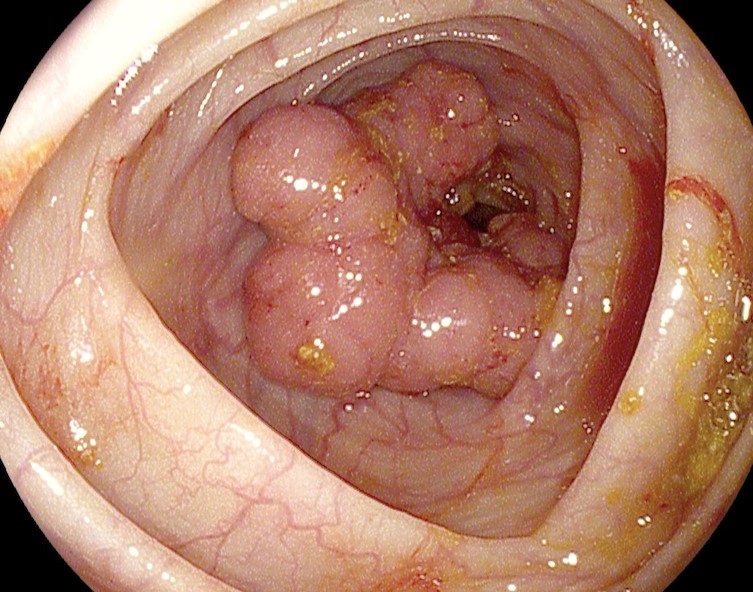
Как выглядит рак прямой кишки – фото
На фото рака прямой кишки можно заметить, что он значительно сужает просвет кишечника. Это является причиной запоров, переполненного живота, метеоризма.
На этом фото карцинома растет инфильтративно, охватывая стенку.
Диагностика
После обращения к врачу, определяют симптомы, которые беспокоят пациента и позволяют предположить болезнь ректального отдела.
Стадии рака прямой кишки
Течение ракового процесса при отсутствии должного лечения прогрессирует. Стадия определяется по степени поражения самого кишечника, прорастанием ее через стенку, наличием метастазов в лимфоузлах, отдаленных поражениях других органов.
В связи с этим опухоли делят на 4 стадии. Такое распределение универсально для любых злокачественных опухолей.
1 стадия – опухоль небольших размеров, растет на слизистом слое, не поражает соседние органы и лимфоузлы.
2 стадия делится на А и Б. 2А – это поражение от трети до половины окружности кишечной трубки, но растет строго в стенке или просвете, метастазов нет. 2Б – размер очага такой же, но есть метастазы в околокишечных лимфоузлах.
3А – опухоль занимает более половины окружности кишки, прорастает через все слои и околокишечную клетчатку. Могут быть единичные метастазы в ближайших лимфоузлах.
3Б – любой размер опухоли, метастазы в отдаленных лимфоузлах, принимающих лимфу от ректальной области.
4 стадия – метастазы распространяются по внутренним органам и отдаленным лимфатическим узлам. Размер первичной опухоли может быть любой.
Методы лечения рака прямой кишки
Небольшой размер опухоли и ее прорастание только через слизистый и подслизистый слой прямой кишки, не затрагивая мышечный и серозный, позволяет выполнить хирургическое удаление самой опухоли. Иногда возможно проведение операции через кишку с помощью колоноскопа.
Если она проросла в мышечный слой, то показана резекция прямой кишки или экстирпация (полное удаление органа). Также удаляется параректальная клетчатка и лимфоузлы, в которых в 20% случаев уже обнаруживаются метастазы. Для проведения операции используют два доступа – лапаротомия (рассечение брюшной стенки) и лапароскопия (операция с помощью видеооборудования через несколько проколов на животе).
Тип операции выбирается исходя из локализации опухоли. Высокое расположение позволяет провести удаление новообразования и временно вывести конец кишки на брюшную стенку – сформировать колостому для дефекации. Такая манипуляция нужна, если пока сшить между собой концы кишки невозможно. Вторым этапом через некоторое время восстанавливают целостность кишечника.
При низком расположении опухолевого процесса, если ниже ее не осталось здоровых тканей, проводят удаление пораженного участка и анального отверстия, накладывают колостому на брюшную стенку.
Прогноз выживаемости
После проведения радикальной операции выживаемость в течение 5 лет колеблется в пределах 34-68%. На исход лечения влияет стадия, на которой была диагностировна опухоль, состояние самого пациента, его возраст, сопутствующие заболевания.
В зависимости от стадии опухолевого процесса, пятилетняя выживаемость определена следующими цифрами:
4 стадия не рассматривается в данной статистике. Радикальные операции зачастую провести невозможно, т.к. метастазы опухоли диссеминрованы по всему организму. Летальный исход зависит от общего состояния больного.
Противопоказания
Операция противопоказана при следующих условиях:
При распространенном процессе с метастазированием во многие органы применяют паллиативные резекции, направленные на облегчение состояния больного. Симптоматические операции – наложение обходных анастомозов, чтобы разгрузить кишечник и избежать осложнений на последних стадиях рака.
Лечение до и после операции
Химиотерапия и лучевая терапия показаны для больных с опухолями 2 и выше стадиями.
Если до операции были выявлены метастазы в нескольких лимфоузлах, а опухоль проросла мышечный слой, то на этапе подготовки к операции проводят лучевую терапию коротким курсом в течение 5 дней. Это позволяет уничтожить ранние метастазы, уменьшить размер самого образования.
Лечение рака прямой кишки после хирургического вмешательства проводится после получения патоморфологических данных об удаленных тканях. Решается вопрос о проведении облучения или его сочетании с химиотерапией. Лучевая терапия после операции уничтожает оставшиеся клетки в зоне первичной опухоли и предупреждает ее рецидив. У неоперабельных больных она облегчает состояние.
Чувствительность к химиотерапии выявляется у 30% больных. Ее назначают с лечебной целью для уничтожения метастазов.
Также химиотерапию проводят адьювантно – для предупреждения распространения карциномы, если выявлялось поражение нескольких лимфоузлов. Этот способ терапии улучшает качество и продолжительность жизни пациентов с метастазами. Применяют препараты платины, 5-фторурацил, лейковарин, фолинат кальция. Лекарства вводятся внутривенно капельно, курсами по несколько дней. Также применяют химиотерапию в сочетании с лучевой до проведения операции при местнораспространенной форме рака. Такое комбинированное лечение проводят в течение 1-1,5 месяца, а после окончания облучения через 6 месяцев выполняют операцию.
Распространен и опасен: главное о колоректальном раке
Какие виды колоректального рака бывают?
Колоректальный рак (КРР) включает в себя несколько видов. Первый и самый распространенный — это рак ободочной кишки (аденокарцинома толстой кишки). Вторым по частоте является рак прямой кишки (аденокарцинома прямой кишки). И третий вид — это рак анального канала, как правило он плоскоклеточный. Значительно реже встречаются другие злокачественные опухоли прямой ободочной кишки: гастроинтестинальная стромальная опухоль, нейроэндокринный рак или карциноид — более доброкачественный вариант нейроэндокринной опухоли. И совсем редко встречаются меланомы прямой кишки и анального канала.
На каком месте по заболеваемости находится колоректальный рак?
Если брать все виды рака, которые относят к КРР, то на третьем месте в мире. Но в развитых странах процент пациентов с КРР немного больше. Скорее всего, это связано с увеличенной продолжительностью жизни и особенностями питания.
Считается, что если в популяции употребляют больше мясных продуктов и меньше растительной пищи, то вероятность возникновения колоректального рака увеличивается.
Какие виды КРР более распространены среди женщин, а какие среди мужчин?
Как можно понять, что у тебя повышенный риск развития колоректального рака? С какого возраста следует начинать профилактические обследования?
Очень важно помнить, что 10% случаев КРР — это наследственные формы.
В США, где скрининг развит наиболее сильно, принято выделять группы среднего, повышенного и высокого риска.
Группа среднего риска — это большинство из нас: здоровые люди, у которых нет близких родственников, которые бы болели КРР, раком желудка, раком тела матки или раком молочной железы. У них отсутствуют наследственные синдромы и хронические воспалительные заболевания кишечника, а именно неспецифический язвенный колит или синдром раздраженной кишки. В этой группе скрининговые обследования нужно проводить с 55 лет.
Группа повышенного риска — это пациенты, у которых кровные родственники (родители или бабушки\дедушки) болели указанными выше видами рака. У таких людей повышен риск возникновения злокачественного новообразования, в том числе и КРР. Представителям этой группы следует начинать обследования раньше, в США советуют это делать с 45 лет.
И, наконец, есть группа высокого риска. В нее входят пациенты с доказанными наследственными синдромами: диффузным семейным полипозом, синдромом Пейтца–Егерса или синдромом Линча. Для таких людей характерно раннее возникновение полипов в кишечнике и затем развитие из них злокачественной опухоли. Также сюда относят пациентов, более 10 лет страдающих неспецифическим язвенным колитом или болезнью Крона. Этой группе нужно начинать скрининговую программу намного раньше. Например, наличие родственников с диффузным семейным полипозом сдвигает эту границу аж к 20 годам. А при синдроме Линча у пациента в 100% случаев разовьется колоректальный рак, если он до него доживет. Если у таких людей находят опухоль кишечника, то удаляют всю толстую и прямую кишку, понимая, что рано или поздно у них разовьется рак и в оставшейся части.
Первая стадия скрининга для всех групп риска — это иммунохимический анализ кала на скрытую кровь. Тест бывает количественный и качественный, но лучше выбирать количественный, он точнее. Если тест показывает наличие крови в кале, то тогда следует выполнить фиброколоноскопию, чтобы посмотреть все толстую и прямую кишку.
Какие программы скрининга действуют сейчас в России?
В России, к сожалению, вообще нет скрининговых программ, если мы говорим о популяционном скрининге. У нас есть только некоторые элементы. Например, в Санкт-Петербурге несколько лет назад проводилась программа по скринингу рака молочной железы. Женщин обследовали, поводили маммографию, специально оснащали кабинеты маммологов и прочее. Но такие программы должны финансироваться отдельно, а у нас все пытаются включить в программу диспансеризации, не совсем понимая, что диспансеризация и онкологический скрининг — разные вещи.
Всего в мире известны три опухолевые локализации, в отношении которых популяционный скрининг доказано эффективен: КРР, рак молочной железы и рак шейки матки. Все остальные вопросы, связанные со скринингом, например, рака легкого или рака предстательной железы, пока только изучаются, очевидных доказательств эффективности сегодня нет. А внедрение скрининговой программы по КРР в США помогло снизить смертность примерно на 10%, это жизнь 13,5 тысяч человек ежегодно.
Но что очень важно для популяционного скрининга, так это хороший охват групп населения. Если он меньше 50%, то затраты на скрининг превышают пользу. В такие программы должны вовлекаться не только онкологи, эпидемиологи и другие врачи, но также СМИ, медиаперсоны да и общество в целом. Это большая комплексная работа, которой сейчас нет в России.
Какие профилактические действия помогут снизить риск КРР?
Безусловно, первое, что можно сделать — отказаться от курения. Также нужно стараться употреблять больше клетчатки и меньше переработанного красного мяса. Если есть проблемы с функционированием кишечника (синдром раздраженной кишки, нарушения стула) — это нужно обязательно лечить. И, наконец, нужно понимать, что если вам стукнуло пятьдесят лет, то необходимо на всякий случай сдать кал на скрытую кровь и сделать колоноскопию. Любые жалобы: изменение стула, наличие крови — должны быть поводом для посещения врача. Нельзя махать рукой на такие обстоятельства, думая, что у тебя просто геморрой. Нужно обратиться к специалисту, который назначит правильное обследование и лечение. Для любого грамотного проктолога наличие крови в стуле — это повод назначить фиброколоноскопию.
На какие моменты нужно обратить внимание, когда тебе назначают колоноскопию?
Как и при любой другой инвазивной манипуляции, чем чаще врач ее выполняет, тем больше у него в этом опыта. Достаточно банальная истина, но нужно обращаться в учреждение с хорошим потоком пациентов. Во-вторых, нужно идти туда, где процедуру вам сделают на качественном оборудовании. И, желательно, где вам обеспечат обезболивание.
К сожалению, у нас есть проблема с отсутствием контроля качества колоноскопии. Хотя вполне объективные критерии ее выполнения существуют. К этим проблемам на западе относятся очень серьезно. Гипотетически можно делать колоноскопию всем людям, например, в городе Санкт-Петербурге. Потратить на это огромные деньги. Но если сделать ее всем и некачественно, то ценность такой процедуры теряется. Если врач пропустит 15% полипов у 15% больных, то ценность этого скрининга будет нулевая. Именно поэтому за рубежом есть четкие объективные критерии оценки качества выполненной процедуры. А у нас их пока нет.
А каковы эти критерии качества?
Самое понятное для неспециалистов — колоноскопия не должна продолжаться меньше 15 минут. Если доктор говорит, что очень быстро засунул колоноскоп, моментально осмотрел всю кишку и он молодец, то это не так.
Значит он смотрел невнимательно. А полипы бывают маленькие, например, полсантиметра-сантиметр. Если врач эти полипы пропустил, а в следующий раз человек собрался сделать колоноскопию, скажем, через 10 лет, то за это время из полипа может развиться рак.
Кстати, критерии качества хирургического вмешательства при КРР тоже важный вопрос. Ведь что такое онкологическая операция? Это операция, качество которой мы не можем определить сегодня, завтра или послезавтра. В отличии от какого-нибудь геморроя, при онкологическом заболевании у пациента, зачастую нет жалоб. Он лег на стол и чувствовал себя хорошо; встал и чувствует то же самое. Но как выполнена эта операция, мы не знаем. Мы можем это определить только через год, когда человек придет, сделает компьютерную томограмму и там действительно будет все хорошо, без признаков рецидива болезни. Но если он придет, а эти признаки будут, то поздно что-то говорить доктору. Время уже упущено.
Сегодня именно для КРР существуют вполне четкие критерии качества. Их придумали онкохирурги в развитых странах. Это, так называемая, препарат-ориентированная хирургия. На основании характеристик удаленного препарата уже через день после операции можно сказать, качественно она была выполнена или нет. Но по этим критериям в России никто не оценивает хирургов. Мы сейчас пытаемся исправить ситуацию, создаем раковый регистр. Уже охватили несколько учреждений в Питере и других городах России, которые будут участвовать в оценке качества операций. Это очень важно, поскольку качественно сделанная операция при КРР дает прибавку к выживаемости в 10%.
Нужно ли выполнять биопсию при колоноскопии?
Современная колоноскопическая техника позволяет отличить обычный доброкачественный полип от чего-то более серьезного. Но нужно понимать, что любой полип больше полусантиметра должен быть удален. Маленькие можно удалять амбулаторно, прямо во время процедуры. Но вот для крупных полипов или полипов с подозрением на злокачественный рост нужно выполнить биопсию. И если он большой, но доброкачественный, то удаляют его в стационаре — обычно это занимает не больше двух дней. А если мы получаем при изучении биопсии злокачественный результат, то тогда уже нужно проходить полное обследование, определять клиническую стадию заболевания. И в зависимости от стадии уже определяется тактика лечения: начиная от эндоскопического удаления во время колоноскопии и заканчивая применением всех методов лечения.
Расскажите, пожалуйста, поподробнее про методы лечения.
В идеале мы должны находить онкологические заболевания, в частности колоректальный рак, на таких стадиях, чтобы было достаточно небольшого вмешательства. Если бы мы всем пациентам диагностировали КРР на первой стадии, то можно было бы ограничиться эндоскопическими вмешательством во время колоноскопии. И это было бы здорово. И более того, это был бы окончательный метод лечения, который приводил бы к выздоровлению у большинства больных в 99% случаев. Но, к сожалению, пока мы далеки от этого.
Есть пациенты с опухолями побольше, но все равно вполне операбельными. В этих случаях достаточно только хирургического вмешательства, которое также приведет к полному излечению большинства больных. Не потребуется больше ничего, кроме наблюдения у онколога.
Когда пациент попадает в руки онкологов уже на третьей стадии, ему требуется использование нескольких методов лечения. Принципиально в онкологии их существует три: хирургическое лечение, лекарственное (химиотерапевтическое) лечение и лучевое воздействие на опухоль. Если мы говорим про рак прямой кишки, то на третьей стадии пациент обязательно должен получить все три составляющие. Причем начинать лечение нужно, как правило, с химиолучевой терапии, а затем уже проводить хирургическое вмешательство. В этом случае мы увеличиваем безрецидивную выживаемость на 10-15%, если сравнивать с только хирургическим лечением.
Фото из архива Ильи Черниковского
Если говорить про рак ободочной кишки, то он, как правило, не подвергается лучевому воздействию. Очень сложно облучить опухоль, которая расположена в брюшной полости. Пациент дышит, двигается, кишечник перистальтирует и нецелевые органы могут попасть под лучевое воздействие. На третьей стадии этого вида КРР уже определенно используется химиотерапия, но как профилактическое лечение после хирургического вмешательства. Она позволяет увеличить выживаемость таких пациентов примерно на 5-10%, что несомненно важно.
Так как на третьей стадии необходимо комбинированное и комплексное лечение, этим не должен заниматься стационар общего профиля. Кроме того, очень важно чтобы решение о тактике лечения принимал консилиум в составе хирурга-онколога, химиотерапевта и радиолога. Это прописано у нас в приказе Министерства здравоохранения «Об утверждении Порядка оказания медицинской помощи населению по профилю «онкология»».
Ну и наконец, самая печальная группа больных, которые обращаются к онкологам на 4 стадии заболевания с метастазами в отдаленные органы. Чтобы совсем не наводить пессимизм, можно сказать, что за последние 20 лет удалось добиться довольно существенных прорывов в лечении таких больных.
Во-первых, оказалось, что единичные метастазы в отдаленные органы очень «покладисты» в лечении КРР. Мы знаем, что примерно в 70% случаев КРР метастазирует в печень. Во вторую очередь в легкое. Сейчас появились разные способы воздействия на метастазы в печени. Помимо обычной химиотерапии и хирургического лечения, есть еще методы малоинвазивного лечения, которые сводятся к закупорке одного или нескольких кровеносных сосудов печени эмболизатом, содержащим химиопрепарат. Кроме этого, к малоинвазивным инструментам относят методы локального воздействия на метастазы в печени: криоабляцию, микроволновую абляция и радиочастотную абляцию метастатических очагов. Все вышеперечисленное позволяет использовать, комбинировать и выбирать наиболее эффективные подходы в том или ином случае. Это позволяет боротся за таких больных довольно долго и существенно продлевать им жизнь.
Во-вторых, появились новые таргетные препараты, которые дают очень хороший эффект. На фоне этих препаратов, при выполнении операции на печени, некоторые пациенты получили существенное 30-40% повышение выживаемости. Это большой прорыв.
Вышесказанное еще раз доказывает, что заниматься пациентами с КРР должны в стационарах, где работают все группы специалистов. Помимо просто хирурга, который может удалить опухоль, нужны еще грамотные химиотерапевты и радиологи, специалисты по хирургическому лечению печени и т.д. Если пациент может получить все это в одном стационаре, у него появляется шанс жить гораздо дольше.
В России такие места есть. Например, в Петербурге как минимум три таких учреждения: «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)», «НМИЦ онкологии им. Н.Н. Петрова» и «Городской клинический онкологический диспансер». А в Москве можно выделить «Московскую городскую онкологическую больницу №62», «НМИЦ онкологии им. Н.Н. Блохина», «МНИОИ им. П.А. Герцена» и «Государственный Научный Центр Колопроктологии». Не нужно бояться названия. Пациенты часто думают, что если написано слово онкологический, то у них все плохо, мы там лечиться не будем. Ну нет же! Слово «онкологический» означает, что в клинике есть все необходимое для лечения этой сложной группы заболеваний.
Расскажите еще, пожалуйста, о влиянии локализации рака на выживаемость.
Есть данные, что при расположении первичной опухоли в левой половине ободочной кишки (то есть, в нисходящей ободочной, сигмовидной и прямой кишке) выживаемость существенно выше, чем при локализации рака в правой половине (слепой или восходящей ободочной кишке). Но пока этот вопрос на стадии изучения, и уже появляются альтернативные точки зрения.
Как правило, опухоли с левой стороны ободочной кишки диагностируются раньше. Это связано с тем, что, во-первых, в левой половине ободочной кишки опухоль часто вызывает стеноз — из-за него возникают нарушения дефекации и кровь в стуле, следовательно, пациенты раньше обращаются к врачу. Во-вторых, когда выполняют колоноскопическое исследование, иногда не могут пройти колоноскопом дальше определенного места. До левой половины добраться проще, далеко не все эндоскописты доходят до слепой кишки и тщательно рассматривают правую половину.
А это пока никто не учитывал в исследованиях. Есть мнение, что это все связано не с биологией опухоли, а лишь с такими факторами. Я сейчас ссылаюсь на нашего самого известного онкогенетика, профессора Имянитова Евгения Наумовича. Он считает, что глобальных генетических различий между правой и левой половиной опухоли нет.
Какие советы вы могли бы дать пациентам?
Первое: вы не должны бояться обследований.
Второе: если у вас подтвердился диагноз КРР, обязательно обратитесь в специализированное учреждение! Часто пациент выбирает врача по советам: говорят у него «хорошие руки». Но если руководствоваться этим принципом, то мы никогда не узнаем реального качества операции, мы увидим только шов. Дальнейшая судьба пациента хирургу, как правило, неизвестна, с рецидивом приходят уже к онкологу. Поэтому важно, чтобы пациент выбирал место лечения, специализирующееся на его заболевании. Если есть отделение в городе, где оперируют пятьсот колоректальных раков в год, то нужно идти туда. А не в клинику, где это вмешательство делают двадцать раз в год, но каждый раз говорят, что с «хорошими руками».
В развитых странах, если отделение выполняет менее пятидесяти операций в год, связанных с КРР, то его перепрофилируют. В Санкт-Петербурге совершенный разброс в этом плане. Пациенты обращаются в разные учреждения и оперируются не в профильных центрах. И дело даже не в том, что там плохие доктора, просто это не их работа. Так же, как если я начну оперировать грыжи. Да, я умею это делать, но это не моя задача. А у нас все, кому не лень, хватаются оперировать рак.
А потом министр здравоохранения приезжает и удивляется, что в Санкт-Петербурге плохая онкологическая статистика. А это все из-за того, что в Петербурге зачастую не следуют порядку оказания помощи онкологическим больным. У нас примерно половина пациентов оперируется не в профильных учреждениях на сегодняшний день. А отвечают за результаты онкологи.
Мы боремся с этим уже давно и продолжим это делать, чтобы закрепить эту простую истину: онкологические больные должны лечиться у онкологов. Это очень важно.
И третий пункт, люди мало что знают о своих правах. У нас в городе пациент, которому поставили диагноз рак, имеет право сделать все обследования, которые необходимы для определения тактики, бесплатно и в рамках одного учреждения. Что сегодня происходит с такими больными? Им ставят диагноз и начинают гонять: в одно место — сделать КТ, в другое — выполнить платно МРТ, а потом только берут на операцию в непрофильное учреждение. А после оказывается, что ему нужно делать химиотерапию. А еще желательно, перед тем как назначить лекарства, провести иммуногистохимическое и молекулярно-генетическое консультирование для более прецизионного лечения. И все это платно.
Такой бардак твориться сейчас в Санкт-Петербурге сплошь и рядом. Больные должны знать, что они могут прийти и получить весь объем исследований в одном месте, бесплатно, для того чтобы определиться с тактикой лечения. И не нужно бояться, что в государственном учреждении это займет много времени. На сегодняшний день, есть приказ комитета по здравоохранению, в котором говорится, что в течение десяти рабочих дней пациент должен быть обследован. Любой врач из поликлиники, если он заподозрил диагноз КРР, может направить человека к нам. Пациент спокойно позвонит по телефону и запишется на следующий день на консультацию. Это то, как нужно поступить в случае обнаружения колоректального рака, но, к сожалению, об этом мало кто знает.