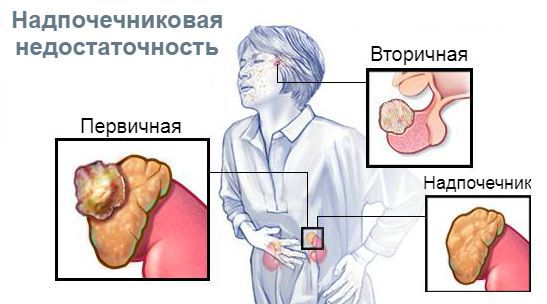
Надпочечник не лоцируется что это значит
Как проходит диагностика надпочечников
Надпочечники вырабатывают одни из самых важных гормонов, поэтому их роль в организме неоценима. Разбираемся, в каких случаях и как проводят диагностику надпочечников.
Некоторые органы можно осмотреть без специальных приборов, но далеко не все. Как осмотреть органы брюшной полости, например, надпочечники, куда инструментами не добраться? Диагностика надпочечников регулярно проводится пациентам с гормональными отклонениями, поэтому и способов определить заболевания этих органов сейчас довольно много.
Роль надпочечников в организме
Надпочечники — органы эндокринной системы. Они вырабатывают одни из самых важных гормонов: адреналин, норадреналин, кортикостероиды и андрогены. Через них надпочечники влияют на:
В каких случаях необходимо пройти обследование?
Если учесть, какую высокую роль надпочечники играют во всех процессах организма, признаки отклонений в их работе очень разнообразны. Обычно, специалисты назначают обследования при следующих симптомах:
Все эти симптомы указывают на нарушение гормонального фона. При отсутствии лечения проблемы будут усугубляться. Через гормоны надпочечники влияют на весь организм, а значит и болезни будут прогрессировать во всём теле.
Диагностика надпочечников: какие исследования помогут?
Исследовать состояние этих органов можно при помощи анализов и специального оборудования. Сочетание этих способов диагностики даёт точный результат, по которому специалист сможет назначить верное лечение.
На УЗИ брюшной полости надпочечники рассмотрит только высококвалифицированный врач. Дело в их расположении: они находятся под мышцами, жировой прослойкой и всеми органами. Тем не менее, с помощью УЗИ проверяют железы на наличие опухолей и изменение структуры — и то, и другое на ультразвуковом исследовании видно хорошо.
МРТ органов брюшной полости позволяет сделать чёткие снимки на любом уровне. Магнитно-резонансная томография противопоказана пациентам с металлическими предметами внутри тела (кардиостимуляторы и так далее). Помимо этого, в замкнутых конструкциях может ухудшиться самочувствие у людей, страдающих клаустрофобией. Но, если у вас нет противопоказаний, этот способ диагностики надпочечников окажется очень информативным.
Компьютерная томография считается самым точным методом исследования. В ходе процедуры будет создана объёмная модель надпочечников, что позволит подробно их осмотреть. Обследование занимает совсем мало времени — если МРТ брюшной полости займёт 40 минут, то на КТ уйдёт всего 15 минут. Но есть противопоказания людям, которые весят больше 120 кг, детям и беременным женщинам.
Что касается сдачи анализов, то это может быть:
По содержанию гормонов в крови можно определить, в какую сторону отклонена работа надпочечников. Каждый гормон вырабатывается определённой частью органа. А значит, по результатам анализа можно понять, что именно сейчас работает не так.
Подготовка к обследованию
Перед УЗИ предстоит за пару дней исключить все продукты, провоцирующие метеоризм. Это сырые овощи и фрукты, хлеб, бобовые и газированные напитки. Перед МРТ и КТ подобной подготовки не требуется. Однако, для проведения всех этих исследований, кишечник должен быть пуст.
Анализы на гормоны требуют не только тщательной подготовки, но и конкретного времени забора материала:
Возможно, ваш врач даст дополнительные комментарии, в зависимости от вашего заболевания. Основные рекомендации для успешного обследования:
Если хорошо подготовиться, диагностика надпочечников пройдёт успешно, обследования покажут верные результаты и существенно помогут в диагностике заболеваний.
УЗИ почек, надпочечников и мочевого пузыря
УЗИ почек, надпочечников и мочевого пузыря
Что такое УЗИ?
Ультразвуковое исследование — это медицинский тест, при котором используются высокочастотные звуковые волны в целях получения изображений в реальном времени внутренних частей тела человека. В отличие от других методов визуализации, ультразвук не использует излучение. УЗИ позволяет диагностировать различные заболевания почек и мочеполовой системы. Обследование почек практически всегда начинается с ультразвукового исследования.
Как выполняется УЗИ почек, надпочечников и мочевого пузыря?
УЗИ почек, надпочечников и мочевого пузыря выполняется конвексным датчиком. Правильнее всего выполнять данное исследование полипозиционно, то есть с нескольких положений пациента. Наши врачи выполняют его в трех основных позициях: лежа на спине, лежа на каждом боку; сидя, к врачу спиной.
Подготовка к УЗИ почек, надпочечников и мочевого пузыря.
Особой подготовки для УЗИ почек не требуется. Если в комплексе идет исследование с мочевым пузырем, то должен быть наполнен мочевой пузырь. Это единственное условие для исследования. Мочевой пузырь необходимо наполнять правильно: за 1-1,5 часа, в зависимости от особенностей организма, до исследования выпить 2-3 стакана воды.
В каких случаях и кто назначает УЗИ почек, надпочечников и мочевого пузыря?
УЗИ почек, надпочечников и мочевого пузыря назначается в нескольких случаях. В первом случае назначает терапевт-кардиолог для исключения каких-либо почечных проблем при гипертонической болезни, то есть при повышении артериального давления. Так как проблемы в почках могут провоцировать подъем артериального давления, также вместе с почками исследуется область надпочечников — место, где выделяются очень важные для человека гормоны: биогенные — катехоламины, это норадреналин и адреналин; минералокортикоиды (к ним относится альдостерон — гормон, отвечающий за обратное всасывание натрия и, соответственно, жидкости), кортикостероиды, глюкокортикоиды и другие. Все они влияют, так или иначе, на артериальное давление. И, если мы видим на УЗИ, что по структуре надпочечников (в идеале их не должно быть видно) они не дифференцируются паранефральной клетчатке, то есть мы, теоретически, знаем, что между печенью и почкой, или селезенкой и почкой, должен быть надпочечник, но в идеале на УЗИ мы его не видим. Это нормальная картина. И если в заключении написано, что надпочечники не лоцируются, это не должно пугать, так и должно быть. И, если мы видим какие-то изменения в сторону, например, появления какой-либо новой ткани, то это повод заподозрить проблему с надпочечником, соответственно, это косвенно объясняет повышение давления и прочее.

Во втором случае УЗИ почек назначают урологи. Здесь может быть сразу несколько причин:
Исходя из поставленной задачи, врач-уролог знает, для чего проводить данное исследование и, соответственно, в направлении пишет цель УЗИ, предварительный диагноз и что нужно исключить или подтвердить. И в зависимости от данного запроса уролога мы отталкиваемся, полипозиционно смотрим, делаем замеры и выдаем заключение. И, если мы наблюдаем это в динамике, то указываем, как и что изменилось (количество камней, положение и прочее).
Противопоказания и ограничения
Ультразвуковое исследование противопоказаний не имеет и может проводиться несколько раз в день. Это относится и к детям, и к женщинам в период кормления и вынашивания ребенка.
Вы всегда можете записаться на прием к врачу УЗИ в сочи в медицинский центр ВегаМед, цены на УЗИ от 400рублей, вы сможете посетить врача УЗИ в день обращения так как клиника располагает свободными кабинетами для приема пациентов.
Записаться можно по телефону +7 (862) 295-00-95
Также предлагаем подписаться на нас в Инстаграм
Можете задать вопрос по WhatsAPP
Записаться без телефонного звонка к медицинский центр «Нажмите сюда для записи«
УЗИ надпочечников: как подготовиться, что показывает результат, норма по УЗИ
Что показывает и как подготовиться к УЗИ надпочечников?
Когда назначается УЗИ надпочечников?
Обследование рекомендуется проводить пациентам в следующих случаях:
Как подготовиться к УЗИ надпочечников?
Перед УЗИ надпочечников подготовку к исследованию опишет лечащий врач. Он обязательно предупредит о том, какие мероприятия следует провести пациенту, чтоб правильно подготовиться к УЗИ надпочечников. Ниже приведены общие рекомендации.
Желательно предварительно сдать анализы на гормоны, чтобы врач знал, на что следует особо обратить внимание.
Как делают ультразвуковое исследование надпочечников?
Обследование занимает обычно не более 20 минут и не представляет особых трудностей для пациента. Проводят его следующим образом.
Больной оголяет область живота и поясницы, ложится на кушетку. Диагност смазывает специальным гелем, исследуемый участок тела и датчик, который передает изображение на монитор. Затем врач в качестве отправных точек находит правую почку, правую долю печени и нижней полой вены. Эти точки представляют собой некий треугольник, внутри которого и будет находиться правый надпочечник. Для лучшей визуализации пациента попросят глубоко вдохнуть. Затем нужно перевернуться на правый бок для исследования структуры левого надпочечника. При необходимости врач может попросить принять и другое положение, чтобы лучше рассмотреть железы.
Расшифровка результата
Нормальные размеры надпочечников по УЗИ
Размеры надпочечников в норме по УЗИ различаются. Ширина правой железы – от 0,3 до 1,6 см, длина – от 1 до 1,5 см, высота – 1-2 см. Длина и высота левого надпочечника обычно составляет от 1,5 до 2,5 см, а ширина – от 0,8 до 1,5 см.
Какие патологии показывает УЗИ?
УЗИ надпочечников может выявить различные патологии этих органов, такие как гиперплазия, гематомы, кисты, опухоли.
Гиперплазия – это заболевание, которое может развиваться, когда человек еще находится в состоянии эмбриона. Признаками болезни являются: раннее появление волос у ребенка на лобке и в подмышках, остановка или задержка роста, угревая сыпь. У мальчиков в этот период начинает ломаться голос, у девочек могут начаться ранние менструации.
Киста – явление для надпочечников довольно редкое.
Опухоли могут быть как злокачественные, так и доброкачественные. Для надпочечников чаще характерны доброкачественные образования.
Противопоказания для проведения УЗИ надпочечников
УЗ-диагностика надпочечников, как и любого другого органа, проходит безболезненно. Данный метод очень распространен и не представляет никакой опасности для человека. В связи с этим противопоказаний очень мало, они могут носить временный характер.
УЗИ надпочечников противопоказано людям, у которых имеются повреждения кожных покровов (раны, шрамы, ожоги) или различные кожные заболевания (гнойные воспаления, сыпь, чесотка) в области проведения обследования по причине невозможности в данном случае получения достоверной информации из-за помех.
Также обследование может быть малоинформативным или же вообще бесполезным у людей с избыточной массой тела в связи с тем, что жировая ткань не дает ультразвуковым волнам пройти вглубь.
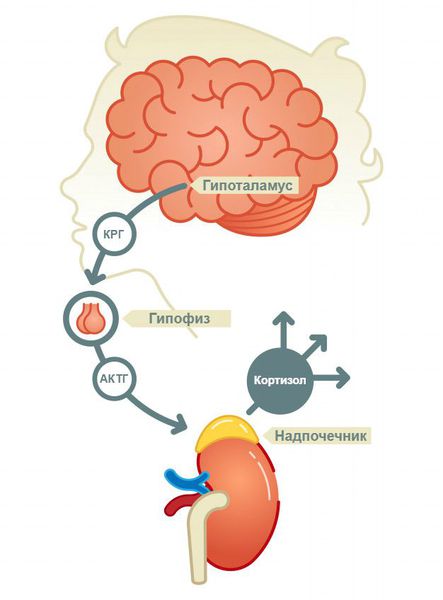
Что такое надпочечниковая недостаточность (гипокортицизм)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Зотовой Ю. А., эндокринолога со стажем в 24 года.
Определение болезни. Причины заболевания
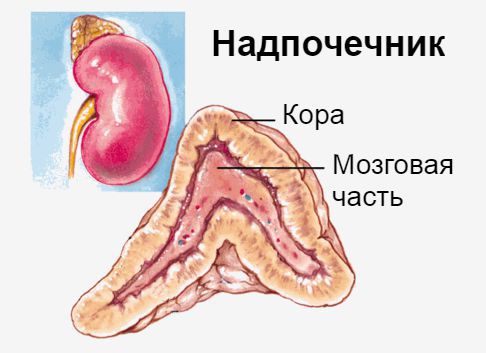
Надпочечники — это эндокринные железы. Их внутренняя (мозговая) часть производит гормон адреналин, который мобилизует все защитные силы организма. Наружная часть надпочечников — кора — вырабатывает кортикостероиды:
Причины первичной надпочечниковой недостаточности:
1. Нарушение развития надпочечников:
2. Деструкция надпочечников (разрушение):
3. Нарушения стероидогенеза (образования стероидов):
Причины вторичной и третичной надпочечниковой недостаточности:
1. Врождённый вторичный гипокортицизм.
2. Деструкция гипоталамо-гипофизарных структур:
Симптомы надпочечниковой недостаточности
Часть симптомов недостаточности маскируется под синдром хронической усталости: необъяснимая утомляемость, отсутствие бодрости в утренние часы. Человек начинает хуже переносить физические нагрузки, самочувствие становится лучше в горизонтальном положении. Астению сопровождает раздражительность, нетерпимость, проблемы с памятью.
Нарушается работа желудочно-кишечного тракта: снижается аппетит вплоть до полного отсутствия, возникает тошнота, рвота, боли в животе. Уменьшение массы тела связано с ухудшением аппетита, нарушением всасывания в кишечнике, обезвоживанием.
При дефиците надпочечниковых андрогенов у женщин снижается либидо, оволосение в подмышечной впадине становится скудным.
В ситуации стресса, острой инфекции, операции значительно повышается потребность организма в гормонах коры надпочечников, поэтому в таких случаях состояние может значительно ухудшиться из-за декомпенсации надпочечниковой недостаточности — опасного для жизни нарушения работы надпочечников, при котором у организма исчерпаны возможности механизмов приспособления. Обращают на себя внимание необычно быстрая утомляемость и чрезмерная усталость, головокружение, очень низкое артериальное давление, тяга к солёной пище, плохой аппетит, тошнота, рвота, понос (диарея), боли в животе, мышечная слабость, похудание без видимых причин, снижение настроения.
Патогенез надпочечниковой недостаточности
Глюко- и минералокортикоиды участвуют в белковом, углеводном, жировом и водно-электролитном обмене. Поэтому при их нехватке данные процессы нарушаются и снижается артериальное давление.
Дефицит альдостерона — естественного минералокортикоида — становится причиной выраженных сердечно-сосудистых нарушений из-за снижения реабсорбции (обратного всасывания) Na+ в почках. В связи с этим уменьшается объём циркулирующей крови и снижается артериальное давление вплоть до шока. При повышении уровня калия нарушается сердечный ритм и развиваются миопатии — заболевания, проявляющиеся мышечной слабостью. При снижении реабсорбции Na+ в кишечнике возникает целый каскад симптомов нарушения пищеварения, таких как боли в животе, нарушение всасывания.
Дефицит андрогенов, которые вырабатывают надпочечники, усиливает процессы распада сложных веществ в организме и повышает уровень остаточного азота.
Отличия центральных форм гипокортицизма от первичного:
Классификация и стадии развития надпочечниковой недостаточности
В зависимости от уровня поражения гипоталамо-гипофизарно-надпочечниковой системы различают три вида надпочечниковой недостаточности:
По клиническому течению выделяют два вида надпочечниковой недостаточности:
При заместительной гормонотерапии первичного хронического гипокортицизма лечащий врач подбирает своему пациенту дозу глюкокортикоидов для возмещения недостающих гормонов, причём важно, чтобы в итоге уровень гормонов был строго в норме — не меньше и не больше.
Если лекарства полностью возмещают дефицит и не дают избытка гормонов в организме, то пациент чувствует себя гораздо лучше. Это означает, что заболевание не излечено раз и навсегда, так как оно хроническое, но находится в фазе компенсации.
Осложнения надпочечниковой недостаточности
Диагностика надпочечниковой недостаточности
Иногда при частичном поражении надпочечников эти показатели остаются в пределах нормы. Чтобы получить более надёжный результат, исследовать функцию коры надпочечников лучше с помощью стимулирующих тестов. Данный этап необходим, если по результатам клинико-лабораторного обследования не удалось однозначно подтвердить наличие надпочечниковой недостаточности.
Лечение надпочечниковой недостаточности
Лечение надпочечниковой недостаточности жизненно необходимо. Оно направлено на ликвидацию процесса, который вызвал поражение надпочечников, и на замещение дефицита гормонов и электролитов.
Все перечисленные препараты всегда нужно принимать строго в определённое время. Пропуск приёма лекарств может быть очень опасен. Если по какой-то причине приём был пропущен, обязательно нужно принять ту же дозу препарата позже или увеличить дозу вдвое.
Если пациенту с недостаточностью предстоит операция, то нужно обязательно обсудить с лечащим врачом изменение дозы: она будет зависеть от сложности вмешательства.
Прогноз. Профилактика
При своевременной диагностике заболевания и адекватном лечении прогноз для жизни благоприятный.
Пациент с этой болезнью может делать всё: учиться, работать, заниматься спортом, иметь семью, как и все здоровые люди. Для этого нужно соблюдать простые правила:
1. Важно всегда иметь при себе информационную карточку. В ней должно быть указано следующее: «У меня надпочечниковая недостаточность. Если я без сознания или у меня судороги, рвота, бред, мне нужно СРОЧНО сделать инъекцию гидрокортизона 100 мг внутримышечно или внутривенно. Промедление опасно для жизни». Также в карточке нужно указать телефон, по которому можно связать с родственниками или лечащим врачом. Эта информация крайне важна для людей или врачей, которые будут помогать в экстренной ситуации.
Визуализация надпочечников: в норме и при патологии (обзор литературы)
Полный текст:
Аннотация
В представленном обзоре рассмотрены нормальная анатомия надпочечников и особенности современных методов их визуализации, которые необходимы для оценки как доброкачественных, так и злокачественных новообразований. В частности, рассмотрены одни из наиболее распространенных образований, такие как аденома, феохромоцитома, метастатическое поражение и адренокортикальный рак. Для этого был проведен анализ релевантных отечественных и зарубежных источников литературы, датируемых сроками с 1991 г. по январь 2021 г.
Во многих случаях образования надпочечников имеют отличительные особенности, которые позволяют охарактеризовать их с помощью неинвазивных методов. В некоторых случаях возможно заподозрить злокачественную природу и вовремя направить пациента на необходимые инвазивные исследования. Компьютерная томография, особенно с применением внутривенного контрастного усиления, представляет собой основной метод визуализации, поскольку в большинстве случаев позволяет предположить нозологическую форму образования. Магнитно-резонансная томография остается высокочувствительным методом с точки зрения выявления опухоли, динамического наблюдения за размерами, однако метод малоспецифичен для определения злокачественного потенциала образования. Позитронно-эмиссионная компьютерная томография также является дополнительным методом и используется в основном в обнаружении злокачественных опухолей, их дифференциальной диагностике, выявлении метастазов и рецидивов после хирургического лечения. Ультразвуковое исследование играет ограниченную роль, тем не менее, имеет большое значение в диагностике у детей, особенно новорожденных. Такие перспективные методы, как радиомика и двухэнергетическая КТ, позволяют расширить возможности визуализации и улучшить диагностическую точность.
Поскольку образования надпочечников часто случайно выявляются при визуализации, выполняемой по другим причинам, важно правильно их интерпретировать. Этот обзор дает читателю широкое представление того, чем различные методы визуализации могут быть полезны при оценке патологии надпочечников и на что следует обращать внимание рентгенологам и врачам-клиницистам.
Ключевые слова
Для цитирования:
Корб Т.А., Чернина В.Ю., Блохин И.А., Алешина О.О., Воронцов А.В., Морозов С.П., Гомболевский В.А. Визуализация надпочечников: в норме и при патологии (обзор литературы). Проблемы Эндокринологии. 2021;67(3):26-36. https://doi.org/10.14341/probl12752
For citation:
Korb T.A., Chernina V.Yu., Blokhin I.A., Aleshina O.O., Vorontsov A.V., Morozov S.P., Gombolevskiy V.A. Adrenal imaging: anatomy and pathology (literature review). Problems of Endocrinology. 2021;67(3):26-36. (In Russ.) https://doi.org/10.14341/probl12752
ВВЕДЕНИЕ
Случайно выявленные образования надпочечников более 1 см в диаметре принято называть «инциденталомами» (от англ. «случай», «побочное обстоятельство»). Широкое использование визуализации, включая ультразвуковое исследование (УЗИ), компьютерную томографию (КТ), позитронно-эмиссионную томографию, совмещенную с компьютерной томографией (ПЭТ-КТ), и магнитно-резонансную томографию (МРТ), резко увеличило частоту выявления образований надпочечников. Если у пациента в анамнезе нет злокачественных новообразований и эндокринных нарушений, такие образования в большинстве случаев являются доброкачественными и нефункционирующими аденомами [1]. Тем не менее дифференциальная диагностика доброкачественной и злокачественной природы поражения надпочечников может быть сложной задачей, имеющей решающее значение, особенно для онкологических пациентов.
Частота выявления инциденталом надпочечников, диагностируемых при КТ, составляет до 7% [1–3]. Это может быть связано с высокой распространенностью применения метода, а также возможностью визуализировать надпочечники при исследовании грудной и брюшной полостей. Согласно результатам вскрытий, образования надпочечников являются также одними из наиболее распространенных опухолей, выявляемых не менее чем у 3% людей старше 50 лет [4]. Методы визуализации позволяют не только выявить образования, но и охарактеризовать их морфологическую структуру, при необходимости вовремя направить на инвазивные исследования. Рентгенологи должны помнить о преимуществах и недостатках каждого метода визуализации, избегать неправильной интерпретации, особенно при дифференциальной диагностике доброкачественных и злокачественных образований.
Целью данной работы была оценка особенностей методов визуализации новообразований надпочечников, необходимых для точной характеристики наиболее частых их поражений.
Был проведен анализ релевантных отечественных и зарубежных источников литературы по базам данных eLIBRARY, PubMed, Web of Science с использованием ключевых слов: «надпочечники», «образования надпочечников», «инциденталомы надпочечников», «визуализация надпочечников», «УЗИ», «КТ», «МРТ», «ПЭТ-КТ», «adrenal gland», «adrenal mass», «adrenal incidentaloma», «adrenal imaging», «ultrasonic diagnostics», «CT», «MRI», «PET-FDG». Были проанализированы 80 научных работ за период с 1991 г. по январь 2021 г. В итоговый обзор были включены 57 англоязычных статей, 5 русскоязычных статей. При обнаружении нескольких статей с общей темой и похожими результатами в обзор включалось наиболее позднее исследование.
В данном обзоре рассмотрены нормальная лучевая анатомия надпочечников, особенности методов их визуализации, а также дифференциальная диагностика наиболее частых образований надпочечников (аденома, феохромоцитома, вторичное поражение, адренокортикальный рак).
НОРМАЛЬНАЯ АНАТОМИЯ НАДПОЧЕЧНИКОВ
Надпочечники располагаются в забрюшинном пространстве в толще околопочечной жировой клетчатки, над верхним полюсом соответствующей почки. Надпочечники состоят из двух морфофункционально самостоятельных эндокринных желез — мозгового и коркового веществ, имеющих различное эмбриональное происхождение.
В период внутриутробного развития плода надпочечники быстро развиваются в течение первых 3 мес. С 12 до 18 нед развития вес надпочечников увеличивается в 7 раз [5]. При рождении размеры их значительно больше, чем у взрослых (примерно от половины до трети размера почек), а вес составляет в среднем 10 г. К 20 годам масса каждого надпочечника увеличивается в 1,5 раза по отношению к массе надпочечника новорожденного и достигает своих максимальных размеров.
По данным УЗИ нормальные надпочечники обычно хорошо видны у новорожденных детей. Это связано не только с большими размерами надпочечников по сравнению с почками, но и с малым количеством забрюшинной жировой ткани и небольшим расстоянием от датчика [6]. При сканировании в В-режиме надпочечники визуализируются с четкими, ровными контурами, треугольной и полулунной формы, с дифференцировкой на однородный гиперэхогенный мозговой и однородный гипоэхогенный корковый слои [7]. У подростков и взрослых обследование надпочечников проводится в нескольких положениях пациента и датчика для оптимальной визуализации. Однако оценка может быть затруднена или невозможна в случае жировой дистрофии печени (нормальная печень является хорошим акустическим окном при оценке правой надпочечниковой области), большого количества газа в кишечнике и желудке (левая надпочечниковая область) и ожирения (плохая проходимость ультразвуковой волны) [6].
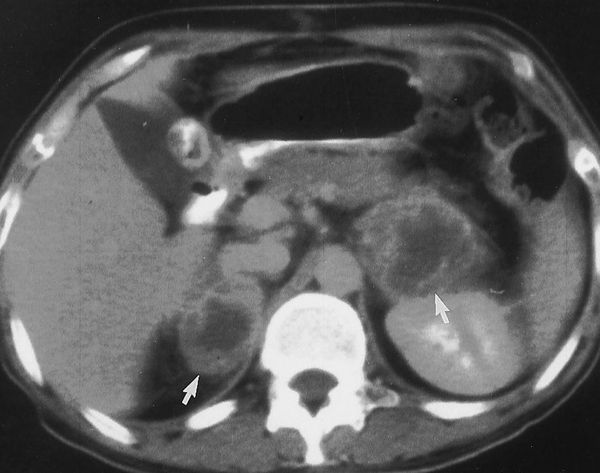
На аксиальных срезах КТ и МРТ каждый надпочечник представляет собой структуру вариабельной формы (линейной, треугольной, Y- или V- образной), длиной до 4,5 см, высотой в среднем до 2 см и толщиной около 1 см [8] (рис. 1). С помощью данных методов надпочечники могут быть визуализированы даже у детей первых лет жизни, так как толщина ножек надпочечников превышает толщину ножек диафрагмы.
Рисунок 1. Нормальные надпочечники на КТ-изображениях с внутривенным контрастным усилением в аксиальной (A) и корональной (B) проекциях.
ВИЗУАЛИЗАЦИЯ НАДПОЧЕЧНИКОВ
Ультразвуковое исследование
УЗИ — это метод выбора при оценке состояния надпочечников у новорожденных и детей младшего возраста. Из-за доступности, относительно низкой стоимости и неинвазивности этот метод также часто используется для оценки надпочечников у подростков и взрослых. Кроме того, УЗИ рекомендуется пациентам с артериальной гипертензией или недостаточностью надпочечников, а также при мониторинге опухолей надпочечников, имеющих доброкачественную природу по данным КТ или МРТ. УЗИ с применением B-режима и эластографии позволяет отличить солидную опухоль от кист надпочечников, в отличие от КТ, при которой дифференцировать эти образования возможно только с применением контрастного усиления [6].
Данный метод имеет ряд ограничений. Визуализация надпочечников зависит от таких факторов, как ширина акустического окна, качество оборудования и опыт врача. Сложность визуализации может быть связана с тем, что при оценке данной области отмечается высокий уровень естественного эхосигнала, почти равного уровню окружающей жировой клетчатки [6].
УЗИ с контрастным усилением улучшает визуализацию сосудистого снабжения даже при небольших опухолях надпочечников, но не позволяет дифференцировать злокачественные и доброкачественные новообразования надпочечников [9]. Оценка характера контрастирования в группе доброкачественных поражений надпочечников показала наличие различий между узловой гиперплазией и аденомами. При узловой гиперплазии контрастирование начинается на периферии образования, а при аденомах преобладает смешанный или центральный характер [10].
При обследовании взрослых пороговый средний диаметр поражения надпочечников, доступный для визуализации, составляет 10 мм. Однако в литературе отмечается, что очаговые поражения диаметром 5 мм можно визуализировать через брюшной доступ, а поражения диаметром 2–3 мм — через эндоскопический [11]. Тем не менее некоторые опухоли с максимальным диаметром менее 20 мм в левом надпочечнике могут плохо визуализироваться при трансабдоминальном УЗИ. Это зависит от их локализации в надпочечнике, а также от анатомических и физиологических условий.
Компьютерная томография
КТ является одним из ведущих методов диагностики новообразований надпочечников. КТ является наиболее частым методом при выявлении инциденталом надпочечников, что может быть связано с включением надпочечников в зону сканирования не только при исследовании органов брюшной полости, но и при исследовании грудной клетки. Применение данного метода позволяет не только диагностировать образования надпочечников, но и в большинстве случаев предположить морфологическую природу.
Согласно обновленной версии рекомендаций Американского радиологического общества (ACR, American College of Radiology) от 2017 г. по алгоритму ведения пациентов с инциденталомами надпочечников, о злокачественном потенциале новообразования необходимо судить по размеру поражения, характеру роста при динамическом наблюдении и онкологическому анамнезу (рис. 2) [12]. Так, если инциденталома имеет диагностические признаки доброкачественных новообразований, таких как миелолипома (наличие макроскопического жира), кисты или кровоизлияния (отсутствие накопления контрастного препарата, разница в плотности пре- и постконтрастных изображений до 10 единиц Хаунсфилда (Hounsfield units, HU)), то дообследование или динамическое наблюдение не требуется. При этом было установлено, что даже инциденталомы надпочечников с плотностью больше +10 HU у пациентов без отягощенного онкологического анамнеза в большинстве случаев являются доброкачественными [13].
Рисунок 2. Алгоритм ведения пациентов с инциденталомами надпочечников.
АВ — абсолютное вымывание; ОВ — относительное вымывание; КВ — контрастное вещество.
(Источник: Чернина В.Ю., Блохин И.А., Николаев А.Е. и др. Тактика ведения инциденталом. Раздел 2. Поджелудочная железа, надпочечники, почки / Серия «Лучшие практики лучевой и инструментальной диагностики». — Вып. 36. — М., 2019. — 40 с.)
Образование больше 4 см, не имеющее доброкачественных признаков, необходимо соотнести с онкологическим анамнезом и рассмотреть вопрос о резекции и проведении ПЭТ-КТ с 18F-фтордезоксиглюкозой (18F-ФДГ). В случае если при нативной КТ образование надпочечников по плотности больше +10 HU, целесообразны сканирование с внутривенным болюсным контрастным усилением и использование специального протокола. Рекомендуется протокол с уменьшенной дозой облучения для дальнейшей характеристики образования надпочечников, поскольку он оценивает как плотность, так и характеристики контрастирования в одном исследовании.
Вне зависимости от содержания внутриклеточного жира для доброкачественных аденом характерно быстрое накопление контрастного вещества и быстрое его вымывание. Злокачественные образования могут также быстро накапливать контрастное вещество, но значительно медленнее его вымывают. Поэтому в протоколе важно учитывать получение портально-венозной фазы на 60–90 с и поздней отсроченной фазы на 15-й минуте от момента внутривенного введения контрастного препарата инжектором. В исследовании Sangwaiya M.J. и соавт. было доказано, что отсроченная фаза даже на 10-й минуте показывает низкую чувствительность (76,8%) для характеристики аденом [14]. Соответственно, и применение отсроченной фазы до 5 мин в стандартном протоколе для брюшной полости является недостаточным временем вымывания внутривенного контрастного вещества из доброкачественных образований.
Расчет абсолютного процента вымывания контрастного вещества проводится по формуле:
значение HU в венозную фазу – значение HU в позднюю отсроченную фазу ×100% / значение HU в венозную фазу – значение HU в нативную фазу.
Расчет относительного процента вымывания контрастного вещества проводится по формуле:
значение HU в венозную фазу – значение HU в позднюю отсроченную фазу ×100% / значение HU в венозную фазу.
Расчет показателей абсолютного и относительного процента вымывания контрастного вещества при исследовании надпочечников имеет высокую диагностическую ценность при дифференциальной диагностике аденом от злокачественных образований. Для расчетов в повседневной практике может быть применен специализированный онлайн-калькулятор, разработанный Department of Radiology USC (University of Southern California), доступный по ссылке https://pcheng.org/calc/adrenal_ct.html
Двухэнергетическая КТ (ДЭКТ) является перспективным методом диагностики, который может расширить возможности оценки образований надпочечников и потенциально снизить потребность в дополнительных исследованиях. Метод заключается в переключении напряжения на рентгеновской трубке с последующей дополнительной постобработкой данных. В недавней работе Nagayama Y. и соавт. данный метод позволил точно дифференцировать аденомы надпочечников и метастазы [15].
Следует отметить, что в текущих рекомендациях ACR не учитывался тот факт, что значения HU могут существенно различаться между томографами, а разница может превышать указанные +10 HU [16]. Эти различия зависят от многих факторов, в частности, от производителя и стажа работы аппарата, напряжения рентгеновской трубки, калибровки и толщины срезов при сканировании. Так, результаты исследования Stadler A. и соавт. продемонстрировали, что могут быть существенные расхождения в значениях HU (до 12 HU) при оценке плотности образований надпочечников в зависимости от типа томографа и настроек протокола [17]. Несмотря на то что измерение плотности образований на КТ позволяет в большинстве случаев дифференцировать образования, использование порогового значения HU не может считаться универсальным и влиять на выбор тактики ведения пациентов.
В крупном скрининговом исследовании рака легкого NLST (National Lung Screening Trial) было показано, что из 17 309 пациентов у 419 (2,4%) человек была выявлена патология надпочечников, при этом в 1,2% находка была клинически значимой [18]. В аналогичной программе скрининга рака легких в Италии общая распространенность образований надпочечников была достаточно высокой и составила 4,4% [2]. В условиях большого потока скрининговых исследований рентгенологи могут пропустить инциденталомы надпочечников. Поэтому решением этого вопроса может быть применение алгоритма машинного обучения для помощи рентгенологу в выявлении случайных образований надпочечников.
В течение 2020 г. весь мир был вовлечен в пандемию, вызванную коронавирусной инфекцией (COVID-19). Данное заболевание в первую очередь поражает легкие, в некоторых случаях приводит к дыхательной недостаточности. Однако возможно вовлечение и других органов, включая надпочечники. У пациентов, умерших от тяжелой формы COVID-19, в надпочечниках были выявлены такие изменения, как некроз, жировая дегенерация, кровоизлияние и тромбозы [19]. Это, в свою очередь, влияет на плотность надпочечников и тем самым может затруднять диагностику.
Позитронно-эмиссионная компьютерная томография
ПЭТ-КТ — это комбинированный метод, который помогает дифференцировать доброкачественные образования надпочечников от злокачественных и необходим для выявления рецидива или метастазов у онкологических больных [20]. Результаты метаанализа показывают, что большинство образований надпочечников можно охарактеризовать с помощью ПЭТ-КТ с 18F-ФДГ с высокой чувствительностью (0,97), специфичностью (0,91) и точностью (0,98) [21]. Данный метод позволяет определить точную анатомическую локализацию областей повышенной метаболической активности и произвести их измерения.
Согласно обновленной версии рекомендаций ACR от 2017 г., онкологических больных при наличии образования надпочечника более 4 см или увеличении размеров ранее выявленного образования следует направить на ПЭТ-КТ, так как высока вероятность метастатического поражения [12].
Магнитно-резонансная томография
По данным МРТ нормальные надпочечники в режимах Т1 и Т2 имеют сигнал от низкого до среднего по отношению к сигналу печени и скелетных мышц. В режимах с подавлением сигнала от жира визуализация нормальных надпочечников наилучшая, так как их сигнал гиперинтенсивнее, чем от подавленной жировой ткани. Также это может быть полезно, если образование содержит жировые включения или кровоизлияние. Точность МРТ может быть повышена, если использовать гадолиниевые контрастные препараты. После введения контрастного вещества 90% аденом демонстрируют гомогенное усиление, в то время как 60% злокачественных образований — гетерогенное [22]. Для аденом характерно контрастное усиление в ранний период, однако интенсивность сигнала даже после контрастного усиления в большинстве случаев одинакова как для аденом, так и злокачественных образований, что не является абсолютным диагностическим критерием [22].
Диффузионно-взвешенная визуализация (diffusion-weighted imaging, DWI) — важный дополнительный инструмент при оценке патологических состояний в брюшной полости. Однако с помощью DWI и измеряемого коэффициента диффузии (ИКД) невозможно отличить доброкачественные поражения надпочечников от злокачественных, а также выявить атипичные аденомы [23].
МРТ с химическим сдвигом остается важным инструментом для дополнительной оценки образований надпочечников, выявленных с помощью других методов визуализации, особенно для пациентов с аллергией на йодсодержащий препарат, а также у детей и беременных женщин. Метод заключается в оценке относительной потери сигнала от надпочечника в противофазу по сравнению с фазой, что является достаточным для того, чтобы предположить природу образования. На сегодняшний день используются два способа количественной оценки снижения интенсивности сигнала [22]. Суть первого способа количественной оценки сводится к расчету соотношения сигнала от надпочечника к сигналу другого органа, чаще всего к сигналу селезенки. Данное сплено-адреналовое соотношение (ASR, spleno-adrenal ratio) отражает процент снижения сигнала от образования надпочечника по сравнению с селезенкой и может быть рассчитано по следующей формуле:
(индекс сигнала образования надпочечника в противофазу / индекс сигнала селезенки в противофазу)/
(индекс сигнала образования надпочечника в фазу / индекс сигнала селезенки в фазу) × 100%.
Второй способ количественной оценки снижения интенсивности сигнала заключается в подсчете индекса интенсивности сигнала (SII, signal intensity index), который рассчитывается по формуле:
(индекс сигнала образования надпочечника в фазу – индекс сигнала образования надпочечника в противофазу) / индекс сигнала образования надпочечника в фазу × 100%.
Для расчетов в повседневной практике может быть применен специализированный онлайн-калькулятор, разработанный Department of Radiology USC (University of Southern California), доступный по ссылке https://pcheng.org/calc/adrenal_mri.html
Sebro R. и соавт. провели исследование, доказывающее, что МРТ более чувствительна (в 33% случаев) для обнаружения аденом с низкой плотностью (менее 20–30 HU), чем КТ без контрастного усиления [24]. Но в то же время было показано, что КТ с контрастным усилением превосходит МРТ (100% против 77,5%) [25].
С помощью МРТ возможно отличить доброкачественные новообразования надпочечников, которые содержат внутриклеточный жир (аденома), макроскопический жир (миелолипома) или жидкостной компонент (кисты, псевдокисты). Также метод позволяет провести дифференциальную диагностику между аденомами и метастазами, заподозрить карциному [26].
Радиомика
Радиомика — относительно новая область науки, направленная на получение «невидимых» количественных характеристик медицинской визуализации, основанных на интенсивности, форме, объеме и текстуре. Одним из методов в этой области является текстурный анализ — инструмент для оценки неоднородностей тканей, невидимых человеческому глазу.
Текстурный анализ по данным КТ представляет собой неинвазивный инструмент для характеристики образований надпочечников. Результаты исследования Yu H. и соавт. показали, что некоторые параметры текстуры являются важным критерием в дифференциальной диагностике доброкачественных и злокачественных образований. В частности, такие параметры, как энтропия и стандартное отклонение, имели наиболее высокие показатели чувствительности (до 73–95%) и специфичности (до 86–100%) [27]. Работа Zhang G.M. и соавт. продемонстрировала, что особые параметры текстуры позволяют дифференцировать аденому от феохромоцитомы с точностью до 81% [28]. Эти же авторы в другом своем исследовании сообщили о точности до 77% при отличии метастазов от доброкачественных образований надпочечников [29].
Кроме того, были проведены исследования, где оценивалась точность текстурного анализа по данным МРТ и ПЭТ-КТ для оценки образований надпочечников. Так, комбинированное использование параметра SUVmax и параметров текстурного анализа по данным ПЭТ-КТ может значительно повысить диагностические характеристики для выявления метастазов: чувствительность, специфичность и точность составили 100, 84,6 и 94,3% соответственно [30].
Результаты исследования Schieda N. и соавт. продемонстрировали, что использование текстурного анализа и химического сдвига по данным МРТ также достигает высокой диагностической точности, чем эти методы по отдельности [31]. Чувствительность и специфичность в диагностике метастазов надпочечников при светлоклеточном раке почки от аденом надпочечников составили 93,3% и 86,21% соответственно.
В свою очередь, были опубликованы данные, где сравнивалась эффективность текстурного анализа и данных рентгенологов при оценке образований надпочечников больших размеров (4–10 см) по данным КТ [32]. При этом показатель точности текстурного анализа оказался выше точности показателей рентгенологов (82% против 68,5%).
Возможность получения дополнительных данных при стандартных методах визуализации позволит улучшить диагностическую точность и тактику ведения пациентов с образованиями надпочечников.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ОБРАЗОВАНИЙ
Аденома надпочечников
Аденома — самая распространенная опухоль надпочечников, частота выявляемости которой составляет 75% среди всех инциденталом [1]. Это доброкачественная опухоль без потенциала злокачественной трансформации, возникающая из коркового слоя надпочечников и состоящая из клеток с внутрицитоплазматическим жиром. Наличие жировых включений является ключевым элементом в дифференциальной диагностике злокачественных новообразований. Большие аденомы могут иметь кистозные компоненты, кальцинаты и геморрагические участки [33].
Типичная аденома имеет размер менее 3 см, что затрудняет ее обнаружение с помощью УЗИ, при котором она выглядит как однородное и гипоэхогенное солидное образование с четкими контурами, гиповаскулярное при цветном допплеровском исследовании и гиповаскулярное при УЗИ с контрастированием [34][35]. Хотя размер не является окончательным показателем доброкачественности, в нескольких исследованиях сообщалось, что средний диаметр аденомы составляет 2–2,5 см, максимально до 3 см. Другие исследования включали более крупные диаметры аденомы (до 4–6 см) [36][37].
При нативной КТ аденома обычно представляет собой четко очерченное округлое или овальное образование, плотность которого равна или немного ниже плотности нормальной ткани надпочечников (до +10 HU, из-за высокого содержания жира) [25].
Для аденомы с низким содержанием липидов требуется проведение КТ с контрастным усилением, где оцениваются такие характеристики, как абсолютное и относительное вымывание контрастного препарата. Если абсолютное вымывание больше 60% или относительное вымывание больше 40% через 15 мин после введения контрастного вещества, то это указывает на аденому. Чувствительность и специфичность этих показателей для дифференциальной диагностики аденомы составляют 88 и 96% для абсолютного вымывания и 83 и 93% для относительного вымывания соответственно [38].
Накопление ФДГ при ПЭТ-КТ является важным критерием при дифференциальной диагностике злокачественных и доброкачественных образований. Однако при аденоме надпочечников может отмечаться повышенное накопление ФДГ, вероятно, обусловленное гормональной активностью этой доброкачественной опухоли [39].
По данным МРТ (независимо от выбранного режима визуализации) аденомы надпочечников имеют четкие, ровные контуры, как правило, однородной структуры, с промежуточной или низкой интенсивностью сигнала по сравнению со скелетными мышцами или печенью; в аденомах больших размеров могут происходить кровоизлияния, что приводит к появлению гиперинтенсивных участков на T1-взвешенном изображении [40].
Важным компонентом МР-протокола надпочечников является химический сдвиг. При использовании этого метода большинство аденом надпочечников демонстрируют потерю интенсивности сигнала на изображениях: снижение интенсивности сигнала более чем на 20% считается диагностическим признаком аденомы [33].
Чувствительность МРТ для аденом плотностью 10–20 HU составляет почти 100%, в то время как для аденом с низким содержанием жира и плотностью больше 30 HU — значительно ниже (13–75%) [41].
Оценка вымывания контрастного вещества при МРТ не демонстрирует такую же диагностическую точность, как при КТ [33]. Таким образом, КТ остается золотым стандартом, особенно при оценке аденом с низким содержанием липидов.
Феохромоцитома
Феохромоцитома происходит из мозгового вещества надпочечников и проявляется избыточной выработкой катехоламинов и связанными с ней клиническими симптомами (головная боль, повышенное потоотделение, учащенное сердцебиение), при этом примерно 10% феохромоцитом протекают бессимптомно [42]. Чаще феохромоцитома является доброкачественной, хотя 10% этих поражений могут быть злокачественными [43]. Злокачественные образования распознаются по локальной инфильтрации или метастазам, обычно поражающим кости, печень, лимфатические узлы, легкие и головной мозг. Размеры феохромоцитом варьируют от 1,2 до 15 см, средний размер — 5,5 см [44].
При подозрении на феохромоцитому первым этапом диагностики является лабораторное обследование. Диагностика феохромоцитомы при визуализации часто является сложной задачей из-за ее разнообразного внешнего вида (связанного с некрозом, фиброзом, кистозной, жировой дегенерацией и кальцификацией), который может имитировать другие заболевания [45].
По данным УЗИ феохромоцитомы неоднородны, инкапсулированы, с гиперваскуляризацией при цветном допплеровском исследовании и ранним артериальным паттерном при УЗИ с контрастным усилением [46].
По данным КТ феохромоцитомы больших размеров могут иметь солидные, кистозные, кальцинированные и/или некротические компоненты. Более мелкие опухоли (менее 7 см) чаще однородной структуры [44]. По данным КТ с контрастным усилением абсолютное и относительное вымывания контрастного вещества аналогичны аденомам. Следовательно, феохромоцитомы невозможно надежно отличить от аденом с помощью данного метода [45][47].
Методом выбора при локализации феохромоцитом является сцинтиграфия c метайодбензилгуанидином (MIBG) [20]. В обзоре литературы Asha Kandathil и соавт. подтверждались высокие чувствительность и специфичность данного метода (94–95%) [48]. Однако авторы представили и противоречивые данные. Так, были продемонстрированы примеры со схожей чувствительностью ПЭТ/КТ и MIBG-сцинтиграфии (76,8% против 75%), а также отдельные случаи большей точности ПЭТ/КТ. В случаях, когда результаты лабораторных исследований не могут поставить точный диагноз, а МРТ противопоказана, метод ПЭТ-КТ может помочь в установке диагноза до гистологической верификации.
По данным МРТ может отмечаться бугристый, полициклический контур опухоли при первично-множественном поражении надпочечника, часто выявляется неоднородность внутренней структуры [40]. В режиме Т2 примерно в 35% случаев феохромоцитомы могут иметь однородный изоинтенсивный или минимально гиперинтенсивный сигнал по отношению к селезенке и в редких случаях (11%) — изоинтенсивный по отношению к спинномозговой жидкости [44]. В режиме Т1 феохромоцитомы обычно изоинтенсивны относительно мышц и гипоинтенсивны относительно печени. На изображениях с противофазой потери интенсивности сигнала не отмечается (в отличие от типичной аденомы) [33]. Однако в некоторых случаях феохромоцитомы могут содержать микроскопический жир, что приводит к потере сигнала на МРТ с химическим сдвигом, имитируя аденомы [43].
Метастазы надпочечников
Многие злокачественные опухоли часто метастазируют в надпочечники, что связано с их богатым кровоснабжением. Наиболее часто в надпочечники метастазирует рак легких, за которым следуют рак молочной железы, толстой кишки, меланома, рак почки и гепатоцеллюлярная карцинома. Метастазы встречаются как односторонние, так и двусторонние, приблизительно в равном соотношении (49 и 51%) [49]. Метастазы клинически не проявляются, но в некоторых случаях (3–8%) обширное двустороннее поражение может вызвать надпочечниковую недостаточность [50]. Метастазы надпочечников не имеют специфических признаков при визуализации по данным КТ без контрастного усиления или МРТ.
По данным КТ метастазы в надпочечниках выглядят как очаговые образования плотностью больше +10 HU, возможны кальциноз и участки кровоизлияния. После введения контрастного вещества наблюдаются неравномерное периферическое накопление и медленное вымывание, что позволяет их дифференцировать от аденом [51].
Недавний метаанализ Wu и соавт. показал важную роль ПЭТ-КТ в дифференциальной диагностике метастазов надпочечников от доброкачественных образований. У пациентов с диагнозом рака легких были продемонстрированы высокие диагностические показатели чувствительности (88,7%) и специфичности (90,8%) [52]. Ретроспективное исследование, проведенное Kim J.Y. и соавт., показало, что такие параметры образований при ПЭТ-КТ, как плотность больше +10 HU и SUV (standardized uptake value, стандартизированный уровень накопления) больше 2,5, более вероятно соответствуют метастазам надпочечников [53]. При этом такие дополнительные данные пациента, как первичный рак в анамнезе, метастазы в другие органы и возраст, значительно влияли на точность диагностики. В исследовании Danae A. Delivanis и соавт. также была доказана высокая специфичность (84%) ПЭТ-КТ и предложено рассматривать этот метод как второй этап визуализации [54].
По данным МРТ особенности визуализации зависят от типа первичной опухоли, но в основном наблюдается низкий сигнал в режиме Т1 и высокий сигнал в режиме Т2; иногда он может быть изоинтенсивным на Т1- и Т2-режимах с кольцевым или неравномерным усилением сигнала после введения контрастного препарата [55]. Химический сдвиг позволяет дифференцировать аденомы надпочечников от метастазов. Однако возможны и ложноположительные результаты при наличии в метастазах внутриклеточного жирового компонента. Так, например, метастазы некоторых первичных опухолей, таких как светлоклеточный почечный рак и гепатоцеллюлярная карцинома, содержат липидные включения [56–58]. Использование DWI также не имеет диагностической ценности для дифференциации аденом от метастазов [59].
Адренокортикальный рак
Согласно рекомендациям Европейского общества эндокринологов (European Society for Endocrinology, ESE) совместно с Европейской организацией по изучению опухолей надпочечников (European Network for the Study of Adrenal Tumours, ENSAT), а также Европейского общества медицинской онкологии (European Society for Medical Oncology, ESMO), пациенты с подозрением на адренокортикальный рак (АКР) должны пройти полное биохимическое обследование надпочечников, а также диагностические методы визуализации [60][61]. Стандартная визуализация для пациентов с подозрением на АКР включает КТ или МРТ брюшной полости, при необходимости КТ грудной клетки или ПЭТ-КТ с 18F-ФДГ. Точное стадирование АКР является решающим шагом в планировании лечения и определении прогноза.
АКР может быть гормонально-активным и проявляться в виде синдрома Кушинга или случайно выявленной гормонально-неактивной опухолью надпочечника. При больших размерах образование может вызывать синдром компрессии и определяться при пальпации.
Внешний вид опухоли зависит от ее размера и на ранних стадиях бывает трудно отличим от аденом. Ввиду быстрого роста АКР характеризуется поздним сроком выявления. Чаще всего выявляется образование больших размеров (в среднем около 10 см), с неровностью контуров, участками некроза и, в некоторых случаях, микрокальцинатами [26][38]. Распространенным осложнением является инвазия в смежные органы, чаще в нижнюю полую вену, в том числе возможно образование внутрисосудистого опухолевого тромба. Следует не забывать о возможности метастатического поражения регионарных лимфатических узлов, а также отдаленных метастазов в печень, легкие и кости.
По данным УЗИ небольшие образования чаще однородны и гипоэхогенны, однако с увеличением размеров увеличивается неоднородность структуры [34]. Нечеткие неровные края образования указывают на агрессивный характер роста. Однако отсутствие этого признака не является критерием доброкачественности [40]. Часто можно выявить паравазальные образования аналогичной опухолевой структуры. При цветном допплеровском исследовании отмечается гиперваскулярность.
При КТ с контрастным усилением выявляется неоднородное накопление контрастного вещества, часто периферическое, в некоторых случаях наблюдается тонкая капсула. Абсолютное и относительное вымывание контрастного препарата при АКР отличается от аденом (менее 60 и 40% соответственно). Однако по данным КТ высокая нативная плотность и неоднородность структуры являются более надежными признаками, чем показатели вымывания, которые варьируют в зависимости от того, какая часть образования был взята для оценки [38].
ПЭТ с 18F-ФДГ необходима для верификации злокачественного потенциала, особенно при опухолях размером более 4 см. Тем не менее, несмотря на способность этого метода дифференцировать доброкачественные и злокачественные образования надпочечников, сохраняется сложность дифференциальной диагностики последних между собой. Радиофармпрепарат 11C-метомидат обладает свойством накапливаться только в тканях коры надпочечников, что позволяет дифференцировать АКР от феохромоцитомы и метастазов [62].
На МРТ-изображениях АКР характеризуется неоднородным сигналом. Участки кровоизлияния могут приводить к появлению гиперинтенсивного сигнала на Т1-взвешенных изображениях, а участки некроза имеют высокую интенсивность сигнала на T2-взвешенных изображениях [26]. На МРТ с химическим сдвигом, как правило, потери сигнала от АКР в противофазу по сравнению с фазой не происходит, однако в редких случаях это не исключено за счет наличия микроскопического жира [41]. МРТ обладает более высокой тканевой контрастностью для определения состояния мягких тканей, чем КТ, что дает ей дополнительное преимущество в оценке границ инвазии опухоли и опухолевого тромба.
Согласно рекомендациям ESE-ENSAT и ESMO, в случае высокой вероятности выявления АКР по данным КТ или МРТ брюшной полости рекомендуется обязательное выполнение КТ органов грудной клетки [60][61]. Дополнительное обследование костей и головного мозга необходимо при клинических признаках отдаленных метастазов. Выполнение пункционной биопсии опухоли надпочечника может быть рекомендовано только при обоснованном подозрении на его метастатическое (вторичное) поражение или в случае неоперабельного метастатического опухолевого процесса перед началом лекарственной противоопухолевой терапии.
ЗАКЛЮЧЕНИЕ
Визуализация (УЗИ, КТ, ПЭТ-КТ, МРТ) играет ключевую роль в дифференциальной диагностике случайно выявленных образований надпочечников, при целенаправленной предоперационной подготовке пациентов и выборе хирургической тактики. Такие перспективные методы, как радиомика и ДЭКТ, позволяют расширить возможности визуализации и улучшить диагностическую точность. В свою очередь, применение алгоритма машинного обучения поможет снизить у рентгенологов частоту пропусков инциденталом надпочечников, особенно в условиях большого потока скрининговых исследований.
Список литературы
1. Song JH, Chaudhry FS, Mayo-Smith WW. The incidental adrenal mass on CT: prevalence of adrenal disease in 1,049 consecutive adrenal masses in patients with no known malignancy. AJR Am J Roentgenol. 2008;190(5):1163-1168. doi: https://doi.org/10.2214/AJR.07.2799
2. Bovio S, Cataldi A, Reimondo G, et al. Prevalence of adrenal incidentaloma in a contemporary computerized tomography series. J Endocrinol Invest. 2006;29(4):298-302. doi: https://doi.org/10.1007/BF03344099
3. Young WF Jr. Clinical practice. The incidentally discovered adrenal mass. N Engl J Med. 2007;356(6):601-610. doi: https://doi.org/10.1056/NEJMcp065470
4. Grumbach MM, Biller BM, Braunstein GD, et al. Management of the clinically inapparent adrenal mass («incidentaloma»). Ann Intern Med. 2003;138(5):424-429. doi: https://doi.org/10.7326/0003-4819-138-5-200303040-00013
5. Folligan K, Bouvier R, Targe F, et al. Le développement de la surrénale humaine [Development of the human adrenal glands]. Ann Endocrinol (Paris). 2005;66(4):325-332. doi: https://doi.org/10.1016/s0003-4266(05)81789-5
6. Słapa RZ, Jakubowski WS, Dobruch-Sobczak K, et al. Standards of ultrasound imaging of the adrenal glands. J Ultrason. 2015;15(63):377-387. doi: https://doi.org/10.15557/JoU.2015.0035
7. Пыков М.И., Макушева В.Г., Ефимов М.С., и др. Ультразвуковая оценка надпочечников у новорожденных детей // Ультразвуковая и функциональная диагностика. — 2010. — №5. — С. 44-53.
8. Лященко Д.Н., Лященко С.Н. Прижизненная анатомия и топография надпочечников // Вестник Оренбургского государственного университета. — 2011. — Т. 16. — №135. — С. 305-307.
9. Dietrich CF, Ignee A, Barreiros AP, et al. Contrast-enhanced ultrasound for imaging of adrenal masses. Ultraschall Med. 2010;31(2):163-168. doi: https://doi.org/10.1055/s-0028-1109357
10. Slapa RZ, Kasperlik-Zaluska AA, Migda B, et al. Application of parametric ultrasound contrast agent perfusion studies for differentiation of hyperplastic adrenal nodules from adenomas-Initial study. Eur J Radiol. 2015;84(8):1432-1435. doi: https://doi.org/10.1016/j.ejrad.2015.05.006
11. Jenssen C, Dietrich CF. Sonografie und Endosonografie der Nebennieren [Ultrasound and endoscopic ultrasound of the adrenal glands]. Ultraschall Med. 2010;31(3):228-247. doi: https://doi.org/10.1055/s-0029-1245449
12. Mayo-Smith WW, Song JH, Boland GL, et al. Management of Incidental Adrenal Masses: A White Paper of the ACR Incidental Findings Committee. J Am Coll Radiol. 2017;14(8):1038-1044. doi: https://doi.org/10.1016/j.jacr.2017.05.001
13. Song JH, Chaudhry FS, Mayo-Smith WW. The incidental indeterminate adrenal mass on CT (> 10 H) in patients without cancer: is further imaging necessary? Follow-up of 321 consecutive indeterminate adrenal masses. AJR Am J Roentgenol. 2007;189(5):1119-1123. doi: https://doi.org/10.2214/AJR.07.2167
14. Sangwaiya MJ, Boland GW, Cronin CG, et al. Incidental adrenal lesions: accuracy of characterization with contrast-enhanced washout multidetector CT—10-minute delayed imaging protocol revisited in a large patient cohort. Radiology. 2010;256(2):504-510. doi: https://doi.org/10.1148/radiol.10091386
15. Nagayama Y, Inoue T, Oda S, et al. Adrenal Adenomas versus Metastases: Diagnostic Performance of Dual-Energy Spectral CT Virtual Noncontrast Imaging and Iodine Maps. Radiology. 2020;296(2):324-332. doi: https://doi.org/10.1148/radiol.2020192227
16. Sande EP, Martinsen AC, Hole EO, Olerud HM. Interphantom and interscanner variations for Hounsfield units—establishment of reference values for HU in a commercial QA phantom. Phys Med Biol. 2010;55(17):5123-5135. doi: https://doi.org/10.1088/0031-9155/55/17/015
17. Stadler A, Schima W, Prager G, et al. CT density measurements for characterization of adrenal tumors ex vivo: variability among three CT scanners. AJR Am J Roentgenol. 2004;182(3):671-675. doi: https://doi.org/10.2214/ajr.182.3.1820671
18. Nguyen XV, Davies L, Eastwood JD, Hoang JK. Extrapulmonary Findings and Malignancies in Participants Screened With Chest CT in the National Lung Screening Trial. J Am Coll Radiol. 2017;14(3):324-330. doi: https://doi.org/10.1016/j.jacr.2016.09.044
19. Bellastella G, Maiorino MI, Esposito K. Endocrine complications of COVID-19: what happens to the thyroid and adrenal glands? J Endocrinol Invest. 2020;43(8):1169-1170. doi: https://doi.org/10.1007/s40618-020-01311-8
20. Elaini AB, Shetty SK, Chapman VM, et al. Improved detection and characterization of adrenal disease with PET-CT. Radiographics. 2007;27(3):755-767. doi: https://doi.org/10.1148/rg.273055031
21. Boland GW, Dwamena BA, Jagtiani Sangwaiya M. Characterization of adrenal masses by using FDG PET: a systematic review and meta-analysis of diagnostic test performance. Radiology. 2011;259(1):117-126. doi: https://doi.org/10.1148/radiol.11100569
22. Волкова Н.И., Поркшеян М.И. Визуализация надпочечников: о чем должен быть осведомлен клиницист? // Эндокринная хирургия. — 2016. — Т. 10. — №2. — С. 18-28. doi: https://doi.org/10.14341/serg2016218-28
23. Miller FH, Wang Y, McCarthy RJ, et al. Utility of diffusion-weighted MRI in characterization of adrenal lesions. AJR Am J Roentgenol. 2010;194(2):179-185. doi: https://doi.org/10.2214/AJR.09.2891
24. Sebro R, Aslam R, Muglia VF, et al. Low yield of chemical shift MRI for characterization of adrenal lesions with high attenuation density on unenhanced CT. Abdom Imaging. 2015;40(2):318-326. doi: https://doi.org/10.1007/s00261-014-0208-8
25. Seo JM, Park BK, Park SY, Kim CK. Characterization of lipid-poor adrenal adenoma: chemical-shift MRI and washout CT. AJR Am J Roentgenol. 2014;202(5):1043-1050. doi: https://doi.org/10.2214/AJR.13.11389
26. d’Amuri FV, Maestroni U, Pagnini F, et al. Magnetic resonance imaging of adrenal gland: state of the art. Gland Surg. 2019;8(3):223-232. doi: https://doi.org/10.21037/gs.2019.06.02
27. Yu H, Parakh A, Blake M, McDermott S. Texture Analysis as a Radiomic Marker for Differentiating Benign From Malignant Adrenal Tumors. J Comput Assist Tomogr. 2020;44(5):766-771. doi: https://doi.org/10.1097/RCT.0000000000001051
28. Zhang GM, Shi B, Sun H, et al. Differentiating pheochromocytoma from lipid-poor adrenocortical adenoma by CT texture analysis: feasibility study. Abdom Radiol (NY). 2017;42(9):2305-2313. doi: https://doi.org/10.1007/s00261-017-1118-3
29. Shi B, Zhang GM, Xu M, et al. Distinguishing metastases from benign adrenal masses: what can CT texture analysis do? Acta Radiol. 2019;60(11):1553-1561. doi: https://doi.org/10.1177/0284185119830292
30. Nakajo M, Jinguji M, Nakajo M, et al. Texture analysis of FDG PET/CT for differentiating between FDG-avid benign and metastatic adrenal tumors: efficacy of combining SUV and texture parameters. Abdom Radiol (NY). 2017;42(12):2882-2889. doi: https://doi.org/10.1007/s00261-017-1207-3
31. Schieda N, Krishna S, McInnes MDF, et al. Utility of MRI to Differentiate Clear Cell Renal Cell Carcinoma Adrenal Metastases From Adrenal Adenomas. AJR Am J Roentgenol. 2017;209(3):152-159. doi: https://doi.org/10.2214/AJR.16.17649
32. Elmohr MM, Fuentes D, Habra MA, et al. Machine learning-based texture analysis for differentiation of large adrenal cortical tumours on CT. Clin Radiol. 2019;74(10):818-818. doi: https://doi.org/10.1016/j.crad.2019.06.021
33. Albano D, Agnello F, Midiri F, et al. Imaging features of adrenal masses. Insights Imaging. 2019;10(1):1. doi: https://doi.org/10.1186/s13244-019-0688-8
34. Fan J, Tang J, Fang J, et al. Ultrasound imaging in the diagnosis of benign and suspicious adrenal lesions. Med Sci Monit. 2014;20:2132-2141. doi: https://doi.org/10.12659/MSM.890800
35. Friedrich-Rust M, Glasemann T, Polta A, et al. Differentiation between benign and malignant adrenal mass using contrast-enhanced ultrasound. Ultraschall Med. 2011;32(5):460-471. doi: https://doi.org/10.1055/s-0031-1273408
36. Peña CS, Boland GW, Hahn PF, et al. Characterization of indeterminate (lipid-poor) adrenal masses: use of washout characteristics at contrast-enhanced CT. Radiology. 2000;217(3):798-802. doi: https://doi.org/10.1148/radiology.217.3.r00dc29798
37. Korobkin M, Brodeur FJ, Francis IR, et al. Delayed enhanced CT for differentiation of benign from malignant adrenal masses. Radiology. 1996;200(3):737-742. doi: https://doi.org/10.1148/radiology.200.3.8756924
38. Johnson PT, Horton KM, Fishman EK. Adrenal mass imaging with multidetector CT: pathologic conditions, pearls, and pitfalls. Radiographics. 2009;29(5):1333-1351. doi: https://doi.org/10.1148/rg.295095027
39. Shimizu A, Oriuchi N, Tsushima Y, et al. High [18F] 2-fluoro-2-deoxy-D-glucose (FDG) uptake of adrenocortical adenoma showing subclinical Cushing’s syndrome. Ann Nucl Med. 2003;17(5):403-406. doi: https://doi.org/10.1007/BF03006609
40. Солдатова Т.В. Дифференциальная диагностика случайно выявленных опухолей надпочечника // Международный эндокринологический журнал. — 2011. — №.8. — С. 77-84.
41. Haider MA, Ghai S, Jhaveri K, Lockwood G. Chemical shift MR imaging of hyperattenuating (>10 HU) adrenal masses: does it still have a role? Radiology. 2004;231(3):711-716. doi: https://doi.org/10.1148/radiol.2313030676
42. Korivi BR, Elsayes KM, de Castro SF, et al. An Update of Practical CT Adrenal Imaging: What Physicians Need to Know. Curr Radiol Rep. 2015;3(4):12. doi: https://doi.org/10.1007/s40134-015-0091-2
43. Blake MA, Kalra MK, Maher MM, et al. Pheochromocytoma: an imaging chameleon. Radiographics. 2004;24(1):87-99. doi: https://doi.org/10.1148/rg.24si045506
44. Jacques AE, Sahdev A, Sandrasagara M, et al. Adrenal phaeochromocytoma: correlation of MRI appearances with histology and function. Eur Radiol. 2008;18(12):2885-2892. doi: https://doi.org/10.1007/s00330-008-1073-z
45. Leung K, Stamm M, Raja A, Low G. Pheochromocytoma: the range of appearances on ultrasound, CT, MRI, and functional imaging. AJR Am J Roentgenol. 2013;200(2):370-378. doi: https://doi.org/10.2214/AJR.12.9126
46. Al Bunni F, Deganello A, Sellars ME, et al. Contrast-enhanced ultrasound (CEUS) appearances of an adrenal phaeochromocytoma in a child with Von Hippel-Lindau disease. J Ultrasound. 2014;17(4):307-311. doi: https://doi.org/10.1007/s40477-014-0083-8
47. Привалов Ю.А., Куликов Л.К., Быкова Н.М. и др. Диагностика и хирургическое лечение феохромоцитом у пациентов с инциденталомами надпочечников // Новости хирургии. — 2013. — Т. 21, — №5. — С. 24-30.
48. Kandathil A, Wong KK, Wale DJ, et al. Metabolic and anatomic characteristics of benign and malignant adrenal masses on positron emission tomography/computed tomography: a review of literature. Endocrine. 2015;49(1):6-26. doi: https://doi.org/10.1007/s12020-014-0440-6
49. Lam KY, Lo CY. Metastatic tumours of the adrenal glands: a 30-year experience in a teaching hospital. Clin Endocrinol (Oxf). 2002;56(1):95-101. doi: https://doi.org/10.1046/j.0300-0664.2001.01435.x
50. Tallis PH, Rushworth RL, Torpy DJ, Falhammar H. Adrenal insufficiency due to bilateral adrenal metastases — A systematic review and meta-analysis. Heliyon. 2019;5(5):e01783. doi: https://doi.org/10.1016/j.heliyon.2019.e01783
51. Mayo-Smith WW, Boland GW, Noto RB, Lee MJ. State-of-the-art adrenal imaging. Radiographics. 2001;21(4):995-1012. doi: https://doi.org/10.1148/radiographics.21.4.g01jl21995
52. Wu Q, Luo W, Zhao Y, et al. The utility of 18F-FDG PET/CT for the diagnosis of adrenal metastasis in lung cancer: a PRISMA-compliant meta-analysis. Nucl Med Commun. 2017;38(12):1117-1124. doi: https://doi.org/10.1097/MNM.0000000000000757
53. Kim JY, Kim SH, Lee HJ, et al. Utilisation of combined 18 F-FDG PET/CT scan for differential diagnosis between benign and malignant adrenal enlargement. Br J Radiol. 2013;86(1028):20130190. doi: https://doi.org/10.1259/bjr.20130190
54. Delivanis DA, Bancos I, Atwell TD, et al. Diagnostic performance of unenhanced computed tomography and 18 F-fluorodeoxyglucose positron emission tomography in indeterminate adrenal tumours. Clin Endocrinol (Oxf). 2018;88(1):30-36. doi: https://doi.org/10.1111/cen.13448
55. Wang F, Liu J, Zhang R, et al. CT and MRI of adrenal gland pathologies. Quant Imaging Med Surg. 2018;8(8):853-875. doi: https://doi.org/10.21037/qims.2018.09.13
56. Outwater EK, Bhatia M, Siegelman ES, et al. Lipid in renal clear cell carcinoma: detection on opposed-phase gradient-echo MR images. Radiology. 1997;205(1):103-107. doi: https://doi.org/10.1148/radiology.205.1.9314970
57. Martín J, Sentís M, Zidan A, et al. Fatty metamorphosis of hepatocellular carcinoma: detection with chemical shift gradient-echo MR imaging. Radiology. 1995;195(1):125-130. doi: https://doi.org/10.1148/radiology.195.1.7892452
58. Sydow BD, Rosen MA, Siegelman ES. Intracellular lipid within metastatic hepatocellular carcinoma of the adrenal gland: a potential diagnostic pitfall of chemical shift imaging of the adrenal gland. AJR Am J Roentgenol. 2006;187(5):550-551. doi: https://doi.org/10.2214/AJR.06.0506
59. Halefoglu AM, Altun I, Disli C, et al. A prospective study on the utility of diffusion-weighted and quantitative chemical-shift magnetic resonance imaging in the distinction of adrenal adenomas and metastases. J Comput Assist Tomogr. 2012;36(4):367-374. doi: https://doi.org/10.1097/RCT.0b013e3182597613
60. Fassnacht M, Dekkers OM, Else T, et al. European Society of Endocrinology Clinical Practice Guidelines on the management of adrenocortical carcinoma in adults, in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. 2018;179(4):G1-G46. doi: https://doi.org/10.1530/EJE-18-0608
61. Fassnacht M, Assie G, Baudin E, et al. Adrenocortical carcinomas and malignant phaeochromocytomas: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020;31(11):1476-1490. doi: https://doi.org/10.1016/j.annonc.2020.08.2099
62. Mendichovszky IA, Powlson AS, Manavaki R, et al. Molecular Imaging in Adrenal Disease-An Emerging Role for Metomidate PET-CT. Diagnostics (Basel). 2016;6(4):42. doi: https://doi.org/10.3390/diagnostics6040042
Об авторах
127051, Москва, ул. Петровка, д. 24-1.
eLibrary SPIN: 6265-6676
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
127051, Москва, ул. Петровка, д. 24-1.
eLibrary SPIN: 8896-8051
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
127051, Москва, ул. Петровка, д. 24-1.
eLibrary SPIN: 3306-1387
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
127051, Москва, ул. Петровка, д. 24-1.
eLibrary SPIN: 6004-2422
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
eLibrary SPIN: 2502-4463
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
127051, Москва, ул. Петровка, д. 24-1.
eLibrary SPIN: 8542-1720
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
127051, Москва, ул. Петровка, д. 24-1.
eLibrary SPIN: 6810-3279
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
| 1. Рисунок 1. Нормальные надпочечники на КТ-изображениях с внутривенным контрастным усилением в аксиальной (A) и корональной (B) проекциях. | |
| Тема | |
| Тип | Исследовательские инструменты |
| Метаданные | |