Накопление рфп в костях что это значит
Лучевые методы в оценке состояния метастатических очагов в костях при РПЖ
Какой из лучевых методов диагностики костных метастазов при РПЖ является наиболее точным и объективным? Какие дополнительные методы можно использовать в случае затруднения диагностики метастазов? Cреди лучевых методов (рентгено-, остеосцинти-, томограф
Какой из лучевых методов диагностики костных метастазов при РПЖ является наиболее точным и объективным?
Какие дополнительные методы можно использовать в случае затруднения диагностики метастазов?
Cреди лучевых методов (рентгено-, остеосцинти-, томографии), широко используемых в современной урологической практике для ранней диагностики локализации и стадии течения метастатического процесса в костях, остеосцинтиграфия (ОСГ) в силу своей высокой чувствительности занимает приоритетное положение [3]. Невысокая специфичность данного метода значительно возрастает при дополнительном использовании других инструментальных методов (КТ, УЗИ, МРТ и т. д.), особенно при диагностировании смешанных и остеолитических очагов метастазов, а также когда визуальные рентгенологические признаки метастатического процесса отсутствуют [3].
Нами проведен ретроспективный анализ 8500 сканограмм больных (в возрасте 60-82 лет), полученных в отделении радиоизотопной диагностики ГВКГ им. Н. Н. Бурденко (1990-1998 годы). Из них изучено 450 (подробно 45) больных с подозрением на РПЖ (или с установленным раком простаты в анамнезе).
В исследуемые группы не включали пациентов с болезнью Педжета, лимфогранулематозом, лейкозом, мраморной болезнью, а также консолидирующими переломами, воспалительными и врожденными деструктивными процессами в костях, симулирующих картину метастатического РПЖ. По показаниям выполняли ТР УЗИ, пункционную биопсию, пальцевое ректальное исследование предстательной железы (ПРИ), проводили серологическое определение уровня сывороточного общего простатспецифического антигена и применяли гистологические методы. Уровень накопления РФП в костной ткани 30% относили к гиперфиксации, патогномоничной для ракового метастатического поражения костей. При наличии метастазов в симметричных отделах скелета (ребра, лопатки, кости таза и др.) уровень фиксации индикатора в данной зоне сравнивали с этим показателем в противоположной (симметричной) зоне (например, 6-е правое ребро — 6-е левое ребро и т. д.). При наличии несимметричных зон (тела позвонков и др.) степень накопления РФП сравнивали с ниже- или вышележащей зоной (позвонком).
Данная работа была выполнена с помощью гамма-камеры GCA-7200 A/di фирмы «Тошиба» (Япония). Методика исследования скелета предусматривала внутривенное введение 99m-Тс-технефора за три часа до сеанса. Сканирование производилось со скоростью 5 см/мин, общее время сеанса составляло 30-35 мин с обычной регистрацией радиоактивного излучения и системной обработкой полученных изображений на ПК с помощью операционной системы компании Unix. Использовали также рентгенаппарат «Сиреграф» (фирма «Сименс») и компьютерный томограф «Пиккер» (фирма «Пиккер», США).
 |
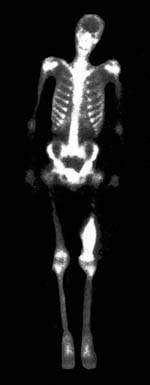
| Рисунок 1. При остеосцинтиграфии определяются очаги гиперфиксации РПФ в Th 6-12, L 1-2 позвонках, в углах обеих лопаток, в пояснично-крестцовом сочленении справа, в крыльях таза больше слева спереди, в ребрах |
Статистическая обработка материала осуществлялась стандартными методами. Были получены следующие результаты. Теоретической основой работы послужили широко известные данные о физико-химических особенностях метаболизма фосфатных комплексов, меченных Тс-99m РФП [6]. Данный индикатор интенсивно диффундирует из кровеносного русла и накапливается в остеобластах, а также в матрице вновь формирующейся остеоидной ткани в мета- и эпифизарных участках трубчатых костей, характеризующихся высоким уровнем васкуляризации и активности костного мозга [2, 3, 8].
 |
| Рисунок 2. На сцинтиграммах костей скелета сохраняются множественные очаги гиперфиксации РПФ, более интенсивные по сравнению с предыдущим обследованием |
В первой группе больных на сканограммах симметричных (ребра, лопатки) и несимметричных отделов скелета (тела позвонков, крестец, непарные кости черепа), полученных на ранних стадиях метастатического процесса, выявлялись единичные (рис. 1), а при повторном исследовании (спустя 2-6 месяцев) множественные зоны гиперфиксации РФП (45-76% ед. Н) [2]. Сканограммы с низкой степенью концентрации индикатора ( Рисунок 3. При остеосцинтиграфии выявлены очаги гиперфиксации РПФ в Th 9 грудном позвонке, нижнем углу правой лопатки и в Th5
У больных четвертой группы (n=8) было проведено комплексное инструментальное обследование (ОСГ, МРТ, Rо-графия); подобный алгоритм оказался наиболее эффективным из всех подходов.
Полученные нами данные свидетельствуют о том, что ОСГ скелета позволяет выявить метастатические очаги на 6-12 месяцев раньше, чем это возможно при использовании обычного рентгенологического метода, что соответствовало результатам, полученным другими учеными [7, 9]. Объясняется этот факт тем, что введенные внутривенно радиоактивные атомы Р легко включаются в Са-Р-обмен в раннем периоде формирования неоостеоида. Остеобластическая стадия морфогенеза костного метастаза РПЖ характеризовалась активизированными остеобластами, продукцией атипичного остеоидного вещества, выраженным сосудистым компонентом и комплексами иммунных и раковых клеток. На макроуровне эти процессы были представлены сцинтиграфически признаками костной (остеобластической) перестройки, рентгенологически — признаками костной деструкции (остеолизиса). Практически важной особенностью ОСГ скелета является полная визуализация всего скелета, что недостижимо при использовании рентгенографии. При отсутствии сцинтиграфических признаков РПЖ наиболее эффективные результаты получены у четвертой группы больных. Совпадение данных ЛТ (ОСГ, Ro-графии) и цитогистологических методов исследований составило 70-80%. Совпадения по различным стадиям РПЖ колебались от 65 до 95%, что было связано со степенью злокачественности раковых клеток, их индуктирующим влиянием на остеобласты, активностью остеогенных деструктивно-репаративных и протекторных стромогенных процессов в метастатических очагах, а также гормональным фоном и характером оперативного вмешательства [3, 5, 6]. Точность ранней диагностики метастатической формы РПЖ достигала 80-95% при одновременном с ОСГ изучении сывороточной ПСА, что также отражено в литературе [1].
| Ранняя диагностика локализации и характера метастазов в костях при раке предстательной железы (РПЖ) с помощью лучевых методов — актуальная проблема современной онкоурологии [4, 6, 8]. Гематогенные метастатические очаги в костях при раке предстательной железы (РПЖ) встречаются в 50-70% случаев, а по данным сцинтиграфии (ОСГ) — в 12-62% (при отсутствии рентгенологических признаков) [3] |
Литература
1. Вуд Мари Э., Банн Пол А. Секреты гематологии и онкологии /Под ред. Токарева Ю. Н., Бухни А. Е.. М.: Бинон, 1997.
2. Линденбратен Л. Д., Наумов Л. Б. Медицинская рентгенология. М.: Медицина, 1984.
3. Портной А. С., Гродзовская Ф. Л. Рак и аденома предстательной железы. Л.: Медицина, 1984. 272. С. 159-162.
4. Руководство по урологии. В 3-х т. /Под ред. Лопаткина Н. А.. М.: Медицина, 1998.
5. Рукавишников В. А., Сальвицкий Б. Н. К вопросу лучевой диагностики злокачественных новообразований костей // Специализированная медицинская помощь и современные проблемы ее интеграции. Тез. докл. науч. конф. 11.12.1986. ГВКГ им. Н. Н. Бурденко, М. 1986. С. 408-409.
6. Савченко Т., Мечев Д., Романенко В. Руководство по ядерной медицине. Вища школа, Киев, 1991. С. 480-489.
7. Harada K., Tanahashi Y., Igari D., Numata I., Orikasa S. Clinical evaluation of inside echo patterns in gray scale prostatic echography /J. Urology 1980. 124, № 2. Р. 216-220.
8. McKillop J. H., Fogelman I. Benign and malignant bone disease // British Nuclear Medicine Society. 1991. Р. 30-53.
9. Signori G. B., Marini F., Perego S., Valente R. Scintigrafia ossea e puntato midollare nella valutazione del carcinoma prostatico /Urologia (Treviso). 1979. 46, № 3. P. 359-363.
Накопление рфп в костях что это значит
Исследование «всего тела» заключается в сканировании пациента от макушки до кончиков пальцев ног.
Вопрос №2. Что такое радиофармпрепарат?
Радиофармпрепарат (РФП) – это соединение, состоящее из специального вещества и радионуклида (изотопа, радионуклидной метки). Специальное вещество отвечает за то, в каком органе накопится РФП, а радионуклидная метка позволяет врачу-диагносту увидеть это накопление на изображении.
В настоящее время в основном используются соединения меченые 99m Tc (технеций-99), а также 123 I (йод-123).
Вопрос №3. Что такое физиологическое накопление РФП?
Физиологическое накопление (гиперфиксация) РФП – это повышенное накопление РФП, определяющееся в различных органах и системах в норме.
Например, большинство РФП выводятся почками, поэтому самое частое физиологическое накопление РФП определяется в мочевом пузыре.
Вопрос №4. Что такое патологическое накопление радиофармпрепарата (РФП)?
Повышенное накопление РФП в очаге по отношению к здоровым тканям, противоположной области (например, в ребре с противоположной стороны, суставе).
Вопрос №5. Как следует себя вести после введения радиофармпрепарата (РФП)?
В целях ограничения возможного облучения окружающих Вас людей следует придерживаться следующих правил:
Помните! При соблюдении этих правил и рекомендаций Вы не представляете радиационной опасности для Ваших близких и окружающих.
Вопрос №6. Кому показана ангионефросцинтиграфия с капотеном?
Данное исследование показано пациентам со средним или высоким риском вазоренальной (почечной) гипертензии. Критерии отбора для теста: внезапная или выраженная гипертензия; гипертензия стойкая к медикаментозной терапии у послушного пациента; шумы при аускультации в брюшной полости или в боку; повышение уровня азота или ухудшение почечной функции во время терапии ингибиторами АПФ; окклюзионное поражение в других сосудистых бассейнах; гипертензивная ретинопатия 3 или 4 степени (поражение глаз); начало гипертензии до 30 или после 55 лет.
О радионуклидной ВИЗУАЛИЗАЦИИ (сцинтиграфии) для врача общей практики
Первое применение радиоактивных индикаторов относят к 1911 году и связывают с именем Дьердя де Хевеши. Молодой ученый, живший в дешевом пансионе, начал подозревать, что остатки пищи, которые он не доел, подавали ему вновь на следующий день.
Первое применение радиоактивных индикаторов относят к 1911 году и связывают с именем Дьердя де Хевеши. Молодой ученый, живший в дешевом пансионе, начал подозревать, что остатки пищи, которые он не доел, подавали ему вновь на следующий день. Он добавил радиоизотопный индикатор к несъеденной порции и с помощью детектора излучения доказал своей хозяйке, что дело обстояло именно так. Хозяйка выгнала молодого ученого из пансиона. Он же продолжал начатую работу, результатом которой стала Нобелевская премия за использование радионуклидов в качестве индикаторов в биологии Радионуклидная (радиоизотопная) диагностика охватывает все виды применения открытых радиоактивных веществ в диагностических и лечебных целях.
Клиническое применение радиоиндикаторов вошло в практику в 50-х годах. Развиваются методы, позволяющие детектировать наличие (радиометрия), кинетику (радиография) и распределение (сканирование) радиоиндикатора в исследуемом органе. Принципиально новый этап радиоизотопной визуализации связан с разработкой устройств широкого поля зрения (сцинтилляционные гамма-камеры) и метода визуализации — сцинтиграфии. Нередко термином «сцинтиграфия» обозначают исследования, проведенные с использованием как линейного сканера, так и сцинтиляционной гамма-камеры. С этим терминологическим стереотипом связано формирование неверных представлений о диагностических возможностях методов.
Сканирование и сцинтиграфия — это различные методы радиоизотопной визуализации. Сцинтиграфия существенно превосходит сканирование по объему и точности диагностической информации. Современные сцинтилляционные камеры представляют собой компьютеро-сцинтиграфические комплексы, позволяющие получать, хранить и обрабатывать изображения отдельного органа и всего тела в широком диапазоне сцинтиграфических режимов: статическом и динамическом, планарном и томографическом. Независимо от типа получаемого изображения оно всегда отражает специфическую функцию исследуемого органа. По сути, это картирование функционирующей ткани. Именно в функциональном аспекте заключается принципиальная отличительная особенность сцинтиграфии от других методов визуализации. Попытка взглянуть на результаты сцинтиграфии с анатомических или морфологических позиций — еще один ложный стереотип, влияющий на предполагаемую результативность метода.
Диагностическая направленность радиоизотопного исследования определяется используемым радиофармацевтическим препаратом (РФП). Что же такое РФП? Радиофармацевтический препарат — это химическое соединение с известными фармакологическими и фармакокинетическими характеристиками. От обычных фармацевтических средств он отличается не только радиоактивностью, но и еще одной важной особенностью — количество основного вещества настолько мало, что при введении в организм не вызывает побочных фармакологических эффектов (например, аллергических). Специфичность РФП по отношению к определенным морфофункциональным структурам определяет его органотропность. Понимание механизмов локализации РФП служит основой для адекватной интерпретации радионуклидных исследований. Введение РФП связано с небольшой дозой облучения, неспособной вызвать какие-либо неблагоприятные специфические эффекты. В этом случае принято говорить об опасности переоблучения, однако при этом не учитываются темпы развития современной радиофармацевтики.
Лучевая нагрузка определяется физическими характеристиками радиоиндикатора (период полураспада) и количеством введенного РФП. Сегодняшний день радионуклидной диагностики — использование короткоживущих радионуклидов. Наиболее популярным из них является технеций-99m (период полураспада — 6 часов). Этот искусственный радионуклид получают непосредственно перед исследованием из специальных устройств (генераторов) в форме пертехнетата и используют для приготовления различных РФП. Величины радиоактивности, вводимые для проведения одного сцинтиграфического исследования, создают уровни лучевой нагрузки в пределах 0,5-5% допустимой дозы. Важно подчеркнуть — длительность сцинтиграфического исследования, количество получаемых изображений или томографических срезов уже не влияют на «заданную» дозу облучения.
l Клиническое применение
Коротко остановимся на реальных диагностических возможностях наиболее распространенных («рутинных») сцинтиграфических исследований.
Визуализация костной системы (остеосцинтиграфия) — наиболее точный метод выявления участков нарушенного костного метаболизма. Остеотропные РФП (Тс-фосфонаты) обладают высоким сродством к кристаллам фосфата кальция, поэтому они связываются преимущественно с минеральным компонентом костной ткани. Уровень накопления РФП в различных типах костей и участках скелета обусловлен степенью остеобластической и метаболической активности, величиной кровотока, что необходимо учитывать при дифференциации нормального и патологического накопления РФП. В частности, повышенное накопление РФП наблюдается в метаэпифизарных отделах трубчатых костей, в областях с постоянной физической нагрузкой.
Заболевания костей сопровождаются патологической перестройкой костной ткани, реактивным или опухолевым костеобразованием — основными механизмами, обусловливающими изменение костного метаболизма и накопление остеотропных РФП в пораженных отделах. В зависимости от сочетания указанных процессов возрастает уровень накопления остеотропных РФП при опухолевых, воспалительных, дегенеративных, травматических заболеваниях.
Основная и наиболее ответственная задача остеосцинтиграфии — поиск метастатических и оценка распространенности опухолевых поражений скелета. Сцинтиграфическая манифестация патологии может проявиться на 3-12 месяцев раньше, чем появятся рентгенологические признаки. Связано это с тем, что локальное изменение обмена остеотропных РФП возникает на ранних фазах развития патологии, еще до появления не только рентгенологической, но и клинической симптоматики. По этой причине радионуклидное исследование обладает наибольшей эффективностью в до- и послеоперационном обследовании больных опухолями с высокой частотой метастазирования в кости (молочная железа, легкие, предстательная железа, почки).
 |
| Рисунок 1. Остеогенная саркома бедра. Обширная область высокого накопления РФП в дистальном отделе левого бедра |
Сцинтиграфическая манифестация метастатических поражений — множественные и реже одиночные локальные зоны высокого накопления РФП («горячие» очаги). Наиболее высокие концентрации РФП отмечаются в остеобластических и смешанных метастазах, низкие — в остеолитических. Ложноположительные ошибки чаще всего связаны с выраженными остеодистрофическими изменениями, а также с травматическими повреждениями ребер и позвоночника. Опухоли костей остеогенного происхождения отличаются наиболее высокой кумуляцией РФП. Например, остеогенная саркома отличается выраженной гиперфиксацией РФП не только в элементах самой опухоли, но и в окружающих мягких тканях за счет реактивной гиперемии (рис. 1). В опухолях неостеогенного происхождения накопление РФП более низкое. Однако практически не представляется возможным дифференцировать отдельные виды опухолей по степени накопления в них РФП. Некоторые опухоли, так же как и их метастазы, могут быть накоплением РФП. К таким опухолям относится, в частности, ретикулосаркома и множественная миелома. Визуализация почек (динамическая реносцинтиграфия) — простой и точный метод одновременной оценки функционального и анатомотопографического состояния мочевыводящей системы. В основу положена регистрация транспорта нефротропного РФП и последующий расчет параметров, объективизирующих два последовательных этапа.
Анализ сосудистой фазы (ангиофазы) направлен на оценку симметричности прохождения «болюса» по почечным артериям и относительных объемов крови, поступающих к каждой почке в единицу времени. Анализ паренхиматозной фазы предусматривает характеристику относительной функции почек (вклад в суммарную очистительную способность) и времени прохождения РФП через каждую почку или ее отделы. Клиническая интерпретация в значительной степени определяется механизмом элиминации РФП. В методах динамической визуализации могут быть использованы два вида РФП:
l гломерулотропные (производные ДТПА), практически полностью фильтруются клубочками и отражают состояние и скорость клубочковой фильтрации;
l тубулотропные (аналоги гиппурана) секретируются эпителием проксимальных канальцев и отражают состояние канальцевой секреции, а также эффективного почечного кровотока. Показания к исследованию включают урологическую и нефрологическую патологию, а также заболевания, где почки являются органами-мишенями.
При различных клинических ситуациях может меняться как форма кривых, так и их количественные характеристики. Следует, однако, подчеркнуть, что характер и величины изменений малоспецифичны для конкретной патологии и прежде всего отражают тяжесть патологического процесса. Наибольшая информативность реносцинтиграфии проявляется при дифференциации одно- или двустороннего поражения почек.
Ведущий признак, определяющий сторону поражения, — асимметрия амплитудно-временных характеристик ангионефросцинтиграмм. Асимметрия сосудистых параметров, и прежде всего выраженная разница времени поступления РФП в почечные артерии, — один из критериев стеноза почечной артерии. Симметричность изменений паренхиматозной функции более характерна, в частности, для гломерулонефрита; асимметрия — довольно постоянный признак пиелонефрита не только при одно-, но и при двустороннем процессе. Аналогичные изменения могут сопровождать различные варианты аномалий почек и верхних мочевых путей (нефроптоз, удвоение собирательной системы, гидронефроз).
В основе метода визуализации печени (гепатосцинтиграфии) лежит использование меченых коллоидов, которые после внутривенного введения фагоцитируются и распределяются в морфофункциональных структурах, содержащих клетки РЭС в соответствии с локальными значениями органного кровотока. В норме в печени локализуется более 90%, в селезенке — около 5%, а в костном мозге — менее 1% введенного радиоколлоида. В зависимости от характера и тяжести патологии эти соотношения меняются. Наиболее общим показанием к гепатосцинтиграфии является гепато- и/или спленомегалия неясного генеза. Основная задача исследования — дифференциация характера и уточнение тяжести поражения печени.
Диффузные заболевания печени манифестируются изменением размера и формы изображения, распределения радиоколлоида в печени и его внеорганного накопления, параметров фагоцитарной способности РЭС и печеночного кровотока. Следует подчеркнуть, что исследование не позволяет дифференцировать клинические или клинико-морфологические формы заболевания печени (например, хронический гепатит). Наибольшая информативность метода проявляется в возможности выявления синдрома портальной гипертензии (СПГ).
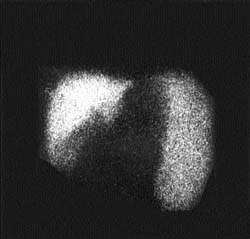 |
| Рисунок 2. Внепеченочная блокада портального кровообращения. Синдром портальной гипертензии манифестируется высоким захватом радиоколлоида увеличенной селезенкой |
Независимо от причин повышенного давления в системе воротной вены (внутри- или внепеченочные формы), сцинтиграфически СПГ манифестируется высоким захватом радиоколлоида и увеличенной селезенкой. Сочетание указанных признаков позволяет выявить СПГ с точностью до 98% (рис. 2). Очаговые поражения печени в зависимости от их распростаненности проявляются наличием одиночных или множественных дефектов накопления РФП в пределах одной или обеих долей печени (рис. 3). В практике нередко выявление участков, где отсутствует накопление РФП («холодные» очаги), прочно ассоциируют с объемными процессами, чаще всего опухолевого генеза. Это представление ложно. Достаточно широкий спектр заболеваний, связанных с вовлечением печени в патологический процесс, сцинтиграфически может манифестировать очаговыми изменениями как следствием локальных гемодинамических или функциональных нарушений (цирроз печени, амилоидоз, гистиоцитоз). Необходимо также помнить, что некоторые органные структуры (аномально расположенный желчный пузырь, молочная железа) могут «экранировать» изображение печени и формировать сцинтиграфический феномен «псевдоопухоли». Именно поэтому по характеру дефекта накопления РФП без учета клинической информации практически невозможно дифференцировать специфику очагового поражения.
A. | B.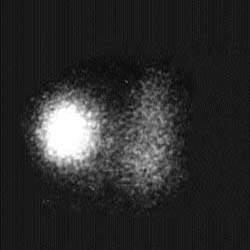 |
| Рисунок 3. Сцинтиграфические варианты узловых поражений щитовидной железы. «Холодный» узел нижнего отдела левой доли — коллоидная киста (А), «горячий» узел правой доли — тиреотоксическая аденома (Б) | |
Возможность выявления очаговой патологии зависит и от разрешающей способности гамма-камеры. Очаги менее 1 см, как правило, сцинтиграфически не манифестируются.
Визуализация желчевыделительной системы (гепатохолесцинтиграфия) основана на использовании серии гепатотропных РФП, аналогичных по своей фармакокинетике красителям (бромсульфалеин, вофавердин). После внутривенного введения они связываются с белками крови, поглощаются полигональными клетками печени и выводятся в составе желчи. Основным преимуществом гепатохолесцинтиграфии является непрерывность визуальной и количественной регистрации процесса кинетики РФП.
Визуальный анализ серии изображений позволяет выявить некоторые органические изменения желчных протоков (расширение), желчного пузыря (деформации), а также функциональные изменения двенадцатиперстной кишки.
Анализ кривых позволяет получить количественные критерии, характеризующие поглотительно-выделительную функцию печени, наполнение желчного пузыря, длительность латентного периода после желчегонного завтрака, скорость опорожнения желчного пузыря. Дискинезии желчного пузыря дифференцируются на основе изменения скорости его опорожнения (гипо- или гипермоторная дискинезия). Следует подчеркнуть, что точность радиологической оценки двигательной функции желчного пузыря превышает рентгенологическую или эхографическую. Это связано с тем, что при сравнении площадей изображения органа до и через фиксированное время после желчегонного завтрака практически невозможно учесть длительность латентного периода желчеотделения и выделить собственно фазу опорожнения желчного пузыря.
Гепатохолесцинтиграфия имеет ограниченное значение в диагностике воспалительной патологии и камней желчного пузыря. Первоочередная задача заключается в оценке тяжести нарушения проходимости шеечно-протоковой зоны и наполнения желчного пузыря. При полной обтурации пузырного протока возникает сцинтиграфический феномен «отключенного желчного пузыря».
Визуализация щитовидной железы (тиреосцинтиграфия) проводится с использованием Тс-пертехнетата и основывается на сходстве в поведении ионов йода и пертехнетата. Однако это сходство прослеживается только на начальной неорганической фазе внутритиреоидного транспорта. Пертехнетат, в отличие от йода, не переходит в органическую фазу, то есть не включается в состав тиреоидных гормонов. Эта особенность исключает возможность его использования при послеоперационном поиске метастазов рака щитовидной железы (последнее проводится только с радиоактивным йодом).
Узловые поражения щитовидной железы и дифференциальная диагностика выявленных клинически или эхографически узловых образований шеи — наиболее частое показание к тиреосцинтиграфии. Основная задача исследования — оценить степень функционирования узлов, идентифицировать солитарные или множественные образования, установить связь узлов с тиреоидной тканью. В зависимости от функциональной активности и степени накопления радиопертехнетата узлы традиционно разделяют на «горячие», «теплые» и «холодные». Однако такое деление относится только к их сцинтиграфической оценке.
Под термином «горячий» узел подразумевают ситуацию, когда РФП накапливается почти исключительно в области узла и не накапливается в других отделах органа. Подобные находки характерны для автономной тиреоидной ткани, токсической аденомы, аутоиммунного тиреоидита, врожденной аплазии доли. Отсутствие накопления РФП в окружающий узел ткани объясняется продукцией автономным узлом тиреоидных гормонов, уменьшающих выделение ТТГ и обусловливающих подавление функции нормальной ткани.
Функционально неактивные («холодные») узлы характеризуются отсутствием или резким снижением накопления радиопертехнетата. Эта менее специфическая находка сопровождает широкий спектр патологии: узловой зоб, коллоидные кисты, аденому, неспецифический струмит, в 15-25% случаев — рак щитовидной железы (рис. 3).
Наибольшие затруднения представляет идентификация «теплых» узлов. Эти узлы рассматривают как разновидность «горячих», но в отличие от последних в них отсутствует или слабо выражено функциональное подавление нормальной тиреоидной ткани. В силу этого накопление РФП в узлах может не отличаться от окружающей паренхимы и приводить к ложноотрицательным трактовкам данных сцинтиграфии.