Наночастицы что это такое простыми
Наночастицы могут служить для доставки генов в клетки, лечения рака и вакцинации
Наночастицы могут перемещаться из легких в другие органы
Другим потенциальным путем попадания наночастиц в организм является обонятельный нерв; наночастицы могут пересекать слизистую оболочку внутри носа и затем достигать мозга через обонятельный нерв. Из трех исследований на людях только одно показало попадание ингаляционных наночастиц в кровоток.
Материалы, которые сами по себе не очень вредны, могут быть токсичными, если они вдыхаются в форме наночастиц.
Воздействие вдыхаемых наночастиц в организме может включать воспаление легких и проблемы с сердцем. Повреждение легких и воспаление в результате вдыхания наноразмерных твердых частиц, по-видимому, связано с окислительным стрессом, который эти частицы вызывают в клетках.
Последствия для здоровья от наночастиц, используемых в качестве носителей лекарств
Наночастицы могут быть использованы либо в качестве самого лекарства, либо в качестве носителя лекарства. Продукт можно вводить перорально, наносить на кожу или вводить через инъекции.
Целью доставки лекарственного средства с помощью наночастиц является либо получение большего его количества к клеткам-мишеням, либо снижение вредного воздействия свободного лекарственного средства на другие органы, либо и то, и другое.
Наночастицы, используемые таким образом, должны циркулировать на большие расстояния, обходя защитные механизмы организма. Чтобы достичь этого, наночастицы предназначены для прилипания к клеточным мембранам, проникновения внутрь определенных клеток в организме или в опухолях и прохождения через клетки. Поверхности наночастиц иногда также модифицируются, чтобы избежать распознавания и устранения иммунной системой.
Наночастицы как носители лекарственного вещества: польза и вред
Наночастицы могут эффективно использоваться для доставки генов в клетки, для лечения рака, а также для вакцинации. Использование наночастиц в качестве носителей лекарственного средства может снизить токсичность включенного препарата, но иногда трудно отличить токсичность лекарственного средства от токсичности наночастиц. Кроме того, наночастицы, попавшие в печень, могут влиять на функцию этого органа.
Наночастицы могут проникать через гематоэнцефалический барьер, что делает их чрезвычайно полезными для доставки лекарств непосредственно в мозг. С другой стороны, это также является серьезным недостатком, поскольку наночастицы, используемые для переноса лекарств, могут быть токсичными для мозга.
Читайте также:
Отказ от ответственности: этот контент, включая советы, предоставляет только общую информацию. Это никоим образом не заменяет квалифицированное медицинское заключение. Для получения дополнительной информации всегда консультируйтесь со специалистом или вашим лечащим врачом.
Добавьте «Правду.Ру» в свои источники в Яндекс.Новости или News.Google, либо Яндекс.Дзен
Быстрые новости в Telegram-канале Правды.Ру. Не забудьте подписаться, чтоб быть в курсе событий.
Невидимая граница: где сталкиваются «нано» и «био»
Невидимая граница: где сталкиваются «нано» и «био»
Молекулы, из которых состоят клетки живых организмов, и образуемые ими структуры, несомненно, попадают в диапазон размеров объектов, обозначаемых приставкой «нано-». Каковы будут последствия взаимодействия «наших» нанобиосистем с искусственными наночастицами, коль скоро в ближайшем будущем последние получат широчайшее распространение?
Автор
Редакторы
В последние годы приставка «нано» стала известна даже тем, кто не имеет представления о её численном значении, а форсированное развитие нанотехнологий ставит вопросы, связанные с общественной безопасностью манипуляций с частицами, чей размер сопоставим с наиболее мелкими объектами в биологической иерархии наших организмов. Потенциал применения нанотехнологий в медицине огромен, но, как и пресловутая палка, обоюдоостр: за наноскопическим барьером скрываются не только чудеса, но и угрозы. Для адекватной оценки этих опасностей необходимо чётко представлять механизмы взаимодействий, возникающих в области непосредственного контакта искусственных наночастиц и клеток живого организма. Эта статья рассказывает о таких взаимодействиях и иллюстрирует потенциальную пользу и вред от использования нанообъектов в медицине.
Если бы, — говорит, — был лучше мелкоскоп, который в пять миллионов увеличивает, так вы изволили бы, — говорит, — увидать, что на каждой подковинке мастерово имя выставлено: какой русский мастер ту подковку делал.
Николай Лесков. Левша
Предвестником того, что в наши дни называется нанотехнологией (см. словарик ниже), часто считается знаменитый доклад Ричарда Фейнмана «Там внизу много места» («There’s Plenty of Room at the Bottom»), сделанный им в Калифорнийском технологическом институте на ежегодной встрече Американского физического общества в 1959 году. В 1980-х годах термин «нанотехнология» активно использовался Эриком Дрекслером, известным идеологом расширения горизонтов техносферы с использованием возможности манипуляций нанообъектами.
В последние годы в России нанотехнологии стали притчей во языцех, и сама приставка «нано-» даже стала частенько использоваться с определённым оттенком издёвки, отражающим несколько нездоровый ажиотаж, раздуваемый государственными корпорациями в этой сфере исследований. Но общественное мнение и правительственные тендеры сами по себе, а нанотехнологии всё же, бесспорно, являются мощнейшей парадигмой, заключающей в себе новый технологический уклад, который в будущем, несомненно, станет основой очередной пост-постиндустриальной революции.
Что же нанотехнологии могут предложить обществу, если отвлечься от сугубо фундаментальных научных исследований? Если перечислять очень кратко, то это и материалы с необычными свойствами (наноматериалы), и наномедицина и фармацевтика, обещающие не только принципиально новые средства диагностики, но и мощную платформу для лечения многих заболеваний, и электроника, и новые приборы и методы исследований, и новый подход к робототехнике, и системы вооружения, и многое другое. Отдельно стоит отметить область так называемых нанобиотехнологий, которой предрекают стать революционной в здравоохранении [1]. Наночастицы начали в массовом порядке применяться и в косметических составах — чаще всего, в солнцезащитных кремах, кондиционерах и лосьонах. В рунете уже появилось множество сайтов, очень подробно освещающих достижения и перспективы нанотехнологий.
Дело в первую очередь в том, что искусственно созданные нанообъекты обладают свойствами, не существовавшими в природе ранее или не встречавшимися в определённом контексте (например, в организме человека). Поскольку организм состоит из сложным образом организованных молекул, на определённом уровне его вполне правомочно описывать в терминах нанообъектов (таких как, например, рибосома, скользящая по нити мРНК или везикулы, перемещающиеся внутри клетки по «канатам» цитоскелета). Возможная опасность искусственных наночастиц связана с тем, что они могут начать взаимодействовать с естественными нанообъектами непредсказуемым образом. Какое, например, действие оказывают дисперсии наночастиц на организм человека при длительном контакте с ними? Или как отразится на работе клетки попадание в межклеточную среду углеродных нанотрубок?
Этот обзор посвящён рассмотрению явлений, возникающих в области контакта искусственных нанообъектов с биологическими системами («интерфейс „нано–био“»), а также физических, физико-химических и биологических эффектов, сопровождающих эти взаимодействия. В заключение будут даны примеры болезнетворного и лечебного влияния нанообъектов на организм человека, которые подтверждают, что окончательный эффект зависит не от самих нанотехнологий, а от умения пользоваться ими в своих интересах. (И будем надеяться, что «свои» интересы и интересы человечества — это одно и то же 😉
Словарик
Зона контакта между «нано» и «био»
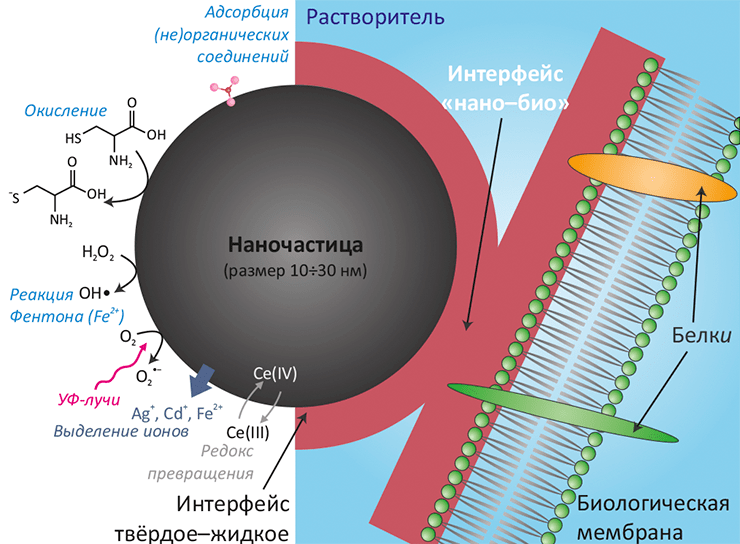
Коллоидный по своей природе, интерфейс нано–био подразделяется на три динамические компоненты: (1) поверхность самой наночастицы, свойства которой определяются размером и физико-химическими параметрами; (2) интерфейс «твёрдое–жидкость» между наночастицей и окружающей средой и (3) собственно интерфейс нано–био — область, где наночастица взаимодействует с биологическим объектом. Наиболее важные характеристики, определяющие поверхностную активность — химический состав частицы, наличие функциональных химических групп на поверхности, форма и радиус кривизны поверхности, её гетерогенность и пористость, а также гидрофильность / гидрофобность (более подробно — на рисунке 1).
Рисунок 1. Пример организации интерфейса «нано–био»: наночастица и липидная мембрана. Основные эффекты являются следствием физико-химических свойств поверхности частицы и модификации этих свойств вследствие контакта с окружающей средой и биологическим объектом. Схематично показаны некоторые процессы, протекающие на поверхности наночастицы. На свойства интерфейса нано–био оказывают влияние следующие факторы:
В отличие от довольно хорошо изученных коллоидной химией «обычных» поверхностей раздела твёрдое–жидкое, соответствующий интерфейс в случае наночастиц в биологическом окружении представляет собой существенно нестационарную систему. Тут уже не действуют формулы для расчёта заряда, изоэлектрической точки, среднего размера агрегатов и других величин, полученные для случая равновесия. Принципиальная нестационарность и негомогенность интерфейса нано–био обусловливается сложной структурой белково-углеводно-липидного матрикса мембраны и постоянно меняющимся из-за клеточной секреции и потоков тканевых жидкостей составом окружающей среды. Эти изменения могут повлечь модификацию свойств поверхности наночастицы, а наночастица, в свою очередь, может повлиять на химический состав среды, частично растворяясь в ней или катализируя различные окислительные процессы и генерацию активных форм кислорода (АФК) (см. рис. 1).
При захвате наночастицы внутрь клетки, она встречается со всё новыми и новыми интерфейсами — уже внутриклеточными. Детальная характеризация процессов и действующих сил на этих границах разделов может стать — и уже становится — основой новых высокоточных методов биологических исследований.
Силы, формирующие интерфейс нано–био
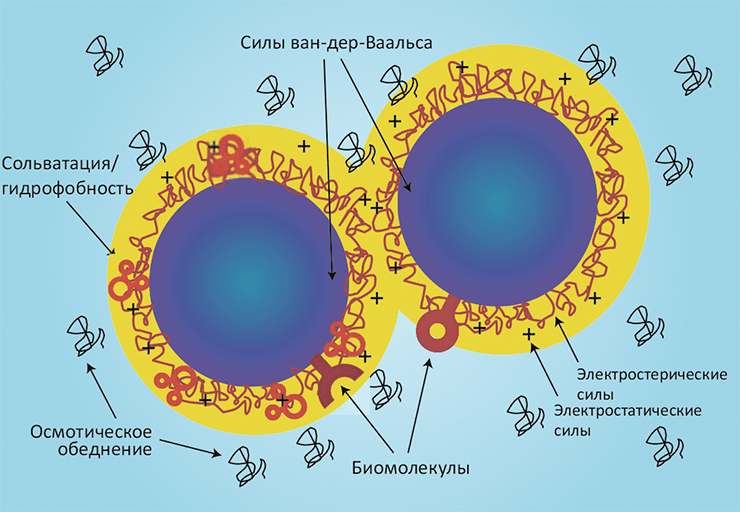
На первый взгляд может показаться, что в случае наночастиц в биологической системе действуют все те же силы, что и в классических задачах коллоидной химии. Действительно, тут работают и силы ван-дер-Ваальса, и электростатика, и влияние растворителя, и гидрофобный эффект. Однако требуется существенная корректировка предпосылок с учётом наноскопического масштаба происходящего и наличия в системе биологических объектов. Особенность наносистем заключается в том, что они содержат сравнительно небольшое число атомов, и характер взаимодействия между частицами будет существенно зависеть от их взаимной ориентации и диэлектрической проницаемости (рис. 2). Чтобы подчеркнуть био особенности интерфейса нано–био, можно сравнить силы, связывающие две взаимодействующие наночастицы SiO2, и силы между такой же частицей SiO2 и живой клеткой (например, фибробластом).
Рисунок 2. Взаимодействия между наночастицами. При суспендировании наночастиц в биологических жидкостях и столкновении с биологическими объектами в ход идут как «обычные» коллоидные силы (такие как электростатика и силы ван-дер-Ваальса), так и другие важные взаимодействия: эффект растворителя (сольватация), гидрофобный эффект и осмотическое обеднение среды при участии неадсорбирующихся молекул. Взаимодействие «простых» коллоидных частиц изучает теория ДЛФО (название происходит от фамилий Дерягина, Ландау, Фервея и Овербека).
Две неорганические наночастицы SiO2 в растворе притягиваются под действием сил ван-дер-Ваальса и расталкиваются электростатическим взаимодействием, поскольку поверхности обеих частиц в растворе ионизуются и получают отрицательный заряд. (В биологических жидкостях, имеющих ионную силу порядка 150 мМ, электростатические взаимодействия могут быть экранированы за счёт диэлектрической проницаемости.) Существенную роль играют также сольватационный и гидрофобный эффекты. Эти явления довольно хорошо изучены в коллоидной теории ДЛФО (см. рис. 2, табл. 1).
В случае взаимодействия с фибробластом действующие силы остаются в принципе те же, только существенно меняется конфигурация системы. Прежде всего, мембрана может деформироваться и постоянно меняет форму, что сразу уводит нас очень далеко от решения задачи из учебника. Дополнительную сложность привносит «лоскутная» гетерогенная организация мембраны, в которой и белки, и липиды образуют «островки» (рафты). Ну и, конечно, самое главное отличие — что клетки не являются пассивным объектом из учебной задачи: они постоянно транспортируют ионы, секретируют белки, меняют форму, — словом, образуют с наночастицей динамический интерфейс. Окончательно отказаться от попытки теоретически моделировать эти процессы заставляет возможность эндоцитоза — «захвата» наночастицы внутрь клетки.
| Сила | Природа возникновения | Дальность (нм) | Вклад в структуру интерфейса |
|---|---|---|---|
| Гидродинамические силы | Конвекционные потоки, деформация и броуновская диффузия в наноскопических интерфейсах часто затруднены или, наоборот, усилены | 10 2 –10 6 | Увеличение частоты столкновений между частицами |
| Электродинамические взаимодействия | Ван-дер-Ваальсовы силы между взаимодействующими частицами и средой | 1–100 | В водных растворах всегда обусловливают притяжение; в биологической среде сила взаимодействия уменьшена |
| Электростатические взаимодействия | Заряженные поверхности притягивают противоионы и отталкивают ионы того же заряда, формируя двойной электростатический слой | 1–100 | Перекрывающиеся двойные слои в большинстве случаев расталкиваются, поскольку поверхности большинства материалов в растворе ионизуются отрицательно; в случае противоположных зарядов возможно притяжение |
| Эффекты растворителя и гидрофобный эффект | Гидрофильные материалы выгодно взаимодействуют с растворителем | 1–10 | Гидрофильные материалы стабильны в растворе и не агрегируют |
| Гидрофобные материалы «стараются» экранироваться от растворителя | Гидрофобные материалы спонтанно выпадают из раствора, образуя нерастворимые агрегаты, оседающие на интерфейсе | ||
| Пространственные (стерические) взаимодействия | Полимеры, адсорбировавшиеся на поверхности неорганических наночастиц или биополимерной оболочке клетки, «расталкиваются» с другими интерфейсами | 1–100 | В целом увеличивают стабильность частиц, но возможны эффекты типа эндоцитоза, особенно в случае «укрывания» водорастворимым полимером |
| Полимерные мостики | Полимеры с заряженными группами, адсорбировавшиеся на поверхности неорганических наночастиц или биополимерной оболочке клетки, могут притягиваться к участкам противоположно заряженных поверхностей | 1–100 | В целом увеличивают агрегацию, особенно при наличии в полимере карбоксильных групп, а в растворе — ионов кальция |
В итоге мы имеем дело с практически бесконечным числом разновидностей «интерфейсов» между наночастицами и биологическими объектами, поскольку наночастицы отличаются и геометрическими параметрами, и физико-химическими, и кристаллическими свойствами. (Последние, кстати, тоже очень интересны, поскольку могут придавать материалам необычные фотонные, электронные, полупроводниковые или каталитические свойства.) Изучить в отдельности для каждого типа частиц особенности взаимодействия с биологическими системами совершенно невозможно, так что более глубокое понимание механизмов этих взаимодействий необходимо для успешного дизайна наноматериалов будущего.
Белковая «корона»
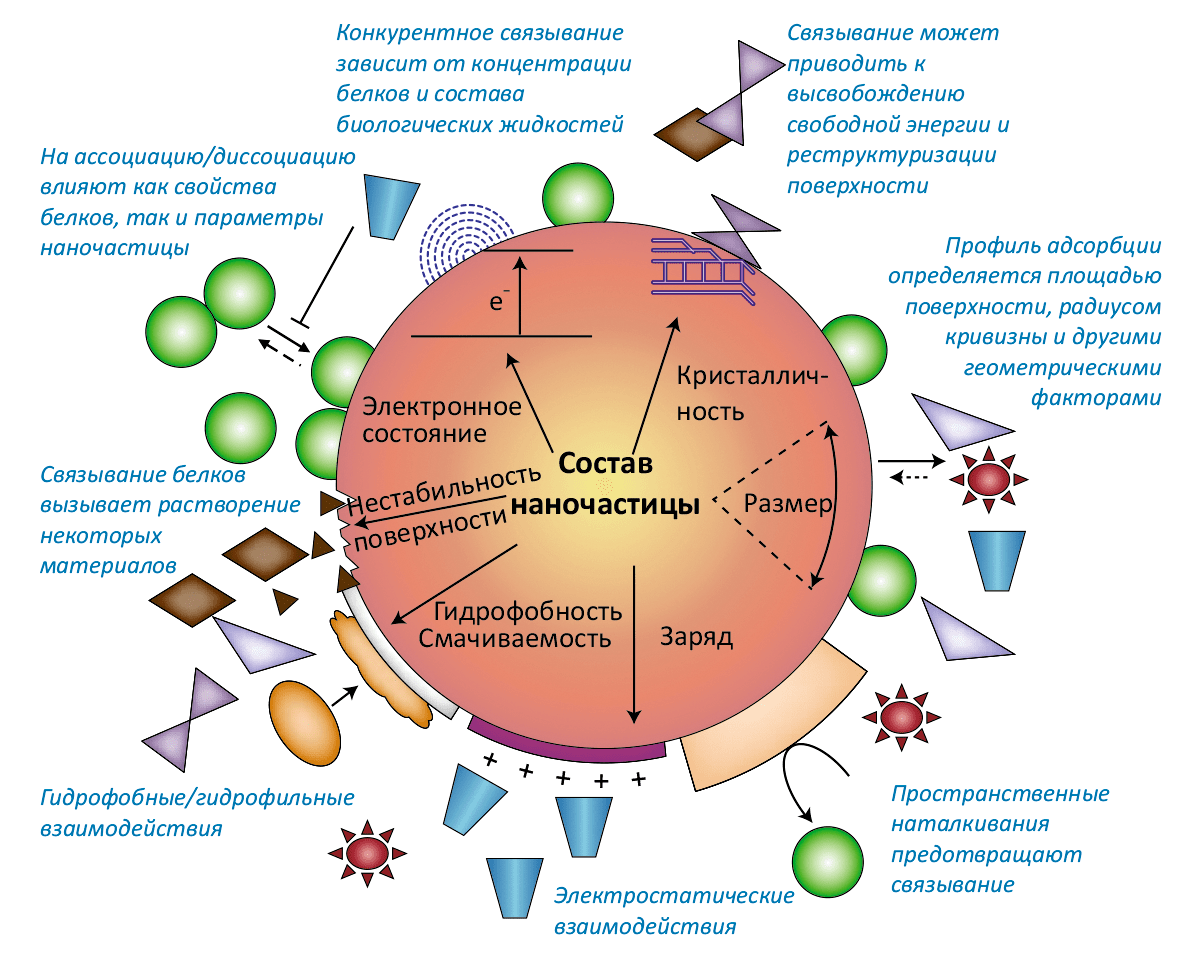
Ещё одной важной особенностью биологического окружения является то, что наночастицы, попав в кровь, лимфу, желудочный сок или любую другую биологическую жидкость, покрываются своего рода «короной» — слоем белков, всё время находящихся в растворе и адсорбирующихся на поверхности частицы. Как следствие взаимного влияния, и свойства частиц меняются под действием «короны», и сами белки, с которыми частица вступает в контакт, могут подвергаться модификациям (рис. 3).
Рисунок 3а. Взаимное влияние белковой «короны» и наночастицы. Белковая «корона» — первый из интерфейсов нано–био, в котором участвует наночастица, попавшая в организм. Хотя «корона» определяет дальнейшую «судьбу» наночастицы, но и сами белки модифицируются при контакте с частицей. Динамический состав «короны» зависит от констант ассоциации/диссоциации, процессов конкурентного связывания, стерических факторов, влияющих на адсорбцию, и состава биологической жидкости, в которой находится наночастица. Разноцветные фигурки обозначают разные типы белков: заряженные, гидрофобные, конформационно лабильные, каталитически активные с окисляемыми тиольными группами и образующие фибриллы.
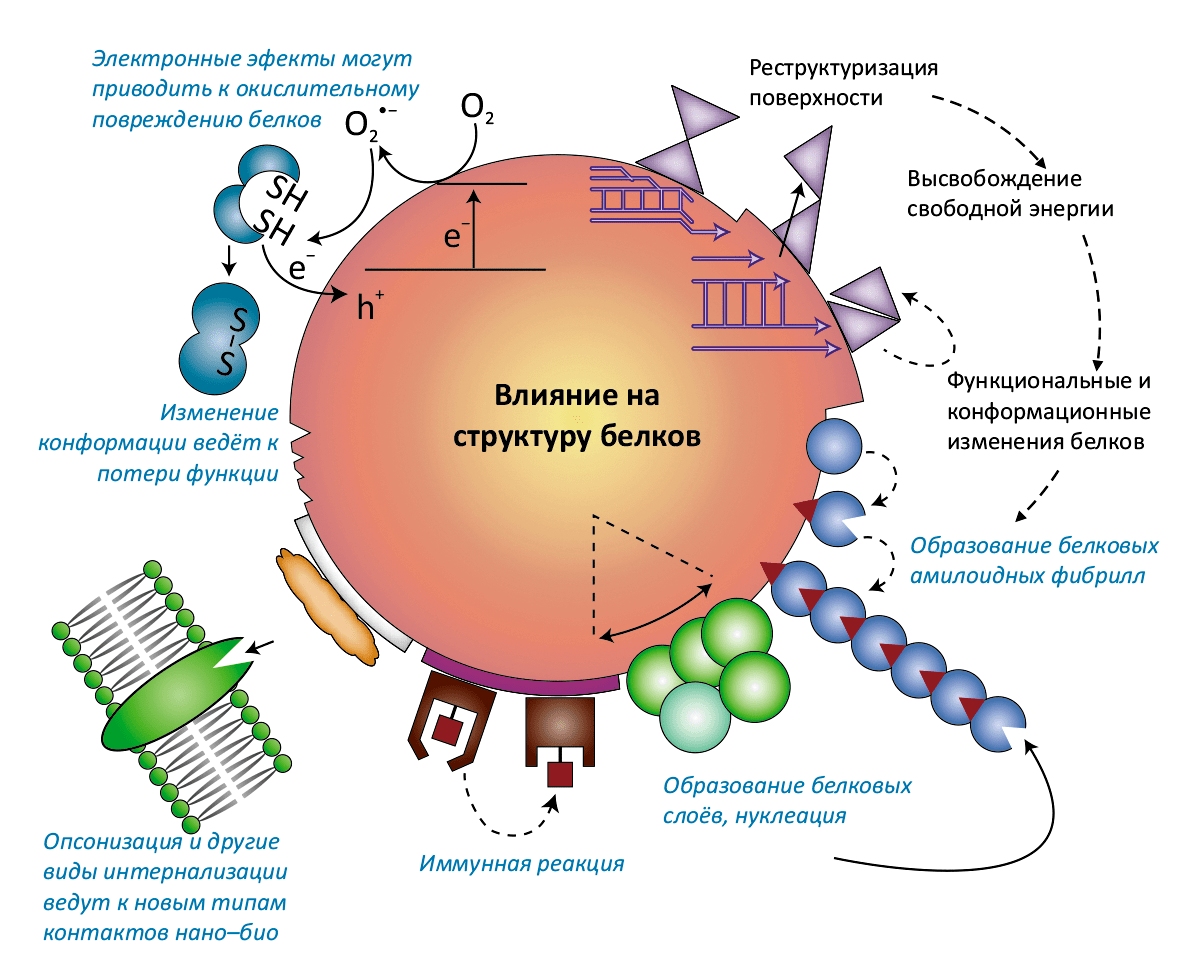
Рисунок 3б. Взаимное влияние белковой «короны» и наночастицы. Варианты модификации структуры и функций белков, вызываемые взаимодействием с наночастицами. В некоторых случаях такие взаимодействия изменяют конформацию белкá, — например, лизоцим из куриного яйца «теряет» α-спираль, необходимую для его каталитической активности. Разноцветные фигурки обозначают разные типы белков: заряженные, гидрофобные, конформационно лабильные, каталитически активные с окисляемыми тиольными группами и образующие фибриллы.
Отдельно следует заметить, что процесс формирования «короны» зависит от «предыстории» частицы, поскольку она уже может содержать адсорбированные молекулы — будь то остатки от производственного процесса, атмосферные газы, промышленные стабилизаторы эмульсий / дисперсий или вещества из состава буферов, используемых для приготовления растворов наночастиц. Контакт частиц с белкáми короны является первым типом интерфейса нано–био на длительном пути наночастицы внутри живого организма.
Основные белки, образующие «корону» наночастиц — например, нанотрубок, частиц диоксида железа, липосом и наногранул полимеров — это альбумин, иммуноглобулины, факторы комплемента, фибриноген и аполипопротеины. Укрывание наночастиц этими белкáми во многом определяет их дальнейшую судьбу — распределение между тканями и органами, скорость выведения из организма, опсонизацию (фагоцитоз с участием рецепторов мембраны).
Белки и другие органические вещества увеличивают растворимость наночастиц (например, ZnO, CdSe, оксидов железа и алюминия), но и наночастицы могут влиять на белковые молекулы, заставляя их агрегировать, окисляя боковые группы, снижая ферментативную активность или изменяя их конформацию. Это обстоятельство уже вызывает определённые опасения — ведь то, что в лабораторном эксперименте наночастицы оксида церия вызывают образование фибрилл микроглобулина β2, может означать, что в определённых условиях возможен аналогичный процесс и в организме человека, — например, в мозгу это приведёт к развитию болезни Альцгеймера. (На настоящий момент, впрочем, нет ни одного свидетельства, что наночастицы как-то участвуют в развитии нейродегенеративных заболеваний.)
Захват наночастиц биомембранами
Контакт наночастиц с биологическими мембранами нередко заканчивается захватыванием первых внутрь клетки с помощью ряда механизмов — рецептор-опосредованных или не связанных с рецепторами. (Кстати, этот феномен обещает большие перспективы для направленного транспорта лекарств [4].) Захват («обволакивание» мембраной) требует образования как специфических, так и неспецифических взаимодействий с мембраной, и является результатом динамического противостояния механизмов захвата частицы и процессов, препятствующим этому. Модификация поверхности частицы особыми лигандами, стимулирующими рецептор-опосредованный эндоцитоз [5], — пример такого механизма (рис. 4).
Рисунок 4. Захват наночастицы мембраной клетки. Для осуществления захвата должны образоваться специфические (лиганд–рецептор) и неспецифические (гидрофобные, кулоновы) взаимодействия. Высвобождающаяся при этом свободная энергия служит для «противоборства» силам, препятствующим захвату частицы:
Проникновение внутрь клетки возможно и без участия рецептора: например, наночастицы, модифицированные определёнными амфифильными группами, могут сами проникать через мембрану, нисколько её при этом не повреждая. Схожий механизм используют и амфифильные пептиды-переносчики или поликатионные полимеры, которые могут использоваться для направленной доставки частиц в клетку.
Существует минимальный радиус частицы, при котором она может быть захвачена внутрь клетки, и «оптимальный» радиус, при котором захват происходит с максимальной эффективностью. Для сферических и цилиндрических частиц такие оптимальные размеры равны 15 и 30 нм, соответственно, но для наночастиц, «укрытых» слоем трансферрина, этот радиус составляет
50 нм. (Трансферрин активно используется для доставки соединений с плохой фармакокинетикой [5].)
С точки зрения чистой термодинамики среди частиц одного объёма легче всего должны захватываться сферы, но на практике во многих случаях оказывается, что другие формы — как, например, цилиндрические частицы гидрогеля полиэтиленгликоля — захватываются с большей скоростью. Однако макрофаги, старающиеся «проглотить» все чужеродные частицы при помощи фагоцитоза, наоборот, часто упускают длинные цилиндрические образования из виду: наверное, поскольку такая форма не встречалась до эры искусственных наночастиц, «тканевые стражи» оказываются сбитыми с толку.
Учитывая, с одной стороны, бóльшую эффективность захвата внутрь клетки, а с другой — меньшую вероятность фагоцитоза, оказывается, что для направленной доставки в клетку лучше всего подходят не сферические, а именно цилиндрические (или дискообразные) частицы, которые лучше ещё тем, что проще проходят через просвет капилляров.
Углеродные нанотрубки также обладают цилиндрической формой. Если говорить о достаточно длинных (>20 μм) и жёстких (многослойных) нанотрубках, то их присутствие в ткани как раз вызывает «сбои» в поведении макрофагов. Эти клетки оказываются неспособными «проглотить» такую большую частицу и лишь выбрасывают в среду токсичные формы кислорода (АФК) и гидролитические ферменты, вызывая хроническое воспаление. И хотя для нанотрубок пока не существует однозначных доказательств, в принципе они могут вызывать развитие мезотелиомы, поскольку асбестовая пыль приводит к этому типу опухоли по весьма схожему механизму. В таблице 2 приведены данные по возможным механизмам токсичности разных типов наночастиц, а также область их использования — если удастся токсичность преодолеть.
Наночастицы внутри клетки: в процессе эндоцитоза
Пути и взаимодействия наночастиц после того, как они попадут внутрь клетки, изучены пока довольно слабо, хотя это и представляет огромный интерес в смысле направленной доставки лекарств в клетку [4]. Не очень понятно и как клетка выбирает конкретный путь захвата: это может быть фагоцитоз, пиноцитоз, рецептор-опосредованный или кавеолин-опосредованный эндоцитоз, причём этот выбор зависит как от клетки, так и от параметров частицы.
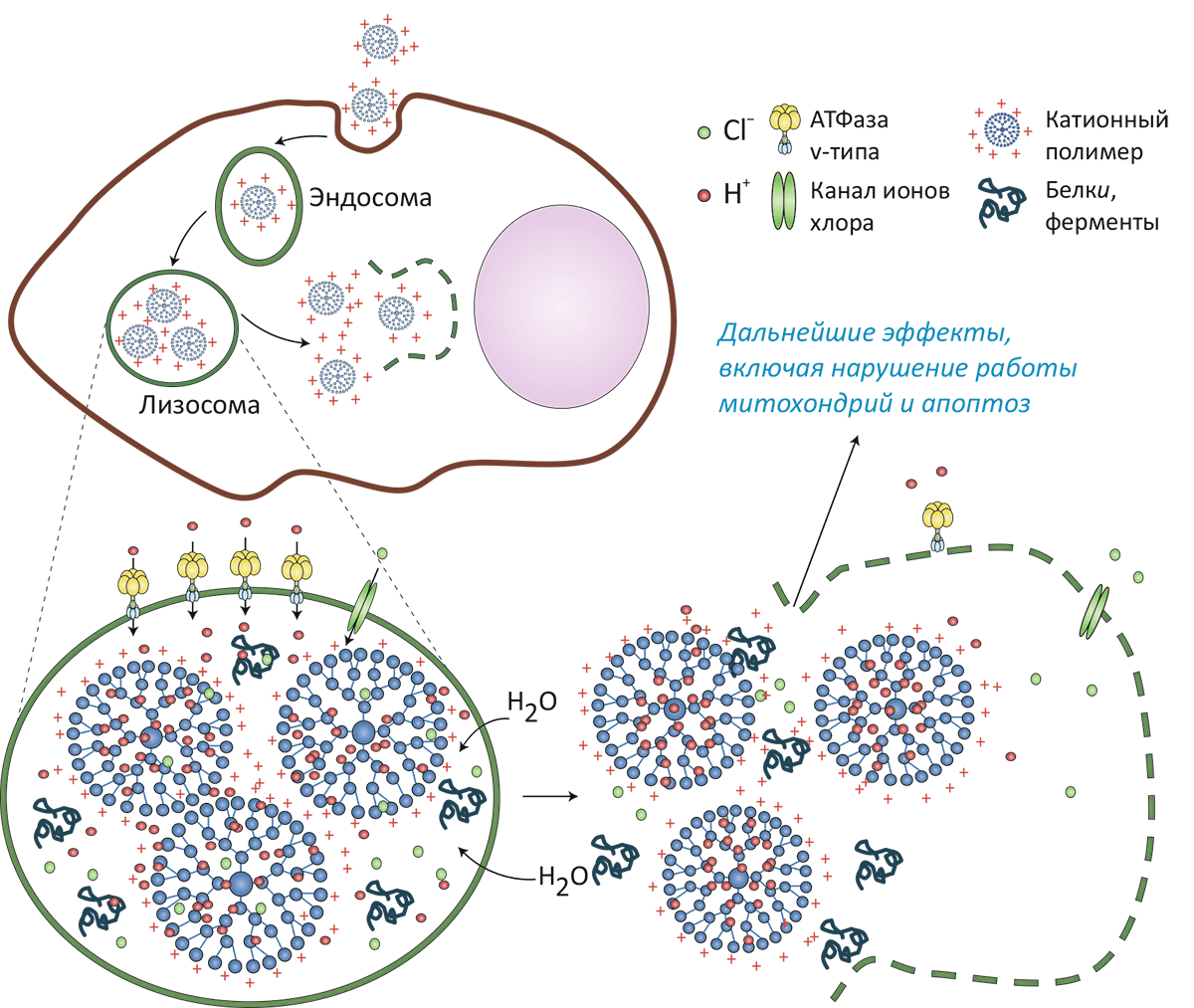
Рисунок 5. Схема механизма «протонной губки», приводящего к разрушению лизосом и лежащему в основе цитотоксичности некоторых наночастиц. Катионные частицы (например, полиэтиленимин или дендримеры) связываются с липидными головками мембраны и захватываются внутрь клетки путём эндоцитоза. Попав в кислое окружение вторичной лизосомы, ненасыщенные аминогруппы присоединяют протоны, закачиваемые внутрь этой органеллы АТФазами v-типа. (На один протон в лизосому попадают также один ион хлора и одна молекула воды.) В результате лизосома «набухает» и, в конечном счёте, лопается, изливая своё содержимое в цитоплазму.
Эффект наночастиц на организм в целом
Наноматериалы, благодаря своим уникальным свойствам (и не в последнюю очередь интерфейсу нано–био), имеют широчайшие перспективы применения в биологии и медицине:
Первостепенное значение на настоящий момент имеют системы направленной доставки лекарств, созданные на основе нанотехнологий — на них приходится около ¾ всех выпущенных на рынок продуктов [6]. Это обстоятельство объясняется тем, что доставка — это, хотя и сложный, но далеко не единственный момент в молекулярной медицине. Куда сложнее разработать активное вещество, которое излечило бы болезнь, будучи доставлено по адресу. (Область разработки лекарственных веществ, называемую драг-дизайном [7], формально тоже можно отнести к наномедицине и нанотехнологиям — ведь такие разработки ведутся с учётом структуры белка-мишени и действующего вещества на атомном, то есть на «нано» уровне.) Сами лекарственные вещества, применяемые на настоящее время, в большинстве случаев были разработаны ещё десятилетия назад, но усовершенствованные системы доставки дают им «второе дыхание».
Однако полноценно эксплуатировать преимущества, которые сулит применение нанотехнологий в медицине, можно только адекватно оценив связанные с наноматериалами опасности и приняв соответствующие меры по защите. Свойства барьера нано–био непосредственно определяют биосовместимость наноматериала в целом — то есть, будет ли он токсичным, какой способ введения наночастиц в организм (например, с диагностической или терапевтической целью) будет наиболее эффективным, насколько активно частицы будут выводиться из организма.
Интересно отметить, что наноматериалы — в частности, знаменитые углеродные нанотрубки, — ведут себя подобно двуликому Янусу — уникальные терапевтические и диагностические свойства (см. табл. 2) сочетаются с токсическим эффектом, оказываемым на лёгкие.
В повреждении лёгких виноваты нанотрубки и дендримеры
При слежении за «судьбой» меченных частицами золота однослойных углеродных нанотрубок после вдыхания их аэрозоля оказывается, что альвеолярные макрофаги реагируют на них по-разному в зависимости от свойств поверхности. «Сухие» нанотрубки оставались практически незамеченными и мигрировали за стенку альвеол, где, взаимодействуя с фибробластами, стимулировали выработку коллагена (что приводит к фиброзу лёгочной ткани). Но если принимать суспензию нанотрубок в 10–15% растворе альбумина, макрофаги начинают идентифицировать их как инородные объекты и захватывают внутрь себя.
Реакция организма на наночастицы сильно зависит от их размера: на примере TiO2 продемонстрировано, что частицы более мелкого «помола» вызывают значительно более сильное воспаление лёгочной ткани и имеют бóльшую токсичность, чем та же масса более крупных частиц. Оказалось, что всё дело в поверхности: одинаковой токсичностью обладают образцы с равной общей площадью поверхности, а не с равной массой. (Зависимость получается настолько сильная, что площадь поверхности даже можно использовать в качестве меры токсичности.)
Ещё один тип наночастиц, которые могут быть токсичными при накоплении в лёгких, — это сверхразветвлённые полимеры (дендримеры), в частности — дендример полиамидоамина (PAMAM). (Оказывается, что лёгкие — это одно из основных мест накопления наночастиц в организме.) Дендримеры уже довольно активно применяются для доставки лекарств в клетку, переноса генов в задачах генной терапии и в других областях. Среди их преимуществ можно назвать точно контролируемые размеры и форму частиц, что связано с особенностями их получения: дендримеры синтезируются «по слоям» и напоминают дерево, «корень» которого находится в центре сферической частицы, а «крона» покрывает всю поверхность. В зависимости от числа таких «слоёв» говорят о «генерации» (G) конкретного дендримера, имея в виду число стадий синтеза и размер результирующих частиц. Дендримеры PAMAM генераций G7–G10 имеют схожий размер с гистонами, из-за чего они хорошо связывают ДНК, — и это обусловливает их способность работать в качестве переносчика генов.
Поскольку дендримеры накапливаются преимущественно в лёгких, исследования их эффекта in vitro проводили на культуре клеток аденокарциномы лёгких A549. Токсический эффект обнаружен только на катионных дендримерах, — в частности, на дендримере PAMAM G3 [9]. Исследование механизма токсичности показало, что дендример запускает программу гибели клетки, но это, против ожиданий, оказался не апоптоз, а аутофагия, активируемая в сигнальном пути Akt–TSC2–mTOR. В то время как основным диагностическим признаком апоптоза является «нарезание» генома клетки на части (чего в этом случае не наблюдалось), при аутофагии характерно образование специальных органелл с двойной мембраной — аутофагосом, в которых клетка фактически «переваривает» себя по частям. То, что это именно аутофагия, было подтверждено использованием 3-метиладенина (3-МА) — ингибитора этого варианта «самоубийства» клетки, — как in vitro, так и in vivo: мыши, получавшие 3-МА на фоне приёма PAMAM G3, меньше страдали от токсического действия дендримера.
К сожалению, 3-МА нестабилен в организме человека и не может использоваться для снижения токсичности наночастиц; однако наверняка будут открыты и другие ингибиторы, применение которых сделает использование наночастиц в медицине более безопасным, — главное, механизм токсичности (по крайней мере, один из них) уже стал известен. «Наше открытие является перспективной отправной точкой для снижения побочных эффектов от использования наноматериалов в лечении людей. Наномедицина обещает невероятные возможности в лечении таких сложнейших заболеваний, как рак и вирусные инфекции, однако вопрос безопасности встаёт тут как никогда остро», — говорит автор исследования по PAMAM G3 Ченгу Жанг (Chengyu Jiang) [10].
Не только вред: антимикробные наночастицы на основе катионных пептидов
Есть у наночастиц и положительные стороны. Учёные из сингапурского Института биоинженерии и нанотехнологий разработали самособирающиеся наночастицы на основе катионных антимикробных пептидов (АМП), которые более активны и менее токсичны, чем «обычные» АМП (а они уже давно привлекают внимание как альтернатива традиционным антибиотикам [11], утратившим свой ореол из-за выработки микроорганизмами резистентности).
Катионные (положительно заряженные в растворе) антимикробные пептиды интересуют учёных всё больше из-за их способности действовать сразу на множество микроорганизмов и уничтожать даже те из них, которые выработали устойчивость против большинства современных антибиотиков. В основе их действия лежат главным образом неспецифические взаимодействия с отрицательно заряженной клеточной стенкой бактерий и разрушение мембраны, за которым следует лизис и гибель микроорганизма.
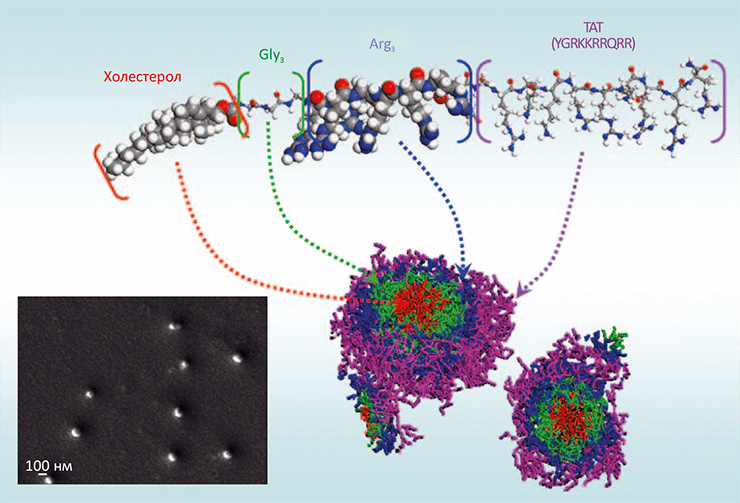
Сингапурские учёные взяли за основу пептид TAT (последовательность YGRKKRRQRRR) — минимальный фрагмент белкá TAT ВИЧ-1, способный проникать через мембрану, — и оптимизировали его, добавив «для верности» ещё шесть положительно заряженных остатков аргинина и — через глициновый «линкер» — молекулу холестерола, предназначенного для формирования гидрофобного «ядра» наночастицы (рис. 6) [12]. Для пептида TAT известны его свойства доставлять через мембрану белки, киРНК, липосомы, мицеллы и квантовые точки, и исследователи решили, что в составе наночастицы, где концентрация положительного заряда будет выше, и эффект будет сильнее.
Испытания новых наночастиц на ряде микроорганизмов — бактерий (в том числе, устойчивых к антибиотикам), грибов и дрожжей — показали высокую активность (минимальная ингибирующая концентрация
10 μМ) и, что самое главное, не обнаружили вредных побочных эффектов: гемолиз практически отсутствовал, равно как и токсическое действие наночастиц на почки и печень (проверено на животных). Под электронным микроскопом в мембранах убитых бактерий видны многочисленные поры, образованные наночастицами, что, видимо, привело к обнажению протопласта и лизису микроорганизмов.
Рисунок 6. Структура пептида, образующего наночастицы с антимикробными свойствами. Показана схема образования мицеллы пептида составом Хол–G3–R6–TAT, в которой холестерол (Хол) образует гидрофобное ядро, а положительно заряженные в растворе остатки устилают поверхность наночастицы. На врезке — сканирующая электронная микрофотография, позволяющая оценить размер образующихся наночастиц (≈100–150 нм).
Лечебное действие пептидных наночастиц проверили и на живых организмах: подопытным мышам вводили в мозг минимальную летальную дозу золотистого стафилококка (Staphylococcus aureus), вызывающего острое воспаление мозга — менингит — и 100%-гибель в течение 48 часов при отсутствии лечения. Однако одновременное введение этих наночастиц (и ещё одно — через сутки) позволило сохранить жизнь многим животным. Высокий терапевтический индекс (отношение летальной концентрации (LD50) к терапевтической концентрации (ED50), равное в этом случае 50) объясняется ещё и тем, что наночастицы с лёгкостью преодолевают гематоэнцефалический барьер — что недоступно «обычным» антибиотикам, — и борются с инфекцией уже «на местах» (это было подтверждено на препаратах мозговой ткани подопытных кроликов).
Сконструированные сингапурцами наночастицы являются весьма перспективным средством лечения различных инфекционных заболеваний, причём это касается не только менингита. (Кстати, «выигрывают» от разработки таких препаратов и пациенты со СПИДом, ведь одной из главных причин смертности в этом случае является контаминация ослабленного организма грибковой инфекцией.) «Полученный нами олигопептид — уникальное вещество, которое само образует наночастицы, способные проникать через мембраны, — говорит И-Ян Янг (Yi-Yan Yang), руководитель этого исследования и заведующий лабораторией в институте, финансируемом сингапурским агентством по науке A*Star. — Эти наночастицы с лёгкостью „пробивают“ мембраны бактерий, дрожжей и грибов и дестабилизируют и убивают клетки» [13].
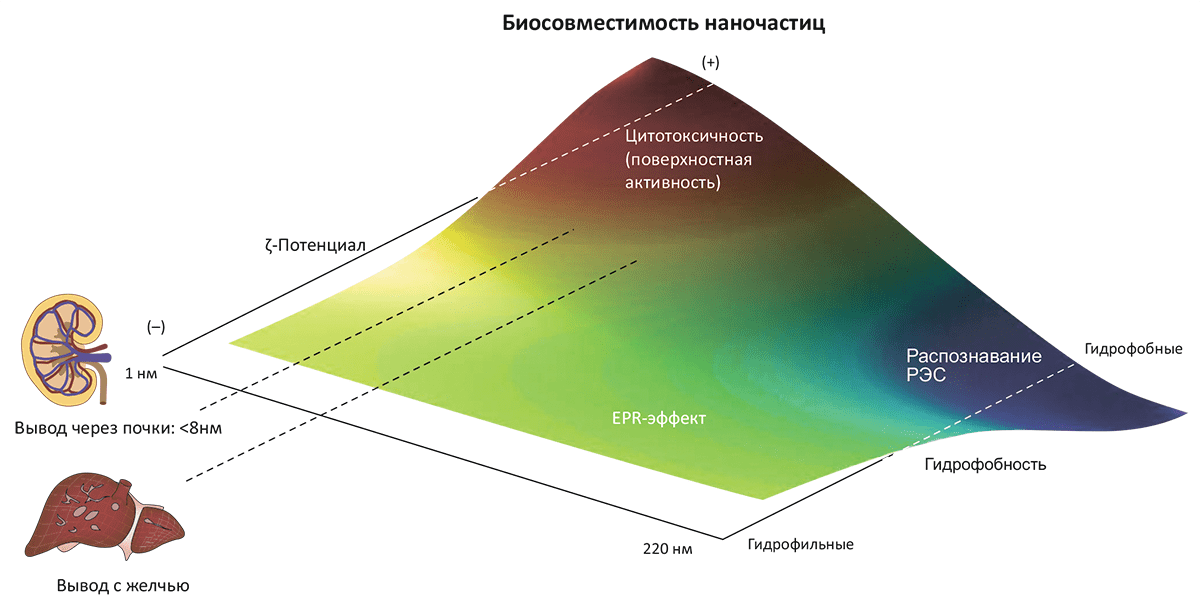
Как видим, наночастицы несут и угрозы (правда, не такие уж леденящие, как пресловутая «серая слизь»), и преимущества. Если попытаться резюмировать вопрос о биосовместимости наночастиц, то оказывается, что самыми главными параметрами, позволяющими оценить токсичность, являются размер наночастиц, их гидрофобность и электрокинетический потенциал (ζ-потенциал) частицы в растворе (рис. 7). (Это выявилось в процессе анализа биосовместимости более 130 различных типов наночастиц.)
Рисунок 7. Биосовместимость наночастиц в зависимости от их физических характеристик. Эта качественная картина получена на основе анализа >130 видов наночастиц, используемых в терапевтических целях. Основные параметры, определяющие биосовместимость (изображённую цветовым спектром) — размер, ζ-потенциал в растворе и гидрофобность. Так, катионные частицы небольшого размера и с высокой реакционной способностью поверхности почти всегда оказываются токсичными — по сравнению с более крупными гидрофобными частицами, которые довольно быстро и безопасно выводятся из организма при участии ретикулоэндотелиальной системы (РЭС). Частицы, избегающие немедленного вывода почками или печенью, обладают средними размерами и нейтральным поверхностным зарядом; они имеют тенденцию аккумулироваться в опухолевой ткани из-за эффекта повышенной проницаемости и удерживания (EPR-эффекта). Именно это свойство делает их оптимальными агентами для терапии онкологических заболеваний.
Гидрофобные частицы имеют очень небольшое время жизни в кровотоке, поскольку они оперативно выводятся из организма печенью и селезёнкой. Размер наночастиц также является определяющим фактором в этом вопросе: частицы размером менее 8 нм выводятся почками, в то время как печень «специализируется» на более крупных образованиях — она удаляет из кровяного русла любые частицы диаметром >200 нм. (Правда, вывод с желчью ограничен размером желчных протоков (30 нм), и более крупные частицы «дожидаются своей очереди», пока не раздробятся до приемлемого размера.) Частицы же промежуточного диаметра (от 30–40 до 200 нм) могут пассивно аккумулироваться, причём в опухолевых очагах (!), — по механизму, известному как увеличенная проницаемость и удерживание (EPR, enhanced permeation and retention). Происходит это из-за повышенного кровоснабжения и пониженного лимфатического дренажа в опухоли.
Что касается поверхностного заряда частиц, то катионные (положительно заряженные) частицы в большинстве случаев токсичны и вызывают гемолиз и агрегацию эритроцитов. (Однако если вспомнить предыдущий пример с антимикробными катионными частицами, станет понятно, что зависимость не абсолютная.)
Безопасные наноматериалы будущего
Уже сегодня, по данным промышленной аналитики, на рынке >800 продуктов, при изготовлении которых использовались нанотехнологии. (Если бы эта аналитика охватывала и российский «рынок», то цифра, скорее всего, возросла бы на порядок.;-) Очевидно, что в ближайшем будущем эта тенденция не только сохранится, но и усилится — и не в последнюю очередь за счёт нанобиотехнологий. Чтобы избежать потенциальных опасностей со стороны «нанолекарств» и наноматериалов, необходимо иметь полные сведения о структуре интерфейсов «нано–био», в которых принимают участие наночастицы, оказавшись внутри живого организма. Видимо, эти знания станут хрестоматийными для первого поколения «наноучёных», которые обеспечат человечество неслыханными — в хорошем смысле — наноматериалами. Главное, чтобы не получилась ненароком «серая слизь».
Первоначально адаптированная версия этой статьи была опубликована в №1 журнала «Косметика и медицина»’2010.