Нарушение дифференцировки лимфоузла что это
Нарушение дифференцировки лимфоузла что это
Лимфатическую систему изучают по локализации или топографоана-томической принадлежности пораженных лимфатических узлов, их размерам, форме, структуре (однородная, неоднородная), расширению лимфатических стволов, сосудов.
Критерием поражения одного узла какой-либо одной группы считают увеличение его размеров до 15 мм и более. Визуализация одной группы узлов с размерами узлов 10-12 мм также расценивается как поражение. Пораженными считают также узлы диаметром 8-10 мм, выявленные в нескольких анатомических областях.
По форме поражения лимфатических узлов выделяют:
1) изолированную форму;
2) образование пакета узлов;
3) формирование конгломерата узлов;
4) лимфоидный инфильтрат.
Изолированной формой поражения являются одиночные увеличенные лимфатические узлы, не связанные между собой.
Группу изолированных лимфатических узлов, тесно соединяющихся между собой, расценивают как пакет. При этом между лимфатическими узлами всегда имеется ткань меньшей плотности.
Конгломератом лимфатических узлов считают объединенные в единое целое узлы с ровными или бугристыми контурами, имеющие, как правило, однородную плотность. Размеры конгломерата различны: от 50 мм до опухоли, охватывающей несколько анатомических групп.
При вовлечении в патологический процесс сальника, перикарда или плевры конгломерат может занимать большую часть брюшной или грудной полости. Главное отличие конгломерата — отсутствие границ между узлами.
Лимфоидный инфильтрат — патологическая ткань с нечеткими краями, расположенная по ходу лимфатических стволов и крупных лимфатических сосудов.
Выделение различных форм поражения лимфатических узлов имеет важное значение для оценки характера их изменений, контроля за динамикой патологического процесса в ходе лечения, поиска диагностических критериев изменения лимфатических узлов при некоторых заболеваниях. Структуру лимфатических узлов оценивают как однородную и неоднородную визуально и по их денситометрическим показателям.
Пакеты и конгломераты, как правило, имеют однородную плотность (35-48 HU). Неоднородная плотность констатируется при распаде узлов (конгломерата, инфильтрата) или при равномерном снижении плотности (24-32 HU). Экстранодальные поражения встречаются у 20% больных лимфомами. Наиболее часто вовлекаются легкие, кишечник, поджелудочная железа, мышцы, сальник, брюшина, надпочечники, перикард, головной и спинной мозг, орбиты.
Характерны нарушения анатомического состояния органов, их смещение лимфоидными образованиями, лимфоидная инфильтрация и увеличение лимфатических узлов окружающих тканей.
К КТ-признакам экстранодальных поражений при лимфомах относятся: очаговые образования, перибронхиальная инфильтрация, увеличение лимфатических узлов средостения, гидроторакс, поражение тканей грудной клетки.
Очаговые образования в легких выявляются в виде множественных субплевральных очагов лимфоидной ткани однородной плотности диаметром около 1 см. Очаги больших размеров неправильной формы встречаются редко.
Перибронхиальная и/или перивазальная инфильтрация наиболее выражена в периферических отделах легких и всегда имеет связь с плеврой. Она же обусловливает гиповентиляцию, иногда приводящую к ателектазам.
Поражения лимфатических узлов при лимфогранулематозе (ЛГМ) и неходжкинских лимфомах (НХЛ) различаются. При ЛГМ поражаются преимущественно ретростернальная, перикардиальная, трахеобронхиальная и бронхопульмональная группы; форма поражения — изолированная, пакет, реже инфильтрат. При НХЛ эти группы поражаются менее чем в 15% случаев; форма поражения изолированная, реже в виде пакета и конгломерата.
В плевральной полости на стороне поражения может определяться гидроторакс, обычно односторонний и незначительно выраженный.
Из субплевральных очагов и образований средостения лимфоидная ткань распространяется на ткани грудной стенки; иногда в процесс вовлекаются органы средостения, плевральная полость, легкие. Это более характерно для НХЛ.
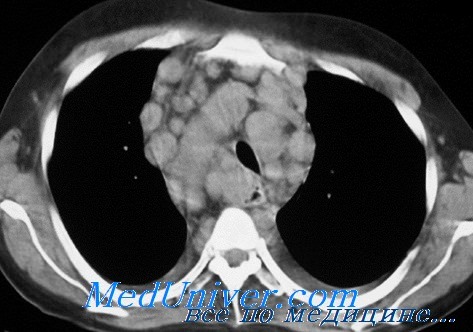
Поражение перикарда определяется в виде утолщения сердечной сумки до 5 мм и более, перикардиальный жир не прослеживается из-за перикардиальной лимфоидной инфильтрации, в полости перикарда имеется небольшое количество жидкости.
Поражение поджелудочной железы, надпочечников и почек может быть узловым и диффузным.
Узловая форма характеризуется увеличением органа, бугристыми краями за счет множественных узлов в ткани органа диаметром от 10 до 35 мм. Контуры при такой форме поражения четкие. Плотность узлов однородная (36-48 HU) и не всегда отличается от интактной ткани. В этом случае для лучшей визуализации применяется усиление. Очаги лимфоидного поражения имеют низкую плотность или незначительное повышение на фоне непораженной ткани.
Диффузное поражение проявляется увеличением органов в размере, нечеткостью контуров, снижением плотности, неоднородной структурой (29-45 HU). Окружающая клетчатка может уплотняться за счет лимфоидной инфильтрации.
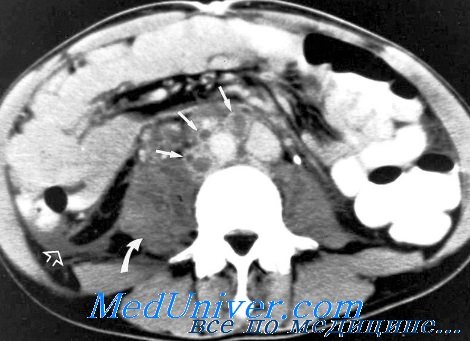
Поражение брюшины и сальника характеризуется утолщением брюшины за счет инфильтрации ее на значительном протяжении. При этом теряется четкость брюшины, не дифференцируются структуры стенки живота и жировой клетчатки.
Сальник имеет вид плотного (36-48 HU) ограниченного образования, прилежащего к брюшине. Границы его местами нечеткие. Лимфатические узлы брыжейки тонкой кишки, брюшной аорты увеличены, а форма их поражения представлена конгломератом, инфильтратом, реже пакетом.
Поражение кишечника чаще встречается в правой половине толстой кишки и характеризуется значительным утолщением стенок (до 5 мм и более) с концентрическим сужением просвета. Наружный контур кишки нечеток в связи с распространением опухолевой ткани за пределы органа, вовлечением окружающей клетчатки и брыжейки. Лимфатические узлы толстой кишки поражаются в форме одиночных узлов, реже в форме пакета.
Предварительная дифференциальная диагностика лимфогранулематоза (ЛГМ) и неходжкиновских лимфом (НХЛ)
| КТ-признаки | Лимфогранулематоз (ЛГМ) (Болезнь Ходжкина) | Неходжкинские лимфомы |
| Возраст | Чаще молодой | Чаще 40-70 лет |
| Стадия | Чаще локализованная | В 85% — генерализованная |
| Частота поражения лимфатических узлов средостения | Более 75% | Менее 25% |
| Частота поражения лимфатических узлов живота: — парааортальные: | Менее 40% | Более 75% |
| — брыжеечные: | Менее 3% | Около 70% |
| Количество групп пораженных лимфатических узлов | 1-2 группы | 3-4 и более |
| Форма поражения лимфатических узлов: — изолированная | Часто, от 6 мм и более | Часто, от 10 мм и более |
| — пакет узлов: | Часто | Часто |
| — конгломерат: | Редко, в средостении | Часто, у 1/3-1/2 |
| — лимфоидный инфильтрат: | Редко | Часто, у 1/3-1/2 |
| Структура лимфатических узлов | Часто однородная | У 1/2 неоднородная с распадом |
| Экстранодальные поражения: — ниже диафрагмы: | Редко | Часто |
| — множественность поражении: | Редко | Часто |
Лимфоидное поражение головного мозга и глазниц встречается крайне редко (1-2%), преимущественно у больных неходжкиновскими лимфомами (НХЛ). Лимфоидное образование головного мозга имеет характерные признаки: неправильную форму, расположение в передних отделах мозолистого тела или глубинных отделах височно-теменных областей. Вокруг опухоли наблюдается значительный отек вещества мозга, который вызывает сдавление рогов боковых желудочков, субарахноидального пространства и борозд.
После усиления лимфоидное образование приобретает более четкие очертания. В центре образования часто отмечается зона распада. В глазницах лимфоидная ткань расположена экстраорбитально, вовлекаются мышцы, слезная железа, иногда происходит разрушение прилежащих костных стенок.
Таким образом, КТ-признаки экстранодальных поражений при лимфогранулематозе (ЛГМ) и НХЛ весьма разнообразны и не имеют специфических черт. Вместе с тем, соблюдение оптимальной методики обследования, сочетание определенных КТ-признаков с учетом распространенности лимфаденопатии и гепатоспленомегалии позволяет проводить предварительную дифференциальную диагностику.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Опухолевые заболевания лимфатических узлов
Лимфомы отличаются друг от друга по клиническим проявлениям, по течению, по ответу на терапию, по тому, как опухолевые клетки выглядят под микроскопом, по молекулярным признакам. Самое главное, что лимфомы лечатся совершенно по-разному. Поэтому слово «лимфома» ни о чем не говорит: это название группы болезней. Чтобы лечить, надо знать конкретный вариант лимфомы.
Исторически лимфомы подразделяются на два главных типа: лимфома Ходжкина и неходжкинские лимфомы.
Раньше было принято говорить лимфогранулематоз (по ведущему признаку, который виден под микроскопом). В 2000-х годах было доказано, что эта болезнь возникает из В-лимфоцитов, для нее характерны крупные и часто многоядерные клетки – клетки Березовского-Рид-Штернберга (по фамилиям ученых впервые их описавших). Поэтому в современной классификации эта болезнь называется лимфома Ходжкина.
Лимфома Ходжкина может развиваться в любом возрасте, но чаще всего ей заболевают молодые люди в возрасте от 15 до 30 лет. Она чаще выявляется у мужчин, чем у женщин и причины этого не ясны. Некоторые считают, что лимфогранулематоз ассоциирован с вирусом Эпштейн-Барра. Подавляющее большинство пациентов с лимфомой Ходжкина сегодня излечиваются с помощью химиотерапии. Лимфогранулематоз отличает строгое распространение процесса от одной группы лимфатических узлов к другой (неходжкенские лимфомы мультицентричны с самых ранних стадий развития).
Неходжкинские лимфомы
Какими симптомами проявляются лимфомы? Чаще всего, это увеличение лимфоузлов. Однако, практически невозможно назвать симптома, которого не бывает у пациентов с лимфомами: эти опухоли могут расти в любом органе и поэтому их клинические проявления очень разнообразны.
Течение неходжкинских лимфом также бывает разным. Некоторые текут длительно, годами и десятилетиями, и даже не требуют лечения. Другие характеризуются более агрессивным течением. По клиническому течению неходжкинские лимфомы подразделяются на три категории: высоко-агрессивные, агрессивные и вялотекущие.
Несмотря на большое разнообразие лимфом, у них есть главный общий признак: все они возникают из клеток иммунной системы и поражают лимфоидные органы. По сути дела, это опухоли из клеток иммунной системы. Клетки иммунной системы постоянно циркулируют по организму. Поэтому возникающие из этих клеток лимфомы обычно уже на момент установления диагноза распространены по организму.
у людей, родственники которых болели или болеют лимфомами;
у людей, страдающих аутоиммунными заболеваниями;
у пациентов, которым когда-то была произведена трансплантация органов (почки, костный мозг);
у лиц, работающих с химикатами (пестициды, различные удобрения, растворители);
у лиц, инфицированных вирусом Эпштейна-Барр, вирусом СПИДа, Т-лимфотропным вирусом человека, вирусом гепатита С и вирусом герпеса 8 типа;
у лиц, инфицированных определенными бактериями, такими как Helicobacter pylori (лимфома желудка)
Таким образом, профессиональная деятельность, инфекция определенными вирусами и бактериями предрасполагает к развитию лимфом. Некоторые вирусы, например, Т-лимфотропный вирус человека, непосредственно вызывает лимфому. Возможно, что большое значение в развитии лимфомы имеет вирус Эпштейн-Бар, который вызывает инфекционный иммунноклеоз. Риск развития лимфом повышен у людей с ослабленной иммунной системой в результате врожденного или приобретенного ее дефекта.
Некоторые ученые говорят, что в развитии лимфом имеют значение факторы экологии. Например, лимфомы чаще выявляются у работников сельскохозяйственной отрасли, у лиц, контактирующих с пестицидами. Возможно, развитие лимфом может провоцироваться фенолом и другими растворителями.
Другие симптомы лимфом:
Лихорадка, которая не объясняется инфекцией или другими причинами и которую не удается устранить с помощью антибиотиков
Потливость, особенно по ночам
Необъяснимая потеря веса
Необычная утомляемость и слабость
Кашель
Кожный зуд
У больных лимфомой Ходжкина часто возникают боли в увеличенных лимфоузлах после приема алкоголя
Симптомы связанные с увеличенными лимфоузлами
У большинства людей имеющих эти неспецифические жалобы лимфомы нет. Распространенные инфекции, ОРЗ, приводят к этим симптомам, но это обычно кратковременно. Серьезные болезни не уходят сами по себе. Поэтому, если у Вас длительное время сохраняются эти неспецифические жалобы, надо обратиться к доктору и пройти обследование.
ОПРЕДЕЛЕНИЕ СТАДИИ ЛИМФОМ
Стадия – это термин, который используется для того, чтобы описать распространенность болезни в организме. Лимфомы обычно подразделяются на четыре стадии: на первой и второй стадии болезнь еще локальна, в то время как третья и четвертая стадии считаются распространенными. Определение стадии предоставляет важную информацию, позволяющую предсказывать прогноз и выбирать вариант лечения. С другой стороны, сам по себе вариант лимфомы может оказаться важнее, чем стадия. При лимфомах прогноз гораздо больше зависит от диагноза, чем от стадии, но людей чаще всего пугают именно стадии.
Стадия I: опухоль обнаруживается только в одной группе лимфоузлов (например, в шейной). Если поражен один нелимфоидный орган (например, желудок), то это считается первой стадией и обозначается буквой E. Стадия устанавливается как I E.
Стадия III: вовлечены группы лимфоузлов по обеим сторонам от диафрагмы.
Буква «Е» говорит о том, что поражен экстранодальный орган (вне лимфатического узла) при локальной стадии.
Точный диагноз сегодня имеет принципиальное значение. Во-первых, потому, что две опухоли, даже очень похожие по клинике и гистологии, могут сильно отличаться по прогнозу. Во-вторых, если раньше, еще 10 лет назад, выбор вариантов лечения, имевщийся в распоряжении докторов, был относительно не велик, то сегодня арсенал способов воздействия на лимфомы значительно расширен.
Лимфомы можно подразделить на 2 большие группы: агрессивные и вялотекущие. Почему одни лимфомы имеют агрессивное, а другие спокойное длительное течение? Это определяется уровнем созревания лимфоцита, из которого возникла опухоль и характером генетических повреждений в нем. Так же как дети в раннем возрасте растут быстрее, чем в подростковом, клетки на разных этапах развития делятся с разной скоростью. Если клетка превращается в опухолевую, она «замораживается» на определенной стадии развития и «наследует» поведение своего нормального аналога: то есть способность быстро или медленно делиться, устойчивость к запрограммированной смерти. Поэтому некоторые лимфомы делятся очень быстро и характеризуются агрессивным течением, а другие почти не делятся, но не могут умереть (нарушен апоптоз). Вялотекущие лимфомы, возникшие из за нарушения апоптоза растут очень медленно, годами и часто не требуют лечения. Бессмертие опухолевых клеток можно представить себе как бесконечную семью, в которой никто не умирает: представьте себе родителей, которые живут бесконечно долго и продолжают рожать детей. Дети вырастают, тоже живут вечно, рожают своих детей и так далее. Таким образом, дом переполнен родителями и детьми. Однако у них не получается хорошо ухаживать за домом, поскольку свои профессиональные качества они утратили.
Информация, которая поступает после биопсии, говорит нам о типе лимфомы и имеет ключевое значение в диагностике. Если результат биопсии не определен, то препарат нужно пересмотреть у другого гистолога, эксперта в области лимфом. Нередко требуется повторная биопсия. Иногда выполняется пункция лимфоузла. При этом после местной анестезии иглу вводят в лимфоузел и насасывают его содержимое. Пунктат лимфоузла выливают на стекло и делают несколько мазков. Пункционная диагностика может применяться для диагностики лимфом у детей. Это связано с тем, что дети болеют преимущественно четырьмя видами лимфом, клетки которых имеют очень характерный вид под микроскопом. У взрослых по пункции лимфоузла также можно диагностировать некоторые болезни. Однако, пункция лимфоузла совершенно не может применяться для диагностики лимфом. Диагноз лимфомы у взрослого человека устанавливается только и исключительно по биопсии. В большинстве случаев у детей также выполняется именно биопсия лимфоузла.
Методы, которые позволяют оценить распространенность болезни.
После установления диагноза лимфомы необходимо определение стадии болезни, то есть выяснение того, какие еще органы вовлечены. Большинство этих исследований абсолютно безболезненны, никаких анестетиков не требуется. Многие из перечисленных ниже исследований могут быть Вам не нужны. Это решается индивидуально врачом.
1. Ультразвуковое исследование
Используется очень часто, назначается всем пациентам. Исследование основано на регистрации отраженных ультразвуковых волн. Оно применяется для того, что бы узнать если увеличенные лимфоузлы в брюшной полости, в средостении, узнать о состоянии органов.
С помощью рентгеновских лучей можно получить картину отражающую состояние грудной клетки и других частей тела. Количество радиации, которое человек получает во время одного рентгеновского исследования, настолько мало, что об этом можно даже и не думать.
3. Компьютерная томография или аксиальная компьютерная томография
При компьютерной томографии также используются рентгеновские лучи. Однако снимки делают под разными углами, как бы вокруг тела. Затем, полученные результаты суммируются в одну общую картину и компьютер показывает детализированный снимок, с каждого »среза» тела. Пациентам с лимфомами часто назначают компьютерную томографию грудной клетки, брюшной полости и таза. Это исследование очень важно, оно показывает увеличенные лимфоузлы, состояние внутренних органов.
4. Магниторезонансная томография
Магниторезонансная томография похожа на компьютерную томографию. Прибор делает множество снимков под разными углами вокруг тела, но вместо рентгеновских лучей он использует магнитное поле. Магниторезонансная томография точнее, чем компьютерная томография. Она позволяет получить более детализированную картину внутренних органов, особенно нервной системы. Не существует более точного способа диагностики очагов в головном и особенно спинном мозге. Она так же важна в диагностике поражений костей. Магниторезонансная томография заказывается, если хотят узнать, есть ли очаги поражения в костях, в головном мозге и в спинном мозге.
5. Радиоизотопное сканирование с галлием
6. Позитронно-эмиссионная томография (ПЭТ)
Позитронно-эмиссионная томография в ведущих зарубежных клиниках практически полностью заместила сканирование с галлием, поскольку эта методика гораздо точнее. Что бы выполнить тест внутривенно вводится дезоксифлюороглюкоза. Многие неходжкинские лимфомы накапливают это вещество. Затем с помощью позитронной камеры производят сканирование всего тела. Как и сканирование с галлием, ПЭТ очень важна в определении ответа на лечение. Если компьютерная томография показывает только размеры лимфоузлов (мы судим об активности на основании размеров), то сканирование с галлием и позитронно-эмиссионная томография показывает активны ли лимфатические узлы, сохраняется ли в них болезнь.
Прогноз – термин, под которым понимается характер течения болезни, вероятность выздоровления. Простых решений почти не бывает, прогноз зависит от многих факторов. Сказать о прогнозе может только лечащий врач.
Кроме диагноза ответ на лечение зависит от множества других факторов. Наибольшее важное значение имеют:
1. Возраст. Пожилые люди обычно хуже переносят лечение. У молодых пациентов меньше осложнений терапии, потому что у них как правило меньше сопутствующих заболеваний. Сопутствующие заболевания приводят к необходимости снижать дозы химиопрепаратов, увеличивать интервалы между введениями, что в итоге приводит к худшим результатам лечения у пожилых пациентов.
2. Предшествующая терапия. Чем больше курсов предшествующей терапии было у пациента, тем менее вероятен успех лечения.
3. Общее состояние. Общее состояние показывает насколько выражено влияние болезни на пациента. У пациентов без так называемых В-симптомов (слабость, похудание, повышение температуры), сохраняющих обычную повседневную активность, результаты лечения лучше.
5. Наличие экстранодальных очагов болезни. Под экстранодальными понимаются очаги болезни вне лимфатических узлов. Если лимфома проникает в другие органы, такие как костный мозг, она хуже поддается лечению.
6. Стадия болезни. Стадии 1 и 2 считаются локальными, в то время как стадии 3 и 4 считаются распространенными или генерализованными. У пациентов с 3 и 4 стадиями болезни в общем виде прогноз хуже.
Нарушение дифференцировки лимфоузла что это
Роль эхографии в дифференциальной диагностике доброкачественных и злокачественных лимфаденопатий.
Аббасова Е.В Пархоменко Р.А. Щербенко О.И.. Родионов М.В.
Лаборатория детской рентгенорадиологии РНЦРР, Москва
Адрес документа для ссылки: h ttp://vestnik.rncrr.ru/vestnik/v4/papers/ abbas_v4. htm
Проблема дифференциальной диагностики лимфаденопатий (ЛАП), в том числе у детей, является весьма актуальной, но она еще далека от разрешения. Актуальность данной темы исследования обусловлена многообразием нозологий, сопровождающихся лимфопролиферативным синдромом, а так же сложностью дифференциальной диагностики доброкачественных и злокачественных ЛАП. Биопсия лимфатического узла (ЛУ) была и остается завершающим этапом дифференциальной диагностики злокачественных и доброкачественных ЛАП, но показания к ее своевременному выполнению не определены и устанавливаются или эмпирически или при развернутой клинической картине заболевания (1, 2, 3, 7, 8).
Вместе с тем, за последнее десятилетие достигнут значительный прогресс в методах визуализации. Среди них ведущим, несомненно, является эхография. Повышение разрешающей способности эхографии в В-режиме позволило визуализировать ранее недоступные исследованию структуры. Так, если в недалеком прошлом удавалось оценить лишь размеры и общую эхогенность ЛУ, то в настоящее время появилась возможность детально исследовать их структуру, состояние ангиоархитектоники и другие, ранее недоступные параметры. [9, 10].
Однако, эхография в В-режиме на сегодняшний день не позволяет уверенно говорить о злокачественности. В связи с этим очевидны усилия по совершенствованию ультразвуковой аппаратуры и поиску новых ультразвуковых признаков, или набора признаков, которые позволили бы повысить показатели специфичности ультразвукового метода и тем самым сузить показания к биопсии ЛУ.
Несмотря на то, что эхография не может поставить гистологического диагноза, на основании ряда эхографических критериев, отображающих структуру ЛУ, определяются дальнейшие диагностические и терапевтические процедуры. Очевидно, что успехи лечения и прогноз заболевания, прежде всего, зависят от раннего выявления и своевременно начатой терапии [6].
На основании вышеизложенного нам представляется актуальным научное исследование по совершенствованию эхографического метода, в том числе определение места и роли новейших ультразвуковых технологий в дифференциальной диагностике лимфопролиферативного синдрома.
Материалы и методы
Общая характеристика наблюдавшихся больных.
Объектом анализа явились результаты комплексного обследования 241 пациента, у которых ультразвуковому исследованию (эхографии) подверглись 907 периферических ЛУ (табл. 1). Исследование проводилось с сентября 2000 года по сентябрь 2004 года. Возраст 174 обследованных пациентов (72 %) был менее 18 лет. Число лиц обоего пола было почти одинаковым: 121 женщина и 120 мужчин.
У 189 человек исследование проводилось в связи с наличием увеличенных ЛУ. В зависимости от окончательного диагноза данная группа была нами поделена на четыре подгруппы (см. также таблицу 1):
а) 109 больных имели реактивную лимфаденопатию неопухолевого генеза;
б) У 47 больных выявлены злокачественные опухоли системы гемопоэза;
в) У 17 человек имелись метастазы солидных новообразований в ЛУ;
г) У 16 человек выявлены различные, редко наблюдавшиеся в нашей практике заболевания.
Контрольная группа из 52 человек была представлена детьми и взрослыми без признаков периферической лимфаденопатии. В эту группу были включены школьники младших классов, обследованных в плане диспансеризации, а также дети и взрослые, обратившиеся за консультативной помощью в детское отделение РНЦ РР по поводу других заболеваний.
Кроме объективного исследования, анализу подвергались данные анамнеза жизни пациентов – такие, как особенности анте- и постнатального периода, в частности, указания на наличие у ребенка внутриутробной инфекции, хронической ЛОР-патологии, частоты и давности ОРВИ и других инфекционных заболеваний, контактов с инфекционными больными, туберкулезной инфицированности.
Таблица 1. Структура исследованных лимфаденопатий.
Болезнь кошачьей царапины
Острый лимфобластный лейкоз
Метастазы злокачественных опухолей
Метастазы солидных опухолей
Метастазы рака молочной железы
Метастазы рака головы и шеи
Общее количество узлов
Морфологическому исследованию было подвергнуто 253 ЛУ из 907 (28 %). Это было осуществлено путем эксцизионной биопсии 101 узлов с гистологическим и иммуногистохимическим (48 случаев) исследованием материала, трепанобиопсии с гистологическим исследованием материала из 4 ЛУ, цитологического исследования материала полученного путем тонкоигольной пункции 152 ЛУ, в том числе под контролем пальпации (83 узла) или под контролем ультразвукового исследования (69 узлов). Природа 651 увеличенных ЛУ у 82 больных устанавливалась на основании данных клинико-эхографического мониторинга, проводимого в сроки от 1 месяца до 1 года после первичного УЗИ, с учетом результатов лечения.
Обследование лимфатических коллекторов области головы и шеи производилось по общепринятой методике. Кроме того, впервые нами был использован дорзальный доступ, когда пациент располагался лежа на животе с максимальным сгибанием головы во фронтальной плоскости. При этом его подбородок максимально соприкасался с грудиной, а лоб упирался в кушетку. Такой способ, по нашим наблюдениям, позволял добиться максимальной фокусировки и улучшению визуализации эхоструктуры верхнешейных ЛУ.
В В-режиме оценивали распространенность поражения ЛУ по регионарным зонам, количество выявленных ЛУ, однотипность изменений эхоструктуры ЛУ. После этого проводился анализ изменений в каждом конкретном видимом эхографически ЛУ. При этом давалась оценка следующих параметров: линейные размеры максимального продольного и поперечного диаметра ЛУ; соотношение продольного и передне-заднего диаметров ЛУ (индекса Solbiati ); форма ЛУ (округлая, овоидная); возможность дифференциации составных частей ЛУ; толщина изображения сердцевины ЛУ (утолщена/истончена/не изменена)- обратно коррелирует с толщиной коры ЛУ; положение изображения сердцевины (обычное/смещено к периферии/деформировано); толщина коры ЛУ (истончена/утолщена/не изменена); общая эхогенность ЛУ (не изменена/снижена/повышена); эхоструктура ЛУ (не изменена/однородная/диффузно-неоднородная/наличие анэхогенных зон); наличие дополнительных гиперэхогенных включений в структуре ЛУ; состояние контуров ЛУ (четкие/нечеткие, ровные/бугристые); состояние окружающих тканей (не изменены/повышенной эхогенности/сниженной эхогенности).
Допплерография (Импульсноволновая допплерография, цветовое допплеровское картирование, энергетическое картирование (ЦД(Э)К) периферических ЛУ.
Для более полного исследования периферических ЛУ в 433 случаях из общего количества ЛУ (907), исследованных в В-режиме (48 %), мы применяли методики ультразвуковой ангиографии – Ц(Э)ДК. Из них в 353 случаях была выполнена импульсноволновая допплерография ( PW ) интранодальных сосудов с артериальным характером кровотока. P И в нашем исследовании проводилась по стандартной схеме исследования магистральных сосудов. В процессе исследования мы использовали линейный датчик с допплеровской частотой 7,5-10 МГц. Для исследования артерий и артериол области ворот использовалась стандартная шкала диапазона скоростей от 0 до 30,5 см/сек. При исследовании приводящих артериальных сосудов наблюдались следующие условия: проводилась корректировка положения датчика и направления допплеровской волны; допплеровский фильтр устанавливался на самые минимальные показатели.
Допплерографические признаки позволили оценить качественные характеристики васкуляризации: наличие или отсутствие интранодального кровотока, тип кровотока, тип интранодальной ангиоархитектоники. На основании обобщения данных литературы мы считаем целесообразным применить следующую классификацию типов сосудистой сети ЛУ по данным Ц(Э)ДК:
1) «хилусный тип», когда нам удалось визуализировать кровеносные сосуды в области ворот (хилуса) в виде единичных артериальных и /или венозных сосудистых фрагментов, без распространения в паренхиму узла и без ветвления;
2) «активированный хилусный тип», когда мы выявляли в той или иной мере хилусные сосуды и сосуды медуллярного слоя в виде «древовидных с ветвлением» венозных и артериальных сосудов (в литературе данный тип нередко обозначается как «центральный»);
3) «периферический тип» сосудистой внутринодальной сети соответствует сосудистым фрагментам локализованным по периферии ЛУ, в области коры ЛУ, преимущественно в подкапсульных отделах;
4) «смешанный кровоток» был представлен богатым кровоснабжением с цветовыми сигналами как в центре, так и по периферии узла. Мы выделили два варианта данного типа кровотока:
4а) в области ворот (хилуса) ЛУ располагается один крупный артериальный сосуд, по периферии единичные точечные цветовые сигналы фрагментов мелких сосудов;
Оценка достоверности различий полученных значений средней «М» и доли «Р» оценивалась с помощью критерия Student : « t » – доверительный коэффициент, уровень вероятности ошибки «р» в работе принят за 0,05, «Р»= 95%. Различия считались статистически достоверными при вероятности безошибочного прогноза р ≤ 0,05. Статистические показатели диагностических свойств параметров – информативность метода при уже определенных диагностических критериях, рассчитывалась по общепринятым формулам.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ.
Эхографические критерии периферических ЛУ в норме.
В анализируемой группе, в которой дети и подростки до 16 лет составляли 84%, при эхографии было выявлено 228 неизмененных периферических ЛУ.
При исследовании у большинства детей выявлялись мелкие ЛУ шейных, подмышечных и паховых групп. При этом 143 узла – (63% от общего количества неизмененных ЛУ) располагались в шейной области, а подмышечные и паховые составляли соответственно 53 (20%) и 37 (14%).
При исследовании аксиллярных и паховых областей дополнительно было выявлено 31 ЛУ (11,7% от нормальных ЛУ), которые имели эхографические признаки липоматоза. Такое изображение аксиллярных л/у было отмечено у женщин старшей возрастной категории после 35 лет и у подростков с нарушением жирового обмена. Остальные периферические ЛУ в контрольной группе пациентов не выявлялись, а их наличие расценивалось как патологическое.
Размеры выявленных неизмененных ЛУ в различных анатомических областях были разными, как и их форма: в наибольшем продольном диаметре от 4 до 27 мм (1,18±0,36 см )- и от 2 до 8 мм (0,468 ± 0,12) – в наименьшем поперечном диаметре. Большинство из них были непальпируемыми. Наиболее крупные ЛУ овальной формы были характерны для шейной зоны, очевидно, как зоны наибольшего антигенного раздражения, тогда как паховые и аксиллярные имели относительно меньшие размеры. Максимальный продольный диаметр югуло-дигастрального ЛУ Кютнера, расположенного в верхней трети шеи у взрослых и старших подростков, достигал 30 мм. Аксиллярные ЛУ встречались как овальной так и округлой формы, что, очевидно, связано с характером окружающих тканей и степенью их давления на ЛУ.
У детей ( 154 случая – младше 11 лет) наибольший продольный диаметр был достоверно меньше ( 1,10±0,31см), чем у взрослых( 49 случаев старше 16 лет- 1,34±0,47 см), р короткому диаметру было недостоверным в указанных возрастных группах, что, очевидно, связано с большей выраженностью лимфоидного компонента в ЛУ у детей в виде относительно боле толстого коркового слоя. Данное наблюдение подтверждается достоверной разницей индексов Solbiati у детей младше 11 лет и у лиц старше 16 лет. ЛУ в норме у детей были более округлой формы (индекс Solbiati детей 2,4± 0,05, у взрослых 2,9±0,125, p
Нами было изучено значение поперечного и продольного размеров ЛУ в констатации лимфаденопатии.
Диагноз ЛАП был правомочен, по нашим данным, при увеличении наименьшего поперечного диаметра шейных ЛУ у взрослых и подростков > 8 мм, у детей младшего школьного возраста >6 мм. Границей гиперплазии для паховых и аксиллярных ЛУ являлось значение передне-заднего диаметра у детей 5мм, у взрослых 8 мм соответственно. Увеличение размеров продольного диаметра по длинной оси лимфатического узла имело, по нашим данным, меньшее значение в постановке диагноза ЛАП.
В нижеследующей таблице представлены характерные признаки при некоторых группах ЛАП.
Таблица 2. Сравнительная характеристика эхографических признаков трех групп лимфаденопатий (ЛАП).