Нарушение конгруэнтности суставных поверхностей что это
Нарушение конгруэнтности суставных поверхностей что это
В патогенезе развития артроза первое место занимает фактор нарушения питания хряща. Наступающие в последующем изменения в хряще ведут к снижению его устойчивости даже к обычной нагрузке.
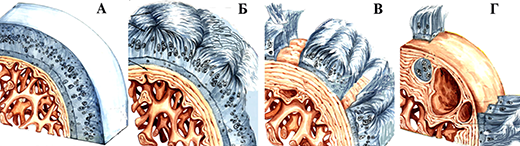
Потеря хрящем эластичности и нарушение конгруэнтности ведут к макро- и микротравме субхондральной пластинки, которая на это реагирует усиленной продукцией костного вещества, проявляющаяся в виде остеосклероза. Избыток костного вещества в этой зоне при продолжающейся нагрузке на суставные поверхности вызывает его распространение в места наименьшего давления и скопление костного вещества, выявляемое рентгенологически в виде остеофитов. Они приводят к механическому раздражению синовиальной оболочки, появлению различных видов ограничения движений в больном суставе. Таким образом в течении деформирующего артроза различают 3 степени:
Кроме степеней артроза выделяют стадии, которые отличаются по характеру течения процесса и клинической картине:
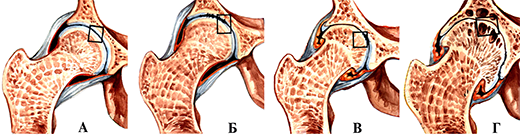
I стадия характеризуется быстрой утомляемостью конечности, «скованностью» мышц. Только некоторые больные отмечают умеренное ограничение движений в суставе из-за скованности. Боли в суставе, как правило, отсутствуют. Только при некоторых артрозо-артритах, которые начинаются с патологического процесса синовиальной оболочки, заболевание может начинаться с болевого и воспалительного синдрома. Рентгенологически в этой стадии развития болезни выявляется сужение суставной щели и субхондральный склероз. Нередко клиническая симптоматика этой стадии заболевания настолько незначительна, что больные даже не обращают на них особого внимания. Поэтому в некоторых литературных источниках можно встретить утверждение, что начало артроза чаще всего бессимптомное.
Посттравматические артрозы нередко начинаются со II стадии, так как при невправленных внутрисуставных переломах имеется первичное нарушение целости суставного гиалинового хряща. К этому добавим, что при наличии смещения внутрисуставных отломков с диастазом между ними более 2 мм, регенерация гиалинового хряща практически невозможна. Имеющийся посттравматический дефект замещается костной мозолью, покрытой рубцовой соединительной тканью, а это уже есть морфологические элементы II стадии развития артроза, который проявляет себя болевым синдромом, особенно при нагрузке на поврежденную конечность.
II стадия характеризуется нарастанием ограничения движений, которые могут сопровождаться крепитацией (похрустыванием). Обычно боли возникают в начале ходьбы и называются «стартовые боли». Они появляются из-за того, что во время первого шага основная нагрузка приходится на самый патологически измененный участок нагружаемой части суставной поверхности. Затем нагрузка при движениях более или менее распределяется равномерно на всю суставную поверхность, и боли могут полностью исчезнуть или заметно уменьшится до такой степени, что не мешают больному преодолевать даже значительные расстояния. Однако, с течением времени, особенно после продолжительной нагрузки, к концу рабочего дня боли усиливаются, но после отдыха могут вовсе исчезнуть. Появляется деформация сустава, гипотрофия мышц, контрактура, хромота. Рентгенологически выявляется значительное сужение суставной щели в 2-3 раза в сравнении с нормой, выражен субхондральный склероз, выявляются остеофиты (шипы) в местах наименьшей нагрузки. К конечному этапу этой стадии развития болезни болевой синдром может иметь волнообразное проявление: периоды усиления болевого синдрома сменяются различными по продолжительности периодами значительного снижения интенсивности болей или полным их исчезновением. Как правило, такое проявление боли связано с вовлечением в процесс синовиальной оболочки, т.е. с развитием хронического рецидивирующего синовита, который является неотъемлемой частью клинических проявлений III стадии развития болезни.
III стадия характеризуется почти полной потерей подвижности в суставе, сохраняются только пассивные качательные движения, выражена сгибательная контрактура. Боли сохраняются в покое, не проходят после отдыха. Возможна нестабильность сустава. При локализации процесса в суставах нижних конечностей к этому времени больные самостоятельно ходить не могут и прибегают к помощи трости или костылей. Рентгенологически – суставная щель почти полностью отсутствует. Суставная поверхность деформирована, выражены краевые разрастания. Основным рентгенологическим различием этой стадии развития болезни и предыдущей является появление множественных кист в субхондральных зонах суставных поверхностей.
Деформирующий артроз тазобедренного сустава. А-норма; Б-Icт.; В-II ст.; Г- III ст.
Чаще всего поражает коленный и тазобедренный суставы. Методы лечения зависят от стадии заболевания.
Повреждение передней и задней крестообразной связки: что предлагает современная медицина?
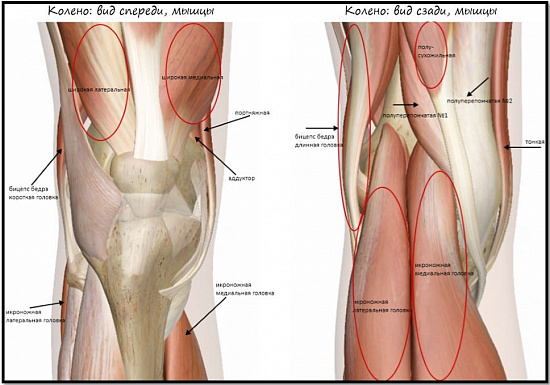
Анатомия коленного сустава крайне сложна. Это самый крупный сустав тела, специфичный по своему строению и испытывающий ежедневные большие нагрузки. Для обеспечения нормальной устойчивой походки и безболезненных нагрузок необходимо соблюдение множества факторов. Один из них — нормальная, полноценная работа связочного аппарата коленного сустава.
Стабилизирующий аппарат коленного сустава
За стабильность коленного сустава отвечает множество структур, которые можно разделить на активные и пассивные стабилизаторы.
Активные — это мощный мышечно-сухожильный каркас, окружающий коленный сустав, – мышцы бедра и голени.
К пассивным стабилизаторам относится сложная система связочного аппарата коленного сустава.
Связочный аппарат колена представлен нескольким компонентами:
Почему возникает повреждение передней крестообразной связки и как с этим справиться?
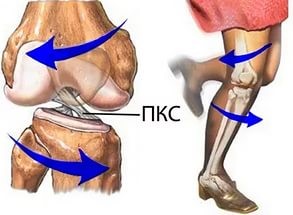
Передняя крестообразная связка (ПКС) – сухожильный тяж, растянувшийся в косом направлении от внутренней поверхности наружного мыщелка бедренной кости к межмыщелковому возвышению большеберцовой кости. Передняя крестообразная связка ответственна за ограничение переднего смещения голени относительно бедра.
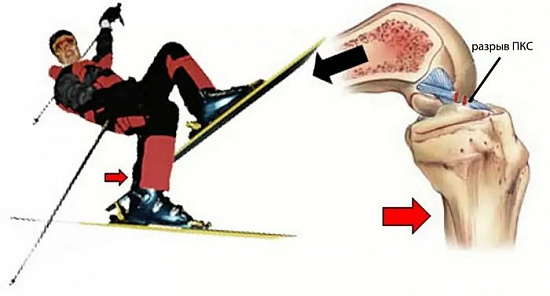
По данным мировой статистики, повреждение передней крестообразной связки составляет до 46-50% во всей структуре повреждений связочного аппарата коленного сустава.
Чаще всего повреждение возникает в результате спортивной травмы, приводящей к форсированной ротации бедра относительно голени. Наиболее подвержены подобным травмам молодые пациенты, занимающиеся игровыми видами спорта: футболом, хоккеем, волейболом, баскетболом и т.д.
Вторая наиболее часто встречающаяся причина — падение на горнолыжном склоне.
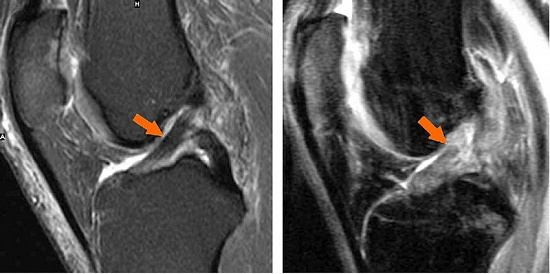
В первые сутки после травмы диагноз «повреждение ПКС» ставится на основании:
Лечение в остром периоде – преимущественно консервативное. Иммобилизация коленного сустава производится с целью заживления сопутствующих повреждений капсулы, боковых связок, уменьшения болевого синдрома и явлений синовита.
Анатомические особенности строения передней крестообразной связки не способствуют самостоятельному заживлению. Иными словами, разрыв передней крестообразной связки самостоятельно уже не срастется.
Консервативное (безоперационное) лечение разрыва редко бывает эффективным и приводит к множеству негативных последствий:
Наиболее предпочтительный вариант лечения передней крестообразной связки — оперативное вмешательство. Проводить его целесообразно через несколько недель после получения травмы и стихания острого периода.
Прямые показания к выполнению операции на передней крестообразной связке:
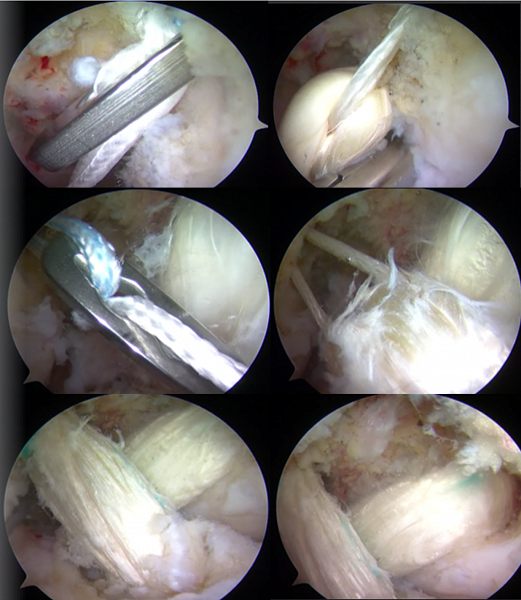
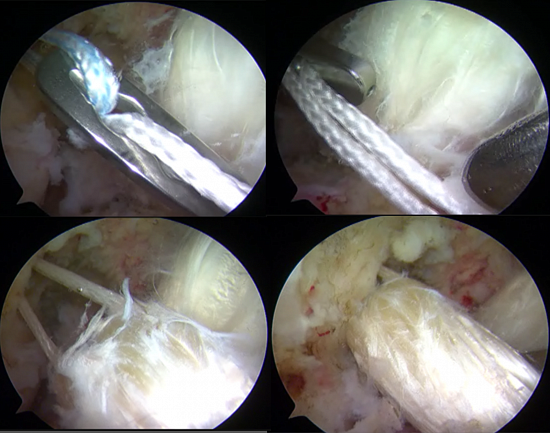
Операция по восстановлению передней крестообразной связки выполняется с помощью артроскопического оборудования.
Повреждение задней крестообразной связки: чем отличается и что можно предпринять для лечения
Задняя крестообразная связка (ЗКС) – мощный сухожильный тяж, тянущийся от наружной поверхности внутреннего мыщелка бедренной кости к заднему межмыщелковому пространству большеберцовой кости. Его основная функция – ограничение смещения голени кзади относительно бедра.
Повреждения задней крестообразной связки встречаются приблизительно в 10 раз реже, чем повреждения передней, и чаще всего являются следствием высокоэнергетической травмы (например, ДТП).
Возникающая при разрыве задней крестообразной связки нестабильность приводит к перенапряжению всех анатомических структур коленного сустава, нарушению биомеханики и конгруэнтности суставных поверхностей. Это в свою очередь ведет к развитию хронических дегенеративно-дистрофических процессов с вовлечением первоначально неизмененных элементов сустава с достаточно быстрым исходом в артроз, который приводит к ограничению физической активности и снижению качества жизни пациента.
Диагностика повреждения аналогична диагностике передней крестообразной связки:
В настоящее время для пациентов, имеющих разрыв задней крестообразной связки, хирургическая тактика лечения является общепринятой.
Оперативное лечение выполняется также с помощью артроскопической техники, но считается более трудоемким и выполняется далеко не всеми специалистами по артроскопической хирургии.
Реабилитация после пластики задней крестообразной связки проходит несколько дольше и требует более плавного перехода к физическим и спортивным нагрузкам.
Примерно в половине случаев разрыв крестообразной связки данного типа сочетается с повреждением других связок – возникают так называемые мультилигаментарные повреждения. Эта ситуация приводит к выраженной нестабильности, грубому нарушению биомеханики и значительно отражается на физической активности пациента.
Возникновение в этом случае мультинаправленной нестабильности коленного сустава требует скорейшего оперативного вмешательства, направленного на восстановление утерянных компонентов связочного аппарата коленного сустава и стабилизации сустава.
Артроскопическая пластика: основные этапы оперативного лечения ПКС и ЗКС
Артроскопия — малотравматичная техника оперативного вмешательства, позволяющая осуществить большинство хирургических манипуляций в коленном суставе через несколько проколов под контролем видеокамеры.
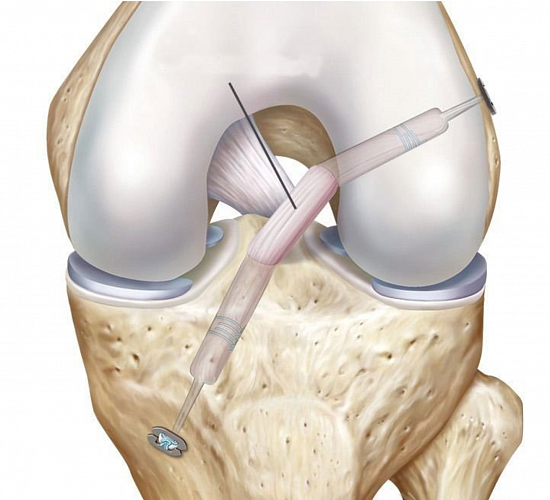
Первым этапом во время операции проводится визуальный осмотр всех отделов сустава, при необходимости выполняется резекция (удаление поврежденной части) менисков (по показаниям – шов мениска), с помощью специального инструментария устраняются поврежденные участки хряща.
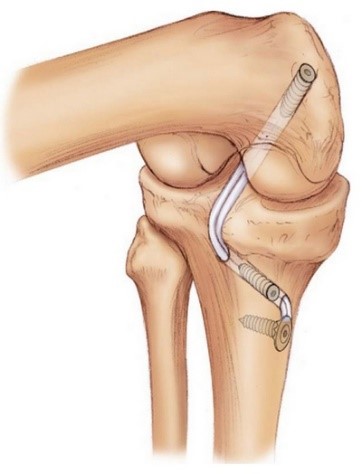
На втором этапе из сустава удаляется культя поврежденной крестообразной связки и ее разорванные волокна. Формируются сквозные костные каналы для проведения через них сухожилий, максимально точно повторяющих анатомию утраченной связки. В качестве пластического материала чаще используются забранные из подколенной области сухожилия полусухожильной и нежной мышц.
Послеоперационный период, независимо от выбора фиксирующих трансплантат фиксаторов (титановые, пластиковые, биорезорбируемые), требует разгрузки сустава для создания условий биологической фиксации и перестройки трансплантата. Эти процессы по данным МРТ исследований занимают от 6 до 12 месяцев.
Основные этапы реабилитации после артроскопической пластики:
Деформирующий артроз суставов
Деформирующий остеоартроз является самой распространенной формой заболеваний суставов. Им болеют 10—15 % обследованных людей всех возрастов. Заболевание часто является причиной нетрудоспособности.
Остеоартроз характеризуется дистрофией и деструкцией суставного хряща с последующими изменениями суставных поверхностей и развитием остеофитов, т. е. со вторичными изменениями подлежащей костной ткани. Сопутствующее воспаление синовиальной оболочки суставов носит непостоянный характер.
Хотя окончательно причина заболевания остается неясной, в развитии остеоартроза придают значение избыточной механической нагрузке на суставную поверхность хряща. По-видимому, имеет также значение нарушение нормального соответствия суставных поверхностей друг другу. В результате перегрузки хряща происходит его повреждение
Наиболее характерными в клинической картине считаются появление суставных болей при движениях и уменьшение их в покое. Часто заболевание начинается с поражения крупных суставов ног, испытывающих большую нагрузку при ходьбе. Больших деформаций и анкилозов обычно не возникает. Однако при поражении тазобедренных и коленных суставов болевые ощущения могут быть выражены, что приводит к существенным нарушениям их функции.
Существенное значение могут приобретать дистрофические изменения позвоночника с остеофитами по краям тел позвонков, поражением межпозвоночных и реберно-позвоночных суставов, а также межпозвоночных дисков. При этом возможно сдавление нервных корешков, элементов симпатической нервной системы, что часто ведет к разнообразной неврологической симптоматике (радикулярные боли, парестезии, ослабление рефлексов). Эти проявления бывают особенно выражены при поражении шейного отдела позвоночника.
Рентгенологически при остеоартрозе первоначально отмечают неравномерное сужение суставной щели пораженного сустава, а также уплотнение и расширение костной пластинки эпифизов. Позже возникает заострение краев суставных поверхностей (остеофиты).
При появлении воспалительных изменений в суставах в крови могут отмечаться повышение числа лейкоцитов, увеличение СОЭ.
В лечении важными являются разгрузка пораженного сустава, ограничение ходьбы и длительного стояния на ногах, снижение массы тела. Лечебной гимнастикой с постепенным увеличением объема и количества движений больные должны заниматься систематически.
Симптомы и лечение артроза плечевого сустава
Симптомы артроза плечевого сустава
Симптомы и лечение артроза плечевого сустава будут меняться с учетом стадии заболевания. Выделяют 3 стадии, для которых специфичны следующие симптомы:
Позже, без лечения артроза плечевого сустава, боли из тупых переходят в острые, локализованные в области ключично-лопаточного треугольника. Резкая болезненность при физических нагрузках может быть практически нестерпимой. Впоследствии сильная ноющая боль беспокоит пациентов даже в ночное время. Характерно, что боли при артрозе плечевого сустава усиливаются при попытке поднять руки вверх или завести их за спину. Часто перевод рук в такое положение сопровождается глухими щелчками, хрустом, треском.
Хруст в плече
Говорить об артрозе плечевого сустава на основе хруста можно лишь в том случае, если он сопровождается болью и ограничением подвижности. Также беспокойство вызывает глухой, “тяжелый” хруст (как будто кости трутся, “цепляются” друг за друга).
Нарушение подвижности в плечевом суставе
Амплитуда произвольных движений сокращается из-за сужения суставной щели. Просвет суставной щели может сокращаться из-за истончения хряща и разрастания остеофитов. Также частично блокировать плечо может воспалительный отек. На поздних стадиях болезни возникают контрактуры (стойкие ограничения подвижности) и даже анкилоз (полное сращение костей).
Деформация плеча
Деформация плеча становится заметной уже на 3-й стадии артроза, когда единственным вариантом лечения может быть хирургическое. По мере истощения суставного хряща запускаются компенсаторные механизмы замещения: костная ткань разрастается на место хрящевой, чтобы сохранить стабильность опорно-двигательного аппарата. Из-за разрастания остеофитов и изменения структуры хряща начинается деформация костной ткани, которая также претерпевает износ.
Наружные контуры сустава изменяются также за счет отека, который возникает из-за перевыработки синовиальной жидкости и нарушения обменных процессов в очаге воспаления.
Деформация плеча свидетельствует о том, что хрящ полностью разрушен, а дегенеративный процесс перешел на головки костей. Закономерным итогом этого, помимо деформации и нарушения конгруэнтности (совпадаемости) суставных поверхностей, становится укорочение связок и дистрофия мышц.
Лечение артроза плечевого сустава
Лечение артроза плечевого сустава подбирается индивидуально для каждого пациента с учетом степени заболевания, индивидуальных особенностей его течения, дальнейшего прогноза и сопутствующих заболеваний. Если процесс вторичен по отношению к основному заболеванию (подагра, сахарный диабет, ревматоидный артрит), то лечение артроза плечевого сустава проводится с привлечением профильных специалистов.
На 1-й стадии артроз плеча может быть полностью остановлен при помощи грамотного лечения и точного соблюдения клинических рекомендаций. На 2-й стадии его развитие можно существенно замедлить при помощи комплексной терапии (физиотерапия, фармакотерапия, ЛФК, здоровый образ жизни). На 3-й стадии, при массивном разрушении архитектуры сустава, большинству пациентов может помочь только хирургическая операция.
Хирургическое лечение артроза плечевого сустава
На последней стадии артроза возникают необратимые изменения костной ткани, поэтому для устранения болей и восстановления подвижности врачи предлагают установку эндопротеза. При этом происходит замена больного сустава на титановый или другой имплант.
Обычно к операции приходится прибегать только при запущенном, нелеченном артрозе. Однако при неблагоприятном течении болезни и неэффективности консервативной терапии хирургическое решение может стать единственным даже при полноценной терапии. Такие операции проводятся даже в молодом и среднем возрасте.
После установки импланта состояние пациента значительно улучшается, однако ему следует соблюдать ортопедический режим. Несмотря на свою “выносливость”, импланты не могут на 100% заменить здоровый сустав.
Если степень артроза позволяет обойтись малоинвазивным вмешательством, больному могут быть назначены:
Физиотерапия при артрозе плечевого сустава
Физиотерапевтические методики облегчают симптомы артроза плечевого сустава и состояние больного, замедляют течение болезни. Некоторые виды физиотерапевтического воздействия способствуют разрушению остеофитов, улучшают поступление лекарственных средств непосредственно в очаг поражения, стимулируют кровообращение и помогают поддерживать объем мышечной ткани. Также они оказывают опосредованное влияние на скорость регенерации хрящевой ткани, устраняют отеки и воспаление.
К наиболее эффективным процедурам для снятия симптомов артроза плечевого сустава относятся:
ЛФК при артрозе плечевого сустава
Гимнастика для лечения артроза плечевого сустава включает преимущественно статические упражнения (когда нужно задержаться в заданной позиции). Такие упражнения способствуют укреплению мышц и связок и позволяют перенести нагрузку с больного сустава (активные движения в сочленении могут только травмировать его). ЛФК применяется для лечения артроза плечевого сустава только в состоянии ремиссии, т.е., при отсутствии симптомов воспаления. При болевых ощущениях гимнастику прекращают.
Медикаментозное лечение артроза плечевого сустав
Лечение артроза плечевого сустава медикаментами имеет перед собой следующие цели:
Противовоспалительные препараты
Противовоспалительные средства (нестероидные и глюкокортикоиды) эффективно блокируют воспаление на 1-й и 2-й стадии болезни, однако дают лишь временный симптоматический эффект. Эта группа препаратов не вызывает структурные улучшения в хрящевой ткани и не сдерживает прогрессирование болезни. Поэтому без основной терапии НПВС и ГК со временем перестают работать.
Противовоспалительные средства для лечения артроза плечевого сустава выпускаются в виде таблеток, капсул, мазей и кремов, а также инъекций и ректальных свеч. НПВС для наружного применения можно использовать на постоянной основе; в других формах выпуска их, как правило, нельзя применять для лечения артроза плечевого сустава медикаментами дольше 12 дней.
Хондропротекторы
Как же они работают? В первую очередь, хондропротекторы улучшают качество синовиальной жидкости (суставной смазки) и делают ее более вязкой. При артрозе синовиальная жидкость часто вырабатывается в больших объемах, однако имеет скудный состав и низкую вязкость. Из-за этого она не может как положено питать хрящ и обеспечивать скольжение суставных поверхностей.
Спазмолитики и витамины
Из-за дегенеративного процесса нагрузка, которую анатомически принимает на себя суставной хрящ, перераспределяется на костные структуры и мышечно-связочный аппарат. Это приводит к постоянным спазмам, которые не только причиняют пациенту боль, но и приводят к разрушению мышц, чувству хронической усталости и ухудшению подвижности в плечевом поясе.
Для снятия спазмов, которые возникают при прогрессировании болезни, используются спазмолитики, миорелаксанты и витамины группы В (также снимают воспаление).
Стимуляторы микроциркуляции
В лечении артроза плечевого сустава крректоры микроциркуляции крови выполняют две функции: они косвенно улучшают регенерацию хрящевой ткани и замедляют процессы ее разрушения, а также имеют умеренный противоотечный эффект. Эта группа препаратов способствует скорейшему выведению продуктов распада, которые образуются при гибели хондроцитов (а значит, организм вырабатывает меньше ферментов, которые могут повредить здоровые клетки). Поэтому они особенно эффективны при совместном применении с блокаторами ферментов.
Другие
В последние годы для лечения артроза плечевого сустава используют также генно-инженерные препараты (например, очищенную плазму крови пациента). Чаще всего применяется плазмолифтинг, при котором плазму вводят локально в очаг дегенеративного процесса. Эта процедура стимулирует кровообращение и регенерацию хондроцитов.
Профилактика артроза плечевого сустава
Профилактика артроза плечевого сустава заключается в следовании простым правилам:
Врачи утверждают, что большую роль в развитии артроза плечевого сустава играет несбалансированный, бедный питательными веществами рацион. Поэтому они рекомендуют минимизировать потребление жирных, соленых, сладких и острых продуктов, отказаться от консервов, полуфабрикатов и другой процессированной пищи. Удовлетворить потребности организма и, в первую очередь, суставов, помогут холодцы, свиные хрящи (уши, ноги), жирная рыба северных морей, орехи, свежие фрукты и овощи, цельные злаки, нежирное мясо, молочная продукция, яйца. Такая диета позволяет уменьшить симптомы артроза плечевого сустава даже в том случае, если патологический процесс уже начался.
Комментариев нет. Вы можете быть первым, кто оставил комментарий.
ООО «СПОРТМЕДКОНСАЛТ»
Тамазян
Вартан Олегович
травматолог-ортопед
Эффективность радиочастотной денервации позвоночных сегментов
Методика радиочастотной деструкции фасеточных нервов является высокоэффективной и безопасной. Это подтверждается так же материалами многочисленных «клиник боли», в которых данный метод является основным в лечении хронической вертеброгенной боли.
Актуальность
Боль в спине – это не только страдания людей, но и большие социально-экономические потери. Согласно данным эпидемиологических исследований, проведенных в странах с развитой экономикой и медициной, более 70 % пациентов на первичном приёме жалуются на недомогание, связанное с заболеванием позвоночника. Это вызвано широкой распространённостью патологических состояний позвоночника, именуемых врачами как остеохондроз, спондилоартроз, спондилез и др. В последние десятилетия у врачей различных специальностей значительно вырос интерес к проблемам вертеброгенной боли, методам её изучения, способам профилактики и лечения. С одной стороны разработка новых инструментов, имплантов, методов хирургической коррекции патологически измененного позвоночника позволяет хирургии находится на вершине технического прогресса, а с другой – вертебролог сегодня сталкивается с проблемой выбора оптимального для пациента метода хирургического лечения [2,3].
За прошедшие годы был предложен ряд малоинвазивных методов лечения спондилогенного болевого синдрома путём разрушения нервной ткани, в том числе, метод радиочастотной денервации (РЧД). Этот метод в настоящее время является альтернативой травматичным медицинским вмешательствам на шейном, грудном и поясничном отделах позвоночника при возникновении у пациентов вертеброгенной боли и неэффективности консервативной терапии.
Материалы и методы
Под нашим наблюдением находились 245 пациентов ( 150 женщин и 95 мужчин ) в возрасте от 21 до 69 лет (средний возраст – 54,3 года). Поводом для обращения к врачу являлись жалобы на боли в шейном ( 18 больных), грудном ( 19 больных ) и поясничном ( 208 больных ) отделах позвоночника.
Всем больным проводилось лучевое обследование, включающее рентгенографию позвоночника в двух проекциях (при боли в шее и поясничной боли дополнительно проводились функциональные пробы), в сомнительных случаях для исключения диско – радикулярного конфликта назначалась МРТ или КТ пораженного отдела. На рентгенограммах в случае дегенеративных изменений межпозвонковых дисков и суставов выявлялся субхондральный склероз замыкательных пластин позвонков, снижение высоты межпозвонкового промежутка, склерозирование и деформация суставных поверхностей, нарушение их конгруэнтности, возможно развитие унко-вертебрального артроза [4], (рис. 1).
Оценка интенсивности болевого синдрома проводилась при помощи карты болевого аудита, максимальный уровень боли в которой соответствует 100 баллам.
Также пациентам проводилось исследование биомеханики шейного и поясничного отделов позвоночника при помощи трёхмерного анализатора движений Zebris 3-D Motion Analyzer (Zebris medizintechnik, Германия) (рис. 2). У пациентов было обнаружено нарушение биомеханики шейного и поясничного отделов позвоночника, что выражалось в ограничении разгибания и асимметрии амплитуды наклонных и ротационных движений.
Также нами были определены общие противопоказания для выполнения РЧД: зависимость от наркотических и седативных препаратов, алкоголя, наличие социальных и психологических факторов, определяющих восприятие боли, возрасте моложе 18 и старше 80 лет, перенесенные ранее операции на позвоночнике, расстройства спинального кровообращения в анамнезе [2].
Затем, для идентификации корректного положения иглы, с помощью радиочастотного генератора Stryker Interventional spine MultiGen RF Console (рис. 5) или генератора RFG-3C PLUS фирмы RADIONICS проводилась электростимуляция фасеточных нервов с частотой 50 Гц. Пациент должен был испытывать ощущения покалывания в области соответствующего фасеточного сустава в диапазоне между 0,4 и 0,6 В. Далее частоту снижали до 2 Гц и наблюдали мышечные сокращения в конечностях, отсутствие которых указывало на корректное положение электрода. С целью анестезии в зону предполагаемой деструкции вводилось 0,5 % раствора новокаина (не более 2,0 мл) и осуществлялась собственно радиочастотная деструкция.
Больные манипуляцию переносили хорошо. В течение тридцати минут после денервации они соблюдали постельный режим, в это время проводилась противовоспалительная терапия (ксефокам 8 мг в/м). Затем больным разрешалось вставать. Пациенты выписывались под амбулаторное наблюдение невролога в этот же день. На амбулаторном этапе проводилось восстановительное лечение (лечебная гимнастика верхних и нижних конечностей), противовоспалительная терапия. В течение 4-6 недель рекомендовалось исключение тяжёлых физических и спортивных нагрузок. Больным рекомендовалось приступить к работе через 7 – 14 дней после манипуляции.
Результаты
Мы не отметили никаких осложнений ни во время операции, ни в раннем, ни в позднем послеоперационном периодах. После радиочастотной деструкции в течение 1-2 недель в 79 % случаев пациенты на фоне значительного уменьшения интенсивности болевого синдрома продолжали жаловаться на чувство тяжести в зоне манипуляции. Через 3-6 недель это чувство исчезало.
Эффект от денервации мы оценивали перед выпиской больного на работу, через 1 месяц, 6 месяцев, 1 год и 1,5 года с момента РЧД.
Результаты манипуляции были разделены на три группы: хороший – отсутствие боли, удовлетворительный – отсутствие боли в покое, значительное снижение её интенсивности при движениях, отсутствие необходимости приема анальгетиков и неудовлетворительный – сохранение интенсивности болевого синдрома на прежнем уровне.
При оценке результатов в ранний срок после манипуляции во всех случаях было отмечено уменьшение болевого синдрома, в среднем, на 36 баллов по шкале болевого аудита как в соответствующем отделе позвоночника, так и в конечностях. Через месяц хороший исход заболевания был отмечен у 101 (41 %), удовлетворительный – у 137 (56 %), неудовлетворительный – у 7 (3 %) пациентов. Таким образом, через месяц после манипуляции улучшение состояния наступило у 97 % больных. Через 6 месяцев распределение исходов заболевания осталось примерно таким же. Через год проведен анализ результатов лечения у 195 больных: хороший исход отмечен у 62 (32 %), удовлетворительный – у 117 (60 %), неудовлетворительный – у 16 (8 %) пациентов. Положительные результаты сохранились у 92 % больных, хотя снизилась доля хороших и увеличилась доля удовлетворительных оценок. Через 1.5 года мы наблюдали 180 больных, у 143 из них боли возобновились практически с прежней интенсивностью.
По шкале оценки боли установлено, что до операции интенсивность болевых ощущений составляла 47,1 ± 6,9 балла, через 3 дня – 11,4 ± 3,5 балла, через 1 месяц – 6,9 ± 4,1 балла, через 6 месяцев – 7,7 ± 3,8 балла, через 1 год – 8,5 ± 4,3 балла, через 1,5 года – 37,7 ± 3,3 балла. По всей видимости, произошла реинервация позвоночных сегментов и в эти сроки возможно повторение радиочастотной деструкции. Повторно манипуляция была выполнена 47 пациентам с выраженным положительным эффектом.
В свою очередь, в группе контроля до проведения консервативной терапии интенсивность боли составляла 46,3 ± 5,3 балла, по окончании лечения – 21,7 ± 4,2 балла, через 6 месяцев – 39,5 ± 3,2 балла, через 1 год – 45,4 ± 5,6 балла (рис. 6).
Таким образом, очевидным является не только более высокая по сравнению с консервативной терапией эффективность РЧД, но и более длительный период ремиссии после выполнения процедуры.
Исследование биомеханики шейного и поясничного отделов позвоночника до и через месяц после операции показало, что в значительной степени увеличивается амплитуда и скорость движений в позвоночных сегментах.
Максимальный уровень сгибания в поясничном отделе позвоночника увеличился в среднем на 33 градуса (с 25 ± 3,4 градусов до 58 ± 5,1 градусов (p