Натрий 2 со4 что это
Сульфат натрия
| Сульфат натрия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | сульфат натрия, натрий сернокислый |
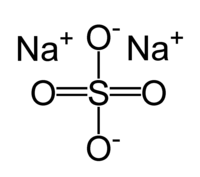
| Химическая формула | Na2SO4 |
| Физические свойства | |
| Состояние (ст. усл.) | белые гигроскопичные кристаллы |
| Отн. молек. масса | 142,04 а. е. м. |
| Молярная масса | 142,04 г/моль |
| Плотность | 2,68 г/см³ |
| Термические свойства | |
| Температура плавления | 884 °C |
| Энтальпия образования (ст. усл.) | −1387,9 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 19,2 (20 °C), 42,3 (100 °C) |
| Классификация | |
| Рег. номер CAS | 7757-82-6 |
Содержание
Свойства
Бесцветные кристаллы. Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10H2O.
Нахождение в природе
В природе безводный сульфат натрия встречается в виде минерала тенардита. Кристаллогидрат Na2SO4·10H2O образует минерал мирабилит (глауберову соль). Встречаются также двойные соли сульфата натрия с другими сульфатами, например астраханит Na2SO4·MgSO4·4H2O, глауберит Na2SO4·CaSO4. Значительные количества сульфата натрия содержатся в рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол. В них при понижении температуры идёт реакция:
В России крупнейшим производителем природного сульфата натрия является компания ОАО «Кучуксульфат» — 600 тыс. тонн в год.
Получение
Промышленный способ получения сульфата натрия — взаимодействие NaCl с H2SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается соляная кислота.
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья. Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
Применение
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах.
Второе по количеству применение сульфата натрия — стекольное производство. Также это вещество используют для получении сульфатной целлюлозы, в текстильной, кожевенной промышленности и в цветной металлургии.
В медицине и ветеринарии ранее широко использовался в качестве солевого слабительного средства, применяется также как компонент в средствах для промывания носа.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешево и легко отфильтровывать.
Зарегистрирован в качестве пищевой добавки E514.
Сульфат натрия, характеристика, свойства и получение, химические реакции
Сульфат натрия, характеристика, свойства и получение, химические реакции.
Сульфат натрия – неорганическое вещество, имеет химическую формулу Na2SO4.
Краткая характеристика сульфата натрия:
Сульфат натрия – неорганическое вещество белого цвета.
Химическая формула сульфата натрия Na2SO4.
Сульфат натрия – неорганическое химическое соединение, соль серной кислоты и натрия.
Сульфат натрия не токсичен, пожаро- и взрывобезопасен. Пылевоздушная смесь сульфата натрия не взрывоопасна.
В земной коре сульфат натрия находится в свободном чистом состоянии, в форме кристаллогидратов, а также в составе двойных солей.
Сульфат натрия в чистом состоянии широко распространён в природе в виде минерала тенардит.
Сульфат натрия образует с водой кристаллогидраты. Их формула Na2SO4·nH2O, где n может быть 1, 7 или 10. Кристаллогидрат Na2SO4·10H2O известен как минерал мирабилит (глауберова соль). Данный десятиводный кристаллогидрат сульфата натрия впервые обнаружен химиком И. Р. Глаубером в составе минеральных вод.
В пищевой промышленности используется 2 типа сульфата натрия:
– добавка Е514(i) – сульфат натрия (Sodium sulphate) с химической формулой Na2SO4;
– добавка Е514(ii) – гидросульфат натрия (Sodium hydrogen sulphate) с химической формулой NaHSO4.
Физические свойства сульфата натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na2SO4 |
| Синонимы и названия иностранном языке | sodium sulfate (англ.) |
натрий сернокислый (рус.)
тенардит (рус.)
Получение сульфата натрия:
Промышленный способ получения сульфата натрия заключается в разработке его месторождений в природе.
В лаборатории сульфат натрия получается в результате следующих химических реакция:
Сульфат Натрия
Химическое название
Сернокислый натрий, натрия сульфат.
Химические свойства
Сульфат Натрия, что это? Данное химическое соединение – это натриевая соль серной кислоты. Формула Сульфат Натрия: Na2SO4. Это бесцветные кристаллы, устойчивые в безводной форме при температуре от 33 градусов Цельсия. При температуре ниже средство образует кристаллогидраты, формула Na2SO4•10H2O. Соленый на вкус кристаллический порошок имеет молярную массу 142 грамма на моль. В естественной среде вещество содержится в минерале тенардит, кристаллогидрат образует соединение мирабилит (глауберова соль). Вещество можно обнаружить в различных формах в рапе, на дне соленых озер.
Химические свойства. Что такое Сульфат Натрия? Формула Сульфат Натрия: Na2SO4. Соединение проявляет свойства средней соли, так как образовано сильной серной к-ой и гидроксидом натрия (слабое основание). Вещество не подвергается гидролизу, так как не имеет в составе «слабого иона». Смесь гидросульфата и Сульфата Натрия может вступить в реакцию с раствором гидроксида натрия.
При электролизе раствора (водного) Натрия Сульфата на катоде выделяется водород, а на аноде кислород (из воды), в результате в катодном пространстве происходит обогащение ионами натрия, в анодном – ионами SO42- и водорода.
Вещество можно получить в промышленных масштабах при взаимодействии хлорида натрия с серной кислотой в специализированных печах, при высокой температуре от 500 до 550 градусов, побочных продуктом реакции является хлороводород. Но в связи с наличием больших запасов природного сырья, этот метод не применяют.
Сульфат Натрия можно использовать на производстве синтетических чистящих и моющих средств; при производстве стекла и целлюлозы; средство используют в текстильной промышленности, цветной металлургии, в кожевельной промышленности. Применяется в виде обезвоживающего средства в хим. лабораториях, в связи с тем, что оно дешево стоит и легко отфильтровывается. В медицине лекарство используют в качестве солевого слабительного и добавляют в состав растворов для промывания носа. Средство используют в виде пищевой добавки под кодом E514.
Фармакологическое действие
Фармакодинамика и фармакокинетика
Вещество постепенно всасывается в кишечнике, повышается осмотическое давление, начинает накапливаться жидкость, происходит раздражение рецепторов кишечной слизистой и усиление перистальтики ЖКТ. Каловые массы разжижаются и быстро эвакуируются. Происходит полное очищение кишечника по всей длине.
Эффект от приема солевого слабительного проявляется в течение 4-6 иногда 14 часов. Вещество также обладает желчегонными свойствами, его можно применять для ликвидации отечности.
Показания к применению
Натрия сульфат используют:
Для чего внутривенно назначают тиосульфат натрия? Для лечения аллергии, невралгии, артрита.
Противопоказания
Побочные действия
Сульфат Натрия, инструкция по применению (Способ и дозировка)
Раствор применяют в соответствии с рекомендациями врача. Назначают от 15 до 30 грамм вещества в р-ре за один прием. Для детей дозировку корректируют. Рекомендуется принимать лекарство на пустой желудок.
Передозировка
Нет данных о передозировке.
Взаимодействие
Диарея, возникающая после приема лек. средства может повлиять на процесс абсорбции других препаратов. Принимать лекарства рекомендуется не позднее, чем за час до начала эвакуации кала.
Условия продажи
Особые указания
Во время лечения рекомендуется пить достаточное количестве воды и другой жидкости.
Следует соблюдать осторожность при назначении препарата пациентам с сердечно-сосудистыми заболеваниями.
При проявлении вздутия живота, метеоризма, сильных болей в области пищеварительной системы рекомендуется прервать лечение и обратится к врачу.
При беременности и лактации
Лекарство, как правило, не назначают во время беременности и при кормлении грудью.
Сульфат натрия: способы получения и химические свойства
Сульфат натрия — соль щелочного металла натрия и серной кислоты. Белый. Плавится и кипит без разложения. Хорошо растворяется в воде (гидролиз не идет).
Относительная молекулярная масса Mr = 142,04; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 884º C; tкип = 1430º C.
Способ получения
1. В результате взаимодействия разбавленной серной кислоты и гидроксида натрия образуется сульфат натрия и вода:
2. При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
NaHSO4 + NaCl = Na2SO4 + HCl
3. В состоянии кипения в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование сульфата натрия и газа хлороводорода:
4. Твердый сульфид натрия и кислород взаимодействуют при температуре выше 400º C с образованием сульфата натрия:
5. При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
Качественная реакция
Химические свойства
1. Сульфат натрия может реагировать с простыми веществами :
1.1. Сульфат натрия реагирует со фтором при температуре 100–150º C. При этом образуются фторид натрия, сульфурилфторид и кислород:
1.2. С водородом сульфат натрия реагирует при температуре 550–600º C, в присутствии катализатора Fe2O3 с образованием сульфида натрия и воды:
2. Сульфат натрия вступает в реакцию со многими сложными веществами :
2.1. Сульфат натрия реагирует с гидроксидом бария с образованием гидроксида натрия и сульфата бария:
2.2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
Натрий сернокислый, реагент широкого спектра применения
Натрий сернокислый — неорганическое соединение, 
Реактив встречается в природе в безводной форме (минерал тенардит), в виде кристаллогидрата (мирабилит или глауберова соль) и входит в состав двойных солей (глауберит с сульфатом кальция, астраханит и вантгоффит с сульфатом магния). Его много в соленых озерах хлоридно-сульфатного типа, в заливе Каспийского моря Кара-Богаз-Гол.
Получают сернокислый натрий из природных минеральных солей (тенардита, мирабиллита), донных отложений соленых озер или в качестве побочного продукта металлургических производств; предприятий, выпускающих соляную кислоту, соединения хрома, искусственные волокна.
 |  |
| Перчатки химзащитные КЩС-2 | Натрий сернокислый безводный Ч |
Свойства
Сульфат натрия безводный — белое или сероватое водорастворимое сыпучее вещество с бесцветными кристаллами или гранулами; гигроскопичное и неустойчивое в нормальных условиях; без запаха, с горько-соленым вкусом. При комнатной температуре реагент активно впитывает влагу из воздуха, превращаясь в кристаллогидрат с 10-ю молекулами воды Na2SO4*10H2O, и только при температуре выше +33 °С становится устойчивым. Мало растворим в спиртах, водно-спиртовых растворах. Не токсичен, пожаро- и взрывобезопасен.
Натрий сернокислый — соль, образованная сильным металлом и сильной кислотой. Поэтому он достаточно пассивен в химических реакциях. При нагревании с углем превращается в сульфид натрия Na2S. Взаимодействует с сильными кислотами и сильными щелочами, алюминием, магнием. Образует твердые растворы с сульфатом калия K2SO4, лития Li2SO4 и некоторыми другими сульфатами; двойные соли с сульфатом скандия Na2SO4*Sc2(SO4)3 и иттрия Na2SO4*Y2(SO4)3; эвтектический сплав с сульфатом стронция SrSO4.
Меры предосторожности
Реагент относится к 4-му классу опасности для человека (низший класс опасности, малоопасные вещества). Но пыль может вызывать раздражение кожи, органов дыхания и слизистых глаз. Вдыхание мелкодисперсионного сульфата натрия может привести к отравлению.
Рабочее помещение, в котором работают с веществом, должно быть оснащено принудительной вентиляцией, работникам следует использовать средства защиты (спецодежда, перчатки, защитные очки, противопылевой респиратор).
Натрий сернокислый хранят на крытых сухих складах с установленной системой вентиляции, в герметичной упаковке, защищающей реагент от влаги.
Категорически не рекомендуется самостоятельно принимать сульфат натрия в качестве слабительного, например, чтобы похудеть. Его бесконтрольное применение может привести к нарушениям работы ЖКТ, резкому снижению давления.
Применение
• Входит в состав бытовых моющих и чистящих средств, порошков для стирки.
• На производствах по изготовлению стекла.
• В текстильпроме и кожевенном деле.
• На целлюлозно-бумажных комбинатах для изготовления бумаги сульфатным способом.
• В цветной металлургии, химпроме, нефтедобыче и нефтепереработке.
• В строительной индустрии — добавка в бетоны для ускорения схватываемости и повышения морозоустойчивости.
• В лабораторной практике в качестве дешевого и удобного осушителя орг. растворителей.
• В фармакологии и ветеринарии — при приготовлении слабительного и растворов для промывания носа.
• Антидот при отравлении тяжелыми металлами (образует с ними 
• Ограниченно применяется в пищепроме как добавка Е514 (регулятор кислотности, эмульгатор, стабилизатор, наполнитель низкокалорийных продуктов). Используется как осушитель пряностей, овощей, грибов, мясопродуктов.
• В косметической индустрии входит в состав антицеллюлитных солей для ванн.












