Натрий едкий что это такое
Каустическая сода: ее свойства и применение
Описание средства
Каустическая сода — сильная ядовитая щелочь. Если ее раствор попадет на кожу, то могут возникнуть ожоги, язвы. Она относится ко 2 классу опасности, поэтому при использовании необходимо соблюдать меры предосторожности:
Каустическая сода — продукт химического синтеза, в природе такого вещества не существует. Продается она в хозяйственных магазинах, отделах бытовой химии, расфасована в пластиковые банки или плотные полиэтиленовые мешки весом от 250 г до 30 кг.
Применение
У едкого натра очень широкий спектр применения в различных отраслях производства: текстильной, химической, пищевой, нефтяной и пр. Большая часть стиральных порошков, шампуней, моющих, чистящих средств содержит каустик. Его используют в производстве бумаги, вискозы, оливок, мороженого, какао, шоколада. В пищевой промышленности он известен как пищевая добавка Е524.
В быту основное назначение гидроксида натрия — борьба с жировыми и органическими загрязнениями. Его применяют для чистки канализации, обезжиривания поверхностей, в изготовлении мыла ручным способом, отбеливании и стирке белья, борьбе с садовыми вредителями, для санитарной обработки помещений.
Чистка канализации
Канализационные трубы имеют свойство засоряться: на их внутренней поверхности оседает жир, мыльная пена, органические остатки. Все это спрессовывается, уменьшая просвет трубы, вода плохо уходит, появляется неприятный запах из сливного отверстия. Причины могут быть как технические, так и эксплуатационные:
Перед работой желательно на несколько минут открыть горячую воду для того, чтобы канализационная система прогрелась, и загрязнения лучше поддавались обработке щелочью. Для очистки канализации от жировых и органических загрязнений с помощью каустической соды существует несколько методов:
Раствор гидроксида натрия используют в качестве профилактического средства 1 раз в 3 месяца для промывки труб от накопившихся частичек жира и органических загрязнений.
Чистка выгребных ям
В выгребные ямы на даче или в частном доме сливаются все нечистоты. Большая их часть имеет жидкую фракцию, которая уходит через земляные стенки, а густая скапливается на дне и по мере необходимости удаляется.
Очень часто стенки выгребных ям покрываются плотной органической пленкой, вода перестает уходить. В результате канализационные отходы быстро переполняют яму. Для растворения пленки и очистки земляных стенок используют каустическую соду. Количество ее берут из расчета 4 кг на 1 кубометр выгребной ямы. Предварительно растворив соду в воде, аккуратно выливают раствор едкой щелочи в яму. Эффект наступает через 2-3 дня. Пленка постепенно растворяется, уровень жидкости уменьшается, на дне остается илистый осадок.
Очистка загрязненных поверхностей
Каустическая сода применяется для чистки эмалированных раковин, поверхностей плит, сильнозагрязненной кухонной посуды от жира, копоти, нагара. Для этого нужно смешать ее с жидким моющим средством или со стиральным порошком, развести водой до консистенции пасты, нанести на поверхность. Через 20–30 минут смыть большим количеством воды.
Использовать каустическую соду на оцинкованных, алюминиевых и тефлоновых поверхностях нельзя. Их можно испортить.
Стирка белья
Раствор каустика используют для замачивания, ручной и машинной стирки хлопчатобумажного, льняного белья. При добавлении щелочи вода становится мягкой, пятна хорошо удаляются, особенно с кухонных полотенец. Раствор готовят следующим образом: в 5 л воды нужно развести 3 ст. л. NaOH. Замочить белье на 1–2 часа. После этого постирать обычным порошком.
При стирке белья в стиральной машине к порошку добавляют 2–3 ложки каустической соды. Пятна, даже застарелые, легко отстирываются. Перед стиркой белье желательно замочить, стирать при температуре 40–60°С.
Изделия из шелковых и шерстяных тканей стирать с помощью щелочи не рекомендуется, она может повредить их структуру.
Изготовление мыла
Способов изготовления домашнего мыла с помощью каустической соды множество. Необходимые ингредиенты:
1 л любого растительного масла;
300 мл дистиллированной воды;
эфирные ароматические масла;
порошки, настои различных трав.
Через 4-5 дней можно вынуть мыло из формочек, дать ему»дозреть» и подсохнуть. На это понадобится время (иногда несколько недель). Признаком готовности мыла считается появление на его поверхности белого порошкообразного налета.
Борьба с вредителями и болезнями растений
Гидроксид натрия применяют в борьбе с садовыми вредителями и болезнями растений, для обеззараживания овощехранилищ, амбаров, клеток для животных, теплиц.
Для обработки растений делают раствор: в 2 л воды добавляют 1 ложку каустика, тщательно размешивают, опрыскивают деревья и кустарники. Это помогает избавиться от тли, долгоносика, грибковых поражений: фитофтороза, мучнистой росы.
Для обеззараживания помещений используют 4%-ный раствор NaOH. Для этого берут 10 ст. л.соды растворяют в 5 л воды и несколько раз обрабатывают зараженные поверхности.
Едкий натр
каустическая сода,
едкая щелочь
— 52,2 (20 °C) г/100 мл
Гидроксид натрия лат. Natrii hydroxidum ; другие названия — каустическая сода, каустик, едкий натр, едкая щёлочь. Самая распространенная щёлочь, химическая формула NaOH. В год в мире производится и потребляется более 57 миллионов тонн едкой щёлочи. Гидроксид натрия также используется для мойки пресс-форм автопокрышек, называется Mold Cleaner фирмы «NALCO». Интересна история тривиальных названий как гидроксида натрия, так и других щелочей, название «едкая щёлочь» обусловлено свойством разьедать кожу, бумагу, стекло и вызывать сильные ожоги. До XVII века, щёлочью (фр. alkali) называли также карбонаты натрия и калия. В 1736 французский учёный А. Л. Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой (по растению Salsola Soda, из золы которого её добывали), а карбонат калия — поташем. В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.
Содержание
Физические свойства
ΔH 0 растворения для бесконечно разбавленного водного раствора —44,45 кДж/моль.
Из водных растворов при 12,3 — 61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления 65,1 °C; плотность 1,829 г/см³; ΔH 0 обр −734,96 кДж/моль), в интервале от —28 до —24°С — гептагидрат, от —24 до —17,7°С — пентагидрат, от —17,7 до —5,4°С —тетрагидрат (α-модификация), от —5,4 до 12,3 °C. Растворимость в метаноле 23,6 г/л (t=28 °C), в этаноле 14,7 г/л (t=28 °C). NaOH·3,5Н2О (температура плавления 15,5 °C);
Химические свойства
Гидроксид натрия (едкая щёлочь)— сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочно-земельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкий калий), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдает электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в ряду электрохимической активности металлов, в котором за ноль принята активность водорода.
Гидроксид натрия вступает в реакции:
1.Нейтрализации с различными веществами в любых агрегатных состояниях, от растворов и газов до твердых веществ:
так и с растворами:
(Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора — тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.)
(2) H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
2. Обмена с солями в растворе:
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе. Его и используют, в частности, для очистки воды от мелких взвесей.
например, с фосфором — с образованием гипофосфита натрия:
4. С металлами: Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксиалюмината натрия и водорода:
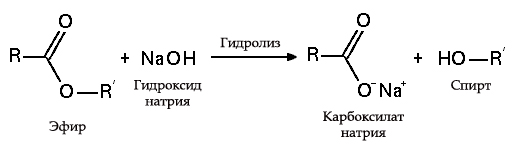
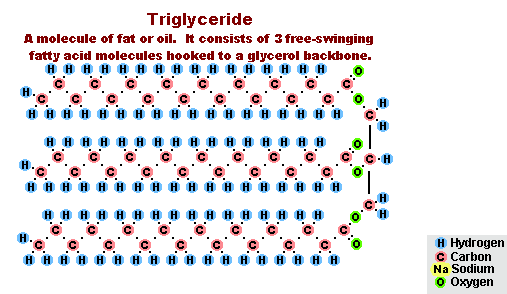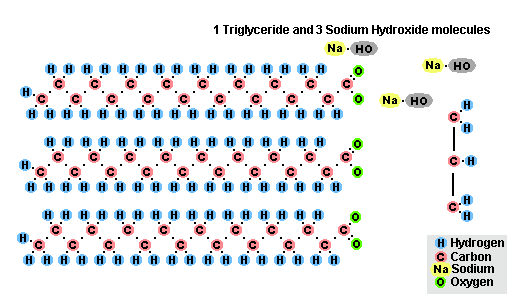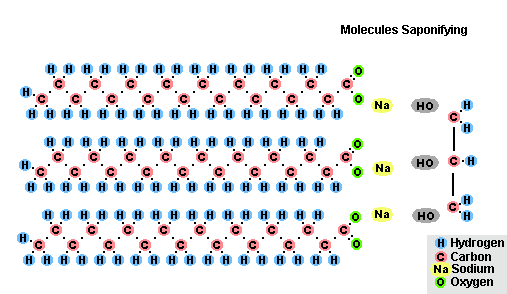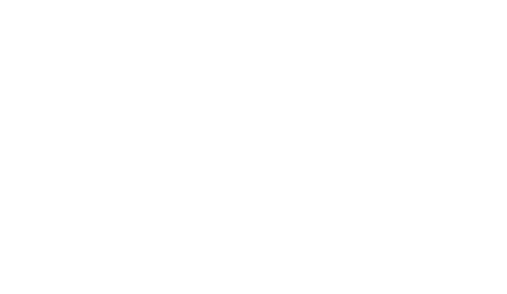
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла, в зависимости от состава жира.
6. С многоатомными спиртами — с образованием алкоголятов:
7. Со стеклом: в результате длительного воздействия горячей гидроокиси натрия поверхность стекла становится матовой (выщелачивание силикатов):
Качественное определение ионов натрия возможно несколькими способами
1. По цвету пламени горелки — ионы натрия придают пламени жёлтую окраску:
2. С использованием специфических реакций на ионы натрия:
| Реагент | Фторид аммония | Нитрит цезия-калия-висмута | Ацетат магния | Ацетат цинка | Пикро- | ||
|---|---|---|---|---|---|---|---|
| Цвет осадка | белый | бледно-жёлтый | жёлто-зеленый | желто-зеленый | белый | белый | бледно-жёлтый |
Способы получения
Промышленные способы получения
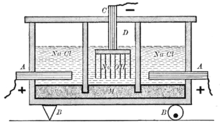
В промышленном масштабе гидроксид натрия получают электролизом растворов галита (каменная соль NaCl) с одновременным получением водорода и хлора:
Едкие щёлочи, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом. Для некоторых производств это важно. Так, в производстве искусственных волокон можно применять только каустик, полученный при электролизе с жидким ртутным катодом. В мировой практике используются все три метода получения хлора и каустика, при явной тенденции в сторону увеличения доли мембранного электролиза. В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Эффективность процесса производства рассчитывается не только по выходу едкого натра, но и по выходу хлора и водорода, получаемых при электролизе, соотношение хлора и гидроксида натрия на выходе 100/110, реакция протекает в следующих соотношениях:
1,8 NaCl + 0, 5 H2O + 2,8 МДж = 1,00 Cl2 + 1,10 NaOH + 0,03 H2,
Основные показатели различных методов производства даны в таблице:
Технологическая схема электролиза с твёрдым катодом
Диафрагменный метод — Полость электролизёра с твёрдым катодом разделена пористой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом [1]. В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита. В результате электрохимического процесса на аноде за счет разложения галита выделяется хлор, а на катоде за счет разложения воды — водород. Хлор и водород выводятся из электролизёра раздельно, не смешиваясь:
При этом прикатодная зона обогащается гидроксидом натрия. Раствор из прикатодной зоны, называемый электролитическим щёлоком, содержащий неразложившийся анолит и гидроксид натрия, непрерывно выводится из электролизёра. На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до 42—50 % в соответствии со стандартом. Галит и сульфат натрия при повышении концентрации гидроксида натрия выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или на стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией. Кристаллический галит (обратную соль) возвращают на электролиз, приготавливая из неё так называемый обратный рассол. Из него во избежание накапливания сульфата в растворах перед приготовлением обратного рассола извлекают сульфат. Убыль анолита возмещают добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов или растворением твёрдого галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния. Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Мембранный метод — аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной мембраной. Мембранный электролиз обеспечивает получение наиболее чистого каустика.
который отводится из электролизёра, а на ртутном катоде образуется слабый раствор натрия в ртути, так называемая амальгама:
Амальгама непрерывно перетекает из электролизёра в разлагатель. В разлагатель также непрерывно подаётся хорошо очищенная от примесей вода. В нем амальгама натрия в результате самопроизвольного электрохимического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Полученный таким образом раствор каустика, являющийся товарным продуктом, не содержит примеси галита, вредной в производстве вискозы. Ртуть почти полностью освобождается от амальгамы натрия и возвращается в электролизер. Водород отводится на очистку. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесенные с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают двух- или трёхступенчатым процессом растворённый в нём хлор.
Лабораторные способы получения
В лаборатории гидроксид натрия получают химическими способами, которые имеют больше историческое, чем практическое значение.
В результате реакции образуется раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % NaOH. Расплавленный NaOH разливают в железные барабаны, где он застывает.
Ферритный способ описывается двумя реакциями:
(1) — процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек-феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции (2); получается раствор гидроксида натрия и осадок Fe2O3, который после отделения его от раствора возвращается в процесс. Раствор содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % NaOH.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество топлива, получаемый едкий натр загрязнен примесями, обслуживание аппаратов трудоемко. В настоящее время эти методы почти полностью вытеснены электрохимическим способом производства.
Гидроксид натрия
| Гидроксид натрия | ||||||||
 | ||||||||
 | ||||||||
| Общие | ||||||||
|---|---|---|---|---|---|---|---|---|
| Традиционные названия | едкий натр, каустик, каустическая сода, едкая щелочь | |||||||
| Химическая формула | NaOH | |||||||
| Физические свойства | ||||||||
| Молярная масса | 39,997 г/моль | |||||||
| Плотность | 1,59 г/см³ | |||||||
| Термические свойства | ||||||||
| Температура плавления | 323 °C | |||||||
| Температура кипения | 1403 °C | |||||||
| Химические свойства | ||||||||
| Растворимость в воде | 108,7 г/100 мл | |||||||
| Безопасность | ||||||||
| Токсичность | Ацетат уранила-цинка | |||||||
| Цвет осадка | белый | бледно-жёлтый | жёлто-зелёный | желто-зелёный | белый | белый | бледно-жёлтый | зеленовато-жёлтый |
Методы получения
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия
К химическим методам получения гидроксида натрия относятся известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнен примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Известковый метод
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с известковым молоком при температуре около 80°С. Этот процесс называется каустификацией; он проходит по реакции:
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он застывает.
Ферритный метод
Ферритный метод получения гидроксида натрия состоит из двух этапов:
Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200°С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xH2О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щелочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твердый продукт в виде гранул или хлопьев.
Электрохимические методы получения гидроксида натрия
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора % | 99 | 96 | 98,5 |
| Электроэнергия (кВт·ч) | 3 150 | 3 260 | 2 520 |
| Концентрация NaOH | 50 | 12 | 35 |
| Чистота хлора | 99,2 | 98 | 99,3 |
| Чистота водорода | 99,9 | 99,9 | 99,9 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Массовая доля Cl − в NaOH, % | 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Диафрагменный метод
Наиболее простым, из электрохимических методов, в плане организации процесса и конструкционных материалов для электролизера, является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подается в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую, иногда, добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их в основном заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до товарной концентрации 42—50 % масс. в соответствии со стандартом.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов, минеральных рассолов типа бишофита, предварительно очищенного от примесей или растворением галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения гидроксида натрия до сих пор широко используется в промышленности.
Мембранный метод
Мембранный метод производства гидроксида натрия наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из катодного пространства вытекает поток обедненного анолита, содержащего так же примеси гипохлорит- и хлорат-ионов и хлор, а из анодного — щелока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Щелочь, получаемая с помощью мембранного электролиза, практически не уступает по качеству получаемой при помощи метода с использованием ртутного катода и постепенно заменяет щелочь, получаемую ртутным методом.
Однако, питающий раствор соли (как свежий так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка определяется высокой стоимость полимерных катионообменных мембран и их уязвимость к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма а также низкая механическая прочность и термическая стойкость ионообменных мембран во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
Ртутный метод с жидким катодом
В ряду электрохимических методов получения щелоков самым эффективным способом является электролиз с ртутным катодом. Щелока, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом (Для некоторых производств это критично. Например, в производстве искусственных волокон можно применять только высокочистый каустик.), а по сравнению с мембранным методом организация процесса при получении щелочи ртутным методом гораздо проще.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
На катоде восстанавливаются ионы натрия, которые образуют слабый раствор натрия в ртути (амальгаму натрия):
Na + + е = Na 0 nNa + + nHg − = Na + Hg
Амальгама непрерывно перетекает из электролизёра в разлагатель амальгамы. В разлагатель также непрерывно подаётся высоко очищенная вода. В нём амальгама натрия в результате самопроизвольного химического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Полученный таким образом раствор каустика, являющийся товарным продуктом, практически не содержит примесей. Ртуть почти полностью освобождается от натрия и возвращается в электролизер. Водород отводится на очистку.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения щелочи с твердым катодом, в особенности мембранным методом.
Лабораторные методы получения
В лаборатории гидроксид натрия иногда получают химическими способами, но чаще используется небольшой электролизер диафрагменного или мембранного типа.
Рынок каустической соды
Мировое производство натра едкого, 2005 год
| Производитель | Объём производства, млн.тонн | Доля в мировом производстве |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Occidental Chemical Company | 2.552 | 4.4 |
| Formosa Plastics | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Solvay | 1.252 | 2.2 |
| Akzo Nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Россия | 1.290 | 2.24 |
| Китай | 9.138 | 15.88 |
| Другие | 27.559 | 47,87 |
| Всего: | 57,541 | 100 |
В России согласно ГОСТ 2263-79 производятся следующие марки натра едкого:
ТР — твёрдый ртутный (чешуированный);
ТД — твёрдый диафрагменный (плавленый);
РР — раствор ртутный;
РХ — раствор химический;
РД — раствор диафрагменный.
| Наименование показателя | ТР ОКП 21 3211 0400 | ТД ОКП 21 3212 0200 | РР ОКП 21 3211 0100 | РХ 1 сорт ОКП 21 3221 0530 | РХ 2 сорт ОКП 21 3221 0540 | РД Высший сорт ОКП 21 3212 0320 | РД Первый сорт ОКП 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Внешний вид | Чешуированная масса белого цвета. Допускается слабая окраска | Плавленая масса белого цвета. Допускается слабая окраска | Бесцветная прозрачная жидкость | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок |
| Массовая доля гидроксида натрия, %, не менее | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
Показатели российского рынка жидкого натра едкого в 2005—2006 г.
| Наименование предприятия | 2005 г. тыс.тонн | 2006 г. тыс.тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик», Стерлитамак | 239 | 249 | 20 | 20 |
| ОАО «Каустик», Волгоград | 210 | 216 | 18 | 18 |
| ОАО «Саянскхимпласт» | 129 | 111 | 11 | 9 |
| ООО «Усольехимпром» | 84 | 99 | 7 | 8 |
| ОАО «Сибур-Нефтехим» | 87 | 92 | 7 | 8 |
| ОАО «Химпром», Чебоксары | 82 | 92 | 7 | 8 |
| ВОАО «Химпром», Волгоград | 87 | 90 | 7 | 7 |
| ЗАО «Илимхимпром» | 70 | 84 | 6 | 7 |
| ОАО «КЧХК» | 81 | 79 | 7 | 6 |
| НАК «АЗОТ» | 73 | 61 | 6 | 5 |
| ОАО «Химпром», Кемерово | 42 | 44 | 4 | 4 |
| Итого: | 1184 | 1217 | 100 | 100 |
Показатели российского рынка твердого натра едкого в 2005—2006 г.
| Наименование предприятия | 2005 г. тонн | 2006 г. тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик», Волгоград | 67504 | 63510 | 62 | 60 |
| ОАО «Каустик», Стерлитамак | 34105 | 34761 | 31 | 33 |
| ОАО «Сибур-Нефтехим» | 1279 | 833 | 1 | 1 |
| ВОАО «Химпром», Волгоград | 5768 | 7115 | 5 | 7 |
| Итого: | 108565 | 106219 | 100 | 100 |
Применение
Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд: