Натрия стеарил фумарат что это
Больше, чем лубрикант. Натрия стеарилфумарат PRUV®от JRS Pharma
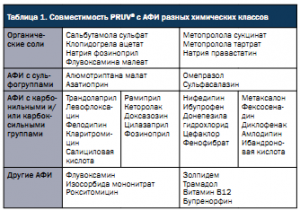
Лубриканты широко применяют в фармацевтическом производстве для предотвращения налипания прессуемой массы к технологическому оборудованию. Традиционно для этого используют магния стеарат и кальция стеарат, добавление которых в таблетмассу значительно уменьшает налипание прессуемого материала к пуансонам и матрице. Однако эти вещества имеют ряд таких недостатков, как несовместимость с некоторыми активными фармацевтическими ингредиентами (АФИ), изменение профиля растворения, переопудривание, образование жирных пленок при растворении в воде шипучих и диспергируемых лекарственных форм и металлический привкус. Более 20 лет назад технологи компании JRS Pharma предложили лубрикант нового поколения – натрия стеарилфумарат PRUV®, который помогает избежать возникновения описанных проблем. В отличие от магния стеарата (рис. 1) натрия стеарилфумарат PRUV® (рис. 2) имеет более выраженные гидрофильные свойства и практически полностью растворяется в воде, что делает его незаменимым лубрикантом при производстве растворимых таблеток. Несовместимость магния стеарата со многими АФИ заключается в реакционной способности иона магния (Mg2+), который в некоторых случаях может легко образовывать нерастворимые соли с АФИ.
Натрия стеарилфумарат PRUV® обладает меньшим зарядом и не образует нерастворимые соединения, что делает его совместимым с абсолютным большинством активных субстанций различных классов (табл. 1).
Сравнительные характеристики натрия стеарилфумарата и
магния стеарата Натрия стеарилфумарат PRUV® демонстрирует эффективность смазывания, такую же как у широко применяемого для таблетирования магния стеарата. Кроме того, рецептуры с натрия стеарилфумаратом PRUV® ускоряют процесс производства и масштабирования разработки. Большим преимуществом PRUV® является увеличение твердости получаемых таблеток при более низкой его концентрации в таблетмассе в сравнении с магния стеаратом и меньшей силе прессования (рис. 3).
К ощутимым недостаткам магния стеарата можно отнести переопудривание, при котором на частицах таблетмассы формируется пленка лубриканта, что, с одной стороны, приводит к улучшению когезии между частицами, а с другой – негативно сказывается на прочности получаемых таблеток. Благодаря своей морфологии PRUV® демонстрирует более эффективное смазывание и проявляет меньшую склонность к образованию пленок в сравнении с таковыми при использовании магния стеарата. При этом твердость получаемых таблеток увеличивается.
Таким образом, эффект переопудривания и увеличение времени перемешивания не влияют на механическую прочность таблеток при применении натрия стеарилфумарата в отличие от магния
стеарата (рис. 4), где эти параметры процесса оказывают существенное влияние на свойства готового продукта.
Растворение плохо растворимых АФИ может ухудшаться из-за наличия в композиции высокогидрофобных ингредиентов, таких как магния стеарат. Благодаря частичной гидрофильности PRUV® обеспечивает быстрое растворение АФИ с плохой растворимостью, что было показано на модельных рецептурах таблеток парацетамола, содержащих натрия стеарилфумарат PRUV® и силикатированную микрокристаллическую целлюлозу PROSOLV® SMCC HD 90 (рис. 5).
Натрия стеарил фумарат что это
Вспомогательные вещества выполняют важнейшую роль в рецептурах и технологии готовых лекарственных препаратов независимо от вида лекарственной формы. При производстве таблеток они способствуют обеспечению однородности дозирования лекарственных веществ, механической прочности, распадаемости, растворимости, стабильности таблеток в процессе хранения, локализации места действия, скорости высвобождения действующих веществ, а также технологичности процесса таблетирования. Современные исследования по созданию новых и совершенствованию используемых технологий таблеток носят многоплановый характер. При этом проблема трения при таблетировании, его влияния на технологичность процесса, качество таблеток и пути его нивелирования с помощью вспомогательных веществ (ВВ), затрагивается только в фрагментарных исследованиях. Это актуализировало осмысление и систематизацию накопленных знаний относительно применения антифрикционных ВВ в производстве таблеток.
С целью уменьшения величины трения при прессовании используют различные технологические приемы, которые условно можно разделить на косвенные и прямые. К косвенным относятся приемы, направленные на снижение усилия прессования и устранение шероховатости поверхности частиц материала. Они предусматривают:
К прямым приемам относится введение в состав рецептур антифрикционных ВВ, которые подразделяют на глиданты, смазывающие (лубриканты ) и антиадгезивы. Однако четкого разделения функций этих ВВ нет, одно и то же вещество может использоваться с разными целями. Так, широко используемый тальк, влияет как глидант и смазывающее. Действие талька основано на взаимном скольжении слоев, состоящих из частиц прочной гексагональной формы. Частицы силиката в слоях связаны ван-дер-ваальсовыми силами сцепления, поэтому связь в слоях значительно прочнее, чем между слоями. Эффективность антифрикционного действия талька повышается по мере увеличения дисперсности. Об этом можно судить по меньшей силе выталкивания, требующейся в случае применения, например, высокодисперсного талька. Крахмал, кроме свойств глиданта, позволяет решать и другие производственные задачи при таблетировании, выполняя функции антиадгезива, дезинтегранта и связующего ВВ (в виде раствора).
Удельная поверхность некоторых марок аэросила
Удельная поверхность, м 2 /г
Удельная поверхность, м 2 /г
При исследовании влияния количества Аэросила-200 и Аэросила-380 на снижение величины трения скольжения модельных порошкообразных ЛВ, нами подтверждены данные литературы, что эффективность применения аэросила тем выше, чем хуже сыпучесть модельной смеси. Показано, что чрезмерно малое, так и большое количество не эффективно влияет на сыпучесть смеси. Малое количество ведет к неравномерному обволакиванию прочих частиц коллоидным кремния диоксидом. Это, в свою очередь, ведет к недостаточному ослаблению сил притяжения между частицами и к плохой сыпучести. Слишком большое количество аэросила ведет к почти полному обволакиванию частиц коллоидным кремния диоксидом. При этом существенно возрастают силы притяжения между отдельными частицами аэросила, что не способствует снижению трения скольжения. Показано, что обоснованное количество аэросила позволило улучшить сыпучесть модельных порошкообразных смесей от 8 до 13%.
Согласно доступным данным литературы, исследования отечественных ученых по расширению ассортимента глидантов носят эпизодический характер. Одним из примеров этих немногочисленных работ является обоснование криопорошка, представляющего собой вещество природного происхождения,содержащего водоросли, и/или оболочки семян культурных растений, и/или глину.
Исследования смазывающих ВВ показывают, что универсальной смазки не существует. Их выбор зависит от свойств материала, метода производства таблеток, знаний и опыта разработчика. В качестве смазывающих веществ применяются жиры, жирные кислоты и их соли (кислота стеариновая, кальция и магния стеараты), тальк, углеводороды (вазелиновое масло) и некоторые ВМС (твин-80, ПЭГ-4000), количество которых регламентируется нормативными документами [8].
Полиэтиленгликоль 4000 и 6000, также известные как Carbowax 4000 и 6000, являются водорастворимыми смазочными материалами. Как правило, полиэтиленгликоль используют при влажном гранулировании в виде водных, спиртовых или водно- спиртовых растворов с различными связующими ВВ.
Минеральные масла очищенных нефтепродуктов являются эффективными смазывающими и антиадгезивами. Однако их применение ограничено, во-первых в связи с образующейся пятнистостью на поверхности таблеток после прессования и, во-вторых, с необходимостью прессования гранулята в течение 24 часов после приготовления, т.к. масло имеет тенденцию проникать в гранулы и терять эффективность смазывающего действия.
Основными представителями смазывающих ВВ остаются кислота стеариновая и ее соли, последние применяют в порошкообразном и гранулированном состоянии. Гранула стеарата представляет собой агломерат тонких первичных частиц, которые благодаря действию сдвига, постепенно, слоями распределяются по стенке матрицы, в результате образующаяся пленка обеспечивает смазывающий эффект достаточно долго. При изучении параметров влагосодержания, гигроскопичности и термической десорбции кальция стеарата и магния стеарата было установлено, что в отличие от кислоты стеариновой, они являются гигроскопичными соединениями и в условиях повышенной относительной влажности способны поглощать из воздуха влагу, находящуюся в соединениях в связанном и свободном состоянии. Данная влага испаряется в диапазоне температур 40-105°C. В зависимости от фирм производителей изученные образцы ВВ различаются по содержанию влаги и сорбционной емкости, что делает важным изучение этих параметров. Эндотермические эффекты для кальция стеарата (Тmax = 125,7°C) и магния стеарата (Тmax = 113°C) вызваны плавлением кристаллической структуры соединений и переходом ее в аморфное состояние. Следует учитывать, что по форме и размерам эти ВВ, в зависимости от производителя, тоже отличаются [1].
Янувия в Екатеринбурге
Ново Нордиск Продакшн С.а.С.
Sanofi India Limited
Инструкция по применению
Фармакологические свойства
Медикаментозное средство Янувия является противодиабетическим средством, которое предназначено для лечения инсулиннезависимого диабета. В состав медикамента входит активное вещество ситаглиптин, которое оказывает направленное воздействие на содержание глюкозы и инсулина в организме.
Ситаглиптин существенно отличается по составу и воздействию от веществ, которые считаются аналогами медикамента, таких как энтероглюкагон, белковый гормон поджелудочной железы инсулин, синтетические противодиабетические средства, гипогликемические лекарственные средства, тиазолидиндионы, ингибиторы альфа-глюкозидазы, островковый амилоидный полипептид поджелудочной железы.
Медикамент является ингибитором дипептидил пептидазы, увеличивает уровень содержания жизненно важных гормонов энтероглюкагона и гастроингибиторного полипептида. Уровень гормонов поднимается после приема пищи, они способствуют нормальному усвоению и регулированию уровня декстрозы.
Медикамент хорошо воспринимается большинством пациентов. Средство назначается пациентам при инсулиннезависимом диабете. Уже после первого приема видны хорошие результаты. Медикамент быстро всасывается и начинает действовать уже спустя час после приема, максимально время абсорбции составляет четыре часа. Принимать медикамент можно в любое время дня, вне зависимости от приема пищи. Медикаментозное средство хорошо усваивается в организме. Около 80 % компонентов лекарства выводятся из организма вместе с мочой. Уже спустя неделю после приема медикамента отмечаются значительные улучшения в ходе течения болезни.
Терапия больных с заболеваниями почек. Медикаментозное средство тестировалось на пациентах с разной формой заболевания почек: от самой начальной до тяжелой степени. Исследования показали, что медикамент оказывает разное воздействие на пациентов в зависимости от формы заболевания почек.
Медикаментозное средство не оказало никакого воздействия на пациентов, которые страдают легкой формой заболевания почек, поэтому таким пациентам не требуется коррекция рекомендуемой дозировки и им можно назначать по 100 мг средства. При средней степени почечной недостаточности у пациентов наблюдалось повышение уровня содержания компонентов средства, так как средство не выводится в достаточном количестве из организма. Таким пациентам необходимо понижать дозировку до 50 мг в день. При выраженном синдроме нарушения всех функций почек, пациенты нуждаются в уменьшении дозировки до 25 мг в день, так как почки не справляются уже со своей функцией и не способны выводить вещества из организма, что может привести к развитию гипогликемии и интоксикации организма. Терапия пациентов с заболеваниями печени. При терапии медикаментом Янувия пациентов, у которых обнаружено нарушение одной или нескольких функций печени, уменьшать дозировку не требуется. Медикамент можно принимать в дозе, составляющей 100 мг в день. Сведений и показаний о воздействии компонентов медикамента на пациентов, которые страдают тяжелой формой печеночной недостаточности, нет. Учитывая тот факт, что медикаментозное средство и его компоненты выводятся из организма через почки, можно предположить, что негативного воздействия на пациента рекомендуемая дозировка не окажет.
Терапия пациентов пожилого возраста. Медикаментозное средство не оказывает негативного воздействия на здоровье пациентов пожилого возраста. Пациенты, возраст которых превышает 65 лет, не нуждаются в корректировке дозировки медикамента. Терапия детей. Медикаментозное средство не следует назначать детям, возраст которых не достигает 18-ти лет, так как исследований о воздействии медикамента на детский организм не проводилось.
Состав и форма выпуска
Показания к применению
Медикаментозное средство используется в качестве монотерапии или комплексного лечения. Препарат назначают при инсулиннезависимом диабете, когда соблюдение рекомендуемой диеты и ограничений физических нагрузок не приводят к нужному результату. Прием медикамента снижает риск значительного снижения концентрации глюкозы в сыворотке крови.
Международная классификация болезней (МКБ-10)
Е.11. Инсулиннезависимый сахарный диабет.
Побочные эффекты
Противопоказания
Применение при беременности
Нет сведений и исследований о воздействии медикамента на плод, находящийся в утробе женщины, поэтому следует отказаться от приема медикамента во время вынашивания ребенка. Во время терапии при помощи медикамента Янувия следует отказаться от грудного вскармливания, та как сведений о проникновении компонентов средства с грудным молоком в организм младенца нет.
Способ и особенности использования
Медикаментозное средство предназначено для внутреннего приема. Используется медикамент для монотерапии, а также в качестве комплексного воздействия на болезнь в сочетании с другими препаратами. Рекомендуемая суточная дозировка составляет 100 мг лекарства. Принимать дозу необходимо дин раз в день. Использовать медикамент можно в любое время дня вне зависимости от употребления пищи. При пропуске таблетки необходимо как можно быстрее восполнить пробел. Нельзя принимать в день больше, чем одну таблетку. При лёгкой степени заболеваний почек пациенты не нуждаются в корректировке дозы, при средней степени тяжести заболевания, пациентам необходимо уменьшить дозировку до 50 мг в день, при почечной недостаточности в тяжелой форме пациентам нужно назначать не более 25 мг в сутки. Пациентам, страдающим заболеваниями печени, корректировка дозировки не требуется. Пожилые пациенты, возраст которых выше 65 лет, могут принимать медикамент в рекомендуемой дозировке без корректировки. Назначать медикамент детям, возраст которых не достигает 18-ти лет, нельзя, так как нет данных о воздействии компонентов средства на развивающийся организм. В инструкции по применению содержится подробная информация о рекомендуемых дозировках и продолжительности терапии, однако окончательное решение принимает лечащий врач после проведения обследования, сбора анализов и определения анамнеза.
Совместимость с алкоголем
Медикаментозное средство нельзя принимать вместе со спиртосодержащими напитками, так как это может привести к проявлению побочных эффектов и других симптоматических признаков.
Взаимодействие с другими лекарствами
Медикаментозное средство не рекомендуется принимать с сердечным гликозидом Digoxin, так как это может стать причиной увеличения концентрации компонентов Янувии в организме. При одновременном приеме препарата Янувии с мощным иммунодепрессантом Cyclosporinum отмечалось повышение уровня ситаглиптина в организме.
Передозировка
Аналоги
Условия продажи
Медикаментозное средство Янувия продается в аптечных пунктах по назначению лечащего врача и при наличии рецептурного листа.
Условия хранения
Медикаментозное средство Янувия рекомендуется хранить в недоступном для детей месте при температуре, не превышающей 30 °С. Срок хранения медикамента составляет два года с даты изготовления. По истечении срока годности использовать медикамент нельзя и его необходимо утилизировать в соответствии с санитарными нормами. Инструкция по применению содержит более подробную информацию о нормах хранения и сроках годности медикамента в открытом и запечатанном виде.
ИНСТРУКЦИЯ
по медицинскому применению лекарственного препарата
Торговое наименование препарата
Международное непатентованное наименование
Лекарственная форма
Состав
1 капсула дозировкой 1 мг содержит : действующее вещество: помалидомид 1,0 мг;
вспомогательные вещества: маннитол, крахмал прежелатинизированный, натрия стеарил фумарат;
1 капсула дозировкой 3 мг содержит : действующее вещество: помалидомид 3,0 мг;
вспомогательные вещества: маннитол, крахмал прежелатинизированный, натрия стеарил фумарат;
1 капсула дозировкой 4 мг содержит : действующее вещество: помалидомид 4,0 мг;
вспомогательные вещества: маннитол, крахмал прежелатинизированный, натрия стеарил фумарат;
Описание
Фармакотерапевтическая группа
Код АТХ
Фармакодинамика:
Помалидомид обладает прямой антимиеломной тумороцидной активностью демонстрирует иммуномодулирующее действие и угнетает стромальные клетки поддерживающие рост опухолевых клеток миеломы. Помалидомид избирательно угнетает пролиферацию и вызывает апоптоз гематопоэтических клеток опухоли. Кроме того помалидомид угнетает пролиферацию линий клеток множественной миеломы устойчивых к леналидомиду и обладает синергизмом с дексаметазоном по способности вызывать апоптоз как чувствительных так и устойчивых к леналидомиду линий опухолевых клеток. Помалидомид усиливает клеточный иммунитет с участием Т-клеток и природных киллеров и угнетает образование провоспалительных цитокинов (напр. фактора некроза опухоли-α TNF-α и интерлейкина-6 IL-6) моноцитами. Помалидомид также тормозит ангиогенез блокируя миграцию и адгезию клеток эндотелия.
Фармакокинетика:
При совместном приеме с высококалорийной пищей со значительным содержанием жиров скорость всасывания помалидомида замедляется значение Сmах снижается примерно на 25 % но общее всасывание практически не изменяется величина AUC уменьшается всего на 8 %. Поэтому помалидомид можно принимать вне зависимости от приема пищи.
Средний кажущийся объем распределения (Vd/F) помалидомида при равновесной концентрации находится в пределах 62-138 л. После применения помалидомида в течение 4 дней по 2 мг в день он обнаруживается в семенной жидкости здоровых добровольцев в концентрации примерно 67 % от уровня в плазме крови который достигается через 4 часа (примерное Тmах) после приема препарата. Invitro связывание энантиомеров помалидомида с белками плазмы крови человека находится в пределах от 12 % до 44 % и не зависит от концентрации.
У здоровых добровольцев после однократного приема внутрь [14С]-помалидомида (2 мг) основным компонентом в крови был помалидомид (примерно 70 % от уровня радиоактивности плазмы). Количество метаболитов не превышало 10% относительно исходного соединения или общего уровня радиоактивности плазмы.
На основании данных invitro помалидомид не индуцирует и не угнетает изоферменты системы цитохрома Р450 не ингибирует другие изученные транспортеры лекарственных веществ. При комбинировании помалидомида с субстратами таких путей клинически значимые лекарственные взаимодействия маловероятны.
Средний период полувыведения помалидомида из плазмы крови составляет 95 часов у здоровых добровольцев и 75 часов у пациентов с множественной миеломой. Средний общий клиренс (CL/F) препарата составляет приблизительно 7-10 л/ч.
У здоровых добровольцев после однократного приема внутрь [14С]-помалидомида (2 мг) примерно 73 % и 15% радиоактивной дозы выводилось через почки и кишечник. При этом около 2 % и 8 % дозы помалидомида с углеродной меткой выводилось через почки и кишечник в неизмененном виде.
Помалидомид в значительной степени подвергается биотрансформации и образующиеся метаболиты выводятся преимущественно через почки. Три основных метаболита образовавшиеся в результате гидролиза или гидроксилирования с последующей глюкуронизацией составляют соответственно 23 % 17 % и 12 % от общего содержания метаболитов в моче.
Анализ данных популяционной фармакокинетики с использованием двухкамерной модели показал что здоровые субъекты и пациенты с множественной миеломой имели сравнимые кажущийся клиренс (CL/F) и кажущийся объем распределения в центральной камере (V2/F). В периферических тканях помалидомид поглощался преимущественно опухолями с кажущимся периферическим клиренсом распределения (Q/F) и кажущимся периферическим объемом распределения (V3/F) соответственно в 37 и 8 раз выше чем у здоровых субъектов.
Данных о применении помалидомида у детей и подростков ( Пожилые
Данных о фармакокинетике помалидомида у пожилых пациентов нет. В клинических исследованиях не требовалось изменения дозы у пациентов старше 65 лет получавших помалидомид (см. «Способ применения и дозы»).
Исследования помалидомида у пациентов с почечной недостаточностью не проводились.
Исследования помалидомида у пациентов с печеночной недостаточностью не проводились.
Результаты доклинического изучения безопасности
В токсикологическом исследовании на крысах помалидомид обладал хорошей переносимостью в дозах 50 250 и 1000 мг/кг/день с многократным дозированием в течение 6 месяцев. Не отмечено нежелательных реакций на препарат при дозировании помалидомида вплоть до 1000 мг/кг/день (что в 175 раз выше терапевтической дозы равной 4 мг). Помалидомид не проявлял мутагенного действия и не вызывал хромосомных аберраций в лимфоцитах периферической крови человека или образования микроядер в полихроматических эритроцитах костного мозга крыс в дозах до 2000 мг/кг/день. Помалидомид обладал тератогенным эффектом как у крыс так и у кроликов при применении в период основного органогенеза.
Показания:
Имновид в комбинации с дексаметазоном показан для лечения взрослых пациентов с рецидивирующей и рефрактерной множественной миеломой получивших не менее двух предшествующих курсов лечения включавших как леналидомид так и бортезомиб и у которых отмечалось прогрессирование заболевания на фоне последнего лечения.
Противопоказания:
— Повышенная чувствительность к помалидомиду или любым другим компонентам препарата.
— Беременность и период грудного вскармливания.
— Для женщин: сохраненный детородный потенциал за исключением случаев когда соблюдены все необходимые условия Программы предохранения от беременности (см. «Особые указания»).
— Для мужчин: невозможность или неспособность соблюдать необходимые меры контрацепции указанные в разделе «Особые указания».
— Детский возраст до 18 лет (в связи с отсутствием данных по эффективности и безопасности).
С осторожностью:
— У пациентов с почечной и/или печеночной недостаточностью (см. также «Способ применения и дозы») а также у пациентов имеющих тромбоз глубоких вен (в том числе в анамнезе).
— У пациентов с наличием факторов риска тромбоэмболий (заболевания сердца или легких повышенное артериальное давление или повышенная концентрация холестерина в крови курильщики).
— При совместном приеме с препаратами повышающими риск тромбозов а именно с препаратами обладающими эритропоэтической активностью и гормонозаместительной терапией (см. также «Побочное действие» и «Взаимодействие с другими лекарственными препаратами»).
— У пациентов с распространенной стадией заболевания и/или высокой опухолевой нагрузкой в связи с потенциальным риском развития синдрома лизиса опухоли (см «Особые указания»).
— У пациентов с нейропатией (в том числе и в анамнезе).
Беременность и лактация:
Помалидомид может обладать тератогенным действием у людей. Препарат противопоказан во время беременности и у женщин с сохраненным детородным потенциалом за исключением случаев применения с соблюдением всех условий предохранения от беременности (см. «Противопоказания» и «Особые указания»).
Период грудного вскармливания
Не установлено выделяется ли помалидомид с грудным молоком человека. Помалидомид обнаруживался в молоке крыс которым вводили препарат. Учитывая возможность нежелательного действия помалидомида на новорожденных необходимо прекратить либо грудное вскармливание либо прием препарата принимая во внимание важность приема данного лекарственного средства для матери.
У животных помалидомид обладает неблагоприятным влиянием на фертильность и тератогенным эффектом. Помалидомид проникает через плаценту и обнаруживается в крови плода (согласно данным полученным на кроликах).
Способ применения и дозы:
Лечение препаратом необходимо начинать и проводить только под наблюдением врача имеющего опыт в лечении множественной миеломы.
Имновид следует принимать каждый день в одно и тоже время. Капсулы нельзя открывать разламывать или разжевывать. Капсулы препарата Имновид следует проглатывать целиком запивая водой вне зависимости от приема пищи. Если пациент забыл принять Имновид в какой-либо день то на следующий день он должен принять обычную дозу в соответствии с назначением. Пациент не должен изменять дозу препарата для восполнения пропущенной накануне дозы.
Рекомендуемая начальная доза препарата Имновид составляет 4 мг внутрь 1 раз вдень с 1 по 21 день повторных 28-дневных циклов.
Рекомендуемая доза дексаметазона составляет 40 мг внутрь 1 раз в день в 1 8 15 и 22 день каждого 28-дневного цикла.
Режим дозирования сохраняется или изменяется в зависимости от клинических и лабораторных данных.
Лечение должно быть прекращено в случае прогрессирования болезни.
Изменение дозы помалидомида или прерывание лечения
Инструкции по прерыванию лечения или изменению дозы помалидомида в связи с нежелательными гематологическими реакциями представлены в таблице ниже:
Инструкция но изменению дозы помалидомида
Токсичность
Изменение дозы
Нейтропения
— АКН * 9 /л или фебрильная нейтропения (температура ≥ 385°C и АКН 9 /л)
Прервать лечение помалидомидом еженедельно выполнять ОАК**.
— АКН восстановилось до значений ≥1 х 10 9 /л
Возобновить лечение помалидомидом в дозе 3 мг в день.
— Для каждого последующего снижения
Прервать лечение помалидомидом
— АКН восстановилось до значений ≥1 х 10 9 /л
Возобновить лечение помалидомидом в дозе на 1 мг ниже предыдущей.
Тромбоцитопения
— Количество тромбоцитов 9 /л
Прервать лечение помалидомидом еженедельно выполнять ОАК**
— Количество тромбоцитов восстановилось до значений ≥50 х 10 9 /л
Возобновить лечение помалидомидом в дозе 3 мг в день.
— Для каждого последующего снижения
Прервать лечение помалидомидом
— Количество тромбоцитов восстановилось до значений ≥50 х 10 9 /л
Возобновить лечение помалидомидом в дозе на 1 мг ниже предыдущей.
Для начала нового цикла лечения помалидомидом количество нейтрофилов должно быть ≥ 1 х 10 9 /л а количество тромбоцитов ≥ 50 х 10 9 /л.
При нейтропении врач должен рассмотреть возможность применения препаратов фактора роста.
При нежелательных реакциях 3 или 4 степени связанных с помалидомидом лечение необходимо приостановить и возобновить в дозе на 1 мг ниже предшествующей если по оценке лечащего врача тяжесть нежелательного явления снижается до 2 или менее степени.
Если нежелательные реакции сохраняются после снижения дозы до 1 мг прием препарата следует прекратить.
Инструкция по изменению дозы дексаметазона
Токсичность
Изменение дозы дексаметазона
Диспепсия 1-2 степени
Поддерживать дозу и применять блокаторы гистамина (Н2) или аналогичные средства. Снизить дозу на один уровень при сохранении
Диспепсия ≥3 степени
Прервать лечение до ослабления симптомов. Добавить блокаторы гистамина (Н2) или
аналогичные средства и снизить дозу на один уровень при возобновлении лечения.
Применять диуретики по необходимости и снизить дозу на один уровень.
Спутанность сознания и изменения настроения ≥2 степени
Прервать лечение до разрешения симптомов. При возобновлении лечения снизить дозу на один уровень.
Мышечная слабость ≥2 степени
Прервать лечение пока показатель мышечной слабости не станет ≤1 степени. При возобновлении лечения снизить дозу на один уровень.
Гипергликемия ≥3 степени
Снизить дозу на один уровень. Применять инсулин или пероральные гипогликемические средства по необходимости.
Прекратить лечение дексаметазоном.
Другие нежелательные явления ≥ 3 степени обусловленные дексаметазоном
Прервать лечение дексаметазоном пока значения нежелательных явлений не станут ≤2 степени. Возобновить лечение снизив дозу на один уровень.
Снижение дозы дексаметазона:
Если токсические явления сохраняются более 14 дней дозу дексаметазона следует снизить на один уровень.
Особенности применения у отдельных групп пациентов
Имновид не рекомендуется для применения у детей и подростков в возрасте до 18 лет в связи с отсутствием клинических данных по эффективности и безопасности.
Изменение дозы помалидомида у пациентов старше 65 лет не требуется. Для пациентов старше 75 лет начальная доза дексаметазона составляет 20 мг один раз в 1 8 15 и 22 день каждого 28-дневного цикла лечения.
Нарушения функции почек
Исследования помалидомида у пациентов с почечной недостаточностью не проводились. Пациентов с умеренной или тяжелой почечной недостаточностью (клиренс креатинина Консультирование
Применение помалидомида у женщин с сохраненным детородным потенциалом противопоказано в случае если неверно одно из следующих утверждений:
Женщина должна
— понимать возможность тератогенного действия помалидомида на плод
— понимать необходимость постоянного использования эффективных методов контрацепции в течение 4 недель до начала лечения во время лечения и 4 недель после окончания лечения помалидомидом
— даже в случае аменореи соблюдать все правила эффективной контрацепции
— быть способной к соблюдению всех правил эффективной контрацепции
— знать и понимать возможные последствия в случае наступления беременности на фоне приема помалидомида а также необходимость срочного обращения за консультацией при подозрении на наступившую беременность
— понимать необходимость неотложного начала приема помалидомида после получения отрицательных результатов теста на беременность
— осознавать необходимость проведения теста на беременность и выполнять его каждые 4 недели за исключением женщин с подтвержденной хирургической стерилизацией
— подтвердить что понимает риск и необходимые меры предосторожности связанные с приемом помалидомида
Врач должен убедиться что женщина с сохраненным детородным потенциалом
— соответствует всем условиям Программы предупреждения беременности включая адекватный уровень понимания ее требований
— согласна с вышеперечисленными условиями.
Применение у мужчин:
Данные изучения фармакокинетики помалидомида у мужчин-добровольцев свидетельствуют о том что помалидомид может содержаться в семенной жидкости пациента. В качестве меры предосторожности все мужчины принимающие помалидомид должны соблюдать следующие условия:
Мужчина должен
— понимать возможный риск тератогенного действия помалидомида при сексуальном контакте с беременной женщиной или женщиной с сохраненным детородным потенциалом
— понимать необходимость использования презервативов при сексуальном контакте с беременной женщиной или женщиной с сохраненным детородным потенциалом не использующей надежные методы контрацепции в период лечения и в течение 7 дней после приостановки и/или завершения лечения. Даже после вазектомии мужчина должен использовать презерватив при сексуальном контакте с беременной женщиной поскольку и в отсутствие сперматозоидов его семенная жидкость может содержать помалидомид.
— понимать что если его партнерша забеременела во время его лечения помалидомидом или в течение 7 дней после прекращения терапии помалидомидом. он должен сразу же проинформировать об этом своего лечащего врача а его партнерше рекомендуется обратиться к врачу-тератологу для обследования и консультации.
Правила контрацепции:
Женщины с сохраненным детородным потенциалом должны использовать один из высокоэффективных методов контрацепции в течение 4 недель до начала лечения во время лечения и в течение 4 недель после окончания лечения помалидомидом даже в случае перерыва в лечении. Исключение составляют пациентки которые на протяжении длительного времени полностью воздерживаются от сексуальных отношений что подтверждается ежемесячно. Если пациентке не подобран эффективный метод контрацепции ее необходимо направить к гинекологу для подбора метода контрацепции и начала его применения.
К примерам высокоэффективных методов контрацепции относят:
— Подкожные гормональные импланты.
— Внутриматочные системы выделяющие левоноргестрел.
— Депо-препараты медроксипрогестерон ацетата.
— Перевязку маточных труб.
— Сексуальные отношения с партнером перенесшим вазэктомию; вазэктомия подтверждается двумя отрицательными анализами семенной жидкости.
— Прогестерон-содержащие таблетки ингибирующие овуляцию (например дезогестрел).
Прием комбинированных пероральных контрацептивов не рекомендован больным множественной миеломой в связи с повышенным риском тромбоэмболических осложнений на фоне лечения помалидомидом и дексаметазоном. Если пациентка использует комбинированные пероральные контрацептивы ее следует перевести на один из эффективных методов контрацепции перечисленных выше. Повышенный риск развития тромбоэмболии сохраняется в течение 4-6 недель после прекращения приема комбинированных противозачаточных средств. Эффективность гормональных противозачаточных препаратов может быть снижена при одновременном назначении дексаметазона.
Подкожные гормональные импланты или внутриматочные системы выделяющие левоноргестрел связаны с повышенным риском инфекционных осложнений в момент их установки и с нерегулярными влагалищными кровотечениями. Пациенткам с нейтропенией использующим эти способы контрацепции следует профилактически назначать антибиотики.
Использование внутриматочных систем выделяющих медь как правило не рекомендуется в связи с высоким риском развития инфекционных осложнений в момент имплантации и повышенной кровопотери во время менструации которая может усилить выраженность нейтропении или тромбоцитопении.
Тесты на беременность
В соответствии с принятой практикой тесты на беременность с минимальной чувствительностью 25 мМЕ/мл должны проводиться под контролем врача всеми женщинами с сохраненным детородным потенциалом включая тех которые полностью и длительно воздерживаются от сексуальных отношений.
Согласно рекомендациям проведение теста на беременность назначение и выдача препарата должны проводиться в один и тот же день. Женщина с сохраненным детородным потенциалом должна получить помалидомид не позднее 7 дней после назначения лечения.
После того как пациентка использовала эффективный метод контрацепции в течение 4 или более недель тест выполняется под контролем лечащего врача в день назначения помалидомида или за 3 дня до визита к лечащему врачу. Тест должен подтвердить отсутствие у пациентки беременности на момент начала приема помалидомида.
Во время и после лечения
— Тест на беременность под наблюдением врача следует повторять каждые 4 недели включая 4 недели после окончания лечения за исключением женщин с подтвержденной хирургической стерилизацией. Тесты выполняются в день визита или в течение 3 дней перед визитом к лечащему врачу.
Мужчины
Мужчинам-пациентам не разрешается быть донорами семени или спермы на протяжении всего времени лечения (включая перерывы в лечении) и в течение 7 дней после завершения приема помалидомида.
Дополнительные меры предосторожности
Пациенты не должны передавать препарат другим лицам. По окончании лечения неиспользованный препарат рекомендуется возвратить в медицинское учреждение. Пациентам не разрешается быть донорами крови семени или спермы на протяжении всего времени лечения (включая перерывы в лечении) и в течение 7 дней после завершения приема помалидомида.
Обучающие материалы ограничения в назначении и выдаче препарата
Пациентов с периферической нейропатией ≥ 2 степени тяжести не включали в клинические исследования помалидомида. При решении вопроса о назначении лечения помалидомидом таким пациентам нужно проявлять осторожность.
Выраженное нарушение функций сердца
Пациентов с выраженными нарушениями функций сердца (застойная сердечная недостаточность [Класс III или IV по NYHA]; инфаркт миокарда в течение 12 месяцев до начала исследования; нестабильная или плохо контролируемая стенокардия) не включали в клинические исследования помалидомида. Осложнения в виде сердечной недостаточности включая застойную сердечную недостаточность и отек легких (см. раздел «Побочное действие») отмечали в основном у пациентов с уже существующей сердечной недостаточностью или факторами риска заболеваний сердца. При решении вопроса о назначении лечения помалидомидом таким пациентам нужно проявлять осторожность включая регулярные осмотры для выявления симптомов сердечной недостаточности.
Синдром лизиса опухоли
Наибольший риск синдрома лизиса опухоли имеется у пациентов с большой опухолевой нагрузкой на момент начала лечения. За этими пациентами должно быть организовано тщательное наблюдение с применением соответствующих профилактических мер.
Первичные опухоли другой локализации
Образование первичных злокачественных опухолей другой локализации зарегистрировано у пациентов получавших помалидомид. Врач должен тщательно обследовать пациентов до и во время лечения с помощью стандартных методов скрининга новообразований для выявления первичной опухоли другой локализации и при необходимости назначить соответствующее лечение.
Были зарегистрированы ангионевротический отек и выраженные кожные реакции. Пациентов с серьезными аллергическими реакциями на талидомид или леналидомид в анамнезе не включали в клинические исследования помалидомида. Такие пациенты могут иметь повышенный риск развития реакций гиперчувствительности и не должны получать помалидомид. Следует рассмотреть возможность прерывания или прекращения лечения помалидомидом в случае кожной сыпи 2-3 степени тяжести. При развитии ангионевротического отека кожной сыпи 4 степени тяжести эксфолиативной или буллезной кожной сыпи помалидомид должен быть отменен.
Головокружение и спутанность сознания
Имеются сообщения о возникновении головокружений и спутанности сознания на фоне помалидомида. Пациентам следует избегать ситуаций когда головокружение и спутанность сознания могут представлять проблему и не принимать другие лекарственные средства которые могут вызывать такие же нарушения без предварительной медицинской консультации.
Интерстициальное заболевание легких (ИЗЛ)
ИЗЛ и другие сходные явления включая случаи пневмонита наблюдались на фоне лечения помалидомидом. Пациентам с острыми симптомами или необъяснимым ухудшением легочной симптоматики следует провести тщательное обследование для исключения ИЗЛ. В ходе этого обследования лечение помалидомидом должно быть приостановлено а при подтверждении диагноза ИЗЛ назначена соответствующая терапия. Лечение помалидомидом может быть возобновлено только после тщательной оценки пользы и риска.
Меры предосторожности при утилизации и обращении
Капсулы нельзя раскрывать или разламывать. При попадании порошка помалидомида на кожу ее необходимо немедленно промыть водой с мылом. При контакте помалидомида со слизистыми оболочками их следует тщательно промыть водой.
Неиспользованный лекарственный препарат и загрязненные им материалы должны быть утилизированы в соответствии с установленными требованиями. По окончании лечения неиспользованный препарат рекомендуется возвратить в медицинское учреждение.
Влияние на способность управлять трансп. ср. и мех.:
Имновид обладает незначительным или умеренным влиянием на способность управлять автомобилем или механизмами. Некоторые побочные действия препарата Имновид такие как утомляемость заторможенность спутанность сознания и головокружение могут отрицательно влиять на способность управления автомобилем и выполнение потенциально опасных видов деятельности требующих повышенной концентрации внимания и быстроты психомоторных реакций. При появлении таких нежелательных явлений следует воздержаться от выполнения данных видов деятельности.
Форма выпуска/дозировка:
Капсулы 1 мг 3 мг 4 мг.
Упаковка:
По 7 капсул в блистере из ПВХ/ПТФХЭ и фольги алюминиевой.
По 3 блистера вместе с инструкцией по медицинскому применению в картонной пачке.
Условия хранения:
Хранить при температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Срок годности:
Не использовать после истечения срока годности указанного на упаковке.
Условия отпуска
Производитель
Селджен Интернешнл Сарл., Route de Perreux 1, 2017 Boudry, Switzerland, Швейцария