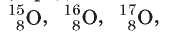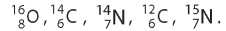Найди чем отличаются атомы нуклидов b11 и b10
Таблица нуклидов
Период полураспада (пример: Gd)| 145 Gd | Нестабильный (менее суток) |
| 146 Gd | 1—10 дней |
| 149 Gd | 10—100 дней |
| 153 Gd | 100 дней — 10 лет |
| 148 Gd | 10—10 000 лет |
| 150 Gd | 10 тыс.—700 млн лет |
| 158 Gd | Стабильный |
Эта таблица нуклидов содержит все известные науке нуклиды. Количество протонов (атомный номер) увеличивается слева направо, а нейтронов — сверху вниз, то есть вертикальные столбцы включают все изотопы химического элемента, а горизонтальные строки — изотоны.
Период полураспада нуклида показан цветом его ячейки (смотрите расшифровку цветов справа на примере гадолиния). Цветные рамки показывают время жизни наиболее стабильных ядерных изомеров.
Интересный факт: не существует стабильных или хотя бы долгоживущих нуклидов с массовыми числами 5 и 8.
Помогите с химией СРОЧНО.
Выбери верные утверждения:
1 число электронов в атоме равно числу протонов в ядре
2 число нейтронов в атоме равно числу протонов
3 нуклоны — протоны, нейтроны
4 масса протона намного меньше массы нейтрона
Найди, чем отличаются атомы нуклидов Li6 и Li7:
1 количеством нейтронов
2 количеством электронов в электронной оболочке
3 числом содержащихся в ядре протонов
4 зарядом ядра
Выбери характеристику понятия «нуклоны»:
1 мельчайшая частица вещества, состоящая из положительного ядра и 2отрицательных электронов
3 элементарные частицы, входящие в состав ядра
4 разновидности атомов элемента с одинаковым зарядом ядра, но разным числом нейтронов в нём
Найди верное утверждение:
А) нуклид Mg24 имеет на 2 электрона меньше, чем нуклид Mg26;
Б) нуклид Mg26 имеет на 2 протона больше, чем нуклид Mg24;
В) нуклид Mg26 имеет на 2 нейтрона больше, чем нуклид Mg24;
Г) нуклид Mg24 имеет на 2 протона меньше, чем нуклид Mg26.
(В ответе запиши букву: например Б)
Выбери верные утверждения:
1 масса протона равна массе электрона
2 электрон — элементарная частица с зарядом 1-
3 атом — электронейтральная частица
4 число нейтронов в атоме равно числу протонов
А) нуклид C12 имеет на 2 электрона меньше, чем нуклид C14;
Б) нуклид C14 имеет на 2 протона больше, чем нуклид C12;
В) нуклид C14 имеет на 2 нейтрона больше, чем нуклид C12;
Г) нуклид C12 имеет на 2 протона меньше, чем нуклид C14.
§10. Нуклиды и изотопы. Понятие о радиоактивности
Д. И. Менделеев, размещая химические элементы в периодической системе, вынужден был поставить некоторые из них не в порядке возрастания атомных масс.
В то время этому факту не было объяснения, и Д. И. Менделеев руководствовался только принципом периодичности, согласно которому эти элементы должны были занимать места в соответствии с химическими свойствами их атомов.
НУКЛИДЫ
Исследованиями начала XX веке было установлено, что атомы одного и того же элемента могут иметь разные массы. Это объясняется тем, что в их ядрах при одном и том же числе протонов может находиться разное число нейтронов. Общее число протонов (Z) и нейтронов (N) в ядре называется массовым числом атома (А):
Массовое число практически определяет массу ядра, а следовательно, и массу всего атома, так как масса электронов составляет ничтожную часть общей массы атома. Т.е. массовое число приблизительно равно относительной атомной массе элемента.
Заряд ядра атома Z (т. е. число протонов) и его массовое число A указывают числовыми индексами слева от символа химического элемента:
Вид атомов с определенным значением атомного номера и массового числа называется нуклидом. Т.е. нуклид – это химический элемент с указанием массового числа.
Например, углерод-12, или 12 С; кислород-16, или 16 O; сера-35, или 35 S. Число нейтронов N у любого нуклида легко подсчитать по разности
Еще один вопрос стоял перед учеными: почему относительные атомные массы большинства элементов не являются целочисленными величинами, хотя массовые числа их нуклидов выражаются целыми числами?
Открытие изотопов позволило дать ответ на этот вопрос.
ИЗОТОПЫ
В начале XX в. было доказано, что большинство химических элементов в природе существует в виде нескольких нуклидов. Так, природный литий (Z = 3), кроме нуклидов, в ядрах которых находится 4 нейтрона, имеет нуклиды с числим нейтронов 3. Массовые числа таких нуклидов равны соответственно 6 и 7: 3 6 Li и 3 7 Li.
Нуклиды такого типа назвали изотопами.
Изотопами называются нуклиды, имеющие одинаковый атомный номер (т.е. одинаковое число протонов в ядре), но различные массовые числа
Следовательно, нуклиды 3 6 Li и 3 7 Li — изотопы лития. Другими словами, изотопы — это разновидности атомов одного и того же эле мента, в ядрах которых содержится разное число нейтронов.
Следовательно, атомы данного химического элемента — это нуклиды с одинаковым зарядом ядра (атомным номером).
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
В природе большинство химических элементов существуют в виде смеси нуклидов, каждый из которых характеризуется своим собственным значением массового числа. Поэтому относительная атомная масса данного элемента является усредненной величиной относительных атомных масс его нуклидов. Конечно, при этом учитывается содержание каждого нуклида в природной смеси.
Теперь понятно, почему относительная атомная масса калия меньше, чем аргона. У калия более 93 % его природных атомов имеет массовое число 39, а у аргона 99 % природной смеси приходится на долю нуклида аргон-40. Поэтому относительная атомная масса калия ближе к 39, а аргона — к 40. Однако заряд ядра атомов калия равен 19+, а аргона 18+, и поэтому в таблице они размещаются согласно этой главной характеристике химического элемента.
Относительная атомная масса элемента — физическая величина, которая показывает, во сколько раз средняя масса атомов данного химического элемента больше 1/12 части массы нуклида углерода-12 ( 12 С).
ЯВЛЕНИЕ РАДИОАКТИВНОСТИ
Все нуклиды можно разделить на два типа: стабильные и радиоактивные. Само название «стабильный» говорит об устойчивости данного нуклида, т. е. его способности существовать без изменения состава ядра сколь угодно долго. Стабильность этих нуклидов определяется прежде всего устойчивостью их ядер.
Устойчивость ядра зависит только от соотношения между числом протонов и нейтронов (для каждого элемента оно свое). Если это соотношение выходит за определенные пределы, ядро (а вместе с ним и атом) становится неустойчивым.
Оно самопроизвольно распадается, превращаясь в ядра атомов других элементов. При этом происходит испускание различных частиц. Это явление и есть радиоактивность.
Радиоактивностью называется самопроизвольное превращение неустойчивых атомных ядер в другие ядра, сопровождающееся испусканием различных частиц.
Ядро нуклидов состоит из нуклонов
Нуклон — частица протон и нейтрон, которые образуют ядро атома.
Ядро атома имеет в диаметре всего лишь несколько ферми (1·10⁻¹⁵ метров), но плотность его огромна (1014 кг/см3). В зависимости от количества нуклонов различаются разные виды атомных ядер, т. е. нуклидов.
Ядро — это сердце атома. Поэтому его обозначают химическим символом атома (элемента).
Нуклон связан со своим нуклидом значительной энергией связи. Эту энергию связи передал нуклон, вступая в систему. Чем больше энергия связи нуклонов в нуклиде, тем стабильнее нуклид.
Нуклиды — совокупность атомов и ядер различных элементов с определенным значением нейтронов и протонов.
Таким образом, нуклоны и нуклиды хотя и имеют схожее написание, но имеют разное значение.
Ядра отличающиеся по числу нейтронов и протонов
Один и тот же элемент может иметь различные виды атомов или нуклиды (изотопы). Например, ядро хлора может иметь 18 или 20 нейтронов.
Каждый нуклид определяется двумя величинами: количеством протонов Z и количеством нейтронов N. Таким образом, количество нуклонов в нуклиде равно Z + N, оно обозначается символом А и называется массовое (нуклонное) число, ибо определяет массу нуклида.
В настоящее время известно более 1400 нуклидов или изотопов. Количество протонов в видах атома колеблется от 1 до 105. Количество нейтронов от 0 до 157.
Большинство нуклидов радиоактивно, т. е. со временем распадаются, постоянных насчитывается немногим больше 280. Множество их создано искусственно и они нестабильны и распадаются.
Специалисты пользуются так называемой картой нуклидов. Это сеть квадратиков, где на горизонтальной оси дано количество нейтронов N, а на вертикальной — количество протонов Z. Каждому соответствуют две величины (N, Z), то есть один квадрат на карте нуклидов.
Несмотря на большую разнородность атомных ядер или нуклидов, эти системы состоят лишь из двух видов элементарных частиц — из протонов и нейтронов. Они связаны ядерной силой, радиус действия которой только один ферми. Наоборот, электрическая сила протонов существенно превышает радиус действия ядерных сил. Она притягивает электроны и в то же время отталкивает остальные совокупности атомов.
Образование ядер элементов
Звезды такие как и наше Солнце живут за счет освобожденной энергии связи. Электроны как основные элементарные частицы не имеют при этих превращениях большого значения, ведь речь идет о ядерных реакциях с выделением термоядерной энергии. Ядра водорода и гелия соединяются в тяжелые элементы, проще сказать, что водород превращается в тяжелые элементы. Астрономам удалось определить, сколько атомов, точнее говоря, ядер различных элементов во Вселенной возникло из водорода.
Сейчас во Вселенной больше всего атомов водорода, так как они еще не превратились в тяжелые элементы. Относительно мало лития, бериллия и бора, так как эти элементы превратились в гелий еще в начале звездной эволюции. И наоборот, элементов, располагающихся в периодической системе вокруг железа, во Вселенной относительно много. Их ядра самые стабильные.
Таким образом, более сложная система — атом — построен из нуклидов и электронов при помощи ядерной силы притяжения.
Найди чем отличаются атомы нуклидов b11 и b10
• характеристики частиц, из которых состоят атомы (табл. 5);
• атомная единица массы — единица измерения масс атомов, она равна 1/12 массы атома Карбона.
Понятие о нуклидах
Как вы уже знаете, ядра атомов состоят из протонов и нейтронов.
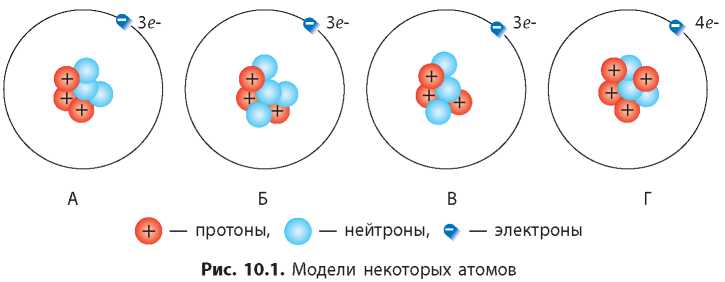
Ядра разных атомов могут содержать разное или одинаковое число протонов и нейтронов. Например, на рисунке 10.1 на с. 50 изображены модели четырех атомов. В ядрах этих атомов содержится по три или четыре протона и нейтрона. Но мы видим, что ядра атомов А и В имеют одинаковый состав: они содержат по три протона и три нейтрона. Ядро атома Б также содержит три протона, но в нем четыре нейтрона. Хотя в ядре атома Г также семь частиц, как у атома Б, но распределение по протонам и нейтронам иное.
Итак, на рисунке 10.1 изображены три разновидности атомов. Каждую такую разновидность атомов называют нуклидом. Вы видите,
что атомы А и В — это атомы одного нуклида, атомы Б — второго, а атомы Г — третьего.
Нуклид — это разновидность атомов с определенным числом протонов и нейтронов в ядре.
Каждый нуклид характеризуют определенными числами: протонное число Z указывает число протонов в ядре атома данного нуклида;
нейтронное число N указывает число нейтронов; массовое число, или нуклонное число, А — это число нуклонов, оно равно сумме протонного и нейтронного чисел:
массовое число = протонное число + нейтронное число
Поскольку массы протона и нейтрона равны приблизительно 1 а. е. м., а масса электрона мизерная, то массовое число атома приблизительно равно его относительной атомной массе, округленной до целого числа.
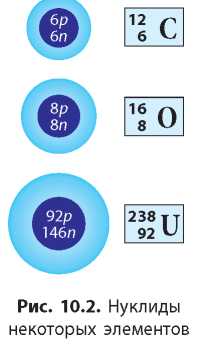
В науке используют специальные обозначения нуклидов: заряд ядра, т. е. протонное число, пишут слева внизу от символа химического элемента, а массовое число — слева вверху (рис. 10.2).
Например, для нуклида Оксигена:
Иногда протонное число опускают и пишут просто 15 O, поскольку и так известно, что у всех нуклидов Оксигена протонное число равно 8.
Нуклиды можно обозначать как химическими символами, так и с использованием названий химических элементов, например: Оксиген-15,
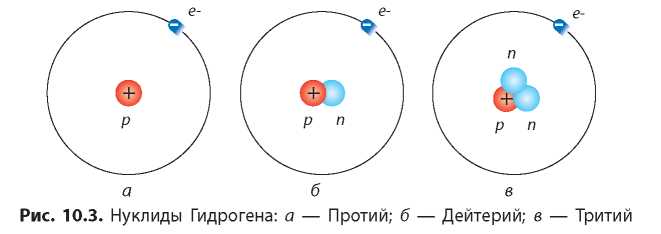
Нуклиды единственного элемента — Гидрогена — кроме таких обозначений еще имеют собственные названия: обычный Гидроген H (Jh ) —
Протий, ядра его атомов состоят только из одного протона (рис. 10.3а); тяжелый Гидроген D (ІН) — Дейтерий, в ядрах его атомов кроме одного протона имеется еще один нейтрон (рис. 10.36); сверхтяжелый Гидроген Т (^H) — Тритий, в ядрах атомов которого кроме одного протона имеется два нейтрона (рис. 10.3е). Ученым удалось получить еще суперсверхтяжелый Гидроген 1н, но собственного названия у него пока нет.
Зная порядковый номер элемента и массовое число нуклида, легко вычислить, сколько электронов, протонов и нейтронов содержит этот атом:
• число электронов равно числу протонов Z, которое совпадает с порядковым номером (зарядом ядра);
Пример. Сколько протонов, нейтронов и электронов содержится в нуклиде Плюмбум-210?
Массовое число этого нуклида Плюмбума равно 210. Так как порядковый номер Плюмбума — 82, то в атоме нуклида Плюмбума-210 содержится 82 протона и 82 электрона. Число нейтронов вычислим как разность между массовым числом и числом протонов:
Ответ: 82 протона, 128 нейтронов, 82 электрона.
Понятие об изотопах
Мы уже выяснили, что ядра атомов одного химического элемента содержат одинаковое число протонов, которое равно порядковому номеру этого элемента в Периодической системе. Но если протонов в ядрах данного элемента должно содержаться строго определенное число, то число нейтронов в ядре может быть разным, поскольку это не влияет на заряд ядра, а только на его массу.
На рисунке 10.1 на с. 50 изображены модели некоторых атомов. И хотя атомы А и Б являются атомами разных нуклидов, в их ядрах одинаковое число протонов (по три). Таким образом, эти нуклиды представляют один и тот же химический элемент: они проявляют одинаковые химические свойства, но обладают разной массой.
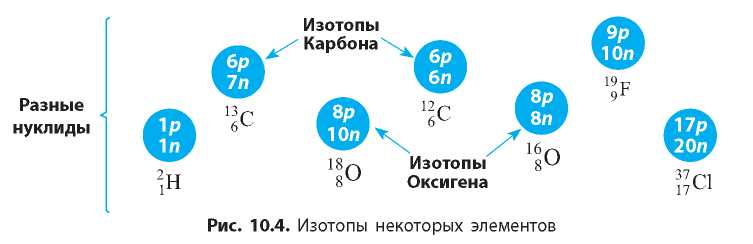
Все нуклиды, имеющие одинаковый заряд (протонное число) и разное нейтронное число, называют изотопами (рис. 10.4). Поскольку нуклиды с одинаковым протонным числом относятся к одному химическому элементу, то:
Изотопы — это разные нуклиды одного химического элемента.
Например, в ядре атомов Оксигена содержится 8 протонов (порядковый номер Оксигена в Периодической системе — 8). А число
нейтронов может быть 7, 8, 9 и даже 10. Следовательно, среди атомов Оксигена можно выделить четыре разных нуклида:
1 ^O. Но все эти нуклиды являются изотопами.
Всего известно более 2000 нуклидов. Поскольку химических элементов в настоящее время насчитывается 118, то большинство этих нуклидов являются изотопами, и можно предположить, что в среднем на каждый элемент приходится около 10 нуклидов. Но, безусловно, каждый химический элемент имеет разное число нуклидов.
Рекордсмены по числу нуклидов — Ксенон и Цезий: каждый из них существует в виде 36 нуклидов, большинство из которых нестабильны.
У большинства химических элементов имеются природные нуклиды, т. е. те, что встречаются в природных телах. Таких нуклидов существует около 300. Остальные нуклиды получены искусственно.
В природе элементы обычно существуют в виде смеси нескольких нуклидов, например Карбон ( 12 C, 13 C и 14 C), Нитроген ( 14 N и 15 N). Рекордсменом по числу природных нуклидов (10) является Станнум. А некоторые химические элементы имеют лишь один природный нуклид, например Флуор ( 19 F), Натрий ( 23 Na), Фосфор ( 31 P).
Вы, наверное, заметили, что значения относительных атомных масс элементов, приведенные в Периодической системе, не целые числа: Ar(C) = 12,011, Ar(Cl) = 35,453, а массовые числа всех нуклидов — целые числа. Это связано с тем, что большинство элементов встречается в природе в виде нескольких нуклидов, и значение, приведенное в таблице, является средним, вычисленным с учетом содержания каждого нуклида. Так, природный Хлор на 75 % состоит из атомов 35 Cl и на 25 % — из 37 Cl, поэтому его относительная атомная масса равна 35,5.
• Все нуклиды разделяют на стабильные и нестабильные. Стабильные нуклиды существуют бесконечно долго. Большинство окружающих нас атомов относятся именно к стабильным нуклидам.
• Химические элементы, не имеющие стабильных нуклидов, называют радиоактивными. К ним относятся все элементы, расположенные в Периодической системе за Бисмутом, а также Технеций и Прометий. Большинство радиоактивных элементов получено искусственно и в природе не встречаются. В Периодической системе вместо относительной атомной массы для радиоактивных элементов указывают массовые числа самых стабильных из их нуклидов.
На греческом языке изос означает «равный, одинаковый, подобный», а топос — «место». Что, по вашему мнению, означает термин «изотоп»?
На латыни nucleos означает «ядро», а eidos — «разновидность». Зная это, объяснит определение термина «нуклид».
• Радиоактивный химический элемент Астат — самый редкий элемент из всех, что встречаются в природе. Если собрать весь Астат в земной коре, то получим не больше одного грамма.
• Радиоактивный радон используют в медицинской практике, в частности для лечения злокачественных опухолей.
. 1. Разновидность атомов с определенным числом протонов и нейтронов называют нуклидом. Если нуклиды содержат одинаковое число протонов, т. е. являются нуклидами одного химического элемента, то такие нуклиды называют изотопами. Разные нуклиды обозначают, указывая массовое число рядом с символом элемента, а нуклиды Гидрогена имеют собственные названия: Протий, Дейтерий, Тритий.
2. Каждый нуклид описывают определенными числами: протонное число Z — число протонов в ядре, нейтронное число N — число нейтронов в ядре, массовое число A — нуклонное число, равное сумме протонного и нейтронного чисел.
3. Каждый элемент может существовать в виде нескольких нуклидов. Нуклиды, встречающиеся в природе, называют природными. Нуклиды, которые могут существовать бесконечно долго, называют стабильными, а нуклиды, которые со временем подвергаются радиоактивному распаду, — радиоактивными.
1. Дайте определения понятий «нуклид» и «изотоп».
2. Чем отличаются стабильные и нестабильные нуклиды? Приведите примеры стабильных и нестабильных нуклидов.
3. Изотопы отличаются друг от друга: а) числом протонов; б) числом нейтронов; в) числом электронов.
4. Как определить число протонов, нейтронов и электронов в атоме?
5. Назовите изотопы Гидрогена. Чем они отличаются?
Задания для усвоения материала
1. Ядро атома химического элемента содержит два протона и один нейтрон. Запишите обозначение этого атома: укажите химический символ, порядковый номер и массовое число.
2. Сколько протонов и нейтронов содержат ядра 7 O, 14 C, 137 Cs?
3. Чем отличается состав ядер атомов нуклидов: а) Лития 6 Li и 7 Li; б) Урана 235 U и 239 U?
4. Какой нуклид Натрия содержит такое же число нейтронов, что и нуклид 24 Mg?
5. Назовите элементы, ядра атомов которых содержат: а) 2 протона и 2 нейтрона; б) 15 протонов и 16 нейтронов; в) 35 протонов и 45 нейтронов. Напишите обозначения этих нуклидов.
6. Из данного перечня выберите: а) изотопы; б) нуклиды с одинаковым нейтронным числом; в) нуклиды с одинаковым нуклонным числом.
Сколько разных видов молекул воды может быть образовано из трех нуклидов Гидрогена и трех нуклидов Оксигена?
Относительная атомная масса Бора составляет 10,81. Как вы считаете, в виде каких нуклидов существует Бор в природе?
Нестабильные нуклиды подвержены радиоактивному распаду, вследствие чего возникает радиоактивное излучение. В дополнительных источниках найдите информацию о видах радиоактивного излучения и их влиянии на живые организмы.
В дополнительных источниках информации найдите примеры использования ядерных реакций в разных областях человеческой деятельности. На каких процессах они основываются? Как влияют на окружающую среду? Каким образом можно обеспечить защиту от радиоактивного облучения?