Не использовать парентерально что это
Парентеральное введение лекарственных средств
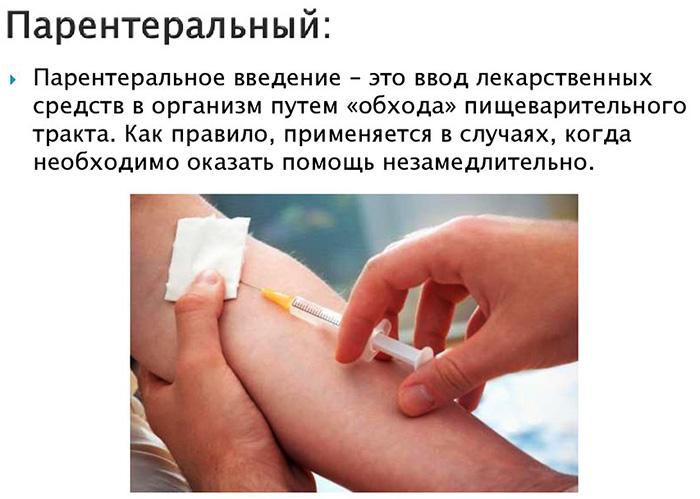
Парентера́льное введение лекарственных средств — это такие пути введения лекарственных средств в организм, при которых они минуют желудочно-кишечный тракт, в отличие от перорального способа применения лекарств. Это прежде всего инъекции и ингаляции. Существуют и другие, более редкие, парентеральные способы введения: субарахноидальный, внутрикостный, интраназальный, субконъюктивальный, — однако они используются в немногих особых случаях.
Различают инъекции малого объёма (до 100 мл) и большого объема, которые называют инфузиями. [1]
Содержание
Преимущества парентерального способа введения
При парентеральном введении лекарственных средств
См. также
Литература
Примечания
Полезное
Смотреть что такое «Парентеральное введение лекарственных средств» в других словарях:
Пероральный приём лекарственных средств — Пероральный приём лекарственных средств приём лекарства через рот (лат. per os, oris), путём проглатывания лекарства. Содержание 1 Применение 2 Недостатки … Википедия
парентеральный способ введения лекарственных средств — Парентеральное введение (подкожное, внутримышечное, непосредственно в кровеносную или лимфатическую системы). [МУ 64 01 001 2002] Тематики производство лекарственных средств Обобщающие термины общие, специфические и прочие … Справочник технического переводчика
Инфузионный насос — производства Фрезениус (Fresenius). Инфузионный насос изделие медицинского назначения для вливания растворов, лекарственных препаратов, питательных веществ в пациента. Обычно инфузионные насосы применяются для в … Википедия
Лютеинизирующий гормон — β полипептид лютеинизирующего гормона Овуляторный всплеск ЛГ (зелёная линия) Обозначения … Википедия
ИНЪЕКЦИЯ — (от лат. injectio вбрасывание), парентеральное введение растворов или жидких лекарственных веществ с лечебной, диагностической или профилактической целями. Для И. используют инъекционные иглы, шприцы, аппарат Боброва и др. И. большого… … Ветеринарный энциклопедический словарь
Туберкулёз — I (tuberculosis; лат. tuberculum бугорок + ōsis) болезнь, вызываемая микобактериями туберкулеза. Наиболее часто поражаются органы дыхания (см. Туберкулез органов дыхания (Туберкулёз органов дыхания)), среди других органов и систем преимущественно … Медицинская энциклопедия
Роды — I Роды Роды (partus) физиологический процесс изгнания из матки плода, околоплодных вод и последа (плаценты, плодных оболочек, пуповины) после достижения плодом жизнеспособности. Жизнеспособным Плод, как правило, становится по истечении 28 нед.… … Медицинская энциклопедия
Способ введения — (путь заражения) в фармакологии, токсикологии и медицине путь введения лекарственного средства, жидкости, отравляющего вещества, инфекционного агента или другого вещества в организм.[1] Содержание 1 Классификация 1.1 … Википедия
Уход — I Уход за больными. Уход совокупность мероприятии, обеспечивающих всестороннее обслуживание больного, выполнение врачебных назначений, создание оптимальных условий и обстановки, способствующих благоприятному течению болезни, быстрейшему… … Медицинская энциклопедия
Тиамин (лекарственное средство) — См. также: Тиамин … Википедия
Парентеральный способ введения лекарственных средств в организм
Наиболее эффективным способом транспортировки лекарственных препаратов в организм человека является парентеральное введение. В этом случае, используемые средства попадают сразу в кровоток, минуя желудочно-кишечный тракт. Такой способ позволяет добиться быстрого и стойкого результата, что особо важно при оказании срочной медицинской помощи.
Определение
Парентеральный способ введения лекарственных средств — это методика транспортировки лекарственных препаратов, вакцин, а также других средств иммунобиологического характера, что позволяет веществу миновать желудочно-кишечный тракт человека.
Такая разновидность введения всегда проходит с нарушением общей целостности кожных, венозных или сосудистых покровов. В некоторых случаях термин может использоваться в качестве впрыскивания фильтрованного вещества для диагностики основных патологических процессов в организме.
Парентеральный способ введения используется значительно реже энтерального, что объясняется значительным снижением побочных эффектов и осложнений при его проведении. Зачастую применяется в случае, когда пациенту требуется срочная медицинская помощь, а также при наличии индивидуальных особенностей организма.
Такой путь введения препарата позволяет обеспечить наиболее стойкую биологическую фильтрацию лекарственного вещества, что возможно благодаря его прохождению через капиллярные стенки и клеточные мембраны. Является единственным способом доставки масляных растворов в организм человека.
Преимущества и недостатки лекарств
Парентеральный способ введения лекарственных средств обладает рядом достоинств, которые преобладают над прероральным методом.
Основные преимущества, учитываемые в медицинской практике:
Также одним из важнейших показателей, который относится к достоинствам применения парентерального введения, является возможность использования действующего вещества пептидной или белковой структуры.
Парентеральный способ введения лекарственных средств характеризуется частым использованием при оказании срочной медицинской помощи, что увеличивает шансы на быстрое выздоровление и отсутствие негативной симптоматики в дальнейшем.
Помимо вышеописанных достоинств, парентеральный способ обладает различными недостатками, основным из которых является наличие физиологических осложнений после проведения процедуры: абсцессы, некрозы или аллергические реакции на индивидуальный раздражитель.
Использование во время проведения процедуры некачественных или нестерильных инструментов повышает риски на заражение различными инфекционными или аутоиммунными заболеваниями, в особенности гепатитом и ВИЧ.
Часто парентеральный способ введения может привести к эндофлибиту — особой формы воспалительного процесса, протекающей в венах.
Исходя из статистических данных, стойкие аллергические реакции при парентеральном способе развиваются намного чаще, нежели при стандартном методе приема медикаментозных средств. Потому, наиболее строгое противопоказание к использованию техники — это наличие переносимости определенного вещества.
Второстепенным осложнением является эмболия масляного или воздушного типа, при которой в стенки кровеносных сосудов может попасть определенное количество воздуха. Такой процесс может способствовать развитию тромбозов или инсультов. Частые инсулиновые инъекции при сахарном диабете могут привести к атрофии.
Относительным недостатком такого метода применения является то, что пациент не способен самостоятельно вводить нужный препарат, потому должен обращаться в специализированное медицинское учреждение. Это может стать основным фактором развития осложнений в случае, когда требуется срочный прием определенного вещества.
Также использование парентерального введения невозможно при наличии у пациента шокового состояния за счет нарушений в процессе кровообращения. Помимо этого, такая процедура является достаточно болезненной.
Как всасываются и распределяются
Распределением лекарственных веществ называется переход препарата из кровотока в органы и ткани организма. Большая часть используемых медикаментозных средств может распределяться неравномерно, что значительно понижает эффективность лечения.
На процесс распределения влияют многочисленные факторы, наиболее важными из которых являются:
| Причина | Описание |
| Растворимость в липидах и воде | Лекарственные средства гидрофильного типа обладают небольшим молекулярным весом, потому хоть и способны проходить в области внеклеточных барьеров, но не могут проникать через мембранную структуру. В то же время липофильные препараты относительно легко распространяются по тканям организма. Вещества, которые не растворяются в воде и жирах, проникают в клеточную структуру исходя из функции трансмембранной системы. |
| Показатель связывания с белковыми структурами | При попадании в кровь, лекарственное средство находится в ней исходя из 2 фракций: связанной и свободной. Поскольку белки не могут взаимодействовать с рецепторами или ферментами, это в некоторых случаях затрудняет процесс транспортировки. Уменьшение функции связывания приводит к увеличению количественного показателя свободной фракции, на 15-20% от общего уровня. |
| Особенности кровотока | После попадания лекарственного вещества в циркуляторную систему, сперва оно достигает тканей и органов, которые лучше всего снабжаются кровью — почки, легкие, печень и сердце. |
| Присутствие биологического барьера | Может встречаться при распространении некоторых видов лекарственных препаратов. В этом случае введению вещества мешают стенки капилляров, мембраны плазматического типа, а также гематоэнцефалический барьер или ГЭБ. |
Всасывание используемого вещества, в первую очередь зависит от техники его введения и физико-химическими особенностями. На показатель также может повлиять лекарственная форма.
Проведение парентеральной транспортировки при помощи инъекции позволяет добиться наибольшей всасываемости, в отличие от таблеток или капель.
Способы введения
Парентеральный способ введения лекарственных средств характеризуется наличием разновидностей, которые отличаются исходя из локализации и места инъекции, посредством которого действующее вещество попадает в кровоток.
Лекарственный препарат вводится подкожно, внутрикожно и внутримышечно. Последний вариант предполагает попадание действующего вещества в кровеносные и лимфатические сосуды. Помимо этого, препарат может вводиться внутрикостно, что проводится при невозможности использования остальных методов.
Отдельная разновидность введения предполагает использование инъекций внутривенно, — непосредственно в сосудистую ткань человека. Такое применение показано пациентам, которым необходимо избежать прохождения вещества через почки и печень.
В отдельных случаях возможно введение препарата в плевральную, суставную или брюшную полость.
Специфические пути введения при помощи парентерального способа:
Вышеописанные специфические разновидности применяются относительно редко, при наличии каких-либо противопоказаний или возможных осложнений, связанных с введением препарата. Отдельные методики позволяют организму точечно получить нужное вещество в определенную область тела, что ускорит процесс всасывания.
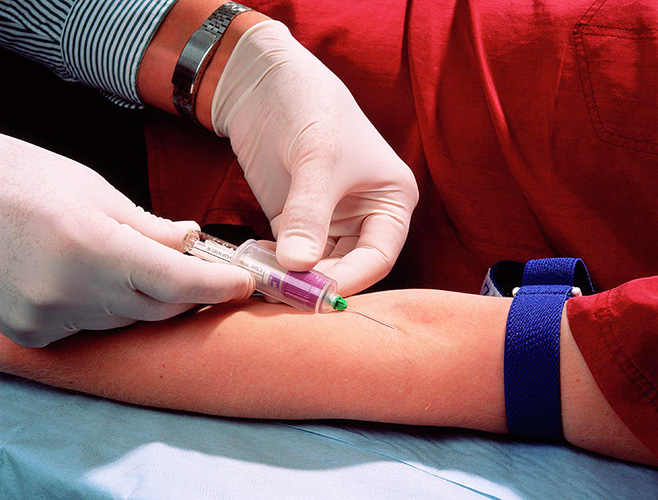
Внутривенное введение
Подготовительные мероприятия по внутривенном введении вещества характеризуются действиями, которые типичны для санитарных рекомендаций — дезинфекция и мытье рук врача, включая стерилизацию иглы шприца и перчаток. Подготовленный инструмент предварительно помещается в стерильный сосуд.
После этого производится сама инъекция, что предполагает наличие следующих действий:
Внутривенная инъекция делается исходя из четкой последовательности действий. Учитывая метод применения и основные показания, может меняться скорость введения вещества.
Основной алгоритм включает:
Процесс проведения внутривенной инъекции предполагает внимательное отслеживание различных показателей состояния у пациента, таких как: бледность кожи, тошнота, головокружение или поднятие температуры.
После введения вещества, игла должна быть быстро извлечена из вены, при этом само место укола прижимается ватным диском, смоченным спиртом. Больному следует спокойно посидеть около 5-10 мин. со слегка согнутой рукой в локтевом суставе. Правильно проведенная инъекция предполагает отсутствие проявления крови или опухлостей.
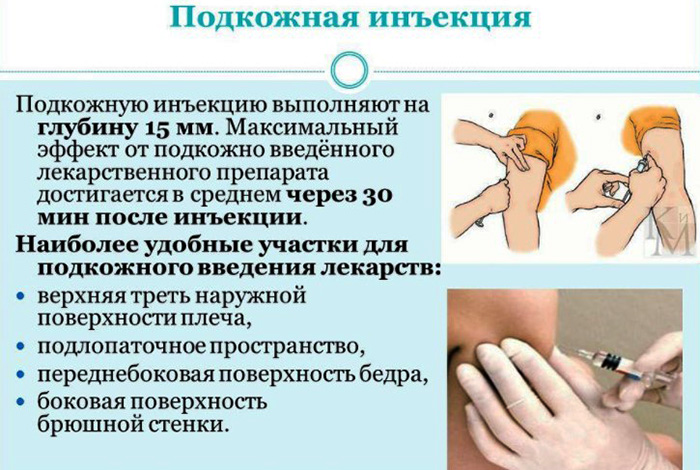
Подкожное введение
Подготовительный этап к подкожным инъекциям никак не отличается от внутривенных. Для начала необходимо стерилизовать руки и дополнительные инструменты.

Также осматривается ампула на наличие внешних проявлений, вещество набирается в шприц. Врач обрабатывает кожу и место укола при помощи спирта.
После этого:
Как и в случае с внутривенным методом, после введения лекарственного вещества, врач прикладывает проспиртованную вату к месту укола. Пациенту также необходимо отдохнуть от 5 до 10 мин. Внешние проявления не должны характеризоваться синим оттенком кожи и опухлостью.
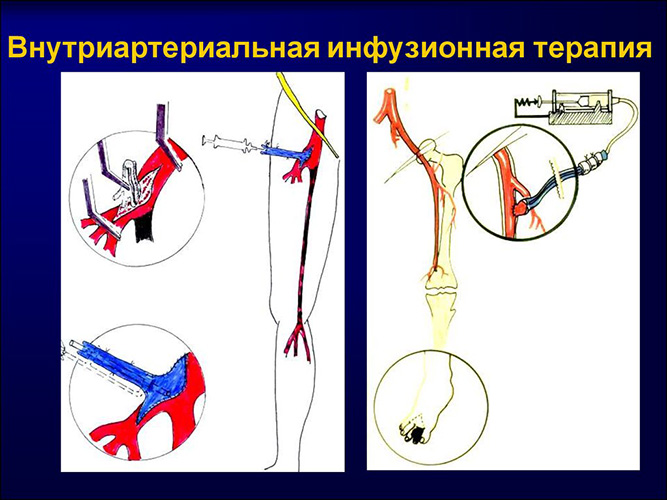
Внутриартериальное введение
Для того чтобы выполнить внутриартериальное введение препарата, врач выбирает артерии, которые расположены в близости к внешнему слою кожи — локтевые сгибы, шейный, бедренный или подмышечный отдел.
Подготовительный процесс для введения выполняется в соответствии с общими рекомендациями. Область для укола определяется медработником исходя из того, где наблюдается наибольшее пульсирование.
Артериальная зона и кожа прокалываются по правилам, характерным для внутривенного введения, при этом учитывается движение крови по артериям. По окончанию процедуры на область укола накладывается повязка, которая оказывает дополнительное давление.
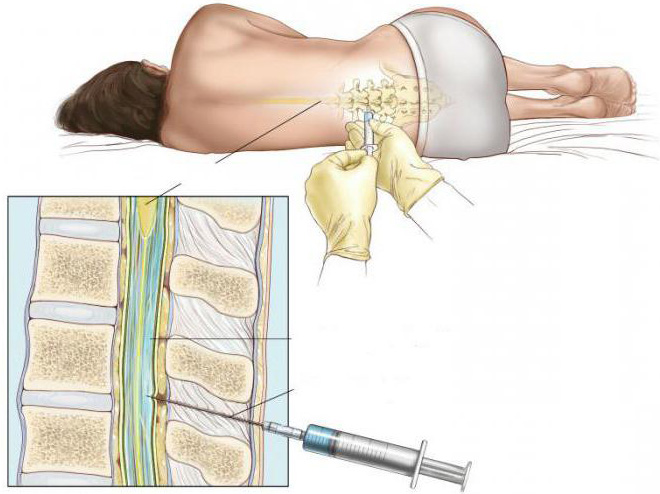
Интратекальное введение
Интратекальное введение медицинского препарата — это наиболее болезненный и сложный метод, который должен выполняться только опытным специалистом. Укол позволяет внести необходимое вещество в спинномозговую жидкость.
В этом случае пациента укладывают на левый бок с одновременным поджатием головы к груди и ног к животу. Локализация укола учитывается исходя из того, где находятся позвонки верхнего поясничного отдела. Помимо антисептических средств, место обрабатывается при помощи обезболивающих средств местного воздействия.
Сама игла вводится в позвоночный канал, при этом дозировка вводимого вещества строго корректируется исходя из глубины внутренних стенок. Такая методика позволяет ввести лекарственный препарат в минимальном количестве, что характеризуется значительным уменьшением побочных эффектов и развития осложнений в будущем.
После проведения укола, пациенту необходимо обездвижено лежать на протяжении 25-30 мин.
Интратекальное введение препарата используется при лечении боли различной локализации, в частности при болезненных проявлениях в шее, спине или хроническом дискомфорте в области живота. Позволяет устранить осложнения при неправильно выполненных операциях на шее и спине.
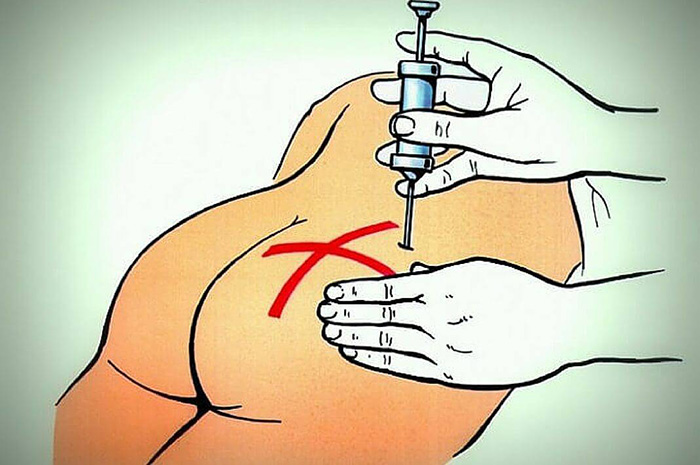
Внутримышечное введение
Внутримышечное введение препарата — это наиболее популярная методика доставки лекарственного средства в медицинской практике. Подготовительный этап аналогичен с внутривенным типом.
Для того чтобы поставить укол, пациент укладывается на кушетку в положении лицом вниз, при этом само место выбирается в верхней области ягодичной мышцы, которое предварительно обрабатывается антисептическим раствором.
Проведение инъекции включает следующие шаги:
Также внутримышечная доставка вещества предполагает использование дельтовидной и трапециевидной мышцы. Неправильное выполнение техники может повлечь за собой такие осложнения, как абсцесс, паралич и фиброз мышечных тканей. Помимо этого, у пациента может развиться гангрена или крапивница, в редких случаях — анафилактический шок.
Подготовка и меры предосторожности
Парентеральный способ доставки вещества требует строгого соблюдения рекомендаций и антисептических правил, потому как введение лекарственных средств без использования стерилизации способно развить различные заболевания инфекционного и патогенного типа.
Следует обратить особое внимание на то, что используемые инструменты, а также руки медицинских работников должны тщательно обрабатываться антисептическими средствами. Непосредственно перед инъекцией, врач должен промыть руки с мылом, после чего — обработать ватным диском, обмоченным в спирт.
Инъекция зачастую проводится в процедурном помещении поликлиники или стационара, в неотложных случаях, возможно введение в домашних условиях, только при помощи опытного медработника.
Помимо самих инструментов, на рабочем столе должны быть пинцеты с дезраствором, спирт, йод, а также специальные приспособления для бесконтактного вскрытия ампул с веществом. Место проведения накрывается стерильной тканью, во избежание риска занесения инфекции. Открывать стол следует только при помощи цапок.
Лекарственный препарат выпускается в виде флаконов или ампул. Перед набором вещества в шприц, следует внимательно прочесть его название, срок годности, а также дозировку. После этого необходимо проверить раствор на прозрачность.
Каждая инъекция требует от врача 2 игл, где одна используется с целью набора вещества (рекомендуется использовать широкий просвет), а другая — для непосредственного введения препарата. Смена инструментов позволяет обеспечить дополнительную стерильность, при этом обработка антисептиками должна происходить и для шеек ампул.
При введении масляного раствора в организм человека, флакон с веществом нагревается до 38℃, используя водяную баню. Для того чтобы доставить препарат, готовый к использованию, применяются стерильные лотки, внизу которых расположены ватные диски, смоченные спиртом.
В медицинской практике нередко встречаются случаи, при которых медработник режется осколками стекла от флакона или ампул. Если такое случилось, необходимо промыть рану, используя перекись водорода, после чего — смазать ее края йодом и наложить сухую повязку, пропитанную антисептическим средством.
Категорически запрещается применять вату в качестве защитного колпачка для иглы. Пренебрежение этим правилом часто влечет за собой развитие подкожной инфильтрации за счет наличия мелких волосистых волокон. Это может быть особо опасно для здоровья пациента. В таком случае лучше использовать одноразовые колпачки, не оставляя иглу шприца незащищенной.
Если лекарственное средство поставляется в виде порошковой субстанции, ее необходимо предварительно развести с использованием растворителя — изотонического раствора, жидкости для инъекций или новокаина. В противном случае, врач не сможет произвести парентеральный способ введения вещества в организм человека.
Видео о парентеральных способах введения лекарственных средств
Парентеральный способ введения лекарственных препаратов: видео-инструкция:

Парентеральное питание в терапевтической практике
Парентеральным питанием (от греч. рara — около + enteron — кишка) называют обеспечение организма питательными ингредиентами (нутриентами) минуя желудочно-кишечный тракт. Парентеральное питание может быть полным, когда все питательные вещества вводят в со
Парентеральным питанием (от греч. рara — около + enteron — кишка) называют обеспечение организма питательными ингредиентами (нутриентами) минуя желудочно-кишечный тракт. Парентеральное питание может быть полным, когда все питательные вещества вводят в сосудистое русло (больной не пьет даже воду), частичным (неполным), когда используют только основные питательные вещества (например, белки и углеводы), и вспомогательным, когда питание через рот недостаточно и требует дополнения.
Патофизиология голодания. В организме взрослого человека главным фактором, определяющим нормальный баланс процессов обмена веществ, является cоотношение между поступлением пищи и расходом энергии.
Если человека лишить пищи, в первую очередь снижается содержание глюкозы в крови и, как следствие, секреция анаболического гормона инсулина. Одновременно повышается секреция катаболического гормона глюкагона, стимулирующего гликогенолиз в печени. Таким образом, запасы гликогена в печени истощаются.
Начиная со вторых суток голодания, глюкагон активирует гормончувствительную липазу, благодаря чему высвобождается большее количество жирных кислот, при окислении которых возрастает уровень кетоновых тел. Если уровень их образования превосходит скорость утилизации, развивается метаболический ацидоз.
При продолжении голодания источниками энергии становятся тканевые белки. Первыми мобилизуются лабильные белки желудочно-кишечного тракта и циркулирующей крови, затем распадаются белки внутренних органов и мышц и последними — белки нервной системы.
Таким образом, голодание в известном смысле можно рассматривать как состояние, при котором организм для удовлетворения своих энергетических потребностей «пожирает сам себя».
Основными целями парентерального питания являются:
Показания к парентеральному питанию. Среди показаний к парентеральному питанию в стационаре выделяют:
а) больной не может питаться через рот (после травм и вмешательств в области лицевого черепа, на пищеварительном тракте);
б) больной не должен питаться через рот.
Случаи целесообразности энтерального питания возникают в послеоперационном периоде у больных с кишечной непроходимостью, панкреонекрозом, после оперативных вмешательств на желудочно-кишечном тракте, а также при воспалительных заболеваниях кишечника (болезнь Крона, неспецифический язвенный колит, илеус);
Такое происходит при травмах черепа и мозга, тяжелых ожогах, состоянии стойкого катаболизма после обширных операций и травм, гнойно-деструктивных процессах с генерализацией высоко инвазивной инфекции. Парентеральное питание рекомендуется при дистрофической форме застойной сердечной недостаточности, реабилитации глубоко астенизированных больных, при тяжелых инфекционных болезнях с предельным катаболизмом, у неврологических больных с распространенными поражениями нервной системы — от инсультов до демиелинизирующих заболеваний;
Достижение описанных целей возможно только при соблюдении следующих условий: адекватная нагрузка жидкостью, достаточная масса быстро усвояемых энергодающих нутриентов, обеспечивающих усвоение достаточного количества ионов калия и условного белка в виде аминокислот в количестве не менее 0,5 г/кг массы тела.
Перед началом парентерального питания необходимо проведение следующих мероприятий:
Расчет потребности в парентеральном питании. Для этого требуется оценка питания больного. Чтобы определить изначальный уровень питания больного, используют показатель массо-ростового индекса (МРИ): МРИ=МТ(кг)/ м 2 (рост).
В норме МРИ равен 21–25 кг/м 2 ; менее 20 кг/м 2 означает отчетливое снижение питания; 17 кг/м2 — значительное снижение питания; менее 16 кг/м 2 — предельное истощение.
Другим ориентировочным показателем питательного статуса является отношение фактической массы тела (ФМТ) к идеальной массе тела (ИМТ), выраженное в %: ИМТ= Рост (см) — 100.
Снижение отношения ФМТ/ИМТ до 80% означает слабую степень белково-энергетической недостаточности; снижение в пределах 70–80% — умеренную недостаточность; снижение до 70% и менее — тяжелую степень белково-энергетической недостаточности.
Одним из наиболее полезных биохимических показателей в оценке питательного статуса, эффективности проводимой нутритивной терапии считается креатинин, 98% которого содержится в скелетных мышцах, преимущественно в виде креатининфосфата. Для расчета мышечной массы используют индекс креатинина (ИК) — отношение суточной экскреции креатинина (г) к росту (см).
В норме ИК = 10,5. При слабой степени белково-энергетической недостаточности ИК = 9,5–8,4.
Определение энергетической потребности. Минимальные энергетические затраты организма в условиях относительно полного физического и эмоционального покоя (в состоянии бодрствования, натощак) определяются как основной обмен (ОО).
ОО (ккал/сут) в покое можно рассчитать по уравнению Харриса–Бенедикта:
ОО = 66,5 + (13,75 х М) + (5 х Р) — (6,7 х В), где М — масса тела (кг), Р — рост (см), В — возраст (годы).
Также возможно использование упрощенной и, соответственно, менее точной формулы ОО = 25 Ё М.
Расчет действительной энергетической потребности больного (ДПЭ) (ккал/сут) производят по формуле
ДПЭ = ОО х ФА х ФУ х ТФ х ДМТ, где ФА — фактор активности: постельный режим — 1,1; полупостельный — 1,2; ходячий — 1,3;
ФУ фактор увечья: после небольших операций — 1,1; большие операции — 1,3; перитонит — 1,4; сепсис — 1,5; множественные травмы — 1,6; черепно-мозговая травма — 1,7 [3];
ТФ — температурный фактор: 38,0°С — 1,1; 39,0°С — 1,2; 40,0°С — 1,3; 41,0°С — 1,4.
Энергию организм получает в основном за счет углеводов и жиров. При окислении 1 г жира выделяется около 9 ккал (38 кДж), в то время как 1 г углеводов обеспечивает около 4 ккал (17 кДж) и 1 г белка или аминокислот — около 5 ккал (23 кДж).
В программе парентерального питания рекомендуемая доля калорийности, получаемая благодаря жировым эмульсиям, составляет 35–40%, глюкозе — 40–45% и аминокислотам — 5–15% [3].
В таблице приведены рекомендованные величины основных компонентов парентерального питания. Рекомендации по дозам аминокислот, глюкозы, липидов и энергетической нагрузке не зависят от типа питания: полное парентеральное питание, энтеральное или смешанное.
Углеводы. В современном парентеральном питании используют главным образом глюкозу, хотя, по мнению некоторых авторов, возможно применение фруктозы, сорбитола и ксилитола. Учитывая ряд нежелательных влияний глюкозы в высоких концентрациях (более 20%) на кислотно-основное состояние (ацидоз), миокард (угнетение его функции), не рекомендуется применение растворов глюкозы в концентрации свыше 20–25%. Максимальная скорость утилизации глюкозы при внутривенном введении составляет 0,75 г/кг в 1 ч. Превышение отмеченной скорости введения препарата приводит к осмотическому диурезу.
Сорбитол фосфорилируется в печени во фруктозо-6-фосфат. Инсулин не действует ни на сорбитол, ни на фруктозу, что делает их инсулиннезависимыми источниками энергии. При их применении не возникает гипергликемический ацидоз, который встречается в случаях, когда для парентерального питания используются препараты, содержащие глюкозу.
Суточная потребность в глюкозе составляет от 2 г/кг (не менее, иначе глюкоза начинает синтезироваться из аминокислот) до 6 г/кг. Инсулин показан из расчета 1 ЕД на 4–6 г глюкозы.
Использование более концентрированных растворов глюкозы (20–40%) возможно для пациентов, требующих ограничения объема инфузии.
Аминокислоты и белки. Определение суточной потребности в белке. Среди лабораторных показателей, отражающих показатели белкового обмена, выделяют содержание сывороточного альбумина, трансферрина, преальбуминов и протеинов, связанных с ретинолом. Снижение концентрации этих протеинов в сыворотке происходит в результате повышенного катаболизма и снижения синтеза белков. Наибольшую информативность содержат лабильные белки с коротким периодом полужизни — преальбумины.
Ориентировочно приводят следующие цифры суточной потребности в белке: минимальное количество — 0,54 г/кг/сут, рекомендованное количество — 0,8 г/кг/сут; при усиленном катаболизме (катаболический статус) — 1,2 —1,6 г/кг/сут.
Об адекватности суточного поступления белка судят по величине азотистого баланса (АБ), определяющего разницу между потреблением и потерями азота и рассчитываемого по следующей формуле:
АБ (г) = (количество потребленного белка/ 6,25) — (АМ + 4), где АМ — содержание азота в моче, собранной за 24 ч.
Коэффициент 6,25 отражает пересчет содержания азота в содержание белка (в 6,25 г белка содержится 1 г азота). Поправка 4 учитывает азот, выделенный не с мочой. При диарее, кровопотере или усиленном отторжении некротизированных тканей внепочечные потери азота принимают равными 6 г/сут.
Зная количество распавшегося белка, также можно оценить суточную потребность в энергии, с учетом того, что на окисление 1 г белка требуется от 150 до 180 ккал.
Современным стандартом является применение в качестве белковой составляющей только растворов кристаллических аминокислот. Гидролизаты белков в настоящее время полностью исключены из клинической практики парентерального питания.
Общая доза вводимых аминокислот составляет до 2 г/кг в сутки, скорость введения — до 0,1 г/кг в час.
Общепринятых требований (в том числе ВОЗ) к растворам аминокислот не существует, однако большинство рекомендаций для растворов аминокислот для парентерального питания включает следующее:
К незаменимым аминокислотам относятся изолейцин, фенилаланин, лейцин, треонин, лизин, триптофан, метионин, валин. Однако перечисленные выше аминокислоты являются незаменимыми лишь для здорового и взрослого организма. Следует учитывать, что 6 аминокислот — аланин, глицин, серин, пролин, глутаминовая и аспарагиновая кислоты — синтезируются в организме из углеводов. Четыре аминокислоты (аргинин, гистидин, тирозин и цистеин) синтезируются в недостаточном количестве.
Аминокислоты, введенные в организм внутривенно, входят в один из двух возможных метаболических путей: анаболический путь, в котором аминокислоты связываются пептидными связями в конечные продукты — специфические белки, и метаболический путь, при котором происходит трансаминация аминокислот.
Аминокислота L-аргинин способствует оптимальному превращению аммиака в мочевину, связывая при этом токсичные ионы аммония, которые образуются при катаболизме белков в печени. L-яблочная кислота необходима для регенерации L-аргинина в этом процессе и как энергетический источник для синтеза мочевины.
Наличие в препаратах заменимых аминокислот L-орнитин-аспартата, L-аланина и L-пролина уменьшает потребность организма в глицине.
Орнитин стимулирует глюкозоиндуцированную выработку инсулина и активность карбамоилфосфатсинтетазы, что способствует увеличению утилизации глюкозы периферическими тканями, синтезу мочевины и, в сочетании с аспарагином, уменьшению содержания аммиака.
Кроме «чистых» растворов аминокислот существуют растворы с энергетическими и электролитными добавками.
Из энергетических компонентов, помимо глюкозы, могут добавляться сорбитол или ксилитол, применение которых рекомендуется не всеми авторами. Сорбитол является лучшим, чем глюкоза, растворителем аминокислот, так как не содержит альдегидных и кетоновых групп и, таким образом, не связывается с аминогруппами в комплексы, снижающие действие аминокислот.
Так, вамин EF содержит глюкозу, аминосол, полиамин и хаймикс — сорбитол, инфезол 40 — ксилитол.
Ион натрия является основным катионом экстрацелюллярной жидкости и вместе с анионом хлорида является важнейшим элементом для поддержания гомеостаза. Ион калия — основной катион интрацеллюлярной жидкости. Было обнаружено, что позитивного баланса азота в организме при общем парентеральном питании можно достичь только при добавлении в инфузионный раствор ионов калия.
Ион магния важен для сохранения целостности митохондрий и для возбуждения импульса в мембранах нервных клеток, миокарде и мышцах скелета, а также для передачи высокоэнергетических фосфатов при синтезе аденозинтрифосфата. У больных на длительном парентеральном питании гипомагнезиемия часто сопровождается гипокалиемией.
Содержащийся в растворах фосфор активизирует глюкозофосфатный цикл.
Электролиты содержат следующие растворы аминокислот: аминосол, инфезол 40 и 100, аминоплазмаль Е.
Дополнение стандартных растворов аминокислот витаминами комплекса В (рибофлавин, никотинамид, пантенол и пиридоксин) обусловлено их ограниченными резервами в организме и необходимостью ежедневного введения, особенно при длительном полном парентеральном питании [1].
Специализированные растворы аминокислот. При различных патологических состояниях имеются особенности в проявлении нарушений обмена. Соответственно меняется количественная и качественная потребность в аминокислотах, вплоть до возникновения избирательной недостаточности отдельных аминокислот. В связи с этим для патогенетически направленного метаболического лечения и парентерального питания были разработаны и широко применяются в клинической практике специальные растворы аминокислот (аминокислотные смеси направленного действия).
Отличительной особенностью растворов аминокислот для больных с печеночной недостаточностью (аминостерил N-гепа, аминоплазмаль гепа (является снижение содержания ароматических (фенилаланин, тирозин) аминокислот и метионина с одновременным увеличением содержания аргинина до 6–10 г/л и разветвленных незаменимых аминокислот (валин, лейцин, изолейцин) — до 43,2 г/л.
Количество аргинина увеличивается для обеспечения функции цикла мочевины и тем самым активации детоксикации аммиака в печени и предупреждения гипераммониемии. Исключение ароматических аминокислот из смесей обусловлено тем, что при печеночной недостаточности в плазме повышается концентрация ароматических аминокислот и метионина. Одновременно концентрация разветвленных аминокислот снижается. Увеличение транспорта ароматических аминокислот в головной мозг усиливает синтез патологических медиаторов, вызывающих симптомы печеночной энцефалопатии. Введение препаратов с повышенным содержанием разветвленных незаменимых аминокислот уменьшает эти проявления. Поскольку эти аминокислотные растворы содержат все незаменимые и широкий спектр заменимых аминокислот, они оказывают корригирующее влияние на метаболические процессы и применяются для парентерального питания.
Для парентерального питания и лечения больных с острой и хронической почечной недостаточностью применяют специальные растворы аминокислот: аминостерил КЕ нефро безуглеводный, нефротект, нефрамин, с определенным соотношением аминокислот. Соотношение незаменимых аминокислот и заменимых в таких растворах составляет 60:40. Кроме того, препараты данной группы содержат восемь незаменимых аминокислот и гистидин (5 г/л), что дает возможность при их введении снизить азотемию. За счет взаимодействия специально подобранного спектра аминокислот с азотистыми остатками происходит выработка новых заменимых аминокислот и синтез белка. В результате уменьшается уремия. Концентрация аминокислот в таких растворах находится в пределах 57%. Отсутствуют углеводы и электролиты или количество электролитов в растворе минимально [1].
Жировые эмульсии. Другим источником энергообеспечения являются жировые эмульсии.
Жировые эмульсии обычно применяют в долговременных программах нутритивной поддержки, особенно в тех случаях, когда парентеральное питание продолжается более 5 дней и возникает необходимость в покрытии дефицита незаменимых жирных кислот.
Незаменимые жирные кислоты являются структурными компонентами всех клеточных мембран и способствуют восстановлению их структур, проницаемости и осмотической резистентности. Кроме того, ненасыщенные жирные кислоты как предшественники простагландинов, тромбоксанов и лейкотриенов играют важную роль в восстановлении метаболических и газообменных функций легких, обеспечивают транспорт жирорастворимых витаминов, являются модуляторами иммунных процессов.
Кроме нутритивного эффекта, жировые эмульсии осуществляют еще следующие функции:
В настоящее время доступны жировые эмульсии нескольких типов.
Клинические эффекты применения физической смеси средне- и длинноцепочечных триглицеридов не отличаются от жировых эмульсий на основе длинноцепочечных триглицеридов. Метаанализ D. Heyland и соавторов (2003) [15] показал отсутствие каких-либо преимуществ физической смеси триглицеридов перед общепринятыми жировыми эмульсиями.
Общепринятые жировые эмульсии, содержащие длинноцепочечные триглицериды с 16–20 атомами углерода, следует рассматривать как наиболее безопасные и отдавать им предпочтение как базовой жировой эмульсии, которая в зависимости от состояния больного может дополняться эмульсией на основе рыбьего жира.
Суточная доза жировых эмульсий составляет до 2 г/кг в сутки, при печеночной недостаточности, энцефалопатии — до 1,5 г/кг в сутки. Скорость введения — до 0,15 г/кг/ч.
Жировые эмульсии противопоказаны при нарушении жирового обмена, расстройствах в системе гемостаза, беременности, остром инфаркте миокарда, различных эмболиях, нестабильном диабетическом обмене веществ, шоке.
Осложнения парентерального питания. Среди осложнений полного парентерального питания выделяют механические, метаболические, гнойно-септические осложнения и аллергические реакции.
Механические осложнения представляют собой технические осложнения катетеризации центральных вен (пневмоторакс, перфорация подключичной вены/артерии, повреждение грудного лимфатического протока, гемоторакс, гидроторакс, паравазальная гематома), различные виды эмболий, тромбоз и тромбофлебит.
Метаболические осложнения включают:
Гнойно-септические осложнения подразумевают инфицирование в месте введения препарата и генерализацию инфекции [4].
Таким образом, парентеральное питание можно рассматривать как фармакотерапию метаболических нарушений и единственный путь обеспечения энергопластических потребностей организма в постагрессивном периоде, требующих наличия специально подобранных композиций питательных веществ.
Литература
В. Г. Москвичев, кандидат медицинских наук
Р. Ю. Волохова
МГМСУ, Москва