К2 эдта и к3 эдта в чем разница
Современные технологии для качественного анализа капиллярной крови
В клинической практике довольно часто возникают ситуации, когда невозможно взять кровь для лабораторных исследований из периферических вен. Это, прежде всего, недоношенные дети и дети первого года жизни, пожилые люди и тучные пациенты, находящиеся в критическом состоянии. Для этого существуют системы, предназначенные для взятия, транспортировки и последующего исследования капиллярной крови. Наибольший спектр микропробирок (микротейнеров со встроенным коллектором) для взятия капиллярной крови с тем же спектром реагентов, что и для пробирок, предназначенных для взятия венозной крови (за исключением пробирок для исследования гемостаза), производится компанией «Бектон Дикинсон». Как известно, лабораторное исследование делится на три основных этапа: преаналитический (внелабораторный), аналитический и постаналитический. Аналитический этап непосредственно связан с функцией лаборатории, и он легко контролируется специалистами лабораторий, а использование современных систем для диагностики (автоматические анализаторы, диагностические наборы, контрольные материалы и калибраторы) сводят к минимуму ошибки на лабораторном этапе. Преаналитический этап в наименьшей степени может контролироваться лабораторией, т. к. значительная часть этого этапа осу ществляется сотрудниками лечебных учреждений. И именно с этим этапом связано до 93% ошибок при производстве анализов [5].
Централизованная клинико-диагностическая лаборатория центра «Охраны материнства и детства» выполняет исследования для 40 лечебных учреждений города Красноярска. Поэтому очень остро стоит вопрос правильной подготовки пациентов и взятия биологического материала у детей. Контроль преаналитических факторов является ключевым для обеспечения качественных результатов. За счет снижения числа ошибок на любом этапе преаналитической подготовки можно существенно улучшить качество исследований, снизить количество повторных проб, сократить расходы рабочего времени и средств на обследование пациентов. Немаловажным является психологический и физический дискомфорт пациента, когда встает вопрос о повторном получении биоматериала (дети и беременные женщины).
В ЦКДЛ выполняются исследования для детей амбулаторно-поликлинической службы города, что составляет 43% от всех выполняемых исследований. И 57% выполняется для пациенток женских консультаций города.
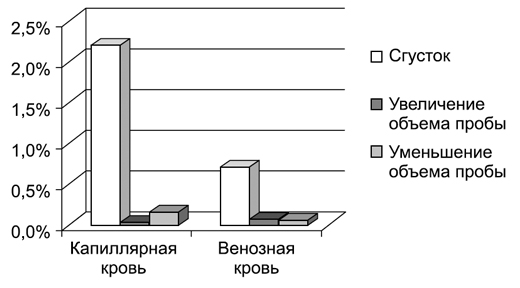
Проведенный анализ отбракованных гематологических проб за год позволил оценить частоту возникновения ошибок на преаналитическом этапе. Исследования гемограмм в среднем в месяц составляют 17 500. Для выполнения гематологических исследований мы используем капиллярную и венозную кровь. Гематологические исследования из капиллярной крови мы проводим только у детей, и эта доля составляет 58%, а 42% составляет исследование венозной крови (это дети старшего возраста и женское население). Процент брака при получении капиллярной крови составил 2,2%, при венепункции процент составил 0,7%. Таким образом, процент ошибок при взятии капиллярной крови в три раза выше, чем при взятии венозной. Основные причины низкого качества взятых проб крови: сгустки в пробе и нарушение объема пробы, которое приводит к нарушению соотношения кровь-антикоагулянт (рис. 1).
Рис. 1. Основные причины низкого качества взятых проб крови
Пробы, полученные со сгустками, составили наибольшую долю ошибок как при получении капиллярной, так и при получении венозной крови. Сгустков в капиллярной крови было получено в три раза больше, чем в венозной. Чем можно объяснить данный факт?
Венозная кровь считается лучшим материалом для лабораторных исследований. При известной стандартизации процессов взятия, хранения, транспортировки венозной крови удается добиться минимальной травматизации и активации клеток, примеси тканевой жидкости, при этом всегда имеется возможность повторить и/или расширить анализ (например: при низком гемоглобине назначить ретикулоциты) и, как следствие, минимизировать необходимость повторных процедур взятия крови (очень важный фактор для детей) и влияние на правильность и точность результатов.
Взятие капиллярной крови для лабораторных исследований возможно в следующих ситуациях:
Анатомическое строение кровеносной системы детей обуславливает необходимость правильно сделать выбор места пункции и медицинского инструментария. В педиатрической практике возможно взятие капиллярной крови из пальца, пятки и в редких случаях из мочки уха. Пункция пальца не должна производиться у младенцев, так как это может привести к повреждению костной ткани. В таком случае подходящим местом прокола для получения образца является пятка у дистальной части пяточной кости. В связи с этим представляется важным использование автоматических ланцетов, гарантирующих низкую травматичность и соблюдение нужной глубины прокола, в зависимости от типа выбранного ланцета. Между объемом получаемой крови и глубиной прокола существует прямая зависимость. В связи с этим тип ланцета должен подбираться в соответствии с местом прокола и объемом получаемого образца. Компания «Бектон Дикинсон» производит одноразовые ланцеты с разным типом прокалывающего устройства: игла или лезвие, а также с разной глубиной прокола. Контактно-активируемые ланцеты BD Microtainer ® c корпусом фиолетового цвета предназначены для получения одной капли крови и гарантируют отсутствие болевого синдрома у пациентов не менее, чем в 90% случаев [2], тогда как ланцеты BD Microtainer ® c корпусом голубого цвета преднзначены для получения до 0,5 мл крови и обеспечивают скорость капиллярного кровотока не менее 2 мкл/с [1]. Для взятия капиллярной крови у новорожденных предпочтение должно отдаваться контактно-активируемым BD Quikheel™ с лезвием, осуществляющим полукруговое режущее движение, что позволяет получить хороший ток крои из ранки не менее, чем в 90% случаев [7].
Учитывая возрастные особенности поведения детей во время процедуры взятия крови (подвижность, эмоциональный стресс и т. д.), следует обратить внимание на последовательность заполнения пробирок. Для корректного забора капиллярной крови начать следует с пробирок с антикоагулянтами (на гематологические исследования), а затем использовать микротейнеры или пробирки для получения сыворотки или плазмы, предназначенной для биохимических, иммунологических и других видов исследований. Так, например, использование пробирки BD Microtainer ® PST™ с корпусом янтарно-желтого цвета гарантирует стабильность образцов плазмы при анализе крови на билирубин не менее 24 часов при комнатной температуре [4]. Необходимо отметить, что исследование гематологических показателей, группы крови, глюкозы и некоторых других биохимических показателей у детей возможно из капиллярной крови, но исследование показателей системы гемостаза, гормонов необходимо проводить только из венозной крови.
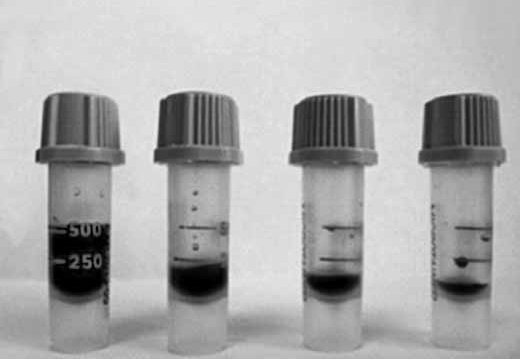
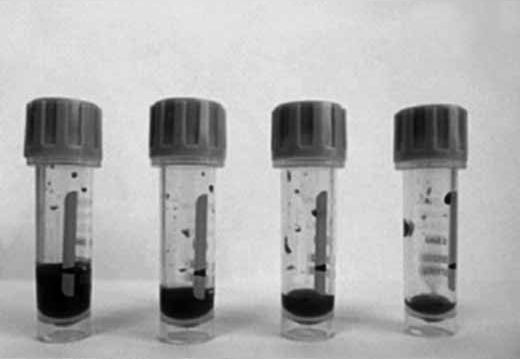
Отклонения от стандартов при взятии пробы, транспортировке и хранении образца, а также факторы, связанные с пациентом, могут привести к неверным или неточным результатам анализов и, следовательно, к постановке ошибочного диагноза. Мы посмотрели влияние объема полученного образца на результаты исследований. Взятие капиллярной крови производилось одномоментно у одного пациента в микротейнеры с К2ЭДТА и К3ЭДТА разных производителей. Пробы были взяты с учетом рекомендаций производителей и с нарушением объема, как это часто бывает на практике (рис. 2, 3).
Рис. 2. Пробы с К2ЭДТА с метками для взятия 250–500 мкл крови
Рис. 3. Пробы с К3ЭДТА с метками для взятия 500 мкл крови
Избыток ЭДТА, независимо от концентрации, негативно воздействует на эритроциты, вызывая сначала их сморщивание, а затем с течением времени и набухание, что приводит к увеличению среднего объема и уменьшению среднего содержания гемоглобина в одном эритроците. Кроме того, использование К2ЭДТА в пробирках BD Microtainer ® сопровождается отсутствием формирования микросгустков [6], а пробирка BD Microtainer ® МАР с К2ЭДТА, предназначенная специально для автоматических анализаторов капиллярной крови, обеспечивает риск образования микросгустков не более 2% [6] и стабильность гематологических показателей не менее 12 часов при хранении проб при комнатной температуре [3]. При этом выявленные в ходе проведенных нами исследований нарушения наиболее выражены в пробах с КЗЭДТА. Нарушение соотношения кровь-антикоагулянт приводит к набуханию тромбоцитов и их расщеплению, что выражается в увеличении их количества, т. к. образующиеся фрагменты имеют достаточно крупные размеры и могут быть подсчитаны как нормальные кровяные пластинки. Также КЗЭДТА вызывает уменьшение общего количества лейкоцитов и их дегенеративные изменения. В связи с этим следует обращать внимание на используемый антикоагулянт, на точное соблюдение рекомендованного производителем объема образца, а также на тщательное и своевременное перемешивание пробы.
При централизации исследований взятие крови в наименьшей степени может контролироваться лабораторией. Зачастую выбор материала и места прокола осуществляется персоналом ЛПУ без учета требований лаборатории, что вынуждает отбраковывать часть образцов. В нашей лаборатории разработаны критерии отказа в проведении исследований в следующих случаях: взятый материал находится в несоответствующей пробирке (т. е. не с тем наполнителем); наличие сгустков в пробе с антикоагулянтами; несоответствие объема пробы (допускается отклонение +10%); гемолиз пробы (кроме исследований, на которые гемолиз влияния не оказывает); отсутствие штрих-кода на направлении или пробирке; отсутствие перечня исследований и т. д. Так как процедурная медицинская сестра не входит в штат лаборатории, а за конечный результат перед пациентом отвечает именно лаборатория, необходимо выработать четкие инструкции:
Немаловажным считаем обучение медицинских сестер на курсах повышения квалификации приемам и правилам забора капиллярной и венозной крови с использованием вакуумных систем и микротейнеров, с последующей выдачей сертификата.
Соблюдение правил преаналитического этапа позволит свести к минимуму ошибки лабораторных исследований.
Таблица 1. Результаты сравнительного анализа гематологических показателей при взятии разного объема капиллярной крови в пробирки с К2ЭДТА
Объем пробы, рекомендованный производителем
К2 эдта и к3 эдта в чем разница
Вакуумная пробирка — основной инструмент для забора венозной крови. Она может быть наполнена реагентом, который позволит провести быстрый и точный анализ. В таком случае каждая пробирка имеет колпачок своего цвета. Цветное кодирование соответствует международному стандарту ISO 6710.
Вакуумные пробирки для получения сыворотки (биохимия, серология). Цвет крышечки – коричневый или красный
Сыворотка крови – жидкая часть крови лишенная форменных элементов и некоторых белков (фибрин и др.) в отличие от плазмы, в которой сохраняются все элементы жидкой части крови кроме форменных элементов.
Получение сыворотки крови является результатом двухступенчатого биохимического процесса: свертывания (коагуляции) крови и ретракции (уплотнения) сгустка. Для запуска коагуляционного каскада необходимо наличие внешнего активатора, каковым может служить кремния диоксид, поэтому процесс свертывания крови быстрее происходит в стеклянных пробирках, так как кремния диоксид является базовым материалом стекла или в пластиковых пробирках с активатором свертывания. Активатор свертывания (clot activator) выполнен в виде напыления на внутренней стенке пробирки.
После образования сгустка начинается этап его уплотнения и выделения сыворотки. На практике ретракция сгустка ускоряется центрифугированием пробирок с кровью.
Для получения максимально чистой сыворотки рекомендуется соблюдение трех условий:
1. После забора крови в пробирку в соответствии с инструкцией необходимо осторожно однократно перевернуть пробирку для более полного контакта крови с активатором свертывания;
2. Дождаться завершения процесса свертывания крови в течение 20-30 минут при комнатной температуре и вертикальном положении пробирки;
3. Центрифугировать пробирку со свернувшейся кровью не менее 10 минут с ускорением 1500 G (примерно 3000 об/мин) для максимального выдавливания сыворотки из сгустка. При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
После центрифугирования и полной ретракции сгустка сыворотка располагается над сгустком, но в контакте с ним. Сохраняется опасность загрязнения сыворотки составляющими сгустка при неосторожном обращении с пробиркой (встряхивание, опрокидывание и пр.). Для лучшего очищения сыворотки и более полного разграничения сыворотки и сгустка применяются специальные пробирки, содержащие биологически инертный олефиновый гель. Последний представляет собой тиксотропный кополимер, который тяжелее сыворотки, но легче кровяного сгустка, поэтому после центрифугирования гель в виде тонкой полоски занимает промежуточное положение и служит разделительным барьером. Стабильность такого барьера гарантирована в течение 5-7 дней при хранении пробирки с кровью при комнатной температуре.
Оптимальные сроки сохранности образца крови в данных пробирках составляет при комнатной температуре 6 часов, при хранении в холодильнике (+4ºС) – 24 часа. Повторное центрифугирование пробирок, особенно с гелем, не допускается.
Полученная сыворотка крови применяется для очень широкого спектра лабораторных биохимических, ИФА и иммунологических исследований:
белковый состав, ферменты, гормоны, онкомаркеры, ВИЧ-инфицирование, гепатиты и пр.
Вакуумные пробирки для получения цельной крови или плазмы
Не все анализы в клинике делаются из сыворотки крови. Для многих видов исследований необходима цельная кровь, содержащая форменные элементы, или плазма, освобожденная от клеток крови центрифугированием. С целью получения несвернувшейся крови разработаны пробирки с определенными добавками – антикоагулянтами. На практике используют два вида антикоагулянтов:
ингибиторы (вещества, вызывающие торможение) тромбина. Тромбин является ключевым игроком в коагуляционном каскаде. Он принимает участие в формировании ряда факторов свертывания крови и способствует трансформации фибриногена в фибрин. Добавление биохимических ингибиторов тромбина эффективно активирует антикоагуляционные свойства крови.
связывание (удаление) ионов Ca2+. При прочих равных условиях свертывание крови происходит при активном участии ионов Ca2+. Удаление их является эффективным механизмом сохранения крови в жидком состоянии.
Гепарин. Цвет крышечки – зеленый, светло-зеленый
Для более чистого разграничения плазмы крови и сгустка применяются специальные пробирки, содержащие кроме гепарина инертный олефиновый гель. Последний представляет собой тиксотропный кополимер, который тяжелее плазмы, но легче форменных клеток крови, поэтому после центрифугирования гель в виде тонкой полоски занимает промежуточное положение и служит разделительным барьером.
Фторид натрия/ЭДТА калия. Цвет крышечки – серый
Добавление фторида натрия и ЭДТА калия в пробирку позволяет предотвратить разрушение глюкозы крови (процесс, называемый гликолизом) и сохранить ее уровень во взятом образце крови.
Фторид натрия и оксалат калия выступают в качестве антикоагулянтов, связывая ионы Са2+ и, кроме того, фторид натрия стабилизирует уровень глюкозы.
Глюкоза разрушается до пирувата и лактата при последовательном осуществлении различных энзиматических реакций. Фторид натрия ингибирует некоторые ферментативные реакции, включая превращение фосфоглицерата в фосфоенолпируватацид, и предотвращает гликолиз.
Для получения качественного результата анализа необходимо:
немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и антикоагулянта
плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1000-1500G (2000-3000 об/мин).
Пробирки с добавлением фторида натрия и оксалата калия используют для проведения определения уровня сахара (глюкозы) в крови. Соотношение компонентов 1/1, общее количество добавляемых реагентов – 4,5 мг/1 мл забираемой в пробирку крови.
Замечания: Фторид блокирует активность уреазы и некоторых других ферментов. Образцы крови из данных пробирок нельзя использовать для прямого определения энзимов. Фторид натрия и ЭДТА калия связывают ион Са2+, заменяя в крови 1 ион кальция на 2 иона натрия или калия. Следствием этого является повышение напряжения ионов в межклеточной жидкости и выкачивание воды из внутриклеточного пространства в межклеточное, сморщивание клеток крови с умеренным «выдавливанием» из эритроцитов гемоглобина. Поэтому видимый гемолиз свойственен образцам крови с данной добавкой.
Глюкоза превращается в лактат в результате комплекса реакций, включающего в себя различные этапы. Фторид ингибирует один их последних этапов разрушения глюкозы, начальные этапы с участием гексокиназы и фосфофруктокиназы блокируются менее эффективно, поэтому можно наблюдать снижение содержания глюкозы в образце крови на 6-7% от первоначального.
После первоначального незначительного снижения уровня глюкозы ее количество остается постоянным при хранении крови в пробирке в течение 8-10 часов при температуре до 25ºС и в течение 2-3 дней в холодильнике (+4ºС).
Этилендиаминтетраацетат (ЭДТА) является предпочтительным антикоагулянтом для гематологических исследований. ЭДТА и его щелочные соли способны создавать хелатные соединения с ионами кальция с образованием растворимых высокостабильных комплексов. Наиболее эффективная концентрация ЭДТА – 1,2 мг/мл крови. Во всем мире используют три варианта солей ЭДТА: ЭДТА-К3, ЭДТА-К2 и ЭДТА-Na2. Наиболее предпочтительной и рекомендуемой Международной Комиссией по Стандартизации в Гематологии является двукалиевая соль ЭДТА:
ЭДТА-К3 показывает меньшую способность поддержания крови в жидком состоянии, также ЭДТА-К3 влияет на подсчет лейкоцитов, занижая их количество.
различия между ЭДТА-К2 и ЭДТА-Na2 в клиническом плане незначительны и ими можно пренебречь, но ЭДТА-Na2 хуже растворим.
Для получения качественного результата анализа необходимо:
немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и антикоагулянта;
плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1000-1500G (2000-3000 об/мин). При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
Наиболее широко используются пробирки, содержащие 1,95 мг ЭДТА/1мл крови. Они нашли свое применение в таких областях лабораторной практики, как:
гематологические исследования – подсчет клеток крови, определение СОЭ и пр.
ПЦР-исследования (качественные и количественные методики).
Пробирки с образцами крови можно хранить до 6-10 часов при 4ºС, хранение свыше 24 часов не рекомендуется из-за снижения числа эритроцитов и лейкоцитов.
Цитрат натрия является антикоагулянтом для сбора венозной крови с це6лью проведения исследований коагуляционных свойств крови.
Процесс свертывания крови представляет собой последовательность сложных реакций, в которых результатом первых реакций (с участием активных ферментов) является активация следующих, первоначально неактивных энзимов. Последним активным ферментом в этой цепочке присутствует тромбин, который осуществляет превращение фибриногена в фибрин. Нити фибрина опутывают клетки крови и окончательно формируют кровяной сгусток. Крайне важную роль на этом этапе играют ионы Са2+. Антикоагуляционные свойства цитрата проявляются в формировании комплекса с ионами Са2+ и эффективном удалении их из крови.
Общее исследование свертывания крови определяется временем, необходимым для последовательной активации ферментов, участвующих в коагуляционном процессе. Проводится определение времени активации и количественное измерение различных составляющих коагуляционного каскада, для чего создаются так называемые «обходные пути» добавлением некоторых промежуточных продуктов свертывания.
Наиболее часто используются пробирки с 3,8% или 3,2% раствором цитрата натрия (0,129 моль/л), соотношение цитрата к количеству забираемой крови 1/9.
Для максимально качественного проведения коагулологических исследований рекомендуется соблюдение определенных правил:
нельзя использовать пробирку для взятия крови на коагуляционные тесты первой, сразу после венепункции, так как на результаты может повлиять выделяющийся при пункции тканевой тромбопластин;
венозный жгут во время взятия крови в пробирку должен быть снят;
немедленно после взятия крови пробирку аккуратно переворачивают 5-6 раз для лучшего перемешивания крови и антикоагулянта;
сразу после этого надо проверить количество взятой крови: ее верхняя граница должна быть на уровне голубой полоски на этикетке.
Оптимальными условиями хранения пробирки с образцом крови является температура 20-24ºС и исследование коагуляционных свойств и факторов свертывания крови должно быть проведено в течение 2-х часов с момента взятия крови
Пробирки с фиолетовой крышкой
Калькулятор
заказов
Новости
ВЫЕЗД на ДОМ!
С 1 декабря возобновляется выезд на дом в Пятигорске!
УЗИ в Пятигорском отделении
с 1 декабря возобновляется услуга по УЗИ диагностике в Пятигорском отделении
ЭДТА-К3 показывает меньшую способность поддержания крови в жидком состоянии, также ЭДТА-К3 влияет на подсчет лейкоцитов, занижая их количество.
различия между ЭДТА-К2 и ЭДТА-Na2 в клиническом плане незначительны и ими можно пренебречь, но ЭДТА-Na2 хуже растворим.
Для получения качественного результата анализа необходимо:
немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и антикоагулянта;
плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1000-1500G (2000-3000 об/мин). При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
Наиболее широко используются пробирки, содержащие 1,95 мг ЭДТА/1мл крови. Они нашли свое применение в таких областях лабораторной практики, как:
гематологические исследования – подсчет клеток крови, определение СОЭ и пр.
ПЦР-исследования (качественные и количественные методики).
Пробирки с образцами крови можно хранить до 6-10 часов при 4ºС, хранение свыше 24 часов не рекомендуется из-за снижения числа эритроцитов и лейкоцитов.
ЭДТА-К3 для капиллярной крови
Каждая пробирка содержит специальные добавки (Без капилляра: Pro-coagulation, Clot Activator /Separation Gel, EDTA K2, EDTA K3, Lithium Heparin, Sodium Heparin, NaF/EDTA K2; С капилляром: Pro-coagulation, Clot Activator /Separation Gel, EDTA K2, EDTA K3, Lithium Heparin, Sodium Heparin, NaF/EDTA K2.) позволяющие осуществлять самые разнообразные виды исследований.
Пробирки для капиллярной крови выпускаются двух типов: без капилляра и с капилляром.
Собранная для анализа кровь будет находиться в полной сохранности, ведь крышка, которая очень легко и прочно закрывается, минимизирует аэрозольный эффект. Если Вы используете пробирки с капиллярами, это станет гарантией того, что капиллярная кровь не свернется во время взятия.
В чем разница между K2 EDTA и K3 EDTA
главное отличие между K2 EDTA и K3 EDTA является то, что K2 EDTA содержит два хелатированных иона калия, тогда как K3 EDTA содержит три хелатированных иона калия, Кроме того, K2 EDTA слегка увеличива
Содержание:
главное отличие между K2 EDTA и K3 EDTA является то, что K2 EDTA содержит два хелатированных иона калия, тогда как K3 EDTA содержит три хелатированных иона калия, Кроме того, K2 EDTA слегка увеличивает MCV (средний корпускулярный объем) эритроцитов при более высоких концентрациях, в то время как K3 EDTA не влияет на MCV эритроцитов при более высоких концентрациях.
Ключевые области покрыты
1. Что такое К2 ЭДТА
— определение, хелатирование, важность
2. Что такое К3 ЭДТА
— определение, факты, недостатки
3. Каковы сходства между K2 EDTA и K3 EDTA
— Краткое описание общих черт
4. В чем разница между K2 EDTA и K3 EDTA
— Сравнение основных различий
Основные условия
Антикоагулянты, гематологические тесты, K2 EDTA, K3 EDTA, MCV
Что такое К2 ЭДТА
К2 ЭДТА (дикалий этилендиаминтетрауксусная кислота) является сильным антикоагулянтом, используемым для хранения крови для полного анализа крови (CBC) в пробирках для сбора крови. Как правило, цельная кровь хранится в этих пробирках. Однако K2 EDTA содержит два иона калия, связанных с молекулой EDTA.
Рисунок 1: Хелатирование ионов металлов ЭДТА
Кроме того, ЭДТА является хелатирующим агентом, который может изолировать ионы металлов, включая ионы трехвалентного железа и ионы кальция, в смеси, снижая их реакционную способность. Таким образом, основная функция K2 EDTA в образце крови заключается в хелатировании ионов кальция из смеси. Кроме того, процесс свертывания крови требует ионов кальция. Но добавление EDTA к образцу делает ионы кальция недоступными для этого процесса, останавливая коагуляцию.
Что такое К3 ЭДТА
K3 ETDA является альтернативной формой K2 EDTA, используемой во время сбора крови для рутинных гематологических анализов. По сравнению с K2 EDTA, K3 EDTA содержит три иона калия, связанных с EDTA. Тем не менее, Международный совет по стандартизации в гематологии рекомендует K2 EDTA в качестве антикоагулянта по двум причинам:
Рисунок 2: Трубка ЭДТА К2
Сходства между K2 EDTA и K3 EDTA
Разница между К2 ЭДТА и К3 ЭДТА
Определение
К2-ЭДТА относится к типу сильного антикоагулянта, используемого во время сбора крови для CBC, в то время как К3-ЭДТА относится к альтернативной форме К2-ЭДТА, используемой в качестве антикоагулянта.
Известный как
K2 EDTA известен как дикалий этилендиаминтетрауксусная кислота, в то время как K3 EDTA известен как трикалий этилендиаминтетрауксусная кислота.
Количество ионов калия
Основное различие между K2 EDTA и K3 EDTA состоит в том, что K2 EDTA содержит два иона калия, в то время как K3 EDTA содержит три иона калия.
Трубы для сбора крови
Другое различие между K2 EDTA и K3 EDTA заключается в том, что раствор K2 EDTA высушивается распылением на внутренней поверхности пластиковых трубок, а раствор K3 EDTA поступает в виде жидкости в стеклянных трубках.
Влияние на MCV красных кровяных клеток
Кроме того, K2 EDTA слегка увеличивает MCV при более высоких концентрациях, в то время как K3 EDTA не влияет на MCV при более высоких концентрациях. Следовательно, это еще одно различие между K2 EDTA и K3 EDTA.
Влияние на объем упакованной клетки
Кроме того, объем уплотненных клеток центрифугированной крови уменьшается с увеличением концентрации K2-ЭДТА, в то время как это уменьшение более выражено при использовании K3-ЭДТА.
Заключение
Рекомендации:
1. Goossens W., et al. «K2- или K3-EDTA: антикоагулянт выбора в рутинной гематологии?»Клиническая и лабораторная гематологиятом 13, нет. 3, 2008, с. 291–295., Doi: