Как и чем лечить лептинорезистентность
Резистентность к лептину: признаки и лечение
Многие люди считают, что в основе ожирения лежит недостаток силы воли, и повышенная калорийность потребляемой пищи. Но современные ученые все чаще утверждают, что в появлении избыточного веса большую роль играет резистентность организма к гормону лептин. Как восстановить активность гормона?
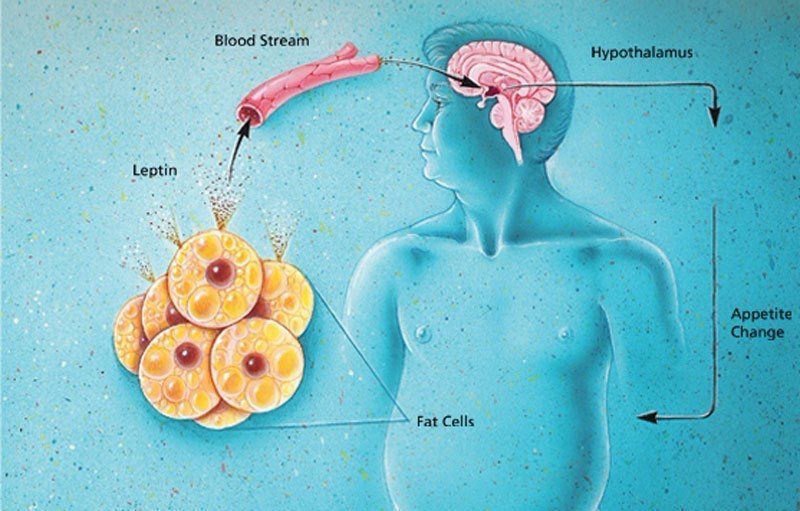
Лептин вырабатывают жировые клетки тела. Если его мало, то в мозг посылается сигнал о недостатке энергии и необходимости получения питания. А если много, то сигнал о том, что организм насытился. Но у некоторых людей сигнализация перестает работать и, несмотря на то, что организм получает достаточно энергии, мозг этого «не видит» и требует больше питания и снизить расход энергии. Это состояние называется резистентностью к лептину.
Симптомы и терапия резистентности к лептину
Признаки лептинорезистентности
Специалисты считают, что более половины населения развитых стран имеют резистентность к лептину.
Его симптомы:
Как восстановить уровень лептина?
На сегодняшний день не существует лекарственных средств, которые могли бы помочь людям избавиться от ожирения и проблем со здоровьем, которые оно приносит. Изменение рациона и ведение правильного образа жизни значительно улучшит баланс лептина:
1. Полноценный преимущественно белковый завтрак не позднее, чем полчаса-час после сна, снизит тягу к углеводной пище. Следует употреблять не менее 75 – 100 гр белка в день.
2. Нужно ограничить употребление пищи, содержащей фруктозу, ее содержание не должно превышать 25 г в день.
3. Необходимо исключить или значительно ограничить алкоголь, сладости, кофеин.
4. Следует отказаться от приготовленной промышленным способом пищи или полуфабрикатов.
5. Строгая рекомендация – употреблять не менее 400 г в сутки сырых овощей, и уменьшить употребление моркови и свеклы в приготовленном виде.
6. Прекратите перекусывать между основными приемами пищи, так как это сбивает суточные ритмы лептидов.
7. Если нет специальных рекомендаций врача, то следует перейти на употребление пищи 3 раза в день, преимущественно низкоуглеводной.
8. Не следует совсем отказаться от употребления углеводов, но надо контролировать их количество.
9. Включите в рацион правильные жиры: орехи, масло кокоса, авокадо и натуральные жиры.
10. Между последним и первым приемом пищи должно пройти не меньше 11-12 часов. Ужин не должен быть позднее, чем за 3 часа до засыпания.
11. Недостаток сна увеличивает количество грелина (гормона голода).
12. Обязательно нужна посильная двигательная активность, занятия лучше проводить после 17 ч. вечера.
13. Включите в питание продукты, богатые цинком, его недостаток увеличивает риск ожирения и сахарного диабета.
Инсулинорезистентность и лептинорезистентность: что это?
Инсулинорезистентность и лептинорезистентность главные и основные причины лишнего веса и первичного ожирения. В США от инсулинорезистентности страдает 60-70 млн. человек и более 84 млн. страдают преддиабетом. Об объективных цифрах в СНГ можно только догадываться. Замечу, что в развитых странах ИР диагностируется у 10-20% населения, а риск её развития у людей старше 50 лет составляет более 40%.
Как же определить у себя инсулино и лептинорезистентность, и как влиять на них при помощи питания, будем разбираться в статье.
Что первично лептинорезистентность или инсулинорезистенстность?
Инсулин и лептин — это гормоны, которые работают в паре и усиливают друг друга. И если функции инсулина известны довольно широкому кругу людей: помогать глюкозе попадать в клетки тела. То гормон лептин и его функции знакомы более узкому сообществу профессионалов. Лептин – это гормон, вырабатывающийся жировой тканью, который передает в мозг сигналы о насыщении, тем самым влияет на снижение и подавление аппетита. Если лептин вырабатывается в недостаточном количестве, это ведет к развитию ожирения. Но возможен и иной сценарий.
Открытие данного гормона было воспринято на первых порах, как изобретение таблетки для стройности. Однако в процессе испытаний и исследований оказалось, что по мере увеличения объемов жировой ткани, несмотря на рост концентрации лептина, его способность подавлять аппетит – снижалась. Это вызвано тем, что нарушаются внутриклеточные сигналы передачи, а рецепторы к этому гормону в мозге становятся нечувствительны, то есть резистентны. Это состояние называется лептинорезистентностью. Чрезмерная концентрация лептина провоцирует развитие инсулинорезистентности, нечувствительности рецепторов клеток к инсулину. А уже это состояние может привести к сахарному диабету второго типа.
Диагностика лептинорезистентности
Лептинорезистентность может быть вызвана рядом причин:
Диагностировать ее можно при помощи анализов: сдается кровь из вены натощак. Но как понять, что эти анализы нужно сдать? Существует несколько признаков, внешних проявлений лептинорезистентности:
Если вы наблюдаете эти симптомы у себя, то стоит обратиться к врачу и сдать соответствующие анализы. Если сделать это на ранних стадиях, есть все шансы справиться с лептинорезистентностью при помощи диеты и избежать возникновения инсулинорезистентности.
Питание при лептинорезистентности
Выстраивая диету при лептинорезистентности важно понимать, что коррекции подвергается не только и не столько рацион, сколько образ жизни и питания. Например, следует убрать перекусы, ужинать за 4-5 часов до сна, а завтракать практически сразу после пробуждения.
Одним из наиболее распространенных протоколов является эпи-палео диета Джека Круза. Пройдемся по группе продуктов при лептинорезистентности:
Инсулинорезистентность симптомы и лечение
Чтобы диагностировать ИР необходимо сдать инсулин и глюкозу крови натощак и по этим показателям вычислить индекс HOMA. Но одним из критериев, наблюдаемых невооруженным взглядом, является объем талии. Если он более 88 см. у женщин и 94 см. у мужчин – можно предположить ИР. Более точно определить объем жировой ткани, как фактора риска развития инсулинорезистентности, помогает биоимпедансное взвешивание. Его я провожу на очных консультациях диетолога в Харькове.
Для лечения инсулинорезистентности применяют: диетотерапию, медикаментозное лечение (только по назначению и под контролем врача), изменение образа жизни в пользу более здорового и активного.
Диета при инсулинорезистентности
Питание при инсулинорезистентности следует приблизительно тем же правилам, что и при нечувствительности к лептину, но есть несколько уточнений и конфликтующих правил, именно поэтому самостоятельно выстраивать диету, если у вас и ЛР, и ИР, будет сложно.
Например, при и лептинорезистентности, и при инсулинорезистентности рекомендуется не делать перекусов. При ИР, кроме того списка, который запрещен при ЛР, рекомендуется исключить: крахмалистые овощи, простые углеводы, насыщенные жиры, жареную пищу, красное мясо, орехи употреблять только после вымачивания.
В питании при инсулинорезистентности распределить нутриенты лучше таким образом:
Больше о диете при инсулинорезистентности и питании при сахарном диабете можно узнать из моего вебинара.
Похудение при инсулинорезистентности
Это вполне реально. Но я часто сталкиваюсь с тем, что люди с инсулинорезистентностью, пытающиеся самостоятельно похудеть, сталкиваются со сложностями. Вес не уходит, либо показатели анализов не приходят в норму. Это связано с тем, что рацион должен быть подобран индивидуально с учетом ваших особенностей, показателей анализов, сопутствующих заболеваний и дефицитов. Учитывайте также, что по мере снижения веса и изменений в анализах, диета должна корректироваться. Поэтому похудение при инсулинорезистентности будет более эффективным при участии диетолога-нутрициолога.
Проблема с избыточной массой тела? Виноват гормон лептин
Избыточный вес и лептин
Лептин является пептидным гормоном, секретируемым клетками жировой ткани. Этот гормон регулирует обмен веществ. Слишком низкий синтез лептина приводит к чрезмерному аппетиту и ожирению. Поэтому анализ крови на лептин проводится для определения причины ожирения.
| Прием эндокринолога с высшей категорией | 1500 руб. |
| Консультативный прием врача по результатам анализов, по результатам УЗИ | 500 руб. |
| УЗИ щитовидной железы с регионарными лимфатическими узлами в стандартном режиме и с применением допплерографических методик | 1000 руб. |
| Биопсия мягких тканей | 2500 руб. |
| Взятие крови из вены | 170 руб. |
| Запись по телефону: 8-800-707-15-60 (бесплатный звонок) | |
| *Клиника имеет лицензию на удаление новообразований |
Лептин — что это
Лептин — это пептидный гормон, классифицируемый как адипокины, который синтезируется жировой тканью. Адипокины — это биологически активные соединения, которые действуют только на жировую ткань или воздействуют на отдаленные ткани. Одним из наиболее важных адипокинов является лептин, состоящий из 17 аминокислот.
Этот гормон синтезируется главным образом жировой тканью и в небольших количествах вырабатывается в скелетных мышцах, эндотелии, желудке, плаценте и гипофизе. Рецепторы лептина, в свою очередь, обнаруживаются в клетках поджелудочной железы, надпочечников, селезенки, яичек, яичников, предстательной железы, плаценты, гипоталамуса и щитовидной железы.
Уровень синтеза лептина напрямую зависит от объема жировой ткани. Он также подвергается ежедневной регуляции — пик клиренса лептина падает между 22 и 3 часами ночи. На стимулирование синтеза лептина также влияют следующие факторы инсулин, глюкоза, глюкокортикоиды и эстрогены.
В свою очередь, производство лептина ингибируется свободными жирными кислотами, гормоном роста и андрогенами, а также гипогликемическими и противовоспалительными препаратами.
Лептин — действие
Лептин оказывает влияние на развитие плода. Затем он синтезируется как плацентой, так и жировой тканью плода. Лептин участвует в развитии дыхательной, пищеварительной и костной систем и участвует в кроветворении.
Лептин регулирует метаболизм липидов и глюкозы. Гормон лептин усиливает окисление жирных кислот, способствуя липолизу. Благодаря этому лептин способствует активации распределения жировой ткани, одновременно препятствуя ее выработке.
В свою очередь, влияние этого гормона на углеводный обмен снижается, чтобы повысить чувствительность клеток к инсулину и увеличить потребление глюкозы. Следующим направлением действия лептина является влияние на прием пищи. Лептин не без оснований называют гормоном сытости.
Понижая уровень нейропептида Y, то есть соединения, способствующего аппетиту, лептин снижает аппетит.
Лептин и грелин
У тучных людей, чей организм постепенно становится устойчивым к такому действию лептина, это может привести к более сильному и более частому голоду. Лептин обладает эффектом, противоположным действию грелина, синтезируемого клетками желудка, который отвечает за чувство голода.
Повышенная секреция грелина связана со стрессом при использовании низкокалорийных диет (ниже 1000 ккал) и при раке. Лептин и грелин должны оставаться в равновесии, иначе могут возникнуть нарушения аппетита.
Лептин также определяет правильное течение полового созревания и роста, влияет на фертильность, модулирует работу иммунной системы, а также увеличивает минеральную плотность кости.
Тест на уровень лептина — показания
Определение уровня лептина в крови обычно не проводится. Это исследование чаще всего поручено диагностировать причины ожирения, особенно у детей.
Важным признаком является ожирение, возникающее у человека, в семье которого были также случаи ожирения, а также ожирения с сопровождающими приступами неконтролируемого голода. Кроме того, появление других расстройств пищевого поведения может быть показанием для определения лептина.
Уровень гормона также определяется при нарушениях менструального цикла, которые могут возникать из-за чрезмерного уменьшения жира или его патологически большого объема.
Как выглядит тест на уровень лептина и сколько он стоит
Определение уровня лептина требует взятия образца венозной крови. Пациенту не нужно готовиться к тесту, единственное условие – это сдача анализа на голодный желудок (т.е. 10-12 часов с момента последнего приема пищи). Стоимость теста на лептин составляет около 1000 рублей.
Лептин — правильный уровень
Норма лептина в крови определяется отдельно для мужчин и женщин, что обусловлено разным объемом жировой ткани у обоих полов. Лептин у мужчин колеблется в пределах 1,2-9,9 нг мл, а у женщин — 4,1-25 нг мл.
На уровень лептина в организме влияет ИМТ, то есть индекс массы тела, беременность, а также циркадный ритм — самый высокий уровень регистрируется ночью и рано утром, самый маленький — с утренних часов.
Интерпретация результатов теста на лептин
Повышенные уровни лептина физиологически обнаруживаются у людей с ожирением. Когда ожирение сопровождается низким уровнем лептина, причиной может быть дефицит лептина. У небольшого процента людей дефицит лептина является врожденным и является следствием мутации гена, кодирующего рецептор лептина LEPR.
Однако, если у человека с избыточной массой тела наблюдается значительное повышение концентрации лептина, причиной может быть резистентность к лептину. Это состояние, при котором избыток жира синтезирует большое количество лептина;
Со временем ткани перестают реагировать на лептин, что нарушает чувство сытости и способствует чрезмерному аппетиту. Мы едим больше, мы набираем жировую ткань, увеличивается синтез лептина — и резистентность к лептину постоянно растет.
Резистентность к лептину — как лечить?
В случае резистентности к лептину вы можете заметить проблемы с потерей веса, несмотря на использование диеты для похудения, а также постоянное желание перекусить. Кроме того, люди, борющиеся с этой проблемой, испытывают хроническую усталость.
Самый эффективный способ борьбы с резистентностью — это уменьшение массы тела. Лучшая диета — это диета на основе жиров, так как углеводы и белки стимулируют синтез лептина. Кроме того, категорически следует избегать переедания.
Также стоит позаботиться о правильном ежедневном цикле сна — идеальное время для засыпания — 22-23, а сон должен длиться около 8 часов.
Как повысить уровень гормона лептина
Люди, пытающиеся уменьшить массу тела, иногда хотят повысить уровень лептина, чтобы обеспечить чувство сытости и облегчить похудение. В каких продуктах появляется лептин?
Ни один пищевой продукт не является источником этого гормона; единственный способ доставить лептин извне — это препараты, содержащие лептин. Лептин в таблетках назначается врачом.
Также используются препараты, повышающие чувствительность клеток к лептину. Напротив, пищевые добавки чаще всего содержат другие соединения, которые подавляют аппетит.
Так как стимулировать синтез лептина естественным путем и в таких количествах, которые соответствуют текущим потребностям организма? Для повышения уровня лептина рекомендуется диета, богатая углеводами, регулярное питание и достаточный сон.
Лептинорезистентность — причина переедания
Все, кто хоть раз пытались сбросить вес, знают: самое сложное — это изменить свои привычки. Не есть на ночь. Отказаться от перекусов или заменить бутерброд яблоком.
Иногда мы едим явно больше, чем нужно, и не можем остановиться. Иногда мы едим за компанию, хотя есть, в общем-то, не хотели. Иногда мы едим, если расстроены, рассержены или напуганы. Порой удаётся взять свой аппетит под контроль, а порой нет. Такие нарушения пищевого поведения учёные связывают с развитием лептинорезистентности.
В этой статье вы найдёте ответы на вопросы: что такое лептинорезистентность, как она проявляется, чем опасна и как лечить лептинорезистентность?
Лептин — гормон стройности
Лептин является гормоном, который производят в основном адипоциты — клетки жировой ткани. Пик его концентрации в крови приходится на ночное время. А во время голодания уровень лептина снижен.
Лептин попадает в головной мозг, где связывается с соответствующими рецепторами в гипоталамусе и запускает целый каскад реакций. В частности, происходит выделение серотонина (ощущение удовольствия от пищи) и меланокортинов — веществ, обладающих анорексигенным эффектом.
Меланокортины связываются с рецептором MC4R в центре голода и насыщения, в результате чего подавляется аппетит. Так лептин принимает участие в регуляции пищевого поведения. Отсутствие гормона или рецептора к нему приводит к нарушению пищевого поведения, неконтролируемому поглощению пищи и развитию ожирения.
Помимо регуляции аппетита лептин стимулирует:
Лептинорезистентность: что это такое?
Лептинорезистентностью называют такое состояние, при котором высокие дозы лептина не оказывают вышеперечисленных эффектов. Оно может быть связано с невосприимчивостью рецептора гипоталамуса к гормону лептину или с “поломкой” в цепи реакций, которые запускает лептин.
В частности, врожденные особенности рецептора MC4R приводят к его низкой активности. В результате в ответ на повышение концентрации лептина, а вслед за ним — меланокортинов, не возникает ожидаемого ощущения сытости. Человек продолжает испытывать голод и переедает.
Механизм развития лептинорезистентности
Механизм развития лептинорезистентности пока что до конца не ясен. Однако, известны две вещи: во-первых, обычно снижение чувствительности и количества рецепторов развивается как компенсаторная реакция в ответ на избыток лиганда (вещества, которое стимулирует этот рецептор).
А во-вторых, при увеличении концентрации лептина в крови выше критического значения, не происходит повышения концентрации лептина в головном мозге. Это, по всей видимости, связано с имеющимися внутри кровеносных сосудов рецепторами, играющими роль транспортных ворот.
Исходя из этого, можно предположить, что лептинорезистентность связана с нарушением транспорта лептина (чрезмерным поступлением лептина в мозг). А при нерегулируемом увеличении концентрации лептина в мозге, снижение чувствительности к нему неизбежно.
Учёные полагают, что лептинорезистентность лежит в основе нарушений пищевого поведения и является одной из причин ожирения. Ещё больше о факторах, приводящих к лишнему весу вы можете прочитать в блоге “Нутрициология”.
Признаки лептинорезистентности
Диагностика лептинорезистентности в настоящее время не проводится, т.к. само явление ещё активно изучается. Пока что не до конца ясно, каким образом можно определить снижение чувствительности к лептину, и является ли лептинорезистентность обязательным симптомом ожирения, или развитие ожирения возможно и без лептинорезистентности.
Но если пока что нет возможности её определить, то как можно вылечить лептинорезистентность? Об этом поговорим ниже.
Лептинорезистентность: как лечить?
Безусловно, многих волнует вопрос, как и чем лечить лептинорезистентность. Можно ли на неё как-то повлиять, если вообще не до конца понятно, что это такое? Как ни странно, можно.
Несмотря на то, что диагностических критериев определения лептинорезистентности нет, сегодня разрабатываются лекарственные препараты, способные вызвать эффект, аналогичный эффекту натурального лептина. Например, это пептидные молекулы меланокортинов, вызывающие подавление аппетита.
В медицинской практике также используются препараты сибутрамина с выраженным анорексигенным эффектом. Они разрешены к применению только по рецепту врача и применяются при нарушениях пищевого поведения, т.к. помогают уменьшить неконтролируемую тягу к пище.
Немедикаментозные способы повышения уровня лептина
Состав потребляемой пищи влияет на уровень лептина. Известно, что в этом принимает участие цинк (чемпион по содержанию цинка — устрицы) и линолевая кислота (ею богато рапсовое масло), причём эффект от одной и той же дозы продуктов у женщин выше, чем у мужчин. Этот факт заставляет предположить, что на уровень лептина могут влиять и половые гормоны.
Физические нагрузки продолжительностью менее часа на уровень лептина влияния не оказывают. Что касается длительных и регулярных нагрузок, то тут мнения учёных расходятся.
У детей, находящихся на грудном вскармливании, уровень лептина выше, чем у находящихся на искусственном, т.к. лептин содержится в материнском молоке. Соответственно, дети на грудном вскармливании получают большее удовлетворение от пищи, при том, что чувство насыщения возникает у них раньше. Таким образом, пищевое поведение человека начинает формироваться ещё в период младенчества.
При этом грудное вскармливание ассоциировано с более низкими концентрациями лептина в пубертате (когда клетки жировой ткани начинают активно делиться и увеличиваться общее количество жировой ткани в организме). Т.е. способ вскармливания в младенчестве может влиять на развитие ожирения в более старшем возрасте.
Безусловно, и гормон лептин и явление лептинорезистентности — крайне интересная и важная тема. Хочется надеяться, что дальнейшие исследования в этой области могут улучшить качество жизни более чем двух миллиардов людей. И помочь тем, у кого пока ещё нет ожирения, но уже есть проблемы с пищевым поведением, исправить проблему не дожидаясь, пока станет слишком поздно.
Метаболический синдром — основы патогенетической терапии
В 1948 г. известный клиницист Е. М. Тареев писал: «Представление о гипертонике наиболее часто ассоциируется с ожирелым гиперстеником, с возможным нарушением белкового обмена, с засорением крови продуктами неполного метаморфоза — холестерином, мочевой кис
В 1948 г. известный клиницист Е. М. Тареев писал: «Представление о гипертонике наиболее часто ассоциируется с ожирелым гиперстеником, с возможным нарушением белкового обмена, с засорением крови продуктами неполного метаморфоза — холестерином, мочевой кислотой. » Таким образом, более 50 лет назад было практически сформировано представление о метаболическом синдроме (МС). В 1988 г. G. Reaven описал симптомокомплекс, включающий гиперинсулинемию, нарушение толерантности к глюкозе, низкий уровень ХС ЛПВП и артериальную гипертонию, дав ему название «синдром Х» и впервые высказав предположение, что в основе всех этих изменений лежит инсулинорезистентность (ИР) с компенсаторной гиперинсулинемией. В 1989 г. J. Kaplan показал, что существенной составляющей «смертельного квартета» является абдоминальное ожирение. В 90-х гг. появился термин «метаболический синдром», предложенный M. Henefeld и W. Leonhardt. Распространенность этого симптомокомплекса приобретает характер эпидемии и в некоторых странах, в том числе и в России, достигает 25—35% среди взрослого населения.
Общепризнанные критерии МС до настоящего времени не разработаны, надо полагать, по причине отсутствия единых взглядов на его патогенез. Продолжающаяся дискуссия о правомочности использования терминов «полный» и «неполный» МС иллюстрирует недооценку единого механизма, обусловливающего параллельное развитие всех каскадов метаболических расстройств при инсулинорезистентности.
ИР — полигенная патология, в развитии которой могут иметь значение мутации генов субстрата инсулинового рецептора (IRS-1 и IRS-2), β3-адренорецепторов, разобщающего протеина (UCP-1), а также молекулярные дефекты белков сигнального пути инсулина (глюкозные транспортеры). Особую роль играет снижение чувствительности к инсулину в мышечной, жировой и печеночной тканях, а также в надпочечниках. В миоцитах нарушаются поступление и утилизация глюкозы, в жировой ткани развивается резистентность к антилиполитическому действию инсулина. Интенсивный липолиз в висцеральных адипоцитах приводит к выделению большого количества свободных жирных кислот (СЖК) и глицерина в портальный кровоток. Поступая в печень, СЖК, с одной стороны, становятся субстратом для формирования атерогенных липопротеидов, а с другой — препятствуют связыванию инсулина с гепатоцитом, потенциируя ИР. ИР гепатоцитов ведет к снижению синтеза гликогена, активации гликогенолиза и глюконеогенеза. Долгое время ИР компенсируется избыточной продукцией инсулина, поэтому нарушение гликемического контроля манифестирует не сразу. Но, по мере истощения функции β-клеток поджелудочной железы, наступает декомпенсация углеводного обмена, сначала в виде нарушенных гликемии натощак и толерантности к глюкозе (НТГ), а затем и сахарного диабета 2 типа (Т2СД). Дополнительное снижение секреции инсулина при МС вызывается длительным воздействием высоких концентраций СЖК на β-клетки (так называемый липотоксический эффект). При имеющихся генетически обусловленных дефектах секреции инсулина развитие Т2СД значительно ускоряется.
Согласно другой гипотезе, ведущую роль в развитии и прогрессировании инсулинорезистентности играет жировая ткань абдоминальной области. Особенность висцеральных адипоцитов — высокая чувствительность к липолитическому действию катехоламинов и низкая к антилиполитическому действию инсулина.
Помимо веществ, непосредственно регулирующих липидный обмен, жировая клетка продуцирует эстрогены, цитокины, ангиотензиноген, ингибитор активатора плазминогена-1, липопротенлипазу, адипсин, адинопектин, интерлейкин-6, фактор некроза опухолей-α (ФНО-α), трансформирующий фактор роста В, лептин и др. Показано, что ФНО-α способен воздействовать на инсулиновый рецептор и транспортеры глюкозы, потенциируя инсулинорезистентность, и стимулировать секрецию лептина. Лептин («голос жировой ткани») регулирует пищевое поведение, воздействуя на гипоталамический центр насыщения; повышает тонус симпатической нервной системы; усиливает термогенез в адипоцитах; подавляет синтез инсулина; воздействует на инсулиновый рецептор клетки, снижая транспорт глюкозы. При ожирении наблюдается лептинорезистентность. Полагают, что гиперлептинемия оказывает стимулирующее действие на некоторые гипоталамические релизинг-факторы (РФ), в частности на АКТГ-РФ. Так, при МС часто отмечается легкий гиперкортицизм, который играет определенную роль в патогенезе МС.
Следует особо остановиться на механизмах развития артериальной гипертонии (АГ) при МС, некоторые из них до недавнего времени были неизвестны, ввиду чего патогенетический подход к лечению МС был не до конца разработан.
Существуют многочисленные исследования, посвященные изучению тонких механизмов влияния инсулинорезистентности и гиперинсулинемии на уровень АД.
В норме инсулин обладает сосудистым протективным эффектом за счет активации фосфатидил-3-киназы в эндотелиальных клетках и микрососудах, что приводит к экспрессии гена эндотелиальной NO-синтазы, высвобождению NO эндотелиальными клетками и инсулин-обусловленной вазодилатации.
В настоящее время установлены следующие механизмы воздействия хронической гиперинсулинемии на АД:
Инсулин принимает участие в регуляции активности симпатической нервной системы в ответ на прием пищи. В экспериментальных работах установлено, что при голодании активность САС снижается, а при потреблении пищи повышается (особенно жиров и углеводов).
Предполагается, что инсулин, проходя через гематоэнцефалический барьер, стимулирует захват глюкозы в регуляторных клетках, связанных с вентромедиальными ядрами гипоталамуса. Это уменьшает их тормозящее воздействие на центры симпатической нервной системы ствола мозга и повышает активность центральной симпатической нервной системы.
В физиологических условиях этот механизм явлется регуляторным, при гиперинсулинемии же приводит к стойкой активации САС и стабилизации АГ.
Повышение активности центральных отделов САС приводит к периферической гиперсимпатикотонии. В почках активация β-рецепторов ЮГА сопровождается выработкой ренина, усиливается задержка натрия и жидкости. Постоянная гиперсимпатикотония на периферии в скелетных мышцах влечет нарушение микроциркуляторного русла, вначале с физиологической разреженностью микрососудов, а затем и к морфологическим изменениям, таким, как снижение количества функционирующих капилляров. Уменьшение числа адекватно кровоснабжаемых миоцитов, которые являются главным потребителем глюкозы в организме, ведет к нарастанию инсулинорезистентности и гиперинсулинемии. Таким образом, порочный круг замыкается.
Инсулин через митоген-активированную протеинкиназу усиливает повреждающие сосудистые эффекты за счет стимуляции различных факторов роста (тромбоцитарный фактор роста, инсулиноподобный фактор роста, трансформирующий фактор роста Р, фактор роста фибробластов и др.), что ведет к пролиферации и миграции гладкомышечных клеток, пролиферации фибробластов сосудистой стенки, накоплению внеклеточного матрикса. Эти процессы вызывают ремоделирование сердечно-сосудистой системы, приводя к потере эластичности сосудистой стенки, нарушению микроциркуляции, прогрессированию атерогенеза и, в конечном счете, к росту сосудистого сопротивления и стабилизации АГ.
Некоторые авторы полагают, что нарушение функции эндотелия играет основную роль в патогенезе АГ, связанной с метаболическими нарушениями. У лиц с инсулинорезистентностью и гиперинсулинемией наблюдается снижение реакции на вазодилатационное и усиление на вазоконстрикторное воздействие, что ведет к кардиоваскулярным осложнениям.
Для метаболического синдрома характерна гиперурикемия (встречается, по разным данным, у 22—60% больных с МС).
В настоящее время показано, что концентрация мочевой кислоты в крови коррелирует с триглицеридемией и степенью выраженности абдоминального ожирения; в основе этого явления лежит тот факт, что усиление синтеза жирных кислот активирует пентозный путь окисления глюкозы, способствуя образованию рибозо-5-фосфата, из которого происходит синтез пуринового ядра.
С учетом всех рассмотренных выше аспектов проблемы и должен формироваться терапевтический алгоритм патогенетического подхода к лечению метаболического синдрома.
Лечение метаболического синдрома
Комплекс лечения метаболического синдрома включает в себя следующие равнозначные позиции: изменение образа жизни, лечение ожирения, лечение нарушений углеводного обмена, лечение артериальной гипертонии, лечение дислипидемии.
Изменение образа жизни
Этот аспект лежит в основе успешного лечения метаболического синдрома.
Цель врача в данном случае — сформировать у больного устойчивую мотивацию, направленную на длительное выполнение рекомендаций по питанию, физическим нагрузкам, приему лекарственных препаратов. «Установка на успех» позволяет пациенту легче переносить те лишения, которых требует изменение образа жизни.
Изменение режима питания. Диета больного метаболическим синдромом должна не только обеспечивать снижение массы тела, но и не вызывать обменных нарушений не провоцировать повышения артериального давления. Голодание при синдроме Х противопоказано, так как является тяжелым стрессом, и при имеющихся метаболических нарушениях может привести к острым сосудистым осложнениям, депрессии, срыву в «пищевой запой». Питание должно быть частым, пищу следует принимать малыми порциями (обычно три основных приема пищи и два-три промежуточных) при суточной калорийности пищи не более 1500 ккал. Последний прием пищи — за полтора часа до сна. Основа питания — сложные углеводы с низким гликемическим индексом, они должны составлять до 50–60% пищевой ценности. Единица гликемического индекса пищи — это изменение гликемии после еды, равное изменению гликемии после потребления 100 г белого хлеба. Высоким гликемическим индексом обладают большинство кондитерских изделий, сладкие напитки, сдоба, мелкие крупы; их потребление следует исключить или свести до минимума. Низкий ГИ у цельнозерновых продуктов, овощей, фруктов, богатых пищевыми волокнами. Общее количество жиров не должно превышать 30% от общей калорийности, сатурированных жиров — 10%. Каждый прием пищи должен включать адекватное количество белка для стабилизации гликемии и обеспечения насыщения. Не менее двух раз в неделю следует употреблять рыбу. Овощи и фрукты должны присутствовать в рационе не менее пяти раз в день. Допустимое количество сладких фруктов зависит от степени нарушения углеводного обмена; при наличии сахарного диабета 2 типа их следует резко ограничить.
Пищевой соли — не более 6 г в день (одна чайная ложка).
Алкоголь, как источник «пустых калорий», стимулятор аппетита, дестабилизатор гликемии, следует исключить из рациона или свести до минимума. В случае невозможности отказа от алкоголя предпочтение следует отдавать красному сухому вину, не более 200 мл в день.
Пациентам рекомендуется ведение пищевого дневника, где они записывают, что, в каком количестве и в какое время было съедено и выпито.
Необходим отказ от табакокурения, это значительно снижает риск сердечно-сосудистых и онкологических осложнений.
Физическая активность. По оценкам G. Reaven, у 25% лиц, ведущих малоподвижный образ жизни, можно обнаружить инсулинорезистентность. Сама по себе регулярная мышечная активность приводит к метаболическим изменениям, снижающим инсулинорезистентность. Для достижения терапевтического эффекта достаточно ежедневно практиковать 30-минутную интенсивную ходьбу или три-четыре раза в неделю проводить 20—30-минутные пробежки.
Лечение ожирения
При лечении метаболического синдрома удовлетворительным результатом может считаться снижение массы на 10—15% в первый год лечения, на 5—7% на второй год и отсутствие рецидивов прибавки массы тела в дальнейшем.
Соблюдение низкокалорийной диеты и режима физической активности не всегда выполнимо для пациентов. В этих случаях показана лекарственная терапия ожирения.
В настоящее время в России зарегистрированы и рекомендованы для длительного лечения ожирения препараты орлистат и сибутрамин. Механизм их действия принципиально различен, что позволяет в каждом конкретном случае подбирать оптимальное лекарственное средство, а при тяжелых случаях ожирения, резистентных к монотерапии, назначать эти препараты комплексно.
Лечение нарушений углеводного обмена
Степень выраженности нарушений углеводного обмена при метаболическом синдроме колеблется от минимальной (нарушенные гликемия натощак и толерантность к глюкозе (НТГ)) до развития сахарного диабета 2 типа.
Лекарственные препараты, влияющие на углеводный обмен, в случае метаболического синдрома должны назначаться не только при наличии Т2СД, но и при менее тяжелых (обратимых!) нарушениях углеводного обмена. Гиперинсулинемия требует агрессивной терапевтической тактики. Имеются данные о наличии осложнений, характерных для сахарного диабета, уже на стадии нарушенной толерантности к глюкозе. Полагают, что это связано с частыми эпизодами постпрандиальной гипергликемии.
Мощный арсенал современных сахароснижающих средств позволяет выбрать в каждом конкретном случае оптимальную терапию.
1. Препараты, снижающие инсулинорезистентность
При метаболическом синдроме — препараты выбора.
В настоящее время единственным бигуанидом, снижающим инсулинорезистентность, является метформин. По результатам UKPDS, лечение метформином при Т2СД снижает риск смерти от сахарного диабета на 42%, инфаркта миокарда — на 39%, инсульта — на 41%.
Может считаться препаратом первого ряда в лечении метаболического синдрома.
Механизм действия: повышение чувствительности тканей к инсулину; подавление глюконеогенеза в печени; изменение фармакодинамики инсулина за счет снижения соотношения связанного инсулина к свободному и повышения соотношения инсулина к проинсулину; подавление окисления жиров и образования свободных жирных кислот, снижение уровня триглицеридов и ЛПНП, повышение ЛПВП; по некоторым данным — гипотензивный эффект; стабилизация или снижение массы тела. Снижает гипергликемию натощак и постпрандиальную гипергликемию. Гипогликемий не вызывает.
Может назначаться при НТГ, что особенно важно с точки зрения профилактики развития Т2СД.
Б. Тиазолидиндионы («глитазоны», инсулин-сенситайзеры)
К клиническому применению разрешены пиоглитазон и розиглитазон.
В России — малоприменяемая группа препаратов, вероятно, из-за относительной новизны, известного риска острой печеночной недостаточности и высокой стоимости.
Механизм действия: повышают захват глюкозы периферическими тканями (активируют GLUT-1 и GLUT-4, подавляют экспрессию фактора некроза опухолей, усиливающего инсулинорезистентность); уменьшают продукцию глюкозы печенью; снижают концентрацию свободных жирных кислот и триглицеридов в плазме за счет подавления липолиза (через повышение активности фосфодиэстеразы и липопротеинлипазы). Действуют только в присутствии эндогенного инсулина.
2. Ингибриторы α-глюкозидаз
Механизм действия: конкурентно ингибирует интестинальные α-глюкозидазы (сахаразу, мальтазу, глюкоамилазу) — ферменты, расщепляющие сложные сахара. Препятствует всасыванию простых углеводов в тонком кишечнике, что приводит к снижению постпрандиальной гипергликемии. Снижает массу тела и, как следствие, оказывает гипотензивное действие.
3. Секрeтогены инсулина
Препараты этого класса назначаются при метаболическом синдроме в случаях, когда не удается добиться удовлетворительного гликемического контроля с помощью средств, снижающих инсулинорезистентность, и/или акарбозы, а также при наличии противопоказаний к ним. Риск развития гипогликемий и увеличения массы тела при длительном применении требует строго дифференцированного подхода при выборе препарата. Назначение при НТГ не практикуется. Весьма эффективно сочетание секретогенов инсулина с бигуанидами.
А. Препараты сульфонилмочевины
Клинический опыт показывает, что монотерапия некоторыми секретогенами инсулина (в частности, глибенкламидом) у больных с метаболическим синдромом обычно оказывается неэффективной даже в максимальных дозах из-за нарастающей инсулинорезистентности — наступает истощение секреторной способности β-клеток и формируется инсулинопотребный вариант Т2СД. Предпочтение следует отдавать высокоселективным лекарственным формам, не вызывающим гипогликемий. Желательно, чтобы препарат можно было принимать один раз в день — для повышения комплаентности лечения.
Этим требованиям удовлетворяют препарат второй генерации гликлазид в фармакологической форме МВ (модифицированного высвобождения) и препарат третьей генерации глимепирид.
Гликлазид — высокоселективный препарат (специфичный к SUR1 субъединице АТФ-чувствительных калиевых каналов β-клетки), восстанавливает физиологический профиль секреции инсулина; повышает чувствительность периферических тканей к инсулину, вызывая посттранскрипционные изменения GLUT-4 и активируя действие инсулина на мышечную гликоген-синтетазу; снижает риск развития тромбозов, ингибируя агрегацию и адгезию тромбоцитов и повышая активность тканевого плазминогена; снижает уровень липидных пероксидов в плазме.
Глимепирид комплексируется с SURX рецептора сульфонилмочевины. Обладает выраженным периферическим действием: увеличивает синтез гликогена и жира за счет активации транслокации GLUT-1 и GLUT-4; снижает скорость глюконеогенеза в печени, повышая содержание фруктозо-6-бифосфата. Обладает более низкой, чем другие препараты сульфонилмочевины, глюкагонотропной активностью. Обеспечивает низкий риск гипогликемий — вызывает при минимальной секреции инсулина максимальное снижение глюкозы в крови. Обладает антиагрегационным и антиатерогенным эффектами, избирательно ингибируя циклооксигеназу и снижая превращение арахидоновой кислоты в тромбоксан А2. Комплексируется с кавеолином жировых клеток, что, вероятно, обусловливает специфичность влияния глимепирида на активизацию утилизации глюкозы в жировой ткани.
Б. Прандиальные регуляторы гликемии (секретогены короткого действия)
Быстродействующие гипогликемические препараты, производные аминокислот. В России представлены репаглинидом и натеглинидом.
Механизм действия — быстрая, кратковременная стимуляция секреции инсулина β-клеткой за счет быстрого обратимого взаимодействия со специфическими рецепторами АТФ-чувствительных калиевых каналов.
Считается, что натеглинид безопаснее в отношении развития гипогликемий: секреция инсулина, вызванная натеглинидом, зависит от уровня гликемии и снижается по мере уменьшения уровня глюкозы в крови. Исследуется возможность применения низких дозировок натеглинида при НТГ у больных с высоким риском сердечно-сосудистых осложнений (NAVIGATOR).
4. Инсулинотерапия
Раннее начало инсулинотерапии при метаболическом синдроме (за исключением случаев декомпенсации диабета) представляется нежелательным, так как, скорее всего, будет усугублять клинические проявления гиперинсулинизма. Однако следует отметить, что, во избежание осложнений сахарного диабета, компенсация углеводного обмена должна быть достигнута любой ценой. При неудовлетворительном эффекте от ранее перечисленных видов лечения должна быть назначена инсулинотерапия, возможно, в допустимых комбинациях с пероральными сахароснижающими препаратами. В отсутствии противопоказаний предпочтительна комбинация с бигуанидами.
Лечение артериальной гипертонии
Целевой уровень АД при развитии сахарного диабета 2 типа —