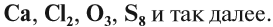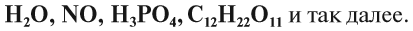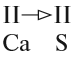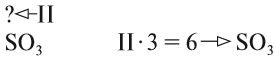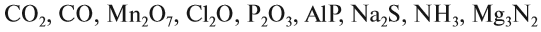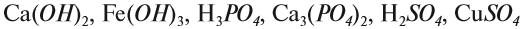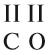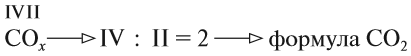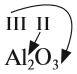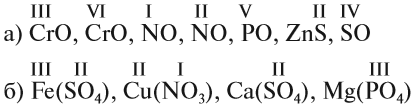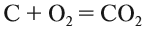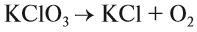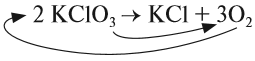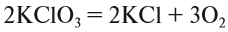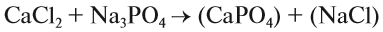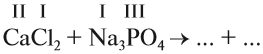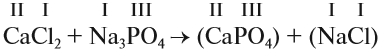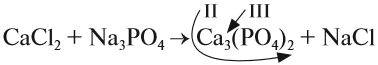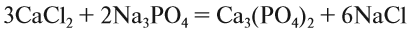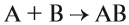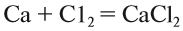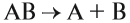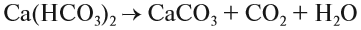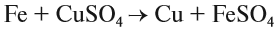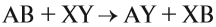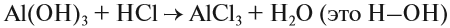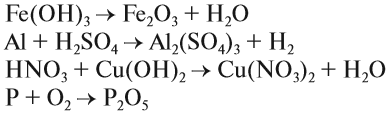Как объяснить ребенку что такое химия
Урок 1. Основные понятия и законы предмета «Химия»
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na + и ионов Cl – (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
Число атомов в молекуле обозначают при помощи индекса:
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
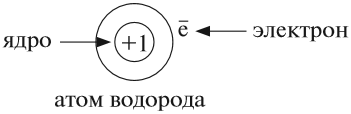
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
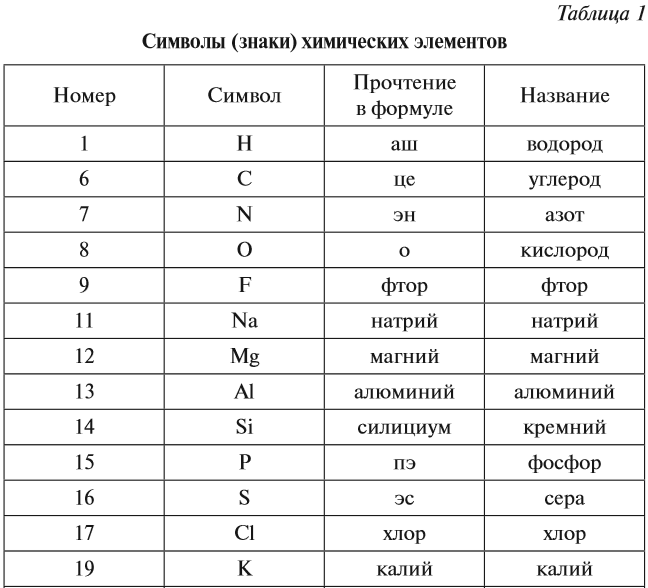
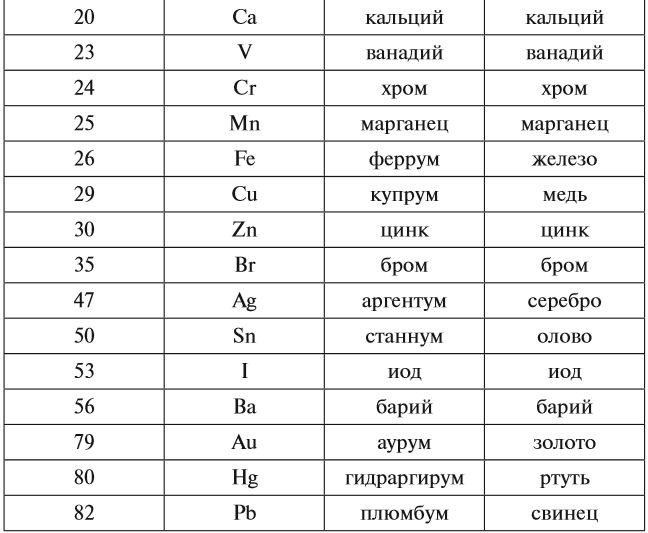
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
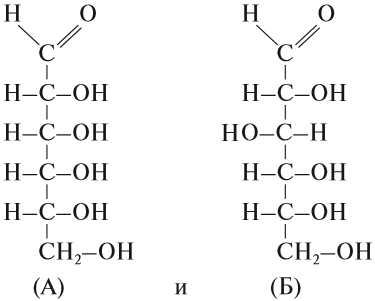
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
* В 2002 г. появилось сообщение о существовании ещё одного простого вещества кислорода — O4.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Задание 1.4. Составьте химические формулы соединений:
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
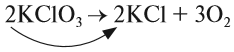
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
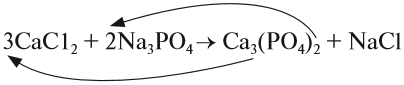
4. Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.
Химия или магия. Знакомим детей с наукой химией
Анна Голуб
Химия или магия. Знакомим детей с наукой химией
химия или магия.
Цель: познакомить детей с наукой химией.
Развивающие задачи: пробудить интерес, активизировать мыслительную деятельность. Продолжать учить вступать в диалог с взрослым. Отвечать на вопросы развернутыми предложениями, аргументировать свои ответы. Стимулировать самостоятельное формулирование выводов детьми.
Обучающие задачи: помогать накоплению у детей конкретных представлений о свойствах различных предметов, через наблюдение. Выявлять агрегатное состояние веществ. Закрепить умение записывать результаты опытов специальными символами.
Воспитывающие задачи: воспитывать аккуратность в работе, соблюдение правил техники безопасности. Вызывать у детей положительные эмоции, закреплять интерес к теме.
Иллюстрированные книги, иллюстрации химиков разных эпох, химических лабораторий. Фартуки, индивидуальные формочки с содой, пластиковые палочки, уксус в закрытой емкости. Мнемотаблица.
Воспитатель предлагает назвать книги книжного уголка (Гарри Поттер, Мэри Поппинс, Василиса Премудрая)
-Какие чудеса, волшебства, превращения могли творить эти замечательные персонажи?
-Что им помогало? Назовите волшебные предметы – помощники.
-Какими еще словами можно назвать волшебство? (колдовство, магия, сказка.)
-Сегодня я расскажу вам об удивительной науке, которая называется химия.
Химики – ученые, они могут глину превратить в самолет, из полена сшить платье. Из нефти, которая находиться в глубинах земли научились делать бензин, красивые ткани, лекарства
Самыми первыми учеными были алхимики,они сделали много полезного: открыли кислоты, щелочи, соли (рассмотреть иллюстрации о работе алхимиков и современных ученых).
Химия наука о веществах и их превращениях. Вещества – это то, из чего состоит все на свете. Дерево, цветок, камень, облако, мы с вами – все состоит из веществ.
-Какие вещества вы можете назвать?
Иногда одно вещество превращается в другое, а то и в несколько разных.
-Кто может рассказать о превращениях воды? (жидкость, снег, лед, пар)
д\игра «жидкое, твердое, газообразное»
«Облачко» выполняется под музыкальное сопровождение.
Дети изображают воду в лужице, речке, ручейке, росинке. Нагреваясь, они превращаются в бегущих человечков пара, поднимаются вверх (руки вверх, очень пластичные движения) высоко в небе встречаются, объединяются в облачко. Морозный воздух охлаждает человечков пара, они твердеют, кристаллизируются, падают на землю.
Все за мной вы повторяйте:
Дружно руки поднимайте.
Вот попрыгаем на месте,
И потянемся все вместе.
Мы покружимся немножко
Поглядим теперь в окошко.
Улыбнемся мы немножко.
Отдохнули, и теперь
Химики проводят опыты в химических лабораториях (рассмотреть иллюстрации, мы тоже будем оснащать, и пополнять свою лабораторию Но вначале вы должны ознакомиться с правилами работы.
Правила работы в детской лаборатории для детей.
Опыты и эксперименты проводить на специальном столе покрытым клеенкой в светлом месте.
Необходимо надеть клеенчатый фартук, чтобы сохранить свою одежду в чистоте. В некоторых случаях необходимо использовать резиновые перчатки.
Для проведения опытов необходимо использовать специальную посуду или формочки.
Никогда не нюхай незнакомое вещество, не пробуй его на вкус.
Никогда не смешивай незнакомые вещества – это опасно.
Прежде, чем начать опыт внимательно изучи инструкцию и приготовь все, что понадобиться.
Не оставляй в баночке вещество, получившееся в результате опыта, сразу вылей его, а баночку помой и убери.
Все опыты с огнем делай вместе со взрослым. Огонь – это действительно опасно!
Дети проходят в лабораторию, надевают фартуки.
На столах детей в формочках находится сода.
Предложить описать соду (белая, сыпучая, не имеет запаха, состоит из мелких крупинок – частиц). Зарисовать в мнемотаблице, используя символы.
Пищевая сода уникальный продукт. Ее используют в хлебопечении, в медицине применяют в лечебных целях. В нашем опыте сода будет просто необходима, ведь мы будем проводить самую настоящую химическую реакцию. Из одного вещества «соды», мы будем получать несколько других.
Итак, химическая реакция – это превращение веществ.
-Наш опыт называется «Огнетушитель».
-Для чего нужен огнетушитель? (показ иллюстраций)
Висит – молчит, а перевернешь, шипит, и пена летит.
Если есть огнетушитель
Будет найден нарушитель.
Не уйти огню от нас
Все потушит пенный газ
-Как появляется пена из него? На эти вопросы мы сможем ответить после проведения опыта.
Воспитатель показывает в отдельной емкости уксус, объясняет, что с уксусом может работать только взрослый.
Уксус – это кислота очень кислая и едкая на запах.
Воспитатель добавляет уксус в формочки с содой, дети наблюдают реакцию.
-Кислота умеет «отщипывать» от других веществ малюсенькие частички – атомы. И получается другое вещество. Так в результате реакции у нас получились новые вещества – соль, вода и углекислый газ. Газ выделился в виде пузырьков и забурлил. Так же происходит реакция и в настоящих огнетушителях.
Воспитатель показывает, как правильно зарисовать результаты опыта в мнемотаблицы
Йод – история его открытия.
Познакомить с историей открытия йода.
Обучающие задачи: расширять знания детей о взаимодействии различных веществ. Систематизировать и уточнять представления детей о химических реакциях. Помогать накоплению у детей конкретных представлений о свойствах различных предметов, через наблюдение. Выявлять агрегатное состояние веществ.
Развивающие задачи: развивать логическое мышление, воображение. Стимулировать самостоятельное формулирование выводов детьми.
Воспитывающие задачи: воспитывать аккуратность в работе, соблюдение правил техники безопасности. Обогащать словарь детей.
Настойка йода, лист сухой ламинарии, вода, перекись водорода, индивидуальная посуда для проведения опытов, лупа, мнемотаблица, салат морской капусты, иллюстрации морского побережья.
Воспитатель предлагает рассмотреть йод в бутылочке и просит рассказать о назначении его.
-Опишите йод, какой он? Для чего йод используют?
Это настойка йода – раствор йода в спирте. Чистый йод – это темно-серые твердые кристаллы. Йод в чистом виде в природе не встречается. Он запрятан в растениях и камнях.
Рассмотреть морское побережье на иллюстрации. Богатые йодом водоросли служат кормом различным животным.
Воспитатель показывает небольшую часть сухого листа ламинарии. Дети исследуют ее.
Замочить сухой лист в воде, понаблюдать за изменениями свойств листа (увеличивается в размерах, становится более пластичным, усиливается запах йода).
Морская водоросль содержит много йода. Она очень полезна для здоровья. Из нее готовят салаты и некоторые лекарства для ослабленных людей. Показать буклеты о медикаментах содержащих йод.
Слониха, слоненок и слон
Устали стоять в зоопарке,
И в море уплыли на синей байдарке.
Слониху, слоненка, слона
Пушистые волны качали
И детской улыбкой дельфины встречали.
Слонихе, слоненку, слону
Дельфины устроили дружеский ужин.
Слониха, слоненок и слон
В обнимку растаяли в дымке –
Дельфины на память остались на снимке.
Слониха, слоненок и слон
Во сне по дельфинам тоскуют,
И хоботом ищут капусту морскую
Слониха, слоненок и слон
Да-да! Спят и видят ее,
Любимое блюдо свое!
Морская капуста приятна,
Дельфины во сне ее шлют вероятно!
Во время небольшой паузы предложить на пробу салат из морской капусты. Описать его вкусовые качества.
200 лет назад французскому химику йод помогла открыть кошка. Она прыгнула на стол и опрокинула склянки с серой кислотой, железом и морскими водорослями. Растворы смешались и превратились в фиолетовое облако. Когда облако рассеялось, химик увидел темные пахучие кристаллы и назвал их «фиалками». Уже позднее йод растворили в спирте, чтобы мазать разбитые коленки.
Что еще о йоде скажешь!
Каждый сразу все поймет!
Если ранку ты помажешь –
Ранка сразу заживет!
Мы будем получать йод в чистом виде. Для этого возьмем обычную йодную настойку и добавим несколько капель перекиси водорода.
Наблюдение за образованием темно-серых кристаллов йода.
Перекись водорода очень активное вещество. Как только оно встречается с другим веществом, оно «нападает» и «отбирает» частички-атомы. Вот и сейчас перекись отобрала частички спирта, остался йод.
Рассмотреть кристаллы йода в лупу.
Зарисовать схему проведения опыта в мнемотаблицу.


Край любимый мой или Знакомим детей с народной мудростью. С чего начинается знакомство с родным краем, его культурой? Когда это происходит? Когда родной становится любимым? Думаю, что в младенчестве,.


Викторина «Физика. Химия. Биология» в 11 классе 1. Химическое вещество, которого больше всего содержится в живой клетке? (Вода) 2. Великий русский ученый, известный как поэт, химик, физик,.
Знакомим детей с Праздником Пасхи Пасха — главное событие года для всех христиан и самый большой православный праздник. Слово «Пасха» пришло к нам из греческого языка и означает.