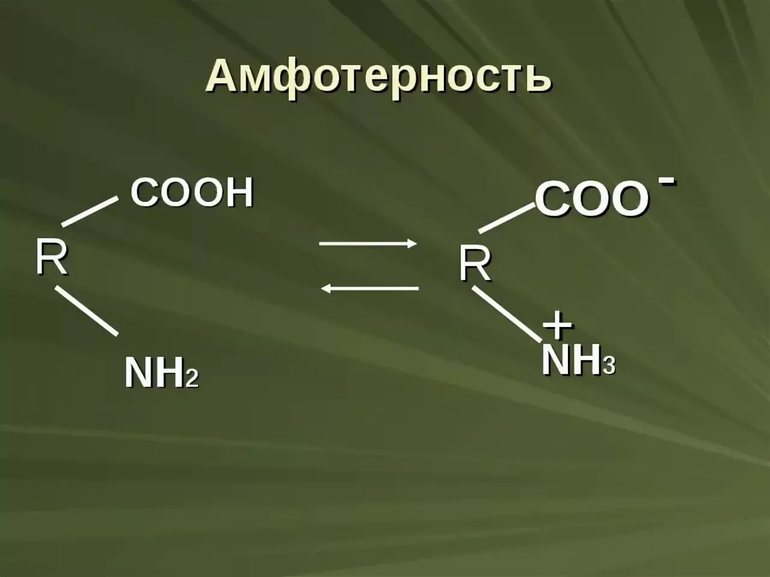
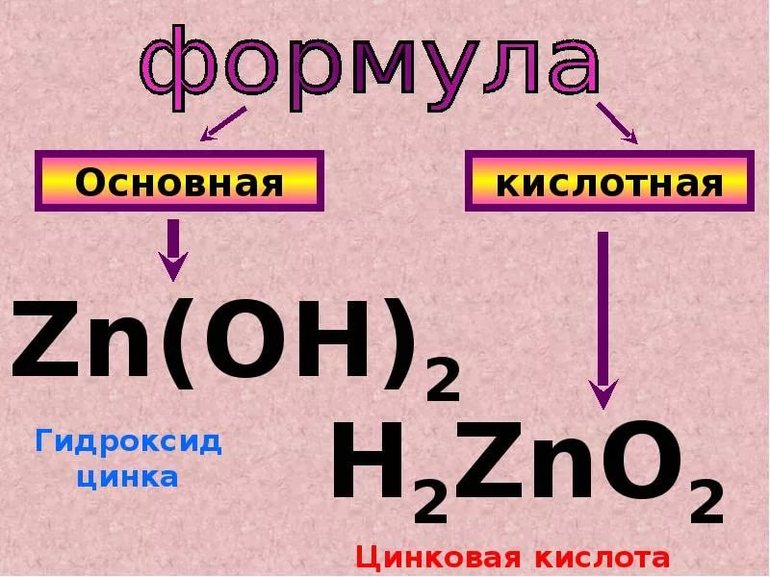
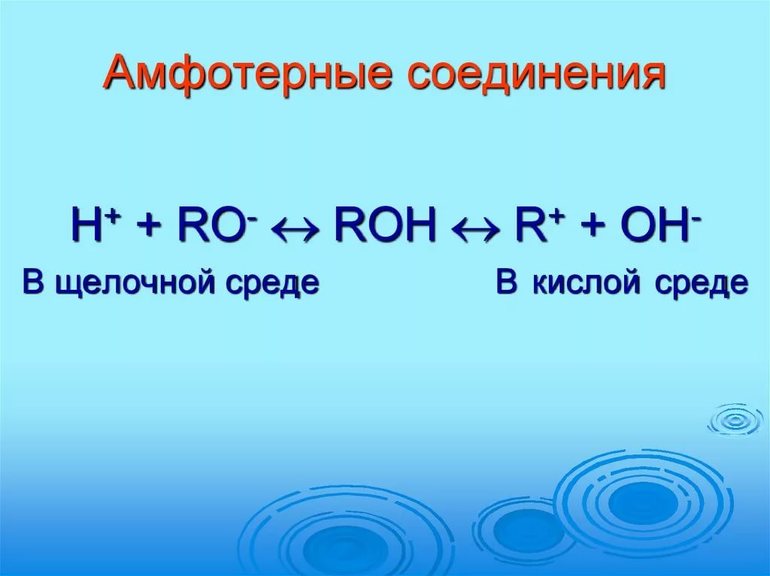
Как определить что гидроксид амфотерный
2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000 o C:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 o C:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Химия, Биология, подготовка к ГИА и ЕГЭ
Амфотерные соединения
Автор статьи — Саид Лутфуллин
Химия – это всегда единство противоположностей.
Посмотрите на периодическую систему.
Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.
K2O + HCl → KCl + H2O
Некоторые элементы (большинство неметаллов и металлы со степенями окисления +5, +6, +7) образуют кислотные оксиды и гидроксиды. Кислотные гидроксиды – это кислородсодержащие кислоты, их называют гидроксидами, потому что в строении есть гидроксильная группа, например, сера образует кислотный оксид SO3 и кислотный гидроксид H2SO4 (серную кислоту):
Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
H2SO4 + 2KOH → K2SO4 + 2H2O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3, Fe2O3, Fe(OH)3)
И четыре исключения: металлы Zn, Be, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, в которых проявляют степень окисления +2, но не смотря на это, эти соединения проявляют амфотерные свойства.
Урок №46. Амфотерные оксиды и гидроксиды
Кислотный остаток (А)
со щелочами проявляет кислотные свойства:
со щелочами проявляет кислотные свойства:
со щелочами проявляет кислотные свойства:
со щелочами проявляет кислотные свойства:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
2Al(OH) 3 + 3SO 3 = Al 2 (SO 4 ) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2 O
2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = t°C = 2NaAlO 2 + H 2 O (при сплавлении)
Если реакция протекает в водном растворе: Al(OH) 3 + NaOH = Na[Al(OH) 4 ]
здесь AlO 2 (I) – одновалентный кислотный остаток метаалюминат
Zn(OH) 2 + SO 3 = ZnSO 4 + H 2 O
ZnO + H 2 SO 4 = H 2 O + ZnSO 4
Zn(OH) 2 + Na 2 O = Na 2 ZnO 2 + H 2 O
Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
ZnO + 2NaOH = Na 2 ZnO 2 + H 2 O
здесь ZnO 2 (II) – двухвалентный кислотный остаток цинкат.
Оксиды и гидроксиды, которые способны реагировать и с кислотами, и со щелочами, называют амфотерными.
Химические элементы, которым соответствуют амфотерные оксиды и гидроксиды, обладают переходными химическими свойствами, не относящимися ни к металлам, ни к неметаллам, их называют амфотерными.
Амфотерность (от греч. Аmphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие. Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например,
Амфотерные гидроксиды практически нерастворимы в воде. Они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых валентность металла III, IV иногда II.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ
(нерастворимы в воде)
1.Реагируют с кислотами: Zn(OH) 2 + 2HCl = ZnCl 2 + 2H 2 O
2.Реагируют со щелочами: Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
ПРИМЕНЕНИЕ
Из всех амфотерных гидроксидов наибольшее применение находит гидроксид алюминия:
· лекарственные препараты, приготовленные на основе гидроксида алюминия, врач назначает при нарушении кислотно-щелочного баланса в пищеварительном тракте;
· в качестве антипирена (средства для подавления способности гореть) вещество вводят в состав пластмасс и красок;
· путём разложения гидроксида алюминия в металлургии получают оксид алюминия (глинозём) — сырьё для получения металлического алюминия.
Товары, в производстве которых используется гидроксид алюминия: лекарственный препарат «Алмагель» и металлургический глинозём
Гидроксид цинка в промышленности служит сырьём для получения различных соединений этого металла, в основном — солей.
Это определение было введено при изучении общей теоретической химии в области ведущих и кислотных взаимодействий при наступлении определенных условий.
Отмечается влияние смены растворяющего вещества на дуальные характеристики.
Амфотерные свойства
Гидроксиды элементов и их сцеплений из таблицы Менделеева, которые относятся к амфотерным соединениям:
Чаще всего вещества проявляют одно из взаимодействий, которое изменяет характер при перемене условий. Например, происходят процессы ионизации азотной кислоты, при этом получаются нитрозильные анионы и нитрит-катионы, в качестве амфолита выступает вода.
Амфотерность рассматривается в виде способности проводящего вещества быть донором и акцептировать протоны в рамках протеолитической концепции Бренстеда и Лоури. В этом случае вода проявляет свойства самоионизации в форме обратимой передачи молекул между жидкостями, в результате появляется одинаковое число анионов и катионов.
Амфолитами являются субстанции с содержанием структурных включений органических молекул, которые передают свойственные характеристики разного характера.
Такие вещества представлены пептидами, белками и аминокислотами. Эти группы частично ионизируются при помещении в раствор.
Молекулы и частицы аминокислот имеют равновесные состояния:
В этих случаях вещество представлено кислотой (воспроизводят катионы) и протоны или работает по основному свойству и акцептирует катионы и протоны.
Характеристики гидроксидов
Способность амфотерного элемента проявляется и в форме взаимодействия с кислотами и основаниями.
Так ведут себя оксиды, комплексные соединения, гидроксиды и отдельные р-элементы на средней стадии окисления. Для неорганических связей с присутствием гидроксильной группы ОН такое взаимодействие является общей характеристикой.
Традиционная теория об амфотерности гидроксидов в процессе разложения на ионы по основному и кислотному виду не подтверждается. Амфотерное поведение гидроксидов заключается в реакции обмена частицами среды с молекулами, имеющими связь с акцепторным центром. Гидроксиды обладают особенностью выделять соль и по-разному взаимодействовать в кислотной среде и растворе щелочи.
В первом случае они действуют по типу оснований, а вторая среда заставляет проявлять реакцию кислот.
Амфотерность гидроксидов и оксидов проявляется в продуцировании 2 рядов солей. Двойственность свойств используется при проведении качественного анализа и отделения веществ с подобными характеристиками от других элементов. Интервал появления осадка проявляется узким промежутком, поэтому внимание уделяется тщательности регулировки растворной среды.
Номенклатура и химические особенности
На особом положении в ряду амфотерных элементов находится алюминий, он стоит на границе между кислотами и основаниями. Это ведет к его диссоциации по двум типам поведения.
Амфотерные металлы и неметаллы обладают свойствами:
Гидроксиды с двойственными свойствами имеют физические промежуточные характеристики, доказать амфотерность можно на примере взаимодействия комплексных соединений из списка веществ 3 периода таблицы Менделеева.
В химии свойства однотипных сульфидов и оксидов, а также гидросульфитов и гидроксидов имеют разную реакцию в пределах отличающихся периодов. Свойство оснований проявляют сульфиды типичных металлов, а кислотные характеристики присутствуют в бинарных соединениях неметаллических субстанций. Различие химического происхождения наблюдается при обменной реакции между действующим веществом и растворителем, а также во взаимодействии сульфидов друг с другом.
Амфотерность гидроксидов металлических элементов объясняется тем, что в воде вещество распадается на отдельные ионы водорода по кислотному виду, а образование гидроксильных ионов проходит по типу основы.
Степени окисления
У некоторых веществ наблюдается несколько ступеней окисления, поэтому амфотерные свойства гидроксидов и оксидов подлежат разной классификации. Вещества с низкими окислительными характеристиками тяготеют к группе оснований, а сам элемент обладает свойствами металла, поскольку содержится в категории катионов. Субстанции с высокой степенью окисления являются участниками кислотных групп и проявляют неметаллические показатели, так как представляют собой анионы.
Например, у гидроксида и оксида марганца (2) главными являются основные свойства, а сам элемент входит в категорию катионов. У разновидности марганца (Vil) преобладают показатели кислоты, а само вещество относится к анионовой группы (тип МПО4).
Свойства оксидов и гидроксидов проявляются в зависимости от характеристики металла. Для элементов подвида бора (исключается таллий) типичной является 3-я степень перехода заряженных частиц от донора-восстановителя к окислительному акцептору. В результате свойства основания для элемента ослабляются.
При переходе к 3 группе встречаются вещества, которые образуют кислоты и неорганические кислоты. Последние обладают сочетанием химических и физических показателей, характерных для кислот и являются типовыми для многих элементов, за исключением щелочноземельных и щелочных металлов.
Рост свойств основного вещества происходит при увеличении радиуса движения ионов. Некоторые субстанции имеют почти одинаковую степень диссоциации с получением ионов, а у других аморфные показатели выражаются слабо.
В соединениях развитие основных свойств происходит медленно. Это объясняется тем, что атомы веществ 3 группы представляют собой аналоги с характерным строением внешней оболочки по типу благородных газов. Другие субстанции отличаются наружным слоем атома в форме электронной оболочки с 10 электронами. В таблице после алюминия наблюдается увеличение радиусов ионов, отмечается диагональное сходство, что ведет к постепенному усилению основных характеристик.
Процессы при диссоциации
В некоторых случаях амфотерные характеристики металлических гидроксидов проявляются не только в водной среде, но под действием кислотного и щелочного раствора. Если в случае с кислотой при продуцировании нейтральных частиц выделяется вода и появляется ион металла (свойство основания), то в щелочной среде не происходит отщепление протона.
При тяготении азота к висмуту степень окисления стабилизируется и усиливаются показатели основного характера. Такие соединительные субстанции выполняют одновременно окислительные и восстановительные функции. Двойственный процесс объясняется ионизацией молекулы воды, которая располагается во внутренней сфере, а протон перемещается к иону ОН.
В этом случае затрудняется определение развитости кислотных и основных показателей вещества, так как оно не имеет в составе подвижного водородного атома.
В результате из бокситов получаются другие элементы, что служит показателем использования химических характеристик при разделении. Метод основывается на применении свойства амфотерности алюминия. К этому же разряду относится выделение магния из воды морей и океанов.
Реакции взаимного действия с расплавами щелочей и кислотами ведут к появлению молекул воды и соли, а в результате степень окисления остается неизменной.
Двойственные показатели
Ионный потенциал вещества увеличивается в результате проявления двойственного механизма при диссоциации амфотерных соединений. Например, Мл (0Н) является неуравновешенным основанием, а Мп (0Н)4 представляет собой амфотерный элемент, который в равной степени проявляет кислотные особенности. НМПО4 переходит в категорию усиленных кислот, при этом снижаются свойства основания.
Щелочная среда используется для восстановления элементов с образованием гидросолей, например, гексагидроксоалюминат натрия. Если судить о тетрагидроксиде титана, то название подчеркивает возможность взаимной реакции с кислотами. Эта же субстанция гидроокиси называется ортокислотой при характеристике ее реагирования в условиях щелочной среды.
Активные металлические соединения образовывают сильнополярные ионные связи, поэтому относятся к группе оснований. Уменьшение динамичности характера вещества изменяется в сторону кислотного реагирования: НМпО, КОН, 5с (ОН)3, Са (ОН)2, НУО3 и другие.
Амфотерные оксиды М2О3 и соответствующие им гидроксиды М (ОН)3 (при этом исключается В2О3) плохо растворяются в водном растворе.
Гидроксиды характеризуются неравномерным изменением двойственных характеристик:
Другие вещества
Соединение гидроксида циркония является малорастворимым в воде и проявляет устойчивость к этой среде. Вещество относится к классу полимеров с положительно заряженными частицами, который содержит периодические цепи, расположенные в клеточном порядке. Материал не реагирует на основания, восстановительных и окислительных агентов.
В кислых растворах гидроксид циркония переводит анионы С1, НО3, СГО4, 8Ог на ионы ОН. Увеличение температурных показателей почти не сказывается на скорости обмена. В случае с цирконием не происходит образование определенных гидратов, термогравиметрические измерения показывают осадок полимерных частиц с образованием структурного слоя.
Германий находится ближе к группе металлов и образовывает связи, в которых его степень окисления расценивается по 2 категории. Соединения являются менее прочными, по сравнению с контактами германиевого аналога свинцовой группы, и отличаются восстановительными характеристиками. Амфотерный гидроксид с явно выраженными кислотными свойствами соответствует черному оксиду германия, молекулы которого не растворяются в жидкости. Последний носит название германистой кислоты, а его осадочные соли — германитов.
Если элемент в зависимости от условий образовывает несколько различающихся по составу оснований, то наиболее сильным признается то, которое отличается низкой окислительной степенью.
Качества основания в таких веществах выражаются ярко. Сильной является кислота, анионы которой содержат множество кислородных атомов в случае появления у элемента нескольких кислотосодержащих соединений.