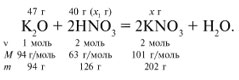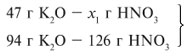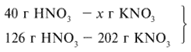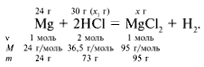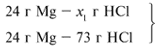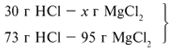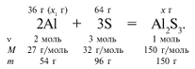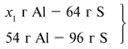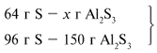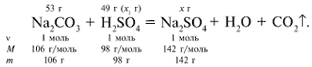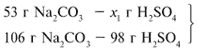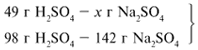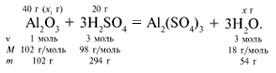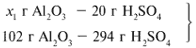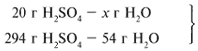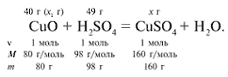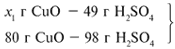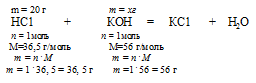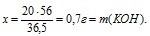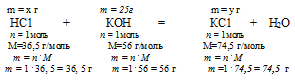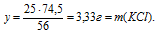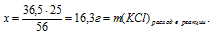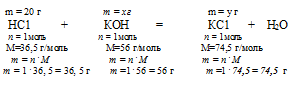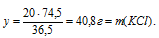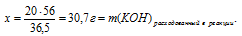Как определить что в избытке а что в недостатке химия
Химия, Биология, подготовка к ГИА и ЕГЭ
Задачи такого типа (точнее, это может быть даже не самой задачей, а частью задачи) есть в части С ГИА, они входят в часть С ЕГЭ, теперь они появились и в части B.
Классический пример задачи на избыток и недостаток.
Этапы решения задачи:
1. Записываем уравнение реакции и уравниваем его:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(Cu) = m\Ar =3.2 г \ 63.5 г\моль = 0,05 моль
m(Hg(NO3)2) = m\Mr = 20 \ 324 = 0,06 моль
3. Сравниваем количество моль веществ и определяем недостаток:
по уравнению реакции меди и нитрат ртути реагируют 1:1, значит, их количество моль тоже должно быть одинаковым
0,05 моль ПО НЕДОСТАТКУ
Почему по недостатку? Это аналогично вопросу — «сколько целых яблок можно сложить из 5 половинок? «
4. Вычисляем массу продукта по количеству моль, соответствующему недостатку:
0,05 моль ——> 0,05 моль
m(Hg)= n*Ar = 0,05 моль * 200 г\моль = 10 г
______________________________________________________________________________________
Пример задачи на избыток и недостаток,
где вещества в другом соотношении:
те же самые этапы решения:
1. Записываем уравнение реакции и уравниваем его:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(N2 ) = m\Mr = 14\28=0.5 моль
3. Сравниваем количество моль веществ и определяем недостаток:
в этом уравнении все не так очевидно, как в предыдущем, поэтому нужно просто прикинуть:
4. Вычисляем массу продукта по количеству моль, соответствующему недостатку:
m(N2O5) = n*Mr = 2* 0.5\5 моль * 108 г\моль = 21 г
______________________________________________________________________________________
Есть задачи, очень похожие на задачи избыток-недостаток,
1. Записываем уравнение реакции и уравниваем его:
здесь у нас возможно 2 варианта — образование средней и кислой соли:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(CO2 ) = V\22.4 л\моль = 24.9 \ 22.4 = 1,11 моль
n(NaOH)= m\Mr = 44.4\40 = 1,11 моль
т.к. количество моль веществ одинаково, то делаем вывод, что реакция протекает по схеме образования кислой соли:
4. Вычисляем массу продукта по количеству моль:
m ( NaHCO3) = n*Mr = 1,11 * 84 = 93,24 г
_____________________________________________________________________________________ _
Задачи на избыток и недостаток не трудные, зачастую они являются частью более сложных задач, поэтому все, что нужно сделать, это натренироваться — порешать как можно больше таких примеров, внимательно уравнивая и работая с коэффициентами.
Как определить что в избытке а что в недостатке химия
Ключевые слова конспекта: расчет массы, объема продукта реакции, если одно из реагирующих веществ дано в избытке; решение задач, когда одно из веществ в избытке.
Вещества реагируют друг с другом в строго определенных количествах. Однако исходные вещества для проведения реакции могут быть взяты в любых количествах. Таким образом, одно из реагирующих веществ может оказаться в избытке, а другое — в недостатке. В этом случае необходимо определить, какое из реагирующих веществ находится в избытке, а какое — в недостатке, и дальнейшие расчеты производить по веществу, находящемуся в недостатке. Это обусловлено тем, что вещество, находящееся в недостатке, прореагирует полностью, таким образом, количество вещества данного реагента нам будет точно известно.
Для того чтобы определить, какое из реагирующих веществ находится в избытке, а какое — в недостатке, необходимо вычислить количества вещества реагентов и сравнить их. Если количества вещества реагентов, участвующих в химической реакции, одинаковы, то в избытке будет то вещество, количество которого больше в соответствии с условиями задачи. Например, если в реакцию, уравнение которой Н2 + Сl2 = 2НСl, взять 0,2 моль водорода и 0,15 моль хлора, то в избытке будет водород, а в недостатке — хлор, так как v(H2) > v(Cl2). Расчет количества образовавшегося водорода в этом случае следует вести по количеству вещества хлора.
Если же вещества реагируют в неравных количествах, то для расчета избытка и недостатка следует учитывать коэффициенты в уравнении реакции. Например, для реакции, уравнение которой 2Н2 + O2 = 2Н2O, отношение количества веществ водорода и кислорода, реагирующих друг с другом, имеет следующий вид:
При использовании количеств веществ, соответствующих условию задачи, это выражение превращается в неравенство, которое и показывает, какое из веществ взято в реакции в избытке. Например, если в рассматриваемой реакции использовать 0,2 моль водорода и 0,15 моль кислорода, в недостатке будет водород, несмотря на то что количество вещества его больше. Это следует из соотношения: 1 • v(H2) Особые трудности возникают в тех случаях, когда в зависимости от того, какой из реагентов в избытке, образуются различные продукты реакции. Например, если углекислый газ взаимодействует с избытком гидроксида кальция, образуется средняя соль — карбонат кальция:
Са(ОН)2 + СO2 = CaCO3 ↓ + Н2O.
Если же в избытке углекислый газ, то в результате реакции образуется кислая соль — гидрокарбонат кальция:
Са(ОН)2 + 2СO2 = Са(НСO3)2.
Поэтому в ряде случаев определение избытка и недостатка следует проводить еще до составления уравнения химической реакции.
В некоторых случаях вещество, взятое в избытке, взаимодействует с одним из продуктов реакции, например при восстановлении магнием оксида кремния (IV) по реакции:
взятый в избытке магний будет взаимодействовать с образовавшимся кремнием:
Такие превращения нужно также учитывать при решении задач.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1. Сколько граммов поваренной соли образуется при сливании растворов, содержащих 24 г гидроксида натрия и 14,6 г хлороводорода?
Задача № 2. Вычислите массу хлорида железа (III), образующегося при взаимодействии 14 г железа и 5,6 л (н. у.) хлора.
Задача № 3. Водород, полученный при разложении 12,6 г гидрида кальция водой, пропустили над 40 г нагретого оксида меди (II). Определите массу образовавшегося металла.
ЗАДАЧИ с КРАТКИМ ОТВЕТОМ
Ответ. m(AgCl) = 50,2 г.
Ответ. m(CuO) = 24 г, оксид меди (II).
Ответ. V(газа) = 11,2 л.
Ответ. Раствор останется окрашенным.
Ответ. m(осадка) = 11,48 г.
Ответ. m(осадка) = 35,85 г.
Ответ. m(осадка) = 5 г.
76,9 мл раствора с массовой долей NaOH 40% (р = = 1,43 г/мл). Найдите массовые доли солей в полученном растворе.
Ответ. V(газа) = 31,36 л.
Ответ. m(осадка) = 39,6 г.
Задачи на количества исходных веществ и продуктов реакции (ответы и решения). Выберите дальнейшие действия:
4.3.5. Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
Очень часто при проведении реакции между веществами оказывается, что один реагент прореагировал полностью, а другой нет. В таком случае говорят, что вещество, которое полностью израсходовалось, было в недостатке, а то вещество, которое осталось – в избытке. Поскольку избыток реагента не участвует в реакции, количество продукта зависит только от количества вещества, которое было в недостатке.
Предположим, что осуществляется реакция между веществами А и B, которая протекает в соответствии с уравнением:
Для осуществления этой реакции было взято количество вещества A, равное nA, и количество вещества B, равное nB. Определить то, какое вещество в избытке, а какое в недостатке, можно, сравнив выражения:
В зависимости от того, какое выражение окажется меньше, то вещество соответственно и будет в недостатке.
Примечание: распространенной ошибкой является то, что вместо выражений (1) сравнивают просто количества веществ. Так делать категорически не допускается! Если n(A) > n(B), то это еще не значит, что вещество A в избытке!
После того, как будет установлено то, какое вещество было в недостатке, расчеты ведутся по его количеству аналогично рассмотренным в главе 4.3.3.
Пример задачи на избыток и недостаток
Нагрели смесь 54 г алюминия и 80 г серы. Вычислите массу образовавшегося сульфида алюминия.
Решение
Запишем уравнение реакции:
Рассчитаем количества веществ алюминия и серы:
n(Al) = m(Al)/M(Al) = 54/27 = 2 моль;
n(S) = m(S)/M(S) = 80/32 = 2,5 моль
Для того чтобы выяснить, какое из исходных веществ в недостатке, разделим количества молей веществ на коэффициенты перед этими веществами в уравнении и сравним рассчитанные выражения:
Значит сера в недостатке. Расчеты далее ведем по количеству вещества серы.
Исходя из уравнения реакции
следует, что количество прореагировавшей серы и образовавшегося в результате реакции сульфида алюминия связаны выражением:
где 3 и 1 – коэффициенты перед S и Al2S3 соответственно. Отсюда:
Следовательно, масса сульфида алюминия будет равна:
В случае, если вместо массовой доли чистого вещества дается массовая доля примесей, то учитывая, что:
мы можем записать, что:
Пример задачи на расчет количества продукта, зная массу реагента с примесями
Какой объем углекислого газа (н.у.) выделится при действии избытка соляной кислоты на технический карбонат кальция массой 150 г, содержащий 10% некарбонатных примесей.
Решение:
Запишем уравнение взаимодействия карбоната кальция с соляной кислотой:
Массовая доля примесей в техническом карбонате кальция составляет 10%, значит массовая доля чистого карбоната кальция будет составлять:
ω(CaCO3) = 100% — ω(прим.) = 100% — 10% = 90%.
Масса чистого карбоната кальция будет равна:
m(CaCO3) = ω(CaCO3) ∙ m(CaCO3 техн.)/100% = 90% ∙ 150 г/100% = 135 г,
Следовательно, количество вещества карбоната кальция равно:
n(CaCO3) = m(CaCO3)/M(CaCO3) = 135 г / 100 г/моль = 1,35 моль
В соответствии с уравнением реакции:
Количества веществ карбоната кальция и углекислого газа равны (одинаковые коэффициенты в уравнении), следовательно:
Тогда, зная, что один моль любого газа при нормальных условиях занимает объем 22,4 л, мы можем рассчитать объем выделившегося CO2:
V(CO2) = n(CO2) ∙ Vm = 1,35 моль ∙ 22,4 л/моль = 30,24 л
Методика решения задач
на «избыток–недостаток»
в курсе основной
общеобразовательной школы
Умение решать химические задачи – важная составляющая знаний по предмету. Согласно государственному стандарту образования по химии учащиеся, оканчивающие школу, должны уметь решать более десятка типов стандартных задач. Среди них и задачи на «избыток–недостаток».
Предлагаю свой вариант подачи материала по решению таких задач в курсе химии 9-го класса.
На изучение этой темы отвожу 2–2,5 урока, в зависимости от уровня способностей учеников класса. Ознакомление с алгоритмом решения задач данного типа происходит в рамках изучения темы «Теория электролитической диссоциации». Однако если класс сильный, то в рамках эксперимента этот тип задач иногда изучаем и в конце 8-го класса в главе «Галогены», а высвободившееся время можно потратить на изучение органической химии в курсе 9-го класса.
На первом уроке разбираю два типа задач на «избыток–недостаток»:


В качестве домашнего задания обязательно предлагаются две-три задачи, подобные изученным на уроке.
На втором уроке закрепляю и углубляю изученный материал, ввожу понятия «процентная концентрация растворов веществ», вступивших в реакцию, «плотность растворов». Кроме того, усложняю задачи, вводя «процентное содержание примесей в исходном веществе» и т. д. Такой прием позволяет повторить элементы уже изученного материала, сэкономить время. В конце второго урока изучения темы или в начале третьего провожу небольшую самостоятельную работу на закрепление изученного материала, включающую одну-две задачи, причем самостоятельная работа предлагается в трех уровнях сложности, в зависимости от способностей ученика.
Урок 1
Решение задач на «избыток–недостаток»
ХОД УРОКА

Решая химические задачи, следует не забывать о правилах их грамотного оформления по схеме: дано, найти, решение, ответ.
ЗАДАЧА 1. На 47 г оксида калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата калия.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Для удобства расчета за х1 примем массу НNО3 и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
Следовательно, азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету необходимо 63 г, поэтому расчет ведем по HNO3:
ЗАДАЧА 2. На 24 г металлического магния подействовали 100 г 30%-го раствора соляной кислоты. Найдите массу образовавшегося хлорида магния.
m(Mg) = 24 г,
m(р-р HCl) = 100 г, 
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Для удобства расчета за х1 примем массу соляной кислоты и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
Из расчета видно, что соляная кислота дана в недостатке, т. к. по условию задачи ее дано 30 г, а для реакции требуется 73 г. Следовательно, расчет ведем по соляной кислоте:

ЗАДАЧА 1. На 36 г алюминия подействовали 64 г серы. Найдите массу образовавшегося сульфида алюминия.
Решение
Примем массу Al за х1 и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
В данном случае вещества, вступившие в реакцию, взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
ЗАДАЧА 2. На раствор, содержащий 53 г карбоната натрия, подействовали раствором, содержащим 49 г серной кислоты. Найдите массу образовавшейся соли.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Примем за х1 массу cерной кислоты, чтобы узнать, какое вещество дано в избытке, какое – в недостатке.
В данном случае оба вещества взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
Однако учитель, подбирая задачи для решения в классе, должен помнить, что в некоторых случаях (например, если кислота или кислотный оксид дан в избытке) решение задачи не ограничивается расчетом двух пропорций, т. к. реакция будет протекать дальше с образованием кислой соли. Это повысит сложность материала. На первых уроках при решении задач данного типа я не включаю в материал задачи на прохождение реакций с образованием кислых или основных солей.
Домашнее задание
ЗАДАЧА 1. На 200 г 10%-го раствора серной кислоты подействовали 40 г оксида алюминия. Найдите массу образовавшейся воды.
M(р-р H2SO4) = 200 г, 
m(Al2O3) = 40 г.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Найдем, какое из вступивших в реакцию веществ дано в избытке, а какое – в недостатке.
Из расчета видно, что Al2O3 дан в избытке, следовательно, расчет ведем по кислоте:
ЗАДАЧА 2. На 40 г оксида меди(II) подействовали раствором серной кислоты, содержащим 49 г безводного вещества. Найдите массу образовавшейся соли.
Решение
Найдем, какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
Cогласно уравнению данной реакции вещества взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
Задачи на определение избытка-недостатка в реакциях нейтрализации
Составляем пропорцию:
20 г НС1 реагируют без остатка с x: г КОН (по условию)
36,5 г НС1 реагируют без остатка с 56 г КОН (по уравнению)
Ответ: 30,7 г КОН потребуется для полной нейтрализации раствора, содержащего 20 г НС1.
Задача 2.
Представим себе ситуацию, когда мы вместо 30,7 г КОН добавили недостаточное его количество, например, 25г. Тогда часть НС1 прореагирует с КОН, а часть останется. В этом случае КОН будет в недостатке, а НС1 — в избытке. Посмотрим, какие вещества и в каких количествах будут находиться в растворе после реакции, если к раствору, содержащему 20 г НС1 добавить недостаточное для полной нейтрализации количество КОН, например, 25 г.
Дано: масса хлороводорода: m(НС1) = 20 г;
масса гидроксида калия: m(КОН) = 25 г.
Найти: Массы всех веществ в растворе после реакции.
Решение:
Так как КОН взят в недостатке, он израсходуется весь в химической реакции. Количество НС1, по отношению к количеству КОН, находится в избытке, следовательно, часть хлороводорода останется после реакции. Кроме того, в процессе химической реакции образуется соль КСl, которая тоже будет содержаться в растворе. Образующаяся вода разбавит имеющийся раствор.
Итак, качественный состав раствора после реакции мы установили:
1) избыточная хлороводородная кислота (НС1);
2) образующаяся соль КС1;
3) вода в виде растворителя.
Определим массы НС1 и КС1 в конечном растворе. Массу КС1 легко определить путем расчета по химической реакции.
Массу оставшейся НС1 можно найти по разности:
m(HCl)оставшейся после р-ции = m(HCl)исх. – m(HCl)израсходованной в р-ци
Массу израсходованной НС1 также необходимо найти по уравнению реакции.
В задачах на избыток-недостаток расчет по уравнению реакции всегда ведут по веществу, взятому в недостатке. Вещество, взятое в недостатке, всегда в реакции расходуется полностью. А вещество, взятое в избытке, расходуется лишь частично, и какая часть его участвует в химической реакции нам неизвестно. Поэтому вести расчет по веществу, взятому в избытке, невозможно.
В данном случае в недостатке у нас КОН. По нему и ведем расчет образовавшейся соли КС1 и расходовавшейся НС1:
Найдем массу образовавшейся соли КС1. Для этого составим пропорцию:
25 г КОН дают у г КС1 (по условию)
56 г КОН дают 74,5 г КС1 (по уравнению)
Находим массу НС1, которая расходовалась в реакции. Для этого составим пропорцию:
х г НС1 расходуется на 25 г КОН (по условию)
36,5 г НС1 расходуется на 56 г КОН (по уравнению)
Теперь мы можем определить массу НС1, которая осталась неизрасходованной:
m(НС1)осталось послс р-ции = m(НС1)исх. – m(НС1)расх. в р-ции = 20 – 16,3 = 3,7 г.
Итак, в результате добавления 25 г КОН к раствору, содержащему 20 г НС1, образовалось 33,3 г КС1 и осталось 3,7 г неизрасходованной НС1. Таким образом, в итоге получился раствор двух веществ (КС1 и НС1) в воде.
Ответ: m(KCl) = 33,3 г; m(HCl) = 3,7г.
Задача 3.
Теперь рассмотрим обратную ситуацию, когда к раствору НС1 мы добавили больше КОН, чем это необходимо для полной нейтрализации. В этом случае КОН будет в избытке, а НС1 — в недостатке. Посмотрим, какие вещества и в каких количествах будут находиться в растворе после реакции, если к раствору, содержащему 20 г НС1 добавить избыточное количество КОН, например, 40 г.
Дано:
масса хлороводорода: m(НС1) = 20 г;
масса гидроксида калия: m(КОН) = 40 г.
Найти: Массы всех веществ в растворе после реакции.
Решение:
КОН взят в избытке, следовательно, НС1 находится в недостатке. НС1 в реакции израсходуется весь, а КОН частично израсходуется и частично останется. В результате реакции образуется соль КС1. Образующаяся вода разбавит имеющийся раствор. Следовательно, качественный состав раствора после реакции будет следующим:
1. Избыточный гидроксид калия (КОН);
2. Образующаяся соль КС1;
3. Вода в виде растворителя.
Массу образовавшейся соли КС1 можно определить путем расчета по химической реакции, а массу оставшегося КОН по разности:
m(КОН)оставшийся после р-ии = m(КОН)исх – m(КОН)расход в р-ии
Массу расходовавшегося КОН можно определить по уравнению реакции.
Напомним, что в задачах на избыток-недостаток расчет по уравнению реакции всегда ведут по веществу, взятому в недостатке. В данном случае по НС1:
Находим массу образовавшейся соли. Для этого составим пропорцию:
20г НС1 даютуг x г КСl (по условию)
36,5г НС1 дают 74,5 г КС1 (по уравнению)
Находим массу расходовавшегося КОН. Для этого составим пропорцию:
20 г НС1 расходуется на х г КОН (по условию)
36,5 г НС1 расходуется на 56 г КОН (по уравнению)
Теперь мы можем определить массу КОН, который остался неизрасходованным:
Итак, в результате добавления 40 г КОН к раствору, содержащему 20 г НС1, образовалось 40,8 г КС1 и осталось 9,3 г неизрасходованного КОН. Таким образом, получился раствор двух веществ (КС1 и КОН) в воде.
Комментарии:
1 В условиях задач на определение избытка-недосатка не указывается, какое вещество в избытке, а какое в недостатке. Более того, в условии нет прямого указания на то, что это задача на избыток-недостаток. Поэтому, в первую очередь, перед нами стоит два вопроса:
1. Как отличить задачу на избыток-недостаток от всех остальных задач?
2. Как определить, какое вещество взято в избытке?