Как понять что гидроксид амфотерный
2.5. Характерные химические свойства оснований и амфотерных гидроксидов.
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
1) растворимость исходных соединений;
2) наличие осадка или газа среди продуктов реакции
Термическая устойчивость оснований
Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются. Наиболее высокая температура разложения у гидроксида кальция – около 1000 o C:
Нерастворимые гидроксиды имеют намного более низкие температуры разложения. Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 o C:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Как понять что гидроксид амфотерный
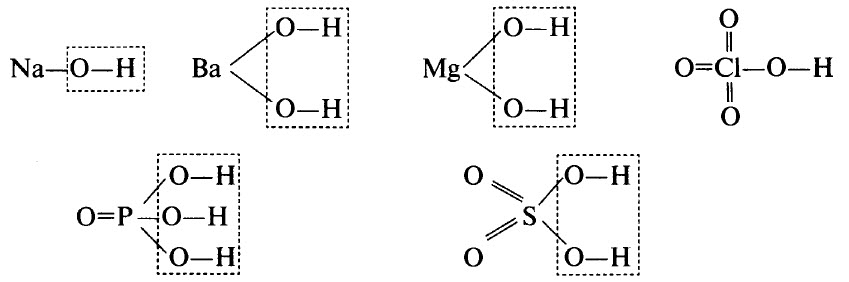
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
В образовавшейся соли алюминий образует анион AlO2 – (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4] – :
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока по химии для 8 класса «Амфотерные оксиды и гидроксиды». Выберите дальнейшее действие:
Химия, Биология, подготовка к ГИА и ЕГЭ
Амфотерные соединения
Автор статьи — Саид Лутфуллин
Химия – это всегда единство противоположностей.
Посмотрите на периодическую систему.
Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.
K2O + HCl → KCl + H2O
Некоторые элементы (большинство неметаллов и металлы со степенями окисления +5, +6, +7) образуют кислотные оксиды и гидроксиды. Кислотные гидроксиды – это кислородсодержащие кислоты, их называют гидроксидами, потому что в строении есть гидроксильная группа, например, сера образует кислотный оксид SO3 и кислотный гидроксид H2SO4 (серную кислоту):
Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
H2SO4 + 2KOH → K2SO4 + 2H2O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3, Fe2O3, Fe(OH)3)
И четыре исключения: металлы Zn, Be, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, в которых проявляют степень окисления +2, но не смотря на это, эти соединения проявляют амфотерные свойства.
Урок «Амфотерные гидроксиды»
Разделы: Химия
Ступень обучения: III (X класс).
Характер ориентации: средний уровень.
Ведущий принцип: деятельностный, коммуникативный.
Содержательный уровень: обучающий, обобщающий, общеразвивающий.
Метод–доминанта: проблемно-поисковый.
Триединая цель урока:
1) Образовательный аспект
2) Развивающий аспект
3) Воспитывающий аспект
Оборудование и реактивы: растворы хлорида цинка, гидроксида натрия, аммиака, хлорида алюминия, соляной кислоты, хлорида магния, хлорида натрия; пробирки.
Ход урока
1. Организационный момент
2. Повторение пройденного материала
Индивидуальный опрос у доски:
— первый ученик – « Химические свойства кислот»
— второй ученик – « Химические свойства оснований».
В это время класс выполняет задание: с какими из перечисленных веществ будет реагировать гидроксид натрия, а с какими соляная кислота?
Написать возможные уравнения реакций.
Затем один ученик выполняет это задание на доске, а остальные проверяют.
2 NaOH + ZnO 
6 NaOH + P2O5 = 2Na3PO4 + 3H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O
2HCl + ZnO = ZnCl2 + H2O
HCl + AgNO3 = AgCl + HNO3
3. Изучение нового материала
Тема урока: «Амфотерные гидроксиды».
Девиз урока: «Химия – наука полутонов».
Э.Е. Нифантьев.
Актуализация знаний
Учитель: Тема нашего урока «Амфотерные гидроксиды». Наша задача знать, какие соединения называют амфотерными гидроксидами и каковы их химические свойства; понять, в чем причина амфотерности; уметь писать уравнения реакций, отражающих химические свойства амфотерных гидроксидов.
Итак, давайте вспомним, что вы уже знаете об «амфотерности».
Ученик: Амфотерные соединения проявляют одновременно и основные, и кислотные свойства.
Учитель: Мы уже познакомились с амфотерными оксидами. Скажите, пожалуйста, какие элементы образуют эти соединения?
Ученик: Металлы в степени окисления +3 и +4,а также металлы, металлические свойства которых выражены неярко (в периодической системе элементов они находятся между металлами и неметаллами, вдоль диагонали). Например: Be, Zn, Ge и др.
Физические свойства амфотерных гидроксидов
Учитель: Амфотерные гидроксиды – это нерастворимые в воде твердые вещества, как правило, белого цвета.
Получение
Учитель: Предположите способ получения амфотерных гидроксидов, помня, что они не растворимы в воде.
Ученик: Реакцией обмена между растворимой солью соответствующего металла и щелочью. (Демонстрационный эксперимент)
Учитель: Но! Избыток щелочи может растворить образовавшийся осадок, поэтому берут слабое основание – NH3 * H2O ( гидроксид аммония или гидрат аммиака).
Химические свойства
Учитель: Известная мудрость гласит: «Опыт- путь к познанию». Поэтому химические свойства амфотерных гидроксидов вы определите, выполняя лабораторный опыт в парах.
Задание: получить гидроксид алюминия и определить его химические свойства. Для этого у Вас на столах есть растворы хлорида алюминия, аммиака, соляной кислоты и гидроксида натрия. Помните о соблюдении правил техники безопасности.Запишите уравнения химических реакций.
Ученики выполняют опыт, записывают в тетрадях уравнения реакций.
Один ученик выходит к доске и записывает все уравнения и объясняет наблюдаемые явления.
Как основание
Как кислота
Образуются соли катионного типа
Образуются соли анионного типа
Вывод: гидроксид алюминия взаимодействует и с кислотами, и с основаниями, т.е. проявляет амфотерные свойства.
Учитель: В чем же причина амфотерности этих соединений?
Для того чтобы ответить на этот вопрос, рассмотрим их диссоциацию.
В водных растворах амфотерные гидроксиды практически не диссоциируют, но в растворах кислот и щелочей могут диссоциировать двумя способами.
Учитель. Нужно отметить, что соли анионного типа, образующиеся при взаимодействии амфотерного гидроксида со щелочью, устойчивы в щелочной среде, но разрушаются при подкислении растворов.
Амфотерные гидроксиды, как и нерастворимые основания, при нагревании разлагаются:
2Al(OH )3 
4. Закрепление
Экспериментальная задача. Даны три пробирки с растворами хлоридов натрия, магния и алюминия. Как определить, в какой пробирке какое вещество?
Один участник выходит к демонстрационному столу и выполняет опыт.
NaCl2 + NaOH =/= реакция не идет
Al(OH)3 + NaOH = Na[ Al(OH)4 ] – осадок растворяется в избытке щелочи.
5. Подведение итогов урока
А это уже один из основных законов природы – закон единства и борьбы противоположностей, который проявляется практически в каждой химической реакции: кислота и основание, окислитель и восстановитель, донор и акцептор и так далее.
Этот закон объективен, его нельзя отменить, можно только воспользоваться им для объяснения явлений.
Мы часто в жизни сталкиваемся с проявлениями этого закона: в технике – противоположно заряженные частицы притягиваются; в человеческих отношениях – часто очень разные люди сближаются, они как будто дополняют друг друга. В жизни всегда борются добро и зло, в каждом человеке обязательно присутствуют плохие и хорошие черты. Поэтому не бывает человека идеального, только хорошего, а в самом падшем, плохом человеке всегда можно найти что-то доброе, светлое. Об этом надо всегда помнить и относиться к окружающим нас людям с пониманием, терпимостью к чужим недостаткам.
Тема нашего сегодняшнего урока является еще одним подтверждением связи химии с нашей жизнью. И теперь давайте вернемся к девизу этого урока: « Химия – это наука полутонов ». Как вы можете объяснить это выражение?
Ученик: Это значит, что нельзя провести четкую границу между простыми веществами металлами и неметаллами, разными классами соединений, органическими и неорганическими веществами. Все подчиняется единству материального мира.
6. Домашнее задание
Параграф 28.3, задания: 1,2,3 (учебник «Химия 10 класс» авторы: И.И.Новошинский, Н.С.Новошинская)
Дополнительное задание к уроку (если останется время)
2. Al2O3 + Na2O 
4. 2Al(OH)3