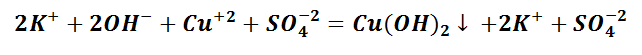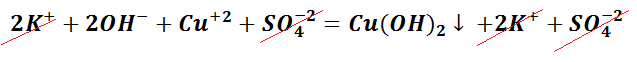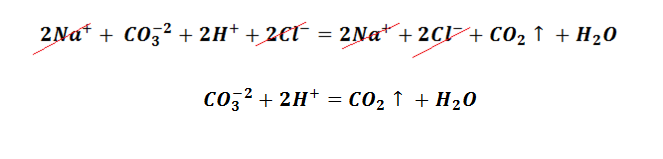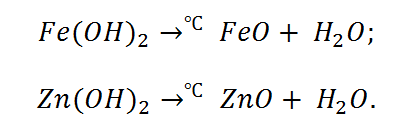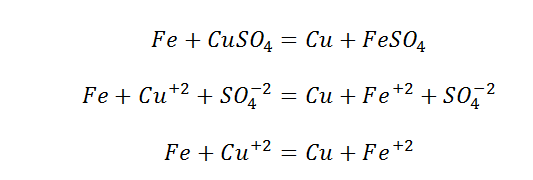Как понять что образуется осадок в уравнении реакции
Урок 10. Признаки химических реакций
В уроке 10 «Признаки химических реакций» из курса «Химия для чайников» рассмотрим, что из себя представляют физические и химические явления; выясним, что такое химическая реакция, а также признаки и условия протекания химических реакций.
Давайте внимательно посмотрим вокруг себя. Мы уже знаем, что весь окружающий нас мир состоит из различных веществ: органических и неорганических, простых и сложных, твердых, жидких и газообразных. Остаются ли эти вещества в природе неизменными? Нет, в природе происходят различные изменения, которые называются явлениями. В зависимости от того, какие изменения происходят с веществами, различают явления физические и химические. Эти два рода явлений можно отличить друг от друга.
Физические явления
Нальем воду в колбу и нагреем ее до кипения. Каждый из вас знает, что при кипении вода превращается в пар, т. е. переходит в другое агрегатное состояние. Однако несложно доказать, что вода и пар — это одно и то же вещество. Подумайте, как это можно сделать.
Нагреем тонкую стеклянную трубку в пламени спиртовки. Стекло станет мягким, и мы легко изменим форму трубки, но стекло как вещество остается тем же.
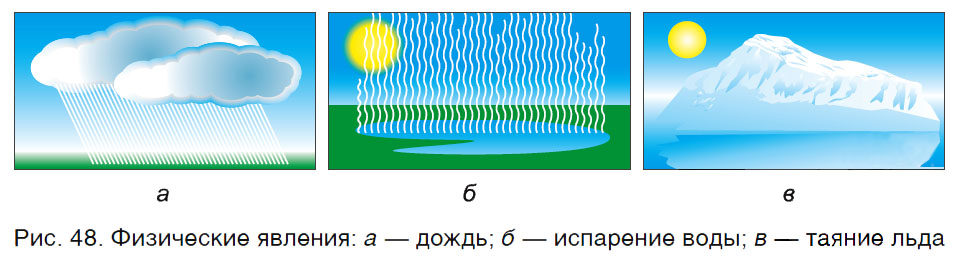
Эти явления физические. При физических явлениях не происходит образования новых веществ. Изменяется только агрегатное состояние веществ, их форма, а состав веществ остается прежним (рис. 48).
Например, вода — это вещество, которое в природе образует не только реки, моря, но и ледники, и облака. Ледники тают, облака роняют капли воды, вода испаряется, т. е. происходит изменение ее агрегатного состояния, но состав молекул остается неизменным.
Сгибание проволоки, дробление соли, плавление металлов (рис. 49), образование мраморной крошки, перемалывание зерна в муку, превращение воды в пар при кипячении — все это физические явления. Они осуществляются в результате деятельности человека. У веществ при этом изменяется только форма или агрегатное состояние.
Физическими называются явления, при которых изменяется только форма или агрегатное состояние веществ.
Химические явления (реакции)
Всегда ли вещества остаются неизменными? Нагреем красную медную проволоку в пламени спиртовки. Проволока покрывается черным налетом, который можно легко соскоблить ножом в виде черного порошка. Это уже новое вещество, в которое превратилась медь. Оно отличается от меди по цвету и плотности. В этом опыте мы наблюдаем химическое явление, которое происходит благодаря химической реакции.
Химические реакции — это явления, при которых происходит превращение одних веществ в другие.
Природа — это огромная лаборатория, в которой непрерывно происходит образование новых веществ. Горные породы и минералы под воздействием солнца, воды, углекислого газа и других веществ постепенно разрушаются и превращаются в новые вещества. В зеленых растениях из углекислого газа и воды образуются глюкоза и крахмал.
Человек превращает взятые из природы вещества (природный газ, нефть, руды) в необходимые ему бензин, резину, пластмассы, волокна, металлы. Часто в результате множества превращений получаются новые вещества, которых нет в природе. При всех этих явлениях происходит разрушение исходных веществ и образование новых веществ.
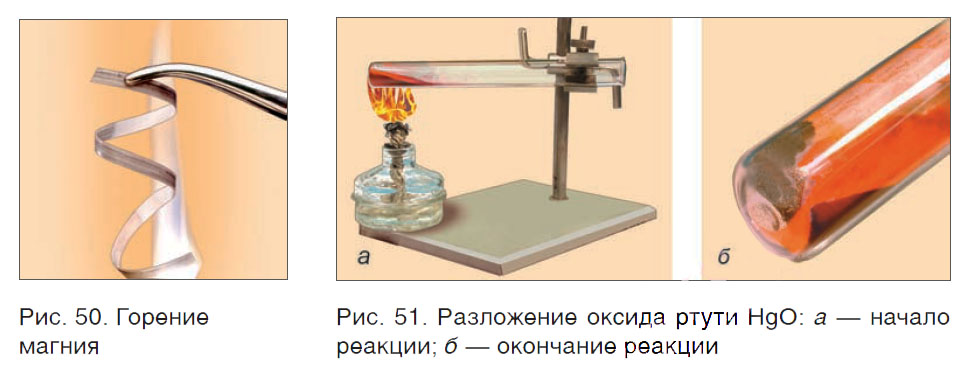
Например, в результате сгорания магния образуется новое вещество MgO (рис. 50). При сгорании метана получаются два вещества: углекислый газ CO2 и вода H2O. Из одного сложного вещества HgO в результате его разложения образуются два новых — ртуть Hg и кислород O2 (рис. 51).
Ржавление железа (рис. 52), кипячение воды, горение лучины, распространение запаха — какие из этих явлений можно отнести к химическим реакциям? По каким признакам можно судить, что химическая реакция произошла?
Признаки химических реакций
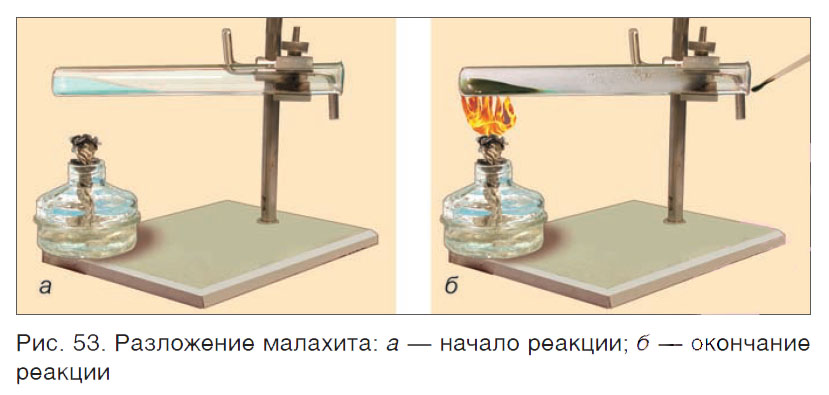
Проведем несколько химических реакций. Нагреем в пробирке зеленый порошок малахита (рис. 53) — минерала, в состав которого входят атомы меди, углерода, водорода и кислорода. Порошок малахита начинает «кипеть» из-за выделяющегося газа. Поднесем к отверстию пробирки спичку, она гаснет — это выделяющийся углекислый газ препятствует ее горению. На стенках пробирки заметны капельки воды, на дне остается черный порошок соединения меди (CuO). Наблюдения доказывают, что образуются новые вещества с другими свойствами. Прекратим нагревание. Сразу прекращается выделение углекислого газа — реакция больше не протекает.
Существуют и другие признаки химических реакций. Например, при горении магния излучается яркий свет и выделяется много теплоты (см. рис. 50).
На заметку: Раньше вспышка магния использовалась для освещения объекта во время фотографирования.
При сливании некоторых растворов наблюдается выпадение осадка (рис. 54). Некоторые осадки можно растворить при помощи других веществ. Например, при сливании растворов соды и известковой воды образуется белый осадок, который легко растворяется в уксусе.
При сгорании спички ощущается резкий запах. Какие еще признаки химических реакций наблюдаются при горении спички?
Изменения, происходящие с веществами, свидетельствуют о протекании химических реакций и являются признаками химических реакций.
Признаки химических реакций:
• Выделение газа.
• Образование или исчезновение осадка.
• Изменение цвета.
• Появление запаха.
• Излучение света.
• Выделение или поглощение теплоты.
Большинство веществ не могут взаимодействовать друг с другом самопроизвольно. Для протекания многих химических реакций необходимо создавать определенные условия.
Условия протекания химических реакций
Необходимое и главное условие для протекания большинства реакций между различными веществами — это их соприкосновение. Для обеспечения лучшего контакта вещества измельчают, переводят в газообразное состояние. Многие вещества лучше реагируют друг с другом, если они растворены в воде.
Во многих случаях этого недостаточно, поэтому реагирующие вещества нагревают. Деревянная лучинка, смесь железа и серы, медь могут долгое время сохраняться при комнатной температуре, реакции начинаются только при их нагревании.
Мало знать, как начать химическую реакцию, надо еще знать, при каких условиях она будет протекать дальше. Почему необходимо все время нагревать сахар, чтобы добиться его полного сгорания, а деревянную лучинку зажигают один раз и она продолжает гореть?
Если при образовании новых веществ выделяется много теплоты, то ее бывает достаточно, чтобы нагревались новые порции вещества и реакция продолжалась. Во многих случаях реакции, начавшись, продолжаются за счет теплоты, выделяемой в этих реакциях, не требуя дополнительной энергии. Примером является горение угля. Другие реакции, например разложение сахара, требуют постоянной затраты энергии на ее продолжение.
В некоторых случаях для начала химического процесса необходимо освещение. Одной из таких реакций, требующих постоянного освещения, является известная вам реакция фотосинтеза.
Таким образом, окружающий нас мир состоит из множества веществ, которые вступают в различные химические реакции. Изучая химические реакции, человек познает сущность процессов, протекающих в живой и неживой природе. Полученные знания помогают более эффективно использовать вещества для получения больших урожаев, выращивания животных, борьбы с различными болезнями. Человечество учится бережно и грамотно относиться к окружающему нас миру.
Краткие выводы урока:
Надеюсь урок 10 «Признаки химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Как определить выделяется газ или нет?
Как понять что вещество осадок?
Ответ, проверенный экспертом
Что бы определить выпадает ли осадок, нужно обратится к таблице растворимости, если вещество нерастворимо, то выпадает осадок. С газами посложнее. … Например, если образуется HCL, он может выделится в виде газа (хлороводород) или остаться в растворе в виде соляной кислоты.
Как образуются осадки в химии?
В большинстве случаев образование осадка вызвано физическими причинами, каждое вещество имеет определённую растворимость, которая при изменении температуры, изменения насыщенности или давления может меняться.
Что является осадком в химии?
ОСАДОК, в химии — нерастворимое твердое вещество, образующееся в РАСТВОРЕ либо прямо в процессе реакции, либо в результате изменения структуры раствора, уменьшающего РАСТВОРИМОСТЬуже растворенного соединения. …
Как понять что это газ в химии?
Что такое соприкосновение в химии?
Соприкосновение — ср. 1. Такое положение двух или нескольких тел, предметов, при котором они соприкасаются своими гранями, частями.
Что такое признаки химических реакций?
ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ
Что значит уравнение в ионном виде?
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Что показывает сокращённое ионное уравнение?
Сокращённое ионное уравнение характеризует сущность реакции, показывает, какие ионы реагируют между собой, и какое вещество они образуют в результате ионной реакции. При этом неважно, в состав каких веществ-электролитов входили эти ионы до реакции.
Как образуются осадки?
Под действием солнечного тепла вода в Мировом океане нагревается превращается в пар и поднимается в воздух. Там влажные воздушные массы поднимаются вверх,где на высоте становятся холодными. Образуется конденсат. Так формируются облака,которые под действием ветра переносятся на материки,где и выпадают в виде осадков.
Какие бывают виды осадков?
Что такое осадки в погоде?
Атмосфе́рные оса́дки (также — гидрометео́ры) — атмосферные явления, связанные с присутствием в атмосфере воды в жидком или твёрдом состоянии, выпадающей из облаков или осаждающейся из воздуха на земную поверхность и какие-либо предметы.
Каковы условия получения хорошего кристаллического осадка?
Таким образом, можно сформулировать следующие правила осаждения кристаллических осадков. Необходимо: 1) вести осаждение из достаточно разбавленного раствора разбавленным раствором осадителя; 2) прибавлять осадитель очень медленно, по каплям (особенно в начале осаждения);
Что значит осадок?
Какие способы осаждения применяют в промышленности?
В промышленности осаждение осуществляют с помощью отстойников (иногда наз. также сгустителями или осветлителями), которые бывают периодического и непрерывного действия. Продолжительность т пребывания суспензии в отстойнике должна быть равна или больше времени осаждения частицы.
Химия
Именная карта банка для детей
с крутым дизайном, +200 бонусов
Закажи свою собственную карту банка и получи бонусы
План урока:
Особенности протекания реакций в растворе
Химические реакции, в отличие от физических, характеризуются образованием новых веществ. Судить об их получении, мы можем, наблюдая изменение окраски, либо выделение газа или осадка.
Вспомним, что происходит с веществом, когда оно попадает в воду. Оно распадается на ионы. Тем не менее, этот процесс характерен не для всех веществ, а только для сильных электролитов, к которым относятся растворимые соли и кислоты, а также щёлочи.
Также необходимо вспомнить, какие реакции относятся к типу обмена.
Судить произошла реакция или нет, мы можем, если будет выполняться хотя бы одно из условий.
Условия протекания реакций между ионами сложных веществ.
Рассмотрим подробно каждое условие и составим алгоритм написания уравнений.
Выпадение осадка является подтверждением того, мы визуально видим, что реакция произошла. Составим уравнение между щёлочью – гидроксидом калия и солью – сульфатом меди (II). Запишем молекулярное уравнение.
Выполняя данный опыт, Вы могли бы наблюдать образование осадка голубого цвета.
Чтобы понять, какое вещество выпало в осадок, воспользуемся таблицей растворимости, а также составим полное ионно-молекулярное уравнение, которое отображает все частицы, находящиеся в растворе, с учётом коэффициентов.
При написании уравнений реакций, не забываем о законе сохранения вещества. Поэтому количество атомов, а также ионов, до реакции и после должны быть равны.
Следует отметить, что в полном ионно-молекулярном уравнении, слева и справа, имеются одинаковые частицы, их можно сократить.
Сокращённая реакция ионного обмена отображает суть химического процесса, а именно, между какими частицами происходит реакция.
Вторым из условий является выделение газа. Эту реакцию Вы наблюдаете, когда гасите соду кислотой, не важно, какой уксусной, лимонной, яблочной, или же при добавлении к ней кефира, результат будет один и тот же, образование пузырьков углекислого газа. Для примера возьмём взаимодействие соды и соляной кислоты. Составим молекулярное уравнение.
Возникает закономерный вопрос, в уравнении отсутствует газ, однако раствор «шипит». Чтобы разобраться в этой проблеме, следует вспомнить, что угольная кислота относится к слабым электролитам и происходит выделение углекислого газа, а также образование молекулы воды. Поэтому полное молекулярно-ионное уравнение приобретает вид.
После сокращение одинаковых частиц левой и правой части, получаем сокращённое ионное уравнение.
Именно по причине наличия ионов водорода, сода «шипит» во всех кислотах.
И к третьему условию относится образование слабого электролита, зачастую это молекула воды, однако могут получаться и другие вещества. Ярким примером является реакция нейтрализации.
Почему этот тип реакции носит такое название? Рассмотрим на примере взаимодействия оснований КОН и Cu(OH)2 с раствором соляной кислоты.
В каждом случае происходит образование воды. В случае нерастворимых оснований, реакция идёт с образованием растворимой соли.
Кислоты и их свойства
Если посмотреть на состав этого класса соединений, то абсолютно во всех содержаться ионы водорода.
Следует заметить, что уравнение диссоциации кислот похожи, но отличие будет по кислотному остатку.Рассмотрим на примерах следующих многоосновных кислот –сернойН2SО4 и фосфорной Н3РО4.Характерной особенностью диссоциации многоосновных кислот – это ступенчатая диссоциация. Это означает, что ионы водорода будут отрываться не сразу все (2 или 3), а по одному.
Следствием этого является способность многоосновных кислот образовывать кислые соли.
В реакциях обмена на их место могут стать только ионы металла, поэтому кислоты реагируют со следующими веществами.
Следственно, при реакции кислот с основными оксидами образуется соль и вода.
Атомы металла входят в состав оснований, в результате реакции нейтрализации, аналогично, как и основными оксидами, продуктом реакции является соль (может быть и кислая, и средняя) и вода.
Исходя из этого, кислая соль образуется, если «не хватает» атомов металла, чтобы обменять их на атомы водорода.
Взаимодействие кислот с солями возможно только в случае, когда соль образована слабой или летучей кислотой, а также в продукте будет газ или осадок.
Особенно хочется отметить взаимодействие металлов с кислотами, поскольку это будет реакция замещения со сменой степени окисления. Не все металлы способны реагировать с кислотами, а только те, что стоят в ряду напряжения до водорода и способны его вытеснить.
Действие концентрированных серной и азотной кислот на металлы отличается от их растворов, при этом происходит образование не водорода, а воды и других продуктов. Детально со свойствами азотной кислоты Вы познакомитесь чуть позже, однако сейчас необходимо запомнить, что при реакции с раствором этой кислоты водород не выделяется.
Основания и их свойства
Для щелочей, подобно многоосновным кислотам, характерна ступенчатая диссоциация.
Тем не менее, будет происходить не только взаимодействие щелочей с кислотами, но и нерастворимых оснований. Объяснением этому служит, то, что кислоты практически все растворимы, за исключением силикатной H2SiO3, которая реагирует только со щелочами. Продуктом будет соль (в зависимости от соотношения реагентов средняя, основная или кислая) и вода.
Кислотные оксиды со щелочами образуют соль и воду.
Для нерастворимых оснований эта реакция не характерна, поскольку именно гидроксильная группа реагирует с оксидами.
Амфотерные основания реагируют также с щелочами. Результатом данного взаимодействия будет соль, зачастую комплексная, и вода.
Взаимодействие солей с щелочами приводит к образованию соли либо основания. Также не забываем об условии, что в продукте должен быть либо газ, либо осадок.
Отличительной способностью обладают нерастворимые, а также амфотерные основания. Они при нагревании распадаются на оксиды.
Соли и их свойства
Этот класс веществ состоит из частичек кислоты – кислотного остатка и основания – катионов металла (либо иона аммония NH4 + ). Диссоциация солей всегда идёт в одну стадию.
Если посмотреть на состав соли, то смело можно предположить, что их растворы будут нейтральными. Поскольку нет ионов, которые отвечают за реакцию среды. Однако на деле совсем не так. Лакмус в водном растворе солей может иметь как красную, так и синюю окраску, а также не изменять её. Объяснением этого явления служит их взаимодействие с водой, которое имеет название гидролиз солей. Возьмём, к примеру, три пробирки, в которых содержатся растворы NaCl, ZnCl2 и Na2CO3. И в каждую добавим лакмус. Результаты эксперимента отображены на рисунке.
Запишем суть реакции соли с водой (молекулу Н2О распишем как НОН), с помощью ионно-молекулярных уравнений.
Сокращённое уравнение хорошо иллюстрирует, почему происходит изменение окраски индикатора. Теперь давайте разберёмся, какие соли подвергаются гидролизу.
Рассмотрим взаимодействие металлов с солями. Чтобы понять принцип их взаимодействия, вспомним ряд активностей металлов.
Данный вид взаимодействия Вы можете наблюдать, выполнив дома опыт (не забываем о разрешении родителей). Вам понадобится раствор медного купороса и скрепка, либо гвоздь.
На поверхности гвоздя выделилась медь в чистом виде. Это окислительно-восстановительная реакция.
Более сильный металл, вытесняет слабый с раствора его соли. Если промоделировать обратную реакцию, а именно положить медную проволоку в раствор соли железа, то не будет никакого взаимодействия. «Силы» у меди не хватит, потеснить железо.
Взаимодействие солей между собой возможно только, если реагенты растворимы, а в продукте будет осадок.
Свойства солей, кислот и оснований, рассмотренных выше, можно объединить в схематическом виде.
1.4.6. Реакции ионного обмена.
Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H + + 2Cl − + Ba 2+ + 2OH − = Ba 2+ + 2Cl − + 2H2O
Сократим одинаковые ионы слева и справа и получим:
Разделив и левую и правую часть на 2, получим:
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
3) Слабых оcнований («NH4OH» и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
Сократив сульфат-ионы слева и справа, получаем:
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na + + CO3 2- + Ca 2+ + 2Cl − = CaCO3↓+ 2Na + + 2Cl −
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, «NH4OH» и H2SO3:
(«NH4OH» — такая запись формулы в кавычках подразумевает, что в реальности вещества с такой формулой не существует. Формула используется для большей простоты промежуточных записей. В реальности вместо «гидроксида аммония» правильнее писать формулу гидрата аммиака NH3·H2O).
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K + + S 2- + 2H + + 2Br — = 2K + + 2Br — + H2S↑
Сократив одинаковые ионы получаем:
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
Полное и сокращенное уравнение будут иметь вид: