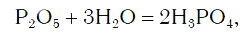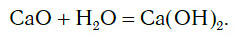Как понять что оксид основный
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
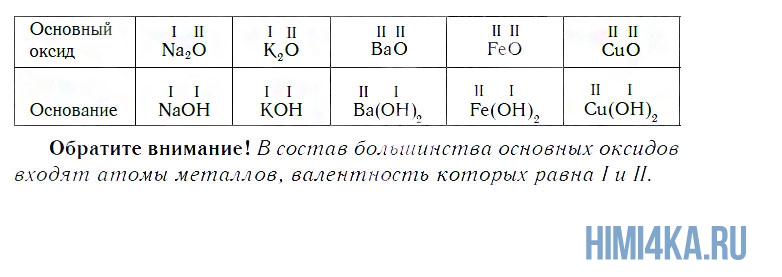
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ
Урок №43. Оксиды: классификация, номенклатура, свойства, получение, применение
Сегодня мы начинаем подробное знакомство с важнейшими классами неорганических соединений. Неорганические вещества по составу делятся, как вы уже знаете, на простые (металлы и неметаллы) и сложные:
А – кислотный остаток
ОН – гидроксильная группа
Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли. Мы начинаем с класса оксидов.
ОКСИДЫ
оксид углерода ( II )
оксид марганца (VII )
Классификация оксидов
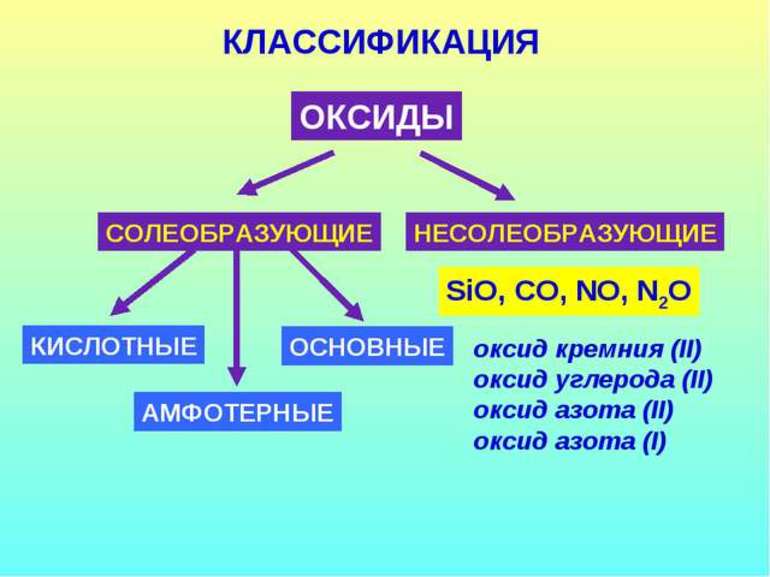
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
Классификация по растворимости в воде
Кислотные оксиды
(не растворим в воде)
Основные оксиды
В воде растворяются только оксиды щелочных и щелочноземельных металлов
Амфотерные оксиды
С водой не взаимодействуют.
В воде не растворимы
Выполните задания:
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
Выпишите оксиды и классифицируйте их.
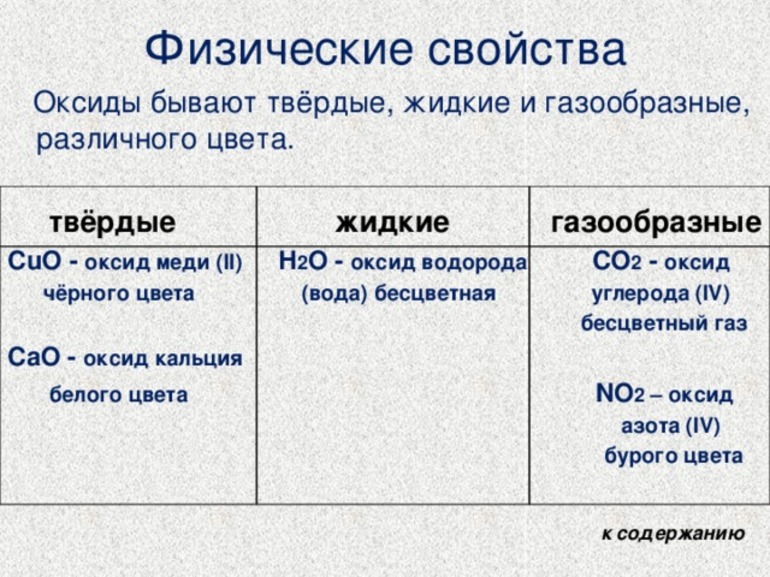
Физические свойства оксидов
Химические свойства оксидов
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
3K 2 O + 2H 3 PO 4 = 2K 3 PO 4 + 3H 2 O
Na 2 O + H 2 O = 2NaOH
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
2. Кислотный оксид + Основание = Соль + Н 2 О (р. обмена)
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
4. Менее летучие вытесняют более летучие из их солей
CaCO 3 + SiO 2 = CaSiO 3 +CO 2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Взаимодействуют как с кислотами, так и со щелочами.
ZnO + 2 HCl = ZnCl 2 + H 2 O
ZnO + 2 NaOH + H 2 O = Na 2 [Zn(OH) 4 ] ( в растворе)
ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (при сплавлении)
Применение оксидов
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
В результате часто получаются очень нужные и полезные соединения. Например, H 2 SO 4 – серная кислота, Са(ОН) 2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO 2 . Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO 2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr 2 O 3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr 2 O 3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Свойства оксидов
Химические свойства оксидов: основных, амфотерных, кислотных
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления ($–2$).
Несолеобразующими называются такие оксиды, которые не взаимодействуют ни со щелочами, ни с кислотами и не образуют солей. Их немного, в их состав входят неметаллы.
Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
Среди солеобразующих оксидов различают оксиды основные, кислотные, амфотерные.
Типичные реакции основных оксидов:
1. Основный оксид + кислота → соль + вода (реакция обмена):
2. Основный оксид + кислотный оксид → соль (реакция соединения):
3. Основный оксид + вода → щелочь (реакция соединения):
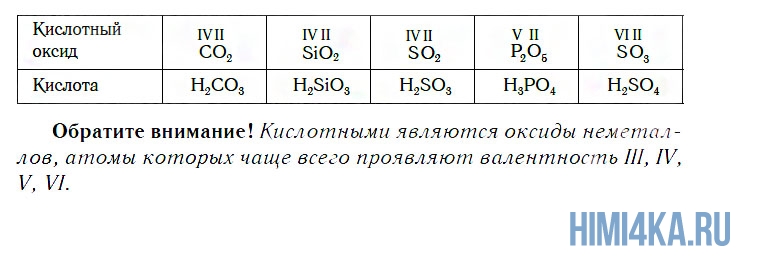
Кислотные оксиды — это такие оксиды, которым соответствуют кислоты. Это оксиды неметаллов:
Типичные реакции кислотных оксидов:
1. Кислотный оксид + основание → соль + вода (реакция обмена):
2. Кислотный оксид + основный оксид → соль (реакция соединения):
3. Кислотный оксид + вода → кислота (реакция соединения):
Такая реакция возможна, только если кислотный оксид растворим в воде.
Типичные реакции амфотерных оксидов:
1. Амфотерный оксид + кислота → соль + вода (реакция обмена):
2. Амфотерный оксид + основание → соль + вода или комплексное соединение:
Общие сведения
В 1775 году французский химик А. Лавуазье правильно истолковал результаты опытов Д. Пристли. Он понял, что газ, поддерживающий горение в герметичном сосуде, — это не часть воздуха, а новый химический элемент. Лавуазье назвал его оксигеном, что в переводе с греческого означает «образующий кислоты», так как думал, что новый элемент входит во все кислоты. Однако такая теория не была верной. Название кислород — это своего рода калька с французского, введенная М. В. Ломоносовым.
Кислород — газ без цвета, запаха и вкуса. При сильном охлаждении превращается сначала в голубую жидкость, затем — в кристаллы синего цвета. Имеет валентность 2 и семь степеней окисления в зависимости от вещества, с которым взаимодействует.
Степени окисления для разных соединений:
Образование оксидов
Получаются оксиды как при непосредственном вступлении кислорода в реакцию с другим химическим элементом, так и при косвенном взаимодействии — в результате разложения кислот, солей и оснований. Самый простой способ получения окисла — это сжигание вещества в кислороде. Формулы оксидов можно определить исходя из значений валентности кислорода и второго химического вещества, а номенклатура названий образуется по схеме:
Например, Mn2O7 — оксид марганца (VII). Допускается название по количеству атомов кислорода — монооксид, диоксид и т. п. Широко распространены и названия, сложившиеся исторически.
Все существующие оксиды разделяются на солеобразующие и несолеобразующие. Последние являются оксидами неметаллов, не имеющих соответственных гидроксидов. Таких соединений немного, к ним относятся оксиды одно- и двухвалентных неметаллов — вода H2O, токсичные газы монооксид углерода CO и оксид азота (II) NO, «веселящий газ» N2O, соединения с кислородом серы и кремния. Они довольно инертны, если и взаимодействуют с другими веществами, то солей не образовывают. Например, при растворении в воде N2O и SO2 образуется серная кислота, и выделяется азот.
Классификация солеобразующих соединений
В химии соединения с кислородом разделяют по характеру их соответствия основаниям, кислотам и амфотерным образованиям. Если металл, составляющий формулу с кислородом, имеет несколько степеней окисления, то промежуточное значение будет у амфотерного, самое большое — у кислотного, а самое низкое — у основного соединения.
К основным оксидам относятся соединения металлов, степень окисления которых равна +1 или +2. Им соответствуют гидроксиды, относящиеся к классу оснований. Реагируют с кислотами, в результате чего получаются соль и вода. В периодической системе усиление основных характеристик наблюдается в главных подгруппах сверху вниз. Список основных оксидов:
К кислотным или ангидридам относятся оксиды неметаллов и металлов со степенью окисления больше +5.
Поскольку в них химические элементы находятся в высшей степени активности, их еще называют высшими. Кислотные свойства таких соединений повышаются по мере продвижения по таблице Менделеева слева направо, так как увеличивается положительный заряд ионов элемента с возрастанием номера периода.
Ангидриды соответствуют гидроксидам, относящимся к кислотам, они могут растворяться в щелочах, образуя при этом соль и воду. Некоторые вступают в реакцию с водой. Типичные представители кислотных оксидов: SO2, SO3, CrO3, P2O5, Cl2O7, Mn2O7. Металлы, которые могут иметь степень окисления +2, +3, +4, образуют с кислородом амфотерные соединения, проявляющие то кислотные, то основные свойства в зависимости от условий химической реакции. К ним относятся Fe2O3, Cr2O3, Al2O3, ZnO, BeO и MnO2.
Физические и химические свойства
Свойства оксидов физического характера определяются структурой их строения. Окислам металлов присуще ионное строение, что определяет и их свойства. Чаще всего это твердые вещества самых разных окрасок. Не растворяются в воде, за исключением соединений щелочных и щелочноземельных металлов. Имеют высокие температуры кипения и плавления. Другие свойства определяются их составом.
Вещества, образованные неметаллическими элементами, чаще всего имеют молекулярный вид строения и более разнообразны по агрегатному состоянию — встречаются жидкие, газообразные и твердые оксиды. К жидкостям относятся:
Окиси серы, углерода и азота при нормальных условиях находятся в газообразном состоянии. Главные химические свойства основных оксидов:
Разные соединения имеют и уникальные свойства. CuO при сплавлении с основаниями, т. е. когда смесь веществ дополнительно нагревают, образует купраты (двойные соли меди и другого металла). Это говорит о слабовыраженных амфотерных свойствах окиси меди.
Также она довольно хорошо восстанавливается до металлического состояния аммиаком, углем и водородом.
FeO распадается при среднем нагревании, но если продолжать поднимать температуру, то получатся оксид Fe3O4 и железо. Может вступать в реакцию с сероводородом и восстанавливаться водородом и коксом. BaO при нагревании до 600 градусов переходит в пероксид бария и может восстановиться до металла при повышении температуры с цинком, магнием и кремнием.
Кислотные оксиды также хорошо реагируют с водой, взаимодействуют с основаниями и основными оксидами. Углекислый газ, растворяясь в воде, образует слабую угольную кислоту, ее применяют для газирования воды, при этом происходит обратная реакция. Диоксид углерода, вступая в реакцию с едким натром NaOH, образует соль угольной кислоты, известную в обиходе как кальцинированная сода. Из углекислого газа получается и так называемая горькая соль MgCO3, для этого нужно соединить CO2 и MgO.
Амфотерные оксиды вступают в химические реакции и с кислотами, и с основаниями. При взаимодействии со щелочами часто получаются соли двойных металлов.
Области применения
Оксиды очень широко применяются в быту, промышленности, медицине и других областях. Вода H2O — источник жизни на земле. Гематит или красный железняк Fe2O3 используют для пигментации красных красок, а магнетит или магнитный железняк Fe3O4 — в металлургии и для изготовления электродов, так как он хорошо проводит электрический ток.
Негашеная известь применяется в строительстве и быту для борьбы с вредителями древесины. Мелкие кристаллы корунда Al2O3 наносят на наждачную бумагу для создания хорошего шлифовального эффекта. Крупные используют в изготовлении искусственных рубинов и сапфиров для ювелирных изделий и часов.
Нанесение оксида железа (II) на сталь называется воронением или чернением. Соединение образовывает прочный тонкий слой на поверхности. Регулируя его толщину, можно получить так называемые цвета побежалости — пленки, изменяющей свой цвет в радужном спектре. Это свойство используют в технологии нанесения цветных рисунков на сталь.
Углекислый газ CO2 используют и в твердом, и в жидком виде. В пищевой промышленности его применяют при изготовлении разнообразных газированных напитков, соды, сахара. В виде сухого льда он используется для сильного охлаждения продуктов и материалов. Жидкой углекислотой наполняют огнетушители.
Широкое применение получил сернистый газ SO2. Его используют в химической промышленности для производства серной кислоты. Способность сернистого газа убивать микроорганизмы и плесень позволила использовать его для дезинфекции подвалов, погребов, складских помещений, а также для хранения и перевозки фруктов и ягод.
Оксид кремния (IV) SiO2 — тугоплавкое и твердое вещество. Встречается в природе в кристаллическом и аморфном состоянии. Кристаллический кремнезем — это минералы кварца в виде халцедона, агата, яшмы, горного хрусталя. Кварцевый песок используют для изготовления стекла, бетона и кирпича. Полудрагоценные камни обрабатывают ювелиры, особенно красиво кристаллы выглядят при использовании одновременно с SiO2 оксида свинца PbO.
Аморфный кремнезем называется опалом и выражается формулой SiO2 ∙ nH2O. Из него делают украшения, химическую посуду, кварцевые лампы. Соединения, имеющие устойчивый цвет, используют для пигментации стекол и красок. CO2O3 придает материалам синий, Cr2O3 — зеленый, ZnO — белый, MnO2 — розовый цвет.
Окись цинка нашла и медицинское применение, ее добавляют в маски и кремы, подсушивают раны при кожных заболевания. Жженую магнезию MgO из-за ее способности хорошо реагировать с соляной кислотой желудочного сока назначают как средство при повышенной кислотности, она помогает убрать изжогу и выступает сорбентом. Оксид хрома (VI) CrO3 используется в восстановительной хирургии. Это вещество безвредно для человеческого организма.
Урок 31. Оксиды
В уроке 31 «Оксиды» из курса «Химия для чайников» познакомимся с оксидами их классификацией, а также узнаем где они встречаются в природе.
Все неорганические вещества делятся на несколько классов, важнейшими из которых являются оксиды, кислоты, основания и соли. Первоначальные сведения об этих веществах вы уже получили. Теперь вам предстоит познакомиться с ними более подробно и систематизировать свои знания.
Вы уже знаете, что самым распространенным элементом на Земле является кислород. Его атомы, соединяясь с атомами других элементов, образуют огромное количество сложных неорганических веществ, среди которых важное место занимают оксиды.
Состав оксидов
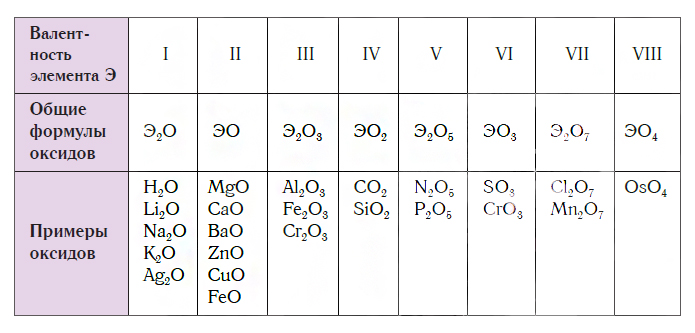
В состав любого оксида входят атомы двух химических элементов, один из которых — кислород, например: Н2О, Al2O3, Р2О5, CuO, Cl2O7. Всего известно около трехсот разных оксидов. Их общая химическая формула — ЭxOy, где буква Э обозначает символ химического элемента, образующего оксид, О — символ кислорода, а буквы x и y — индексы, обозначающие число атомов в молекулах или в формульных единицах оксидов.
Поскольку валентность атомов кислорода в оксидах всегда равна II, а валентность атомов других элементов принимает значения от I до VIII, состав оксидов выражается формулами, приведенными в следующей таблице.
Классификация оксидов
Поскольку оксидов известно очень много, возникает необходимость классификации этих веществ по их химическим свойствам, т. е. по способности превращаться в другие вещества.
Вы уже знаете, что оксиды могут реагировать с водой, превращаясь при этом в соединения двух типов — кислоты и основания. Так, например, оксид фосфора(V) P2O5, присоединяя воду, превращается в кислоту H3PO4:
а оксид кальция CaO, взаимодействуя с водой, превращается в основание Ca(OH)2:
Иначе говоря, оксиду фосфора соответствует кислота, а оксиду кальция соответствует основание. Исходя из этого, оксиды можно разделить на две большие группы — кислотные и основные оксиды.
К кислотным относятся оксиды, которым соответствуют кислоты. Наряду с Р2О5, кислотными являются также оксиды: CO2, SiO2, SO2, N2O5, SO3 и некоторые другие. Всем им соответствуют кислоты.
К основным относятся оксиды, которым соответствуют основания. Кроме СaO, основными являются оксиды: Na2O, K2O, BaO, FeO, CuO и ряд других. Всем этим оксидам соответствуют основания.
Оксиды в природе
Оксиды содержатся в каждой из трех оболочек нашей планеты — в атмосфере, гидросфере, литосфере.
Самым распространенным оксидом в атмосфере и гидросфере является вода H2O, а в литосфере — оксид кремния(IV) SiO2, встречающийся в виде красивых кристаллов кварца (рис. 116) и кварцевого песка.
Краткие выводы урока:
Надеюсь урок 31 «Оксиды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.