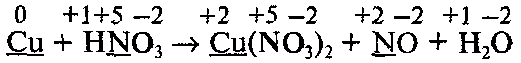Как понять что реакция окислительно восстановительная
1.4.8. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции (ОВР) — такие реакции, которые протекают с изменением степеней окисления элементов.
Изменение степеней окисления происходит из-за полной или частичной передачи электронов от одних атомов к другим:
Процесс приобретения атомом дополнительных электронов называется восстановлением:
Вещество, которое содержит восстанавливающиеся атомы, называют окислителем.
В примере выше окислителем является азотная кислота HNO3.
Аналогично повышение степени окисления происходит в том случае, когда атом элемента теряет некоторое количество своих электронов. Процесс потери атомом электронов называют окислением:
Химическое вещество, которое содержит окисляющиеся атомы, называют восстановителем. В указанном примере восстановителем является фосфин PH3.
Виды окислительно-восстановительных реакций
Межмолекулярные ОВР
Межмолекулярные окислительно-восстановительные реакции — такие реакции, в которых атомы окислителя и атомы восстановителя находятся в разных веществах. Например:
Внутримолекулярные ОВР
Внутримолекулярные окислительно-восстановительные реакции — такие реакции, в которых атомы восстановителя и атомы окислителя содержатся в одном веществе. Например:
Реакции диспропорционирования
Реакциями диспропорционирования называют такие реакции, в которых атомы одного химического элемента, являются окислителями и восстановителями и при этом находятся в одном веществе. Такие реакции также называют реакциями самоокисления-самовосстановления. Например, к таким реакциям относятся все реакции взаимодействия галогенов с растворами щелочей:
Расстановка коэффициентов в окислительно-восстановительных реакциях
Метод электронного баланса
Метод электронного баланса — метод расстановки коэффициентов в окислительно-восстановительной реакции, основанный на том, что количество электронов, отданных восстановителем, равно числу электронов, полученных окислителем.
Алгоритм расстановки коэффициентов данным методом выглядит следующим образом:
1) Следует записать схему реакции, указав формулы всех реагентов и продуктов. Например, при взаимодействии концентрированной серной кислоты с фосфором образуется фосфорная кислота, диоксид серы и вода:
2) Далее следует расставить все степени окисления и найти те элементы, у которых изменилось значение степени окисления.
3) После расстановки степеней окисления химических элементов находят те элементы, которые изменили свои степени окисления. Далее записывают уравнения полуреакций окисления и восстановления. В нашем случае они имеют вид:
4) Поскольку количество отдаваемых электронов восстановителем должно быть равно количеству принимаемых электронов окислителем, далее следует подобрать дополнительные множители к записанным полуреакциям:
5) Подобранные к полуреакциям множители переносятся в схему реакции:
6) Отталкиваясь от тех коэффициентов, которые уже известны из электронного баланса, оставшиеся коэффициенты расставляют методом подбора:
Примечание:
Следует отметить, что если в одной структурной единице какого-либо участника реакции содержится не один атом химического элемента, изменившего степень окисления, а 2 или больше, то это обязательно следует учитывать при записи уравнений полуреакций. Обратите внимание на составление электронного баланса для реакции горения этана в кислороде:
Как можно видеть в первом уравнении полуреакции, мы учли то, что в левой части уравнения уже сразу содержится не менее двух атомов углерода, поскольку одна формульная единица C2H6 содержит два атома C. По этой причине мы поставили коэффициент 2 перед атомами углерода в левой и правой частях полуреакции, а также удвоили количество «уходящих» электронов (14 вместо 7-ми).
Во второй полуреакции мы также учли, что в левой части уравнения реакции не может быть менее двух атомов кислорода, поскольку 2 атома O содержатся в одной молекуле O2. Однако как вы могли заметить, в случае простого вещества кислорода мы не стали писать 2O, а записали O2. Также следует поступать и в случае других простых молекулярных веществ, например, O2, F2, Cl2, N2, H2 и т.д.
Очевидно, что электронный баланс — не самая сложная часть в процессе составления уравнения окислительно-восстановительной реакции. Часто трудности возникают в том, какие продукты записывать в правой части схемы реакции.
Для того чтобы записывать уравнения ОВР, не нужно пытаться выучить все возможные реакции, тем более, что это невозможно в принципе. Надо учиться их составлять. В первую очередь, что действительно следует выучить, так это формы существования окислителей и восстановителей до и после реакции в зависимости от среды раствора. Среда раствора определяется по наличию или отсутствию среди реагентов кислоты или щелочи. Также всегда нужно помнить, что в качестве возможных продуктов не следует писать формулы веществ, реагирующих с остальными продуктами и/или со средой. Так, например, в продуктах не может быть кислоты, если изначально среда раствора щелочная и наоборот. В общем, говоря более простыми словами, все продукты должны быть химически «безразличны» друг к другу, а также к среде раствора (исключение — электролиз).
Ниже представлены основные окислительно-восстановительные переходы окислителей и восстановителей в зависимости от среды. Во многих случаях указаны не целые формулы веществ, а формулы ионов, входящих в их состав. В таком случае для записи уравнения реакции в молекулярном виде формулу иона требуется дополнить противоионами. Катионы металлов, чаще всего, объединяют с кислотными остатками, если среда кислая, а анионы с катионами металлов (если среда щелочная) или водорода, если среда кислая или нейтральная.
Окислители
Восстановители
Коррозия металлов и способы защиты от нее
Коррозией металла называют процесс его самопроизвольного разрушения в результате контакта с окружающей средой.
Коррозия бывает химическая и электрохимическая.
Химическая коррозия — вид коррозии, при котором металл разрушается из-за его взаимодействия с газами или жидкостями, не проводящими электрический ток. Так, например, к химической коррозии относится образование окалины при взаимодействии железа с кислородом при высоких температурах, а также разрушение металлического оборудования под действием нефтяных фракций, содержащих сернистые соединения.
Электрохимической коррозией называют разрушение металла в растворе электролита вследствие возникновения в данной системе электрических токов. Электрические токи, способствующие коррозии, возникают в тех случаях, когда в растворе электролита изделие из металла контактирует с другим менее активным металлом. Также такие токи могут появляться из-за химической неоднородности металлического материала, из которого выполнено изделие.
Так, например, из-за электрохимической коррозии страдают подводные части судов, паровые котлы, трубопроводы, металлические конструкции в почве и т.д.
Способы защиты металлов от коррозии
1) Контроль условий, в которых эксплуатируется металлическое оборудование. Например, хранение и использование изделий из стали на открытом воздухе нежелательно и этого, по возможности, следует избегать. Эксплуатация металлического оборудования в помещениях с низкой влажностью существенно продлит его срок службы.
2) Создание защитных покрытий, изолирующих металлоконструкцию от контакта с окружающей средой. Среди таких покрытий различают:
— неметаллические покрытия — всевозможные краски, лаки, эмали, а также пленки из таких полимеров, как полиэтилен, поливинилхлорид и т.д.;
— химические покрытия (оксидные, нитридные, фосфатные и т.д.) (Такие покрытия получают специальной химической обработкой поверхности металла.);
Металлические покрытия получают нанесением на защищаемую металлическую конструкцию тонкого слоя другого металла (чаще всего с помощью процесса электролиза).
При этом, если в качестве покрытия используется менее активный металл, то такое покрытие будет защищать металлоконструкцию только при условии его целостности. В случае, если целостность такого покрытия будет нарушена, защищаемый металл будет ускоренно корродировать.
Также широко используется покрытие металлоконструкций более активным металлом. Например, распространено использование так называемого оцинкованного железа. Такое покрытие защищает металлические объекты даже при нарушении его целостности, поскольку пока практически полностью не исчезнет слой покрытия из более активного металла, коррозия металла, из которого сделан защищаемый объект, не начнется.
3) Электрохимические методы защиты:
— катодная защита — вид защиты, при котором металлический объект подключается с помощью проводников к катоду внешнего источника тока либо же приводится в контакт с более активным металлом.
Частный случай катодной защиты, при котором металлическая конструкция приводится в контакт с более активным металлом, называют протекторной защитой.
4) Изменение химических свойств среды, в которой эксплуатируется металлическое изделие, в частности:
— добавление в среду веществ, замедляющих коррозию (ингибиторов коррозии).
— дегазация среды (удаление растворенных в ней газов, в частности, кислорода). Например, такой метод работает для защиты от ржавления железа, поскольку в процессе ржавления железа активное участие принимает не только вода, но и кислород:
Окислительно-восстановительные реакции (ОВР)
Все химические реакции можно разделить на два типа:
1) Реакции, которые протекают без изменения степеней окисления элементов: степени окисления всех элементов в молекулах исходных веществ равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
2) Реакции, которые протекают с изменением степеней окисления элементов: степени окисления всех или некоторых элементов в молекулах исходных веществ не равны степеням окисления этих элементов в молекулах продуктов реакции. Например:
Реакции второго типа называются окислительно-восстановительными.
Окислительно-восстановительные реакции (ОВР) — это химические реакции, при протекании которых степени окисления элементов изменяются.
Изменение степеней окисления в ходе ОВР обусловлено полным или частичным переходом электронов от атомов одного элемента к атомам элемента.
Так, в реакции 4.1.2 каждый атом магния отдает 2 электрона:
Mg 0 = Mg +2 + 2ē (или: Mg 0 — 2ē = Mg +2 ) (4.1.4)
Эти электроны переходят к молекуле кислорода. Каждый атом кислорода в молекуле О2 присоединяет 2 электрона, поэтому молекула кислорода присоединяет 4 электрона:
Атом марганца, который в исходном веществе (KМnО4) имеет степень окисления +7, присоединяет 5 электронов и превращается в атом марганца со степенью окисления +2 (такую степень окисления он имеет в молекуле продукта реакции MnCl2):
Mn +7 + 5ē = Mn +2 (4.1.7)
Рассмотренный выше механизм ОВР объясняет, почему эти реакции называют реакциями с переносом электронов. Реакции, при протекании которых степени окисления не изменяются, называются реакциями без переноса электронов. Таким образом, любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называется окислением. В результате процесса окисления алгебраическая величи на степени окисления элемента повышается.
В рассмотренных примерах процессы 4.1.4 и 4.1.6 являются процессами окисления.
Процесс присоединения электронов называется восстановлением. В результате процесса восстановления алгебраическая величина степени окисления понижается.
Процессы 4.1.5 и 4.1.7 являются примерами процессов восстановления.
Частицы (атомы, молекулы, ионы), которые отдают электроны, называются восстановителями.
В реакциях 4.1.2 и 4.1.3 восстановителями являются соответственно Mg и НCl.
Частицы, которые присоединяют электроны, называются окислителями.
В реакциях 4.1.2 и 4.1.3 окислителями являются соответственно O2 и KМnО4.
Следовательно, в общем виде окислительно-восстановительную реакцию можно представить следующей схемой:
Восстановитель + Окислитель = Продукты реакции
Восстановитель участвует в процессе окисления, т. е. окисляется. А окислитель участвует в процессе восстановления, т. е. восстанавливается.
Важнейшие окислители и восстановители
Какие же вещества могут быть окислителями и какие восстановителями? Это зависит от величины степеней окисления элементов, которые входят в состав данных веществ. Как известно, некоторые элементы имеют постоянные степени окисления во всех или в большинстве сложных веществ. Для таких элементов изменение степеней окисления нехарактерно. Поэтому свойства веществ обычно не зависят от присутствия этих элементов. Элементы с переменной степенью окисления, как правило, легко ее изменяют, т. е. могут участвовать в процессах отдачи или присоединения электронов. Поэтому свойства сложных веществ обусловлены наличием в их составе элементов с переменной степенью окисления.
Если в состав вещества входит элемент с высшей степенью окисления, он может только понижать ее, т. е. участвовать в процессе восстановления. Следовательно, данное вещество может только присоединять электроны и выступать только в роли окислителя.
Например, свойства перманганата калия KМnО4 определяются степенью окисления марганца (калий и кислород — элементы с постоянной степенью окисления). Марганец в KМnО4 имеет высшую степень окисления +7, поэтому KМnО4 может быть только окислителем.
Если в состав вещества входит элемент с низшей степенью окисления, он может только повышать ее, т. е. участвовать в процессе окисления. Следовательно, данное вещество может только отдавать электроны и выступать только в роли восстановителя.
Например, свойства аммиака NH3 определяются степенью окисления азота (для водорода степень окисления +1 является практически постоянной). Азот в NH3 имеет низшую степень окисления —3, поэтому NH3 может быть только восстановителем.
Если в состав вещества входит элемент с промежуточной степенью окисления, он может как повышать, так и понижать ее, т. е. может участвовать и в процессе окисления, и в процессе восстановления. Следовательно, данное вещество может быть и окислителем, и восстановителем. Это зависит от второго участника реакции.
Например, свойства сульфита натрия Na2SО3 определяются степенью окисления серы, которая имеет промежуточную степень окисления +4. Поэтому Na2SО3 проявляет окислительно-восстановительную двойственность. В реакции с перманганатом калия:
сульфит натрия окисляется до сульфата натрия, т. е. выступает в роли восстановителя. Это обусловлено тем, что KМnО4 может быть только окислителем (см. выше). А в реакции с сероводородом:
сульфит натрия восстанавливается до свободной серы, т. е. выступает в роли окислителя, так как H2S может быть только восстановителем (сера в H2S находится в низшей степени окисления).
Важнейшими окислителями являются:
б) сложные вещества, молекулы которых содержат элементы в высшей степени окисления — перманганат калия KМnО4, хроматы и дихроматы (например, дихромат калия K2СrО7), азотная кислота HNO3 и ее соли — нитраты, концентрированная серная кислота H2SO4, оксид свинца (IV) РbО2, хлорная кислота HClO4 и ее соли — перхлорат и др.
Важнейшими восстановителями являются:
Среди веществ, содержащих элементы в промежуточных степенях окисления, есть вещества, для которых более характерными являются или окислительные, или восстановительные свойства. Обычно являются окислителями галогены Сl2 и Br2, хлорноватистая кислота НClО и ее соли — гипохлориты, хлораты (KСlO3 и др.), оксид марганца (IV) МnO2, соли трехвалентного железа (FeCl3 и др.). Как правило, в роли восстановителей выступают водород Н2, углерод С, оксид углерода (II) СО, сульфиты металлов (Na2SO3 и др.), соли двухвалентного железа (FeSO4 и др.).
Типы окислительно-восстановительных реакций
Различают 3 типа окислительно-восстановительных реакций.
1) Межмолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав молекул различных веществ. Примерами данного типа реакций являются
2) Внутримолекулярные окислительно-восстановительные реакции. В этих реакциях элемент-окислитель и элемент-восстановитель входят в состав одного вещества. Например:
К этому типу ОВР относятся многие реакции термического разложения веществ.
З) Реакции самоокисления-самовосстановления, называемые также реакциями диспропорционирования. Это ОВР, при протекании которых один и тот же элемент, находящийся в промежуточной степени окисления, и окисляется и восстанавливается. Часть атомов данного элемента отдает электроны другой части атомов этого же элемента. Например:
Составление уравнений окислительно-восстановительных реакций
Для составления уравнений окислительно-восстановительных реакций часто используется специальный метод — метод электронного баланса. В основе его лежит следующее правило: общее число электронов, которые отдает восстановитель, должно быть равно общему числу электронов, которые присоединяет окислитель.
Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой:
а) Определим степени окисления всех элементов в молекулах исходных веществ и продуктов реакции:
б) Подчеркнем символы элементов, которые изменяют степени окисления в ходе реакции:
в) Составим уравнения процессов окисления и восстановления:
Обратите внимание, что в левой части уравнения процесса окисления взято два атома брома, так как продуктом окисления является двухатомная молекула брома Br2.
г) Находим множители для уравнений процессов окисления и восстановления, при умножении на которые числа отданных и присоединенных электронов будут равны. Так как наименьшим общим кратным чисел «5» и «2» является «10», то уравнение процесса восстановления нужно умножить на «2», а уравнение процесса окисления — на «5»:
д) Найденные множители запишем как коэффициенты перед формулами веществ, которые содержат элементы, участвующие в процессах окисления и восстановления:
е) После этого уравниваем числа атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода.
Обычно числа атомов водорода и кислорода уравнивают в последнюю очередь. Во многих случаях равенство чисел атомов кислорода в левой и в правой частях уравнения ОВР свидетельствует о том, что это уравнение составлено правильно (в составленном уравнении 40 атомов кислорода и в левой, и в правой частях).
Рассмотрим некоторые более сложные примеры составления уравнений ОВР.
Составим уравнение реакции, которая протекает по следующей схеме:
Определим степени окисления всех элементов и подчеркнем символы элементов, которые изменяют свои степени окисления:
Составим уравнения процессов окисления и восстановления и найдем множители, на которые нужно умножить эти уравнения:
Обратите внимание, что не все атомы азота, которые входят в состав HNО3, изменяют свою степень окисления: часть атомов азота без изменения степени окисления переходит в молекулы Cu(NO3)2 Поэтому найденные методом электронного баланса коэффициенты напишем перед всеми формулами, содержащими Сu и N, кроме формулы HNO3:
Коэффициент перед формулой HNO3 равен общему числу атомов азота в правой части уравнения, т. е. равен 8 (из них 6 атомов, которые не изменяют степень окисления):
В последнюю очередь уравниваем числа атомов водорода и кислорода:
В некоторых ОВР более двух элементов изменяют свои степени окисления. В качестве примера рассмотрим следующую реакцию:
Два элемента — фосфор и сера — в ходе этой реакции окисляются, один элемент — азот — восстанавливается:
Общее число электронов, которые участвуют в процессах окисления, равно 22; в процессе восстановления участвует 1 электрон. Поэтому общий множитель для двух уравнений процессов окисления равен 1, а множитель для уравнения процесса восстановления равен 22. Запишем эти множители в качестве коэффициентов перед формулами соответствующих веществ:
В заключение уравняем числа атомов водорода и кислорода: