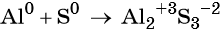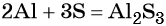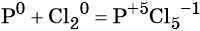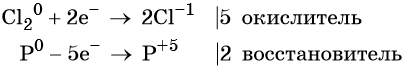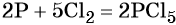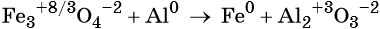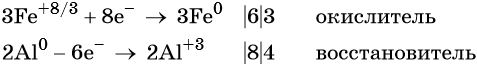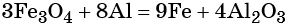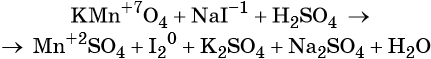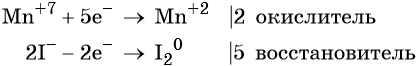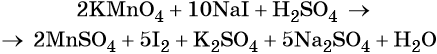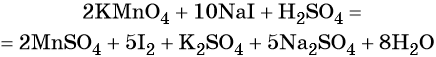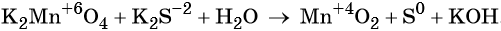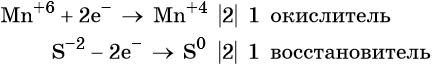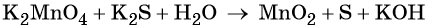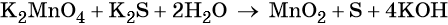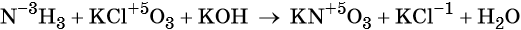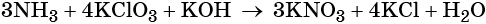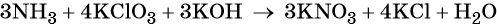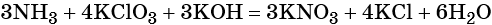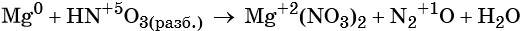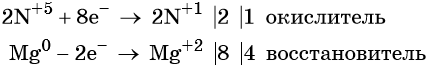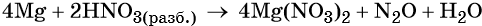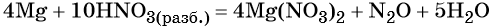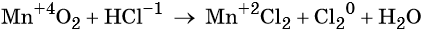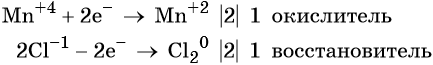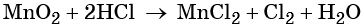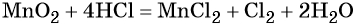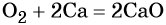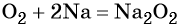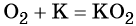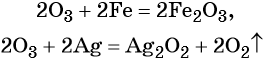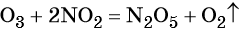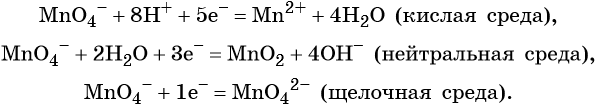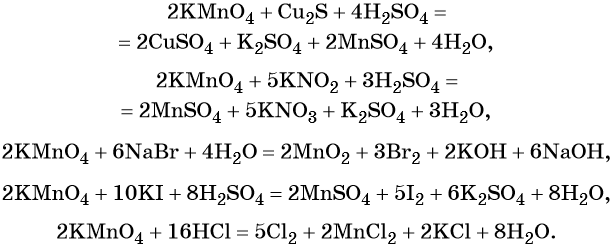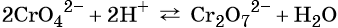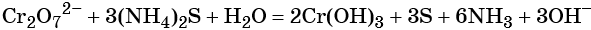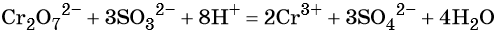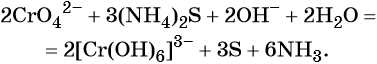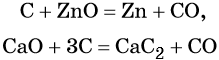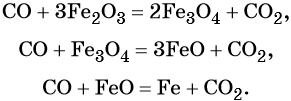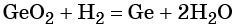Как понять что реакция окислительно восстановительная реакция
Как определить окислительно-восстановительную реакцию
Прежде чем научиться определять окислительно-восстановительную реакцию, необходимо понять, что подразумевается под окислительно-восстановительной реакцией. Окислительно-восстановительные реакции рассм
Содержание:
Прежде чем научиться определять окислительно-восстановительную реакцию, необходимо понять, что подразумевается под окислительно-восстановительной реакцией. Окислительно-восстановительные реакции рассматриваются как реакции переноса электронов. Он включен в органическую и неорганическую химию. Он получил свое название «Redox», потому что окислительно-восстановительная реакция состоит из реакции окисления и реакции восстановления. Определение степени окисления является ключевым моментом при определении окислительно-восстановительной реакции. В этой статье обсуждаются типы окислительно-восстановительных реакций, приводятся примеры для каждой окислительно-восстановительной реакции, половинные реакции в окислительно-восстановительной реакции, а также разъясняются правила определения степени окисления и изменения в степени окисления.
Что такое окислительно-восстановительная реакция
Реакции кислотных оснований характеризуются процессом переноса протона, аналогично окислительно-восстановительные или окислительно-восстановительные реакции включают процесс переноса электрона. Окислительно-восстановительная реакция имеет две половинные реакции, а именно реакцию окисления и реакцию восстановления. Реакция окисления включает потерю электронов, а реакция восстановления включает принятие электронов. Следовательно, окислительно-восстановительная реакция содержит два вида: окислитель подвергается окислительной половине реакции, а восстановитель подвергается восстановительной половине реакции. Степень снижения окислительно-восстановительной реакции равна степени окисления; это означает, что количество электронов, потерянных от окислителя, равно количеству электронов, принятых восстановителем. Это сбалансированный процесс с точки зрения обмена электронами.
Как определить окислительно-восстановительную реакцию
Найдите число окисления:
Чтобы определить окислительно-восстановительную реакцию, сначала нам нужно знать степень окисления каждого элемента в реакции. Мы используем следующие правила для присвоения номеров окисления.
• Свободные элементы, которые не объединены с другими, имеют степень окисления ноль. Таким образом, атомы в H2, Руб.2, Na, Be, Ca, K, O2 и P4 имеют одинаковую степень окисления ноль.
• Для ионов, состоящих только из одного атома (одноатомных ионов), степень окисления равна заряду на ионе. Например:
• В нейтральной молекуле сумма всех чисел окисления равна нулю.
• В многоатомном ионе сумма всех чисел окисления равна заряду на ионе.
• Числа окисления не должны быть только целыми числами.
Определите реакцию окисления и реакцию восстановления:
Рассмотрим следующую реакцию.
Шаг 1: Определить окислитель и восстановитель. Для этого нам нужно определить их степень окисления.
Шаг 2: Напишите полуреакции для окисления и восстановления. Мы используем электроны для уравновешивания зарядов в обе стороны.
Шаг 3: Получение окислительно-восстановительной реакции. Добавляя (1) и (2), мы можем получить окислительно-восстановительную реакцию. Электроны в полуреакциях не должны появляться в сбалансированной окислительно-восстановительной реакции. Для этого нам нужно умножить реакцию (1) на 2, а затем добавить ее к реакции (2).
Выявление окислительно-восстановительных реакций
Пример: рассмотрим следующие реакции. Какой из них напоминает окислительно-восстановительную реакцию?
В окислительно-восстановительной реакции степень окисления изменяется в реагентах и продуктах. Должны быть окисляющие и восстанавливающие виды. Если степень окисления элементов в продуктах не изменяется, это не может рассматриваться как окислительно-восстановительная реакция.
Это не окислительно-восстановительная реакция. Потому что реагенты и продукты имеют одинаковые степени окисления. H (+1), Cl (-1), Na (+1) и O (-2)
Типы окислительно-восстановительных реакций
Существует четыре различных типа окислительно-восстановительных реакций: реакции сочетания, реакции разложения, реакции вытеснения и реакции диспропорционирования.
Комбинированные реакции:
Реакции разложения:
В реакциях разложения соединение распадается на два или более компонентов. Это противоположность сочетания реакций.
Реакции смещения:
В реакции замещения ион или атом в соединении заменяется ионом или атомом другого соединения. Реакции смещения имеют широкий спектр применения в промышленности.
Все щелочные металлы и некоторые щелочные металлы (Ca, Sr и Ba) замещаются водородом из холодной воды.
Некоторые металлы в элементарном состоянии могут замещать металл в соединении. Например, цинк заменяет ионы меди, а медь может заменять ионы серебра. Реакция смещения зависит от ряда активности места (или электрохимического ряда).
Ряд активности для реакций вытеснения галогена: F2 > Cl2 > Br2 > Я2, По мере продвижения по галогеновой серии мощность окислительной способности уменьшается.
Диспропорциональные реакции:
Это особый тип окислительно-восстановительной реакции. Элемент в одной степени окисления одновременно окисляется и восстанавливается. В реакции диспропорционирования один реагент должен всегда содержать элемент, который может иметь по меньшей мере три степени окисления.
Здесь степень окисления в реагенте равна (-1), она увеличивается до нуля в O2 и уменьшается до (-2) в H2О. Степень окисления в водороде не изменяется в реакции.
Окислительно-восстановительные реакции рассматриваются как реакция переноса электрона. В окислительно-восстановительной реакции один элемент окисляется и выделяет электроны, а один элемент восстанавливается за счет выделения высвобождаемых электронов. Степень окисления равна степени восстановления с точки зрения обмена электронов в реакции. В окислительно-восстановительной реакции есть две половины реакции; они называются окислительной полуреакцией и восстановительной полуреакцией. Увеличивается степень окисления при окислении, аналогично степень окисления уменьшается при восстановлении.
Окислительно-восстановительные реакции для «чайников»
Все химические реакции делятся на два вида:
Второй тип реакций называют окислительно-восстановительными.
Возникает логичный вопрос, а почему, собственно, такие реакции получили название окислительно-восстановительных, а, не, скажем, окислительно-изменительных? И, вообще, что это за «зверь» такой окисление?
Для того, чтобы обстоятельно ответить на эти вопросы, предварительно следует разобрать такие понятия, как «валентность», «электроотрицательность» и «степень окисления».
| Окислительно-восстановительные реакции сопровождаются перемещением электронов от одних атомов (молекул, ионов) к другим |
Изложение дальнейшего материала ведется с учетом того, что читатель знаком с понятиями «атом» и «электрон». Вкратце лишь напомним, что атом элемента состоит из ядра (положительно заряженного) и электронов (отрицательно заряженных), которые вращаются по своим орбиталям вокруг ядра.
Что происходит, когда атом отдает свои электроны? Поскольку электроны являются отрицательно заряженными частицами, то, уменьшение их количества автоматически приводит к увеличению заряда атома.
Атом (молекула, ион), получивший электрон, наоборот, уменьшает свой заряд.
ВНИМАНИЕ! Теперь начнём «путать следы».
В общем, надо признать, что такая терминология не лишена логики, ведь, если переложить язык химии на повседневную жизнь, то:
Продолжаем «путать следы» дальше.
Подводим краткий итог сказанному:
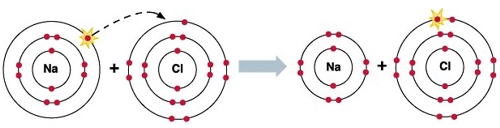
На рисунке выше показано взаимодействие атома натрия с атомом хлора, в ходе которого, натрий отдает один свой электрон атому хлора. В этой реакции натрий является элементом-восстановителем, в ходе реакции он окисляется (степень окисления натрия увеличивается); атом хлора является элементом-окислителем, в ходе реакции он восстанавливается (степень окисления хлора уменьшается).
Следует понимать, что в окислительно-восстановительных реакциях кол-во отдаваемых электронов веществом-восстановителем, обязательно равно кол-ву электронов, принятых веществом-окислителем. Если кредитор дал взаймы 100 долларов, то заемщик получил кредит в 100 долларов.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Окислительно-восстановительные реакции. Окислитель и восстановитель
Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Основные коэффициенты в уравнении реакции равны единице:
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:
Проставляем найденные основные коэффициенты в уравнение реакции:
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
В кислой среде образуются ионы Cr 3+ :
В щелочной — производные анионного комплекса [Cr(OH)6] 3– :
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:
Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.