Лютеций в честь чего
Лютеций
Лютеций (химический символ — Lu; лат. Lutetium ) — химический элемент, относящийся к группе лантаноидов.
Содержание
История открытия
Элемент в виде оксида в 1907 году независимо друг от друга открыли французский химик Жорж Урбэн, австрийский минералог Карл Ауэр фон Вельсбах и американский химик Чарльз Джеймс. Все они обнаружили лютеций в виде примеси к оксиду иттербия, который, в свою очередь, был открыт в 1878 г. как примесь к оксиду эрбия, выделенному в 1843 г. из оксида иттрия, обнаруженного в 1797 г. в минерале гадолините. Все эти редкоземельные элементы имеют очень близкие химические свойства. Приоритет открытия принадлежит Ж. Урбэну.
Происхождение названия
Название элемента его первооткрыватель Жорж Урбен произвёл от латинского названия Парижа — Lutetia Parisorum. Для иттербия, от которого был отделён лютеций, было предложено название неоиттербий. Оспаривавший приоритет открытия элемента Фон Вельсбах предложил для лютеция название кассиопий (cassiopium), а для иттербия — альдебараний (aldebaranium) в честь созвездия Северного полушария и самой яркой звезды созвездия Тельца, соответственно. Учитывая приоритет Урбена в разделении лютеция и иттербия, в 1914 году Международная комиссия по атомным весам приняла название Lutecium, которое в 1949 г. было изменено на Lutetium (русское название не менялось). Тем не менее, до начала 1960-х годов в работах немецких учёных употреблялось название кассиопий.
Получение
Для получения лютеция производится его выделение из минералов вместе с другими тяжёлыми редкоземельными элементами. Отделение лютеция от других лантаноидов ведут методами экстракции, ионного обмена или дробной кристаллизацией, а металлический лютеций получается при восстановлении кальцием из фторида LuF3.
Цена металлического лютеция чистотой >99,9 % составляет 3,5—5,5 тыс. долларов за 1 кг. Лютеций является самым дорогим из редкоземельных металлов, что обусловлено трудностью его выделения из смеси редкоземельных элементов и ограниченностью использования.
Свойства
Физические свойства
Лютеций — металл серебристо-белого цвета, легко поддаётся механической обработке. Он является самым тяжёлым элементом среди лантаноидов как по атомному весу, так и по плотности (9,8404 г/см³). Температура плавления лютеция (1663 °C) максимальна среди всех редкоземельных элементов. Благодаря эффекту лантаноидного сжатия среди всех лантаноидов лютеций имеет наименьшие атомный и ионный радиусы.
Химические свойства
При комнатной температуре на воздухе лютеций покрывается плотной оксидной плёнкой, при температуре 400 °C окисляется. При нагреве взаимодействует с галогенами, серой и другими неметаллами.
Лютеций реагирует с неорганическими кислотами с образованием солей. При упаривании водорастворимых солей лютеция (хлоридов, сульфатов, ацетатов, нитратов) образуются кристаллогидраты.
При взаимодействии водных растворов солей лютеция с фтороводородной кислотой образуется очень малорастворимый осадок фторида лютеция LuF3. Это же соединение можно получить при реакции оксида лютеция Lu2O3 с газообразным фтороводородом или фтором.
Гидроксид лютеция образуется при гидролизе его водорастворимых солей.
Аналитическое определение
Как и другие редкоземельные элементы, может быть определён фотометрически с реагентом ализариновый красный С.
Применение
Носители информации
Феррогранаты, допированные лютецием (например, гадолиний-галлиевый гранат, GGG), используются для производства носителей информации на ЦМД (цилиндрических магнитных доменах).
Лазерные материалы
Используется для генерации лазерного излучения на ионах лютеция. Скандат лютеция, галлат лютеция, алюминат лютеция, легированные гольмием и тулием, генерируют излучение с длиной волны 2,69 мкм, а ионами неодима — 1,06 мкм, и являются превосходными материалами для производства мощных лазеров военного назначения и для медицины.
Магнитные материалы
Сплавы для очень мощных постоянных магнитов систем лютеций-железо-алюминий и лютеций-железо-кремний обладают очень высокой магнитной энергией, стабильностью свойств и высокой точкой Кюри, но очень высокая стоимость лютеция ограничивает их применение только наиболее ответственными областями использования (специальные исследования, космос и др.).
Жаропрочная проводящая керамика
Некоторое применение находит хромит лютеция.
Ядерная физика и энергетика
Оксид лютеция находит небольшое по объему применение в атомной технике как поглотитель нейтронов, а также в качестве активационного детектора. Монокристаллический силикат лютеция (LSO), допированный церием, является очень хорошим сцинтиллятором и в этом качестве используется для детектирования частиц в ядерной физике, физике элементарных частиц, ядерной медицине (в частности, в позитрон-эмиссионной томографии).
Высокотемпературная сверхпроводимость
Оксид лютеция применяется для регулирования свойств сверхпроводящих металлооксидных керамик.
Металлургия
Добавление лютеция к хрому и его сплавам придает лучшие механические характеристики и улучшает технологичность.
В последние годы значительный интерес к лютецию обусловлен, например, тем, что при легировании лютецием ряда жаростойких материалов и сплавов на хромоникелевой основе резко возрастает их срок службы.
Изотопы
Природный лютеций состоит из двух изотопов: стабильного 175 Lu (изотопная распространённость 97,41 %) и долгоживущего бета-радиоактивного 176 Lu (изотопная распространённость 2,59 %, период полураспада 3,78⋅10 10 лет), который распадается в стабильный гафний-176. Радиоактивный 176 Lu используется в одной из методик ядерной гео- и космохронологии (лютеций-гафниевое датирование). Известны также 32 искусственных радиоизотопа лютеция (от 150 Lu до 184 Lu), у некоторых из них обнаружены метастабильные состояния (общим числом 18).
| Энергия возбуждения | |||||
|---|---|---|---|---|---|
| Символ нуклида | Z(p) | N(n) | Масса изотопа (а. е. м.) | Период полураспада (T1/2) | Спин и чётность ядра |
| 150 Lu | 71 | 79 | 149,97323 | 43 мс | 2+ |
| 151 Lu | 71 | 80 | 150,96758 | 80,6 мс | 11/2- |
| 152 Lu | 71 | 81 | 151,96412 | 650 мс | 5- |
| 153 Lu | 71 | 82 | 152,95877 | 900 мс | 11/2- |
| 154 Lu | 71 | 83 | 153,95752 | 1 с | 2- |
| 155 Lu | 71 | 84 | 154,954316 | 68,6 мс | 11/2- |
| 156 Lu | 71 | 85 | 155,95303 | 494 мс | 2- |
| 157 Lu | 71 | 86 | 156,950098 | 6,8 с | 1/2+ |
| 158 Lu | 71 | 87 | 157,949313 | 10,6 с | 2- |
| 159 Lu | 71 | 88 | 158,94663 | 12,1 с | 1/2+ |
| 160 Lu | 71 | 89 | 159,94603 | 36,1 с | 2- |
| 161 Lu | 71 | 90 | 160,94357 | 77 с | 1/2+ |
| 162 Lu | 71 | 91 | 161,94328 | 1,37 мин | 1- |
| 163 Lu | 71 | 92 | 162,94118 | 3,97 мин | 1/2+ |
| 164 Lu | 71 | 93 | 163,94134 | 3,14 мин | 1- |
| 165 Lu | 71 | 94 | 164,939407 | 10,74 мин | 1/2+ |
| 166 Lu | 71 | 95 | 165,93986 | 2,65 мин | 6- |
| 167 Lu | 71 | 96 | 166,93827 | 51,5 мин | 7/2+ |
| 168 Lu | 71 | 97 | 167,93874 | 5,5 мин | 6- |
| 169 Lu | 71 | 98 | 168,937651 | 34,06 ч | 7/2+ |
| 170 Lu | 71 | 99 | 169,938475 | 2,012 сут | 0+ |
| 171 Lu | 71 | 100 | 170,9379131 | 8,24 сут | 7/2+ |
| 172 Lu | 71 | 101 | 171,939086 | 6,70 сут | 4- |
| 173 Lu | 71 | 102 | 172,9389306 | 1,37 лет | 7/2+ |
| 174 Lu | 71 | 103 | 173,9403375 | 3,31 лет | 1- |
| 175 Lu | 71 | 104 | 174,9407718 | стабилен | 7/2+ |
| 176 Lu | 71 | 105 | 175,9426863 | 3,85⋅10 10 лет | 7- |
| 177 Lu | 71 | 106 | 176,9437581 | 6,6475 дня | 7/2+ |
| 178 Lu | 71 | 107 | 177,945955 | 28,4 мин | 1+ |
| 179 Lu | 71 | 108 | 178,947327 | 4,59 ч | 7/2+ |
| 180 Lu | 71 | 109 | 179,94988 | 5,7 мин | 5+ |
| 181 Lu | 71 | 110 | 180,95197 | 3,5 мин | 7/2+ |
| 182 Lu | 71 | 111 | 181,95504 | 2,0 мин | 1 |
| 183 Lu | 71 | 112 | 182,95757 | 58 с | 7/2+ |
| 184 Lu | 71 | 113 | 183,96091 | 20 с | 3+ |
Распространённость в природе
Содержание в земной коре — 0,00008 % по массе. Содержание в морской воде — 0,0000012 мг/л. Основные промышленные минералы — ксенотим, эвксенит, бастнезит.
Лютеций в честь чего
Как кельты не могли предположить, что в честь их поселения на берегу современной Сены будет назван крупный астероид из главного пояса и самый последний химический элемент из семейства лантаноидов, так и сам первооткрыватель этого элемента вряд ли мог предположить, как и где его можно будет использовать. Но древняя Лютеция впоследствии стала Парижем, космический зонд «Розетта» на пути к комете Чурюмова — Герасименко сделал подробные снимки уже астероида Лютеции, а исследователи нашли применение даже такому необычному химическому элементу, как лютеций. А вы вообще знали о его существовании?
Париж мог бы называться и Лютецией. Фото: Daniel Vorndran / DXR CC BY-SA 3.0
Лютеций был открыт в 1907 году, и, как это часто бывает, не одним исследователем, а сразу несколькими. Француз Жорж Урбэн, австриец Карл Ауэр фон Вельсбах и американец Чарльз Джеймс, как это часто бывает, независимо и почти одновременно сообщили о заполнении ещё одной пустой ячейки Периодической таблицы. Поскольку элемент был назван в честь старого названия Парижа, то нетрудно догадаться, кому в итоге отдали приоритет открытия. Лютеций принадлежит к группе химических элементов, которых называют лантаниды или лантаноиды, кому как больше нравится. Большинство из них в природе встречаются относительно редко, по крайней мере, так считали в девятнадцатом веке, поэтому за этими и ещё за несколькими другими элементами закрепилось название «редкоземельные». Основная сложность в их обнаружении была даже не в том, что они редкие, а в том, что они очень похожи друг на друга по своим химическим свойствам. Поэтому отделить примесь лютеция от, скажем, иттербия – это сложнее, чем отличить фотографии двух автомобилей, сошедших друг за другом с конвейера. Но химики научились делать не только это, но и ещё множество удивительных вещей. Правда не без помощи физиков и учёных из других областей наук.
Лютеций, хоть и выглядит как серый и непрезентабельный на вид металл, но стоит лишь в четыре раза дешевле золота. Фото: W.Oelen / Wikimedia Commons CC BY-SA 3.0
Например, одно из соединений лютеция с немного пугающим названием «допированный церием оксиортосиликат лютеция» используется в современном методе клинической диагностики – позитронно-эмиссионной томографии. Если вам когда-нибудь попадалась на глаза хотя бы одна серия телевизионного сериала Доктор Хаус, то наверняка слышали про «КТ, МРТ», которые делали каждому пациенту, даже быстрее, чем анализ крови. Но если магнито-резонансная и компьютерная томографии у всех на слуху и есть во многих медицинских центрах, то позитронно-эмиссионная томография не так широко распространена. Тем не менее, этот метод очень интересен и с медицинской и с физической точки зрения. Поэтому вкратце расскажем, как он устроен и какую роль в нём занимает лютеций.
ПЭТ-КТ томограф. Фото: Partynia/Wikimedia Commons CC BY-SA 4.0
Из названия этого вида томографии следует, что в нём как-то замешаны позитроны. Позитрон – это частичка самой настоящий антиматерии. По своим свойствам позитрон аналогичен электрону, только в отличие от электрона он несёт положительный заряд. Как обычная материя, так и антиматерия, хорошо живут сами по себе, но если они встречаются друг с другом, то происходит аннигиляция – исходные частицы пропадают, рождая новые частицы и энергию. Один из вариантов аннигиляции позитрона и электрона – это рождение двух гамма-квантов, которые разлетаются в точности в противоположные стороны. Поэтому если место, где существуют позитроны и электроны, окружить множеством детекторов, тогда можно будет фиксировать моменты их аннигиляции. Если в один и тот же момент два противоположных детектора зафиксировали попадания гамма-квантов, значит, мы наблюдали самую настоящую аннигиляцию. Но откуда внутри человека взяться антиматерии, коль скоро мы обсуждаем реальную жизнь, а не сюжеты фантастических комиксов?
Внутреннее устройство ПЭТ-КТ томографа. Фото: Rum Bucolic Ape/Flickr.com CC BY-ND 2.0
Позитроны могут образоваться при радиоактивном распаде некоторых изотопов, например, кислород-15, углерод-11 или фтор-18. Период их полураспада составляет от нескольких минут до нескольких часов, так что долгожителями их никак не назовёшь. Получают их обычно на ускорителях, поэтому и использовать эти изотопы нужно, что называется, не отходя от кассы, а точнее от какого-нибудь циклотрона. После чего сразу же синтезировать биологически активное вещество, содержащее эти изотопы, ввести его в организм пациента, а пациента поместить в томограф. Вещество накапливается в определённых интересующих врачей тканях организма, изотопы распадаются с образованием позитронов, позитроны аннигилируют с электронами, гамма-кванты разлетаются в разные стороны, и вот тут наконец-то на арену выходит оксиортосиликат лютеция.
Для регистрации гамма-квантов применяют сцинтилляционные кристаллы. Чем чувствительнее будет кристалл к гамма излучению от аннигиляции позитронов и электронов, тем более точным будет трёх-мерное изображение внутреннего органа или тканей, получаемое при томографическом исследовании. Один из лучших материалов для таких кристаллов, как вы уже догадались, это тот самый оксиортосиликат лютеция с добавками других редкоземельных элементов. На практике позитронно-эмиссионный томограф очень часто комбинируется с другими видами томографии, в первую очередь компьютерной томографии, поэтому и метод исследования часто называется ПЭТ-КТ, хотя от простого КТ он очень сильно отличается, хотя бы тем, что внутри пациента на доли мгновения образуется самая настоящая антиматерия.
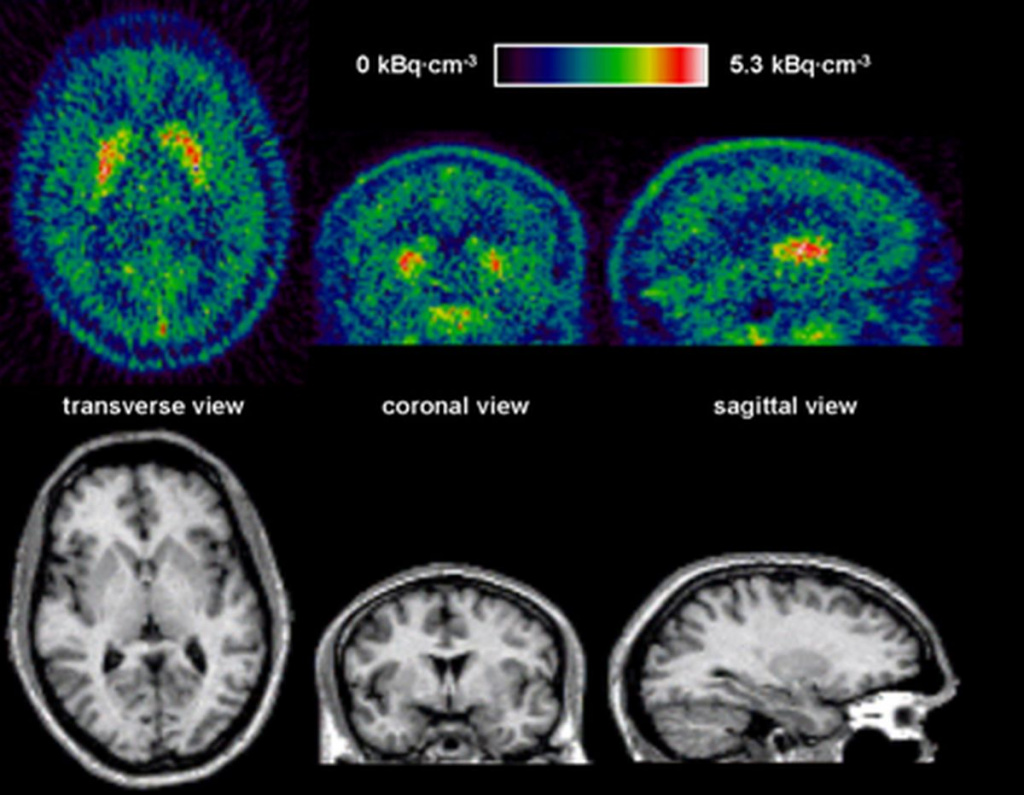
Распределение аденозиновых рецепторов в мозге живого человека, полученное с помощью ПЭТ и изотопа 11C. Фото: Grachev ID, Doder M, Brooks DJ, Hinz R. /Journal of Diagnostic Imaging in Therapy CC BY-SA 2.0
Другое применение лютеция также напрямую связано с медициной и лечением онкологических заболеваний, правда, на этот раз элемент действует не снаружи, а уже внутри организма пациента. Клетки одного из видов опухолей (нейроэндокринных) имеют на своих мембранах специфические структуры, которые называются соматостатиновые рецепторы, причём их количество намного больше, чем у нормальных здоровых клеток. Чтобы источник бета-излучения, роль которого выполняет изотоп лютеция-177 доставить напрямую к опухолевым клеткам, его можно химически связать с молекулой, похожей на соматостатин, которая как ключ к замку «подходит» к соматостатиновым рецепторам. Такой комплекс из пептидной молекулы и изотопа лютеция называется 177Lu-DOTA-TATE или Lutathera, а сам метод – пептидная рецепторная радионуклидная терапия. Вдобавок к тому, что изотоп лютеция-177 в связке с пептидом убивает клетки опухоли бета-излучением, он ещё служит источником гамма-излучения, позволяя увидеть, где находится препарат, и визуализировать саму опухоль с помощью ПЭТ-КТ, о которой мы как раз рассказывали парой абзацев выше. Как говорится, два в одном.
Контейнер для радиофармпрепаратов. Фото: Dean Calma / IAEA CC BY-SA 2.0
И напоследок о вечном, а точнее об использовании лютеция в геохронологии для определения возраста горных пород или других интересных объектов. Если период полураспада изотопа лютеция-177 составляет порядка недели, то вот другой изотоп этого же самого элемента распадается сильно медленнее. Лютеций-176, в ядре которого меньше всего лишь на один нейтрон, имеет период полураспада ни много ни мало около 37 миллиардов лет, что почти втрое больше чем возраст Вселенной! Поэтому, измеряя концентрации лютеция и элемента, в который он превращается, – гафния, можно измерять временные промежутки и исследовать процессы соответствующего временного масштаба, например, установить, когда образовались те или иные горные породы на нашей планете.
Несмотря на то что с лютецием в обычной жизни можно встретиться лишь при довольно специфических и, что уж говорить, не всегда радостных обстоятельствах, этот элемент, если так можно выразиться, старается показать лучшее, на что он способен, помогая лечить людей и удовлетворять научный интерес исследователей.
Минерал гранат обладает высоким сродством к редкоземельным элементам, поэтому он хорошо подходит для лютеций-гафниевого метода определения возраста. Фото: Lech Darski/Wikimedia Commons CC BY-SA 3.0
Лютеций
Происхождение названия
Фон Вельсбах предложил для лютеция название кассиопий (cassiopium) в честь созвездия, для иттербия — альдебараний (aldebaranium) в честь звезды Альдебаран. Однако, учитывая приоритет Урбена в разделении лютеция и иттербия, предложения фон Вельсбаха не были приняты. Тем не менее до начала 1960-х годов немецкие учёные употребляли в своих работах название кассиопий.
Получение
Отделение лютеция от других лантаноидов ведут методами экстракции, ионного обмена или дробной кристаллизацией.
Цена металлического лютеция чистотой >99,9% составляет 3.5-5.5 тыс. долл за 1 кг. Лютеций является самым дорогим из существующих в природе редкоземельных элементов, что обусловлено трудностью его выделения из смеси РЗЭ и ограниченностью использования.
Свойства
Физические свойства
Твёрдый блестящий металл, может быть прокатан в упругую фольгу. Лютеций является самым тяжёлым элементом среди лантаноидов как по атомному весу, так и по плотности (9,8404 г/см 3 ). Кроме того, температура плавления лютеция (1663°C) максимальна среди всех редкоземельных элементов. Благодаря эффекту лантаноидного сжатия, среди всех лантаноидов лютеций имеет наименьший радиус иона.
Химические свойства
Очень медленно окисляется на воздухе, длительное время сохраняя блеск.
Бромид лютеция(III) (кристаллогидрат) имеет розовый цвет, хорошо растворим в воде.
С солями фтороводородной кислоты образует очень мало растворимый осадок фторида лютеция.
Со щелочами образует нерастворимый гидроксид.
Аналитическое определение
Как и другие РЗЭ, может быть определён фотометрически с реагентом ализариновый красный С
Применение
Носители информации
Феррогранаты, допированные лютецием (например, гадолиний-галлиевый гранат, GGG), используются для производства носителей информации на ЦМД (цилиндрических магнитных доменах).
Лазерные материалы
Используется для генерации лазерного излучения на ионах лютеция. Скандат лютеция, галлат лютеция, алюминат лютеция, легированные гольмием и тулием, генерируют излучение с длиной волны 2,69 мкм, а ионами неодима 1,06 мкм, и являются превосходными материалами для производства мощных лазеров военного назначения и для медицины.
Магнитные материалы
Сплавы для очень мощных постоянных магнитов систем лютеций-железо-алюминий и лютеций-железо-кремний обладают очень высокой магнитной энергией, стабильностью свойств и высокой точкой Кюри, но очень высокая стоимость лютеция ограничивает их применение только наиболее ответственными областями использования (специальные исследования, космос и др).
Жаропрочная проводящая керамика
Некоторое применение находит хромит лютеция.
Ядерная физика и энергетика
Оксид лютеция находит небольшое по объему применение в атомной технике как поглотитель нейтронов, а также в качестве активационного детектора. Монокристаллический силикат лютеция (LSO), допированный церием, является очень хорошим сцинтиллятором и в этом качестве используется для детектирования частиц в ядерной физике, физике элементарных частиц, ядерной медицине (в частности, в позитрон-эмиссионной томографии).
Высокотемпературная сверхпроводимость
Металлургия
Добавление лютеция к хрому и его сплавам придает лучшие механические характеристики и улучшает технологичность.
В последние годы значительный интерес к лютецию обусловлен, например, тем, что при легировании лютецием ряда жаростойких материалов и сплавов на хромоникелевой основе резко возрастает их срок службы.
Изотопы
Природный лютеций состоит из двух изотопов: стабильного 175 Lu (изотопная распространённость 97,41%) и долгоживущего бета-радиоактивного 176 Lu (изотопная распространённость 2,59%, период полураспада 3,78×10 10 лет), который распадается в стабильный гафний-176. Радиоактивный 176 Lu используется в одной из методик ядерной гео- и космохронологии (лютеций-гафниевое датирование). Известны также 32 искусственных радиоизотопа лютеция (от 150 Lu до 184 Lu), у некоторых из них обнаружены метастабильные состояния (общим числом 18).
Распространённость в природе
Содержание в земной коре 0,00008% по массе. Содержание в морской воде 0,000 0012 мг/л. Основные промышленные минералы — ксенотим, эвксенит, бастнезит.
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород | 2 He Гелий | ||||||||||||||||
| 2 | 3 Li Литий | 4 Be Бериллий | 5 B Бор | 6 C Углерод | 7 N Азот | 8 O Кислород | 9 F Фтор | 10 Ne Неон | ||||||||||
| 3 | 11 Na Натрий | 12 Mg Магний | 13 Al Алюминий | 14 Si Кремний | 15 P Фосфор | 16 S Сера | 17 Cl Хлор | 18 Ar Аргон | ||||||||||
| 4 | 19 K Калий | 20 Ca Кальций | 21 Sc Скандий | 22 Ti Титан | 23 V Ванадий | 24 Cr Хром | 25 Mn Марганец | 26 Fe Железо | 27 Co Кобальт | 28 Ni Никель | 29 Cu Медь | 30 Zn Цинк | 31 Ga Галлий | 32 Ge Германий | 33 As Мышьяк | 34 Se Селен | 35 Br Бром | 36 Kr Криптон |
| 5 | 37 Rb Рубидий | 38 Sr Стронций | 39 Y Иттрий | 40 Zr Цирконий | 41 Nb Ниобий | 42 Mo Молибден | (43) Tc Технеций | 44 Ru Рутений | 45 Rh Родий | 46 Pd Палладий | 47 Ag Серебро | 48 Cd Кадмий | 49 In Индий | 50 Sn Олово | 51 Sb Сурьма | 52 Te Теллур | 53 I Иод | 54 Xe Ксенон |
| 6 | 55 Cs Цезий | 56 Ba Барий | * | 72 Hf Гафний | 73 Ta Тантал | 74 W Вольфрам | 75 Re Рений | 76 Os Осмий | 77 Ir Иридий | 78 Pt Платина | 79 Au Золото | 80 Hg Ртуть | 81 Tl Таллий | 82 Pb Свинец | 83 Bi Висмут | (84) Po Полоний | (85) At Астат | 86 Rn Радон |
| 7 | 87 Fr Франций | 88 Ra Радий | ** | (104) Rf Резерфордий | (105) Db Дубний | (106) Sg Сиборгий | (107) Bh Борий | (108) Hs Хассий | (109) Mt Мейтнерий | (110) Ds Дармштадтий | (111) Rg Рентгений | (112) Cp Коперниций | (113) Uut Унунтрий | (114) Uuq Унунквадий | (115) Uup Унунпентий | (116) Uuh Унунгексий | (117) Uus Унунсептий | (118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний | (120) Ubn Унбинилий | ||||||||||||||||
| Лантаноиды * | 57 La Лантан | 58 Ce Церий | 59 Pr Празеодим | 60 Nd Неодим | (61) Pm Прометий | 62 Sm Самарий | 63 Eu Европий | 64 Gd Гадолиний | 65 Tb Тербий | 66 Dy Диспрозий | 67 Ho Гольмй | 68 Er Эрбий | 69 Tm Тулий | 70 Yb Иттербий | 71 Lu Лютеций | |||
| Актиноиды ** | 89 Ac Актиний | 90 Th Торий | 91 Pa Протактиний | 92 U Уран | (93) Np Нептуний | (94) Pu Плутоний | (95) Am Америций | (96) Cm Кюрий | (97) Bk Берклий | (98) Cf Калифорний | (99) Es Эйнштейний | (100) Fm Фермий | (101) Md Менделевий | (102) No Нобелей | (103) Lr Лоуренсий | |||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда