Магний что это в химии
Магний: способы получения и химические свойства
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Химические свойства
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Магний (Mg, Magnesium)
История магния
Магний в виде металла был впервые получен Гемфри Дэви в 1808 году. Английский химик проводил процесс электролиза между влажной смесью белой магнезии и оксидом ртути, в результате чего получил сплав ртути с неизвестным металлом (амальгаму). После выгонки ртути Дэви получил новое вещество – порошок металла, который был назван магнием (calorizator). Через два десятилетия, в 1828 году француз А.Бюсси получил чистый металлический магний.
Общая характеристика магния
Магний является элементом главной подгруппы II группы III периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 12 и атомную массу 24,305. Принятое обозначение – Mg (от латинского Magnesium).
Нахождение в природе
По количеству содержания в земной коре магний занимает 8-е место среди минеральных веществ, он очень распространён. Природными источниками магния являются морская вода, ископаемые минеральные отложения и рассолы.
Физические и химические свойства
Магний является лёгким и ковким металлом, его цвет – серебристо-белый с явным металлическим блеском. В обычном состоянии покрыт плёнкой оксида магния, которую можно разрушить, нагрев металл до 600-650˚С. Магний сгорает, выделяя ослепительно белое пламя и образуя оксид и нитрид магния.
Суточная потребность в магнии
Суточная потребность в магнии зависит от возраста, пола и физического состояния человека. Для здорового взрослого человека составляет от 400 до 500 мг.
Продукты питания богатые магнием
В продуктах питания содержится различное количество магния, расположим их по мере убывания содержания полезного микроэлемента:
Усвояемость магния
Всасывание органических соединений магния в основном происходит в двенадцатиперстной и толстой кишках, при чрезмерном употреблении кофеина, алкоголя и калия организм теряет значительную часть магния с мочой.
Взаимодействие с другими
Для организма важен баланс между кальцием и магнием, потому что именно эти минералы отвечают за нормальное состояние костной ткани и зубов. В аптечных витаминно-минеральных комплексах количество кальция и магния содержится в оптимальных количествах.
Натрий, магний и фосфор регулируют процессы в нервной системе и отвечают за мышечную активность. Обменные процессы магния в организме происходят с помощью витаминов В6, D, Е и калия.
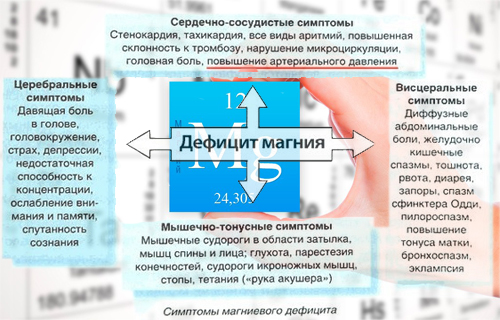
Признаки нехватки магния
Нехватку магния в организме могут вызвать болезни почек, расстройство желудка, приём мочегонных средств и некоторых контрацептивов, чрезмерное увлечение алкоголем и кофеином. Признаками нехватки магния считают бессонницу, раздражительность, головокружения, нарушения сердцебиения и скачки кровяного давления, частые головные боли, чувство усталости, мерцающие точки перед глазами, судороги, мышечные спазмы, выпадение волос.
Признаки избытка магния
Признаками избытка магния считают:
Полезные свойства магния и его влияние на организм
Магний важен для эффективного функционирования нервов и мышц, важен для превращения сахара крови в энергию. Магний поддерживает здоровое состояние зубов, помогает предупредить отложения кальция, камни в почках и желчном пузыре, приносит облегчение при несварении. Организм человека содержит приблизительно 21 г магния.
Магний нормализует деятельность сердечно-сосудистой и эндокринной систем организма, функции головного мозга, оказывает помощь при выведении токсинов и тяжёлых металлов.
Применение магния в жизни
Соединения магния (сплавы) используются в самолётостроении и автомобильном производстве из-за прочности и лёгкости магниевых сплавов. Магний применяется как химический источник тока, в медицине, военном деле, в фотографии.
Магний как химический элемент таблицы Менделеева
Как был открыт Магний
История открытия магния началась уже в древние времена. В Магнезии (современная Греция) были обнаружены два черных минерала. Им дали название «магнезы» — по месту их обнаружения. В те времена их считали «разнополыми металлами». Магний приняли за минерал мужского пола, так как он притягивал металлы. А марганец женского пола за способность обесцвечивать стекло. Сейчас сложно определить как о нем стало известно в те времена, но в 17 веке магний уже был распространен повсеместно из-за его целебных свойств. В 1618 году фермер из Эпсома в Англии попытался дать коровам воду из колодца. Коровы отказались пить из-за горького вкуса воды, но фермер заметил, что вода словно исцеляет царапины и сыпь. Вещество стало известно как соли Эпсома и его слава распространилась по всей Европе. Это вещество было в конечном счете признано гидратированным сульфатом магния.
Отделить магний из минерала удалось только в 1808 году. Английский ученый Хэмфри Дэви методом электролиза смог выделить чистый магний из магнетита и оксида ртути. Как оказалось позже, ему удалось выделить не чистый элемент, а только оксид магния. В 1828 году французский химик Антуан Бюсси смог произвести небольшое количество чистого магния, нагревая сухой хлорид магния с калием в качестве восстановителя. В 1833 году Майкл Фарадей первым стал производить магний электролизом расплавленного хлорида магния. Основываясь на этих экспериментах, немецкий химик Роберт Вильгельм Бунзен работал в 1840-х и 1850-х годах над процессами производства магния электролизом расплавленных солей с использованием разработанного им метода Бунзена. В 1852 году он разработал электролизер для производства большого количества магния из расплавленного безводного хлорида магния. На сегодняшний день, этот способ является предпочтительным для производства магния.
Где и как добывают Магний
Ежегодная добыча магния составляет около миллиона тонн. Основными поставщиками магния являются Китай, Россия и США. При этом на Китай приходится порядка 80% от этого числа, а на Россию 15% и соответственно США около 5%. Добыча магния осуществляется и в других странах, но она в сравнении является незначительной.
Магний в основном добывается двумя способами. Первый заключается в электролизе расплава расплавленного хлорида магния в ячейках Даунса. Ячейки Даунса состоят из больших железных желобов, которые нагреваются снизу. В качестве анодов служат графитовые стержни. Образующийся газообразный хлор собирается в верхней части ячейки и снова используется для производства хлорида магния из оксида магния. Кальций и хлорид натрия добавляют к расплавленной соли, чтобы понизить температуру плавления хлорида магния.
Вторым способом на сегодняшний день пользуется Китай и производит около 80% от общего объема магния.
Распространенность Магния
Что касается распространенности этого химического элемента во Вселенной, то тут можно отметить, что этот химический элемент является довольно распространенным. Он самовоспроизводится в крупных стареющих звездах в результате добавления трех ядер гелия в ядро углерода. Когда такие звезды взрываются как сверхновые, большая часть магния выбрасывается в межзвездную среду. Там уже соответственно магний может перебраться в другую звездную систему. Поэтому магний занимает почетное девятое место по распространенности во Вселенной.
Что же касается Земли, то тут можно отметить, что магний занимает четвертое место. Его опережают только железо, кислород и кремний. На долю магния приходится 13% от массы нашей планеты. Что же касается земной коры, то он занимает восьмое место по массе атомов. Если брать элементы растворенные в мировом океане, тот тут он замыкает тройку лидеров, после натрияя и хлора.
В природе в чистом виде он не встречается из-за высокой реакционной способности. По большей своей части он встречается в виде сульфатов, карбонатов, силикатов и хлоридов. Наиболее значимыми магнийсодержащими минералами являются доломит, магнезит, оливин, энстатит и кизерит. Еще к довольно известным минералам относят серпентин, тальк, сепиолит и карналлит.
Применение Магния
Применение магния очень широкое благодаря его легкодоступности и нетоксичности. Он затрагивает многие отрасли начиная от технических и заканчивая медициной. Технические подразумевают собой автомобиле строение, военно-космический комплекс, электронные устройства и многие другие. В автомобилестроении из магния изготавливаются многие части двигателя внутреннего сгорания. В военно-космическом комплексе множество частей шатлов и ракетных установок. Все это благодаря маленькому весу и высокой прочности некоторых сплавов. В электронике нет ни одного устройства в котором бы не содержался бы магний. Банально мобильные телефоны, планшеты и ноутбуки имеют в своем составе печатные платы, динамики процессоры, которые изготавливаются с примесями магния.
Так же стоит отметить металлургическую промышленность. В сплавах многих коммерчески важных металлов присутствует примесь магния. Еще магний используется в качестве восстановителя при отделении урана, титана и разного рода солей. Так же можно добавить, что магниевая примесь используется в качестве легирующего металла при производстве алюминия.
В химической промышленности магний используется при изготовлении удобрений, чтобы компенсировать недостаток магния в почве. Так же некоторые соединения магния используются в качестве присадок к различным видам технических жидкостей и многое другое.
Интересные факты
Интересных фактов связанных с магнием достаточно много из-за широкого круга использования. Стоит начать с того, что магний является неотъемлемой частью жизни на Земле и для человека в том числе. Этот химический элемент является чрезвычайно важным для нормального функционирования человеческого организма из-за его влияния на белки ферментных реакциях.
Кроме всего вышеперечисленного не стоит забывать, что магниевая стружка является взрывоопасным веществом. Причем магниевая пыль может самовоспламениться в воздухе. Еще интересным моментом является то, что на сегодняшний день известен 21 изотоп магния, что довольно-таки немало и причем стабильных из них только 3.
Магний
| Магний | |
|---|---|
| лёгкий, ковкий, серебристо-белый металл | |
 | |
| Название, символ, номер | Магний / Magnesium (Mg), 12 |
| Атомная масса (молярная масса) | [24,304; 24,307]а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s 2 |
| Радиус атома | 160 пм |
| Ковалентный радиус | 136 пм |
| Радиус иона | 66 (+2e) пм |
| Электроотрицательность | 1,31 (шкала Полинга) |
| Электродный потенциал | −2,37 В |
| Степени окисления | 0; +2 |
| Энергия ионизации (первый электрон) | 737,3 (7,64) кДж/моль (эВ) |
| Плотность (при н. у.) | 1,738 г/см³ |
| Температура плавления | 650 °C (923 K) |
| Температура кипения | 1090 °C (1363 K) |
| Уд. теплота плавления | 9,20 кДж/моль |
| Уд. теплота испарения | 131,8 кДж/моль |
| Молярная теплоёмкость | 24,90 Дж/(K·моль) |
| Молярный объём | 14,0 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a=0,32029 нм, c=0,52000 нм |
| Отношение c/a | 1,624 |
| Температура Дебая | 318 K |
| Теплопроводность | (300 K) 156 Вт/(м·К) |
| Номер CAS | 7439-95-4 |
Магний — элемент второй группы (по старой классификации — главной подгруппы второй группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg (лат. Magnesium ). Простое вещество магний — лёгкий, ковкий металл серебристо-белого цвета.
Содержание
История открытия
В 1695 году из минеральной воды Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и слабительным действием. Аптекари назвали её «горькой солью», а также «английской» или «эпсомской солью». Минерал эпсомит представляет собой кристаллогидрат сульфата магния и имеет химическую формулу MgSO4 · 7H2O. Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
В 1792 году Антон фон Рупрехт выделил из белой магнезии восстановлением углём неизвестный металл, названный им австрием. Позже было установлено, что «австрий» представляет собой магний крайне низкой степени чистоты, поскольку исходное вещество было сильно загрязнено железом.
В 1808 г. английский химик Гемфри Дэви с помощью электролиза увлажнённой смеси магнезии и оксида ртути получил амальгаму неизвестного металла, которому дал название «магнезиум», сохранившееся до сих пор во многих странах. В России с 1831 года принято название «магний». В 1829 г. французский химик А. Бюсси получил магний, восстанавливая его расплавленный хлорид металлическим калием. В 1830 г. М. Фарадей получил магний электролизом расплавленного хлорида магния.
Изотопы
Природный магний состоит из смеси 3 стабильных изотопов 24 Mg, 25 Mg и 26 Mg с молярной концентрацией в смеси 78,6 %, 10,1 % и 11,3 % соответственно.
Все остальные 19 изотопов нестабильны, самый долгоживущий из них 28 Mg с периодом полураспада 20,915 часов.
Нахождение в природе
Кларк магния — 1,95 % (19,5 кг/т). Это один из самых распространённых элементов земной коры. Большие количества магния находятся в морской воде в виде раствора солей. Основные минералы с высоким массовым содержанием магния:
Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озёр. Месторождения карналлита осадочного происхождения имеются во многих странах.
Магнезит образуется преимущественно в гидротермальных условиях и относящихся к среднетемпературным гидротермальным месторождениям. Доломит также является важным магниевым сырьём. Месторождения доломита широко распространены, запасы их огромны. Они генетически связаны с карбонатными осадочными слоями и большинство из них имеет докембрийский или пермский геологический возраст. Доломитовые залежи образуются осадочным путём, но могут возникать также при воздействии на известняки гидротермальных растворов, подземных или поверхностных вод.
Чрезвычайно редким минералом является самородный магний, образующийся в потоках восстановительных газов и впервые обнаруженный в 1991 году в береговых отложениях Чоны (Восточная Сибирь), а затем в лавах в Южном Гиссаре (Таджикистан).
Природные источники магния
В 1995 г. бо́льшая часть мирового производства магния была сосредоточена в США (43 %), странах СНГ (26 %) и Норвегии (17 %), на рынке возрастает доля Китая.
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
Расплавленный металл периодически отбирают из электролизной ванны, а в неё добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много (около 0,1 %) примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые удаляют примеси из магния или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции, вначале производят обжиг доломита:
Затем сильный нагрев с кремнием:
2MgO + CaO + Si → CaSiO3 + 2Mg
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
Физические свойства
Магний — металл серебристо-белого цвета с гексагональной решёткой, обладает металлическим блеском; пространственная группа P 63/mmc, параметры решётки a = 0,32029 нм, c = 0,52000 нм, Z = 2. При обычных условиях поверхность магния покрыта довольно прочной защитной плёнкой оксида магния MgO, которая разрушается при нагреве на воздухе до примерно 600 °C, после чего металл сгорает с ослепительно белым пламенем с образованием оксида и нитрида магния Mg3N2. Скорость воспламенения магния намного выше скорости одёргивания руки, поэтому при поджоге магния человек не успевает одёрнуть руку и получает ожог. На горящий магний желательно смотреть только через темные очки или стекло, так как в противном случае есть риск получить световой ожог сетчатки и на время ослепнуть.
Плотность магния при 20 °C — 1,738 г/см³, температура плавления 650 °C, температура кипения 1090 °C, теплопроводность при 20 °C — 156 Вт/(м·К).
Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.
Фазовый переход в сверхпроводящее состояние
При температуре Тс= 0,0005 К магний (Mg) переходит в сверхпроводящее состояние.
Химические свойства
При нагревании на воздухе магний сгорает с образованием оксида и небольшого количества нитрида. При этом выделяется большое количество теплоты и света:
Магний хорошо горит даже в углекислом газе:
Раскаленный магний энергично реагирует с водой, вследствие чего горящий магний нельзя тушить водой:
Mg + H2O → MgO + H2 + 75 kcal
Возможна также реакция:
Щелочи на магний не действуют, в кислотах он растворяется с бурным выделением водорода:
Смесь порошка магния со взрывом реагирует с сильными окислителями, например с сухим перманганатом калия.
Также следует упомянуть реактивы Гриньяра, то есть алкил- или арилмагнийгалогениды:
RHal + Mg → (C2H5)2O RMgHal
Где Hal = I, Br, реже Cl.
Металлический магний — сильный восстановитель, применяется в промышленности для восстановления титана до металла из тетрахлорида титана и металлического урана из его тетрафторида
Применение
Используется для получения лёгких и сверхлёгких литейных сплавов (самолётостроение, производство автомобилей), а также в пиротехнике и военном деле для изготовления осветительных и зажигательных ракет. Со второй половины XX века магний в чистом виде и в составе сплава кремния с железом — ферросиликомагния, стал широко применяться в чугунолитейном производстве благодаря открытию его свойства влиять на форму графита в чугуне, что позволило создать новые уникальные конструкционные материалы для машиностроения — высокопрочный чугун (чугун с шаровидным графитом — ЧШГ и чугун с вермикулярной формой графита — ЧВГ), сочетающие в себе свойства чугуна и стали.
Сплавы
Сплавы на основе магния являются важным конструкционным материалом в космической, авиационной и автомобильной промышленности благодаря их лёгкости и прочности. Из магниевого сплава изготавливались картеры двигателей бензопилы «Дружба» и автомобиля «Запорожец», ряда других машин. Сейчас из этого сплава производятся легкосплавные колёсные диски.
Химические источники тока
Магний в виде чистого металла, а также его химические соединения (бромид, перхлорат) применяются для производства энергоёмких резервных электрических батарей (например, магний-перхлоратный элемент, серно-магниевый элемент, хлористосвинцово-магниевый элемент, хлорсеребряно-магниевый элемент, хлористомедно-магниевый элемент, магний-ванадиевый элемент и др.) и сухих элементов (марганцево-магниевый элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др.). Химические источники тока на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высокой ЭДС.
Соединения
Гидрид магния — один из наиболее ёмких аккумуляторов водорода, применяемых для его компактного хранения и получения.
Огнеупорные материалы
Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей и специальной футеровки металлургических печей.
Перхлорат магния, Mg(ClO 4)2 — (ангидрон) применяется для глубокой осушки газов в лабораториях, и в качестве электролита для химических источников тока с применением магния.
Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния MgBr2 — в качестве электролита для химических резервных источников тока.
Военное дело
Медицина
Магний является жизненно-важным элементом, который находится во всех тканях организма и необходим для нормального функционирования клеток. Участвует в большинстве реакций обмена веществ, в регуляции передачи нервных импульсов и в сокращении мышц, оказывает спазмолитическое и антиагрегантное действие. Оксид и соли магния традиционно применяются в медицине в кардиологии, неврологии и гастроэнтерологии (аспаркам, сульфат магния, цитрат магния). В то же время, использование солей магния в кардиологии при нормальном уровне ионов магния в крови является недостаточно обоснованным.
Фотография
Магниевый порошок с окисляющими добавками (нитрат бария, перманганат калия, гипохлорит натрия, хлорат калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в химических фотовспышках (магниевая фотовспышка).
Аккумуляторы
Магниево-серные батареи являются одними из самых перспективных, теоретически превосходя ёмкость ионно-литиевых, однако пока эта технология находится на стадии лабораторных исследований в силу непреодолимости некоторых технических препятствий.
Производство
Производство в России сосредоточено на двух предприятиях: г. Соликамск (СМЗ) и г. Березники (АВИСМА). Общая производительность составляет, примерно, 35 тыс. тонн в год.
| Ранг | Страна | Производство (тыс тонн) |
|---|---|---|
| — | Весь мир | 6,970 |
| 1 | Китай | 4,900 |
| 2 | Россия | 400 |
| 3 | Турция | 300 |
| 4 | Испания | 280 |
| 5 | Австрия | 200 |
| 6 | Словакия | 200 |
| 7 | Бразилия | 150 |
| 8 | Австралия | 130 |
| 9 | Греция | 115 |
| 10 | КНДР | 80 |
| 11 | Индия | 60 |
| — | Другие страны | 150 |
Цены на магний в слитках в 2006 году составили в среднем 3 долл./кг. В 2012 году цены на магний составляли порядка 2,8—2,9 долл./кг.
Биологическая роль и токсикология
Токсикология
Соединения магния малотоксичны (за исключением солей таких ядовитых кислот, как синильная, азотистоводородная, плавиковая, хромовая).
Биологическая роль
Магний — один из важных биогенных элементов, в значительных количествах содержится в тканях животных и растений (хлорофиллы). Его биологическая роль сформировалась исторически в период зарождения и развития протожизни на нашей планете в связи с тем, что солевой состав морской воды древней Земли был преимущественно хлоридно-магниевый, в отличие от нынешнего — хлоридно-натриевого.
Магний является кофактором многих ферментативных реакций. Магний необходим для превращения креатинфосфата в АТФ — нуклеотид, являющийся универсальным поставщиком энергии в живых клетках организма. Магний необходим на всех этапах синтеза белка. Он участвует в поддержании нормальной функции нервной системы и мышцы сердца, оказывает сосудорасширяющее действие, стимулирует желчеотделение, повышает двигательную активность кишечника, что способствует выведению из организма холестерина.
Усвоению магния мешают наличие фитина и избыток жиров и кальция в пище. Недостаток магния в организме может проявляться по-разному: бессонница, хроническая усталость, остеопороз, артрит, фибромиалгия, мигрень, мышечные судороги и спазмы, сердечная аритмия, запоры, предменструальный синдром (ПМС). При потливости, частом употреблении слабительных и мочегонных, алкоголя, больших психических и физических нагрузках (в первую очередь при стрессах и у спортсменов) потребность в магнии увеличивается.
Более всего магния содержится в пшеничных отрубях, тыквенных семечках, какао-порошке. К пище, богатой магнием относят также кунжут, отруби, орехи. Однако обилие фитина в этих продуктах делает его малодоступным для усвоения, поэтому только зелёные овощи могут служить надёжным источником магния. Магния совсем мало в хлебе, молочных, мясных и других повседневных продуктах питания современного человека. Суточная норма магния — порядка 300 мг для женщин и 400 мг для мужчин (предполагается, что всасывается около 30 % магния).
При употреблении витаминно-минеральных комплексов, содержащих магний, необходимо помнить, что при чрезмерном его потреблении возможна передозировка, сопровождающаяся снижением артериального давления, тошнотой, рвотой, угнетением центральной нервной системы, снижением рефлексов, изменениями на электрокардиограмме, угнетением дыхания, комой, остановкой сердца, параличом дыхания, анурическим синдромом.
Также следует соблюдать осторожность при приеме магния людям с почечной недостаточностью.
Таблица нормы потребления магния
| Пол | Возраст | Суточная норма потребления магния, мг/день | Верхний допустимый предел, мг/день |
|---|---|---|---|
| Младенцы | от 0 до 6 месяцев | 30 | Не определён |
| Младенцы | от 7 до 12 месяцев | 75 | Не определён |
| Дети | от 1 до 3 лет | 80 | 145 |
| Дети | от 4 до 8 лет | 130 | 240 |
| Дети | от 9 до 13 лет | 240 | 590 |
| Девушки | от 14 до 18 лет | 360 | 710 |
| Юноши | от 14 до 18 лет | 410 | 760 |
| Мужчины | от 19 до 30 лет | 400 | 750 |
| Мужчины | 31 год и старше | 420 | 770 |
| Женщины | от 19 до 30 лет | 310 | 660 |
| Женщины | 31 год и старше | 320 | 670 |
| Беременные женщины | от 14 до 18 лет | 400 | 750 |
| Беременные женщины | от 19 до 30 лет | 350 | 700 |
| Беременные женщины | 31 год и старше | 360 | 710 |
| Кормящие грудью женщины | от 14 до 18 лет | 360 | 710 |
| Кормящие грудью женщины | от 19 до 30 лет | 310 | 660 |
| Кормящие грудью женщины | 31 год и старше | 320 | 670 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs |
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au