Макрофагальный модулятор что это
Макрофагальный модулятор что это
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
В соответствии с «М1/М2» парадигмой выделяют два подтипа активированных макрофагов – классически активированные (М1) и альтернативно активированные (М2), которые экспрессируют различные рецепторы, цитокины, хемокины, факторы роста и эффекторные молекулы. Однако данные последних лет указывают на то, что в ответ на изменение сигналов микроокружения, макрофаги могут проявлять уникальные свойства, не позволяющие отнести их ни к одному из этих подтипов.
Макрофаги играют главную роль в реакции организма на имплантируемый материал – катетеры, стенты, эндопротезы, дентальные имплантаты. Макрофаги фагоцитируют частицы износа поверхности суставных протезов, инициируют воспаление в зоне протезирования и остеолиз, управляют процессами образования фиброзной капсулы вокруг инородных тел. Представлен краткий обзор факторов, вызывающих миграцию, адгезию и активацию макрофагов, анализ их функциональных характеристик на различных поверхностях, включая биодеградирующие и не деградирующие материалы in vivo и in vitro.
Введение
Современную медицину в настоящее время невозможно представить без применения имплантируемых изделий, устанавливаемых в организм на различные сроки с целью восстановления анатомии и функции утраченных или пораженных патологическим процессом органов и тканей. Биосовместимость синтетических материалов или тканеинженерных конструкций является основной проблемой, влияющей на результаты таких имплантаций. Реакция на протезирующий материал развивается в следующей последовательности: альтерация тканей, инфильтрация клетками острого, затем хронического воспаления с формированием грануляционной ткани и фиброзной капсулы. Степень выраженности этих реакций определяет биосовместимость имплантируемого изделия. Макрофаги играют главную роль в реакции организма на устанавливаемый материал – катетеры, стенты, эндопротезы, дентальные имплантаты и др.
Морфология макрофагов
Функции макрофагов
Миграция моноцитов/макрофагов
Тканевые макрофаги происходят преимущественно из моноцитов крови, которые мигрируют в ткани и дифференцируются в различные популяции. Миграция макрофагов направляется хемокинами: ССL2 CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, ССL15, ССL19, CXCL10, CXCL12; факторами роста VEGF, PDGF, TGF-b; фрагментами системы комплемента; гистамином; белками гранул полиморфноядерных лейкоцитов (ПМЯЛ); фосфолипидами и их производными.
Активация макрофагов
Эти исследования наглядно показывают, что формирующиеся в естественных условиях популяции макрофагов значительно отличаются от получаемых in vitro М1 и М2 популяций. Воспринимая множество активирующих сигналов, макрофаг отвечает «по запросу», секретируя медиаторы адекватно изменению окружающей среды, поэтому в каждом конкретном случае формируется свой фенотип, иногда, возможно, даже уникальный.
Реакция макрофагов на чужеродный материал
Адсорбция белков плазмы крови является первой стадией взаимодействия имплантируемых материалов с тканями организма. Химический состав, свободная энергия, полярность поверхностных функциональных групп, степень гидрофильности поверхности определяют количество, состав и конформационные изменения в связываемых белках, являющихся матриксом для последующей адгезии клеток, в том числе макрофагов. Наиболее значимыми в этом плане являются фибриноген, IgG, белки системы комплемента, витронектин, фибронектин и альбумин.
В этой связи существенное значение приобретают изучение клеточных популяций в зоне протезирования, разработка методов и подходов к блокированию чрезмерной воспалительной реакции с исходом в фиброз и стимуляция репаративной регенерации в месте имплантации различных материалов.
Заключение
Макрофаги – полиморфная популяция клеток, фенотип которых определяется сигналами микроокружения. Они играют решающую роль в реакции организма на чужеродный материал, используемый для эндопротезирования, катетеризации, стентирования и др. видов лечения. Характер реакции и степень ее выраженности зависят как от размера имплантируемого материала, так и от его физикохимических свойств и могут иметь как положительное, так и отрицательное значения для организма пациента. Для деградируемых материалов на основе коллагена показана зависимость типа активации макрофагов и скорости регенерации соединительной ткани от способа обработки коллагенового сырья. Это открывает широкие возможности для специалистов, разрабатывающих новые методы децеллюляризации тканей, химической модификации и стерилизации коллагеновых материалов в целях получения имплантатов для регенеративной медицины.
Проблемы, связанные с активацией макрофагов недеградирующими материалами, по-видимому, должны решаться иначе. Макрофаги, фагоцитирующие микрочастицы износа поверхности суставных эндопротезов, и макрофаги, мигрирующие к обширным поверхностям синтетических имплантов, инициируют длительно персистирующее воспаление, остеолиз в первом случае и фиброз во втором. Нивелирование этого эффекта, скорее всего, будет достигнуто путем блокады направленной миграции, адгезии и активации моноцитов/макрофагов, что потребует более глубоких знаний об этих процессах, чем те, которыми мы располагаем в настоящее время.
Функции макрофагов в различных условиях микроокружения опухоли
Связанные с опухолью макрофаги, как известно, стимулируют ключевые этапы прогрессирования опухоли. В этом обзоре рассказывается о многочисленных экспериментальных и клинических исследованиях, проведенных с целью изучения функций, регуляции и клинической значимости опухолевых макрофагов. В отношении клинической значимости наиболее интересны три участка инвазии раковых клеток: опухолевые гнезда, пограничная зона между стромой и опухолевыми клетками, а также области, близкие к сосудистой сети опухоли или удаленные от нее. Более полное понимание разнообразия опухолевых макрофагов может привести к разработке избирательных методов лечения, основанных на восстановлении противораковых функций этих клеток.
Вступление
Опухолевые макрофаги (ОМ) изобилуют в большинстве типов злокачественных новообразований, способствуют опухолевому ангиогенезу, выходу раковых клеток из опухоли в кровоток, способствуют их выживанию и постоянному росту в метастатических колониях, подавлению противоопухолевых иммунных механизмов. В то же время ОМ могут подавлять, дополнять или опосредовать противоопухолевые эффекты цитотоксических агентов, лучевой терапии, антиангиогенных препаратов и ингибиторов контрольных точек.
Происхождение этих клеток в настоящее время является предметом обсуждения. Недавние исследования показали, что макрофаги во многих тканях происходят не из циркулирующих моноцитов, как первоначально предполагалось, а из эмбриональных макрофагов (особенно из макрофагов желточного мешка), которые закладываются в тканях во время развития. Эти предшественники остаются в тканях взрослого организма и размножаются, таким образом, сохраняясь независимо от гемопоэтической системы взрослого человека. В некоторых органах, например, в кишечнике, основные популяции макрофагов развиваются путем рекрутирования моноцитов. Выборочное истощение каждого из этих двух подтипов ОМ показало, что только эмбриональные макрофаги поддерживают опухолевый рост.
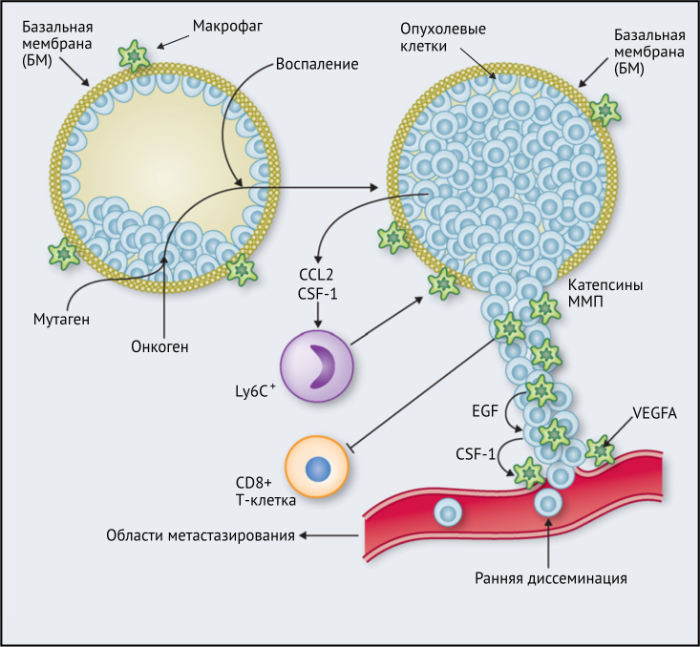
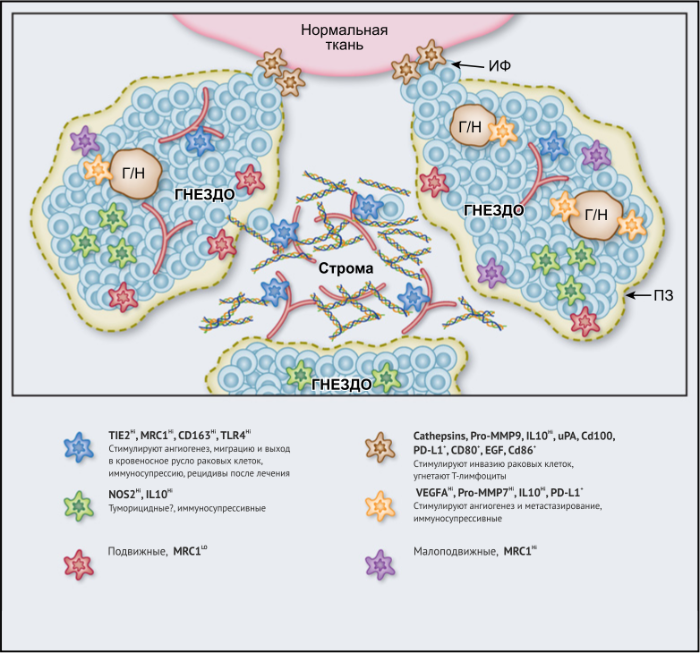
ОМ могут находиться в различных состояниях активации. Обычно они отклоняются от «классически» активированного, агрессивного по отношению к опухоли фенотипа (иногда называемого M1) в сторону «альтернативно» активированного опухолевого промотора (M2). Однако как и макрофаги во многих других тканях, ОM обладают замечательной функциональной пластичностью и часто экспрессируют маркеры, характерные для обоих состояний активации, что делает такой полярный подход к их классификации неточным. Предполагается, что функции ОМ могут, по крайней мере частично, регулироваться их расположением в опухоли; что они проявляют разные функции по меньшей мере в трех областях инвазии раковых клеток: области высокой плотности раковых клеток (так называемом «опухолевом гнезде»); периваскулярной (ПВ) нише; и плохо васкуляризованных гипоксических/некротических областях опухоли (Рис.1 и 2).
Области инвазии
Существует по крайней мере три основных локализации, в которых прогрессия опухоли была ассоциирована с повышенной инвазией клеток.
Результаты исследований, проведенных на мышах, показывают, что макрофаги способствуют развитию злокачественных опухолей различными способами: реконструируют внеклеточный матрикс, опосредуют разрушение базальной мембраны, увеличивают подвижность раковых клеток, и их способность к миграции, способствуют прогрессированию преинвазивных поражений, выделяют фактор роста эндотелия сосудов A (VEGF-A). Макрофаги вокруг преинвазивных поражений молочных желез у мышей высвобождают CXCR2-связывающие хемокины CXCL1 и CXCL5, которые способствуют миграции и инвазии соседних предростопластических (предраковых) эпителиальных клеток. В то же время подавление активности макрофагов вызывало замедление развития инвазии опухолевых клеток и развития опухоли в целом.
Недавнее исследование на модели рака легких Kras G12D показало, что нарушение регуляции онкогенов, таких как Myc, в раковых клетках вызывает трансформацию медленно прогрессирующей аденомы легкого в агрессивную аденокарциному. Это связано с тем, что изменения в Myc стимулировали увеличение экспрессии CCL9 и IL-23 эпителиальными клетками легких. CCL9 затем стимулировал накопление VEGFA + макрофагов и, следовательно, ангиогенез опухоли, а также PD-L1-зависимое вытеснение T- и B-клеток. Кроме того, IL-23 стимулировал гибель Т- и В-клеток и цитотоксических NK-клеток (Рис.1).
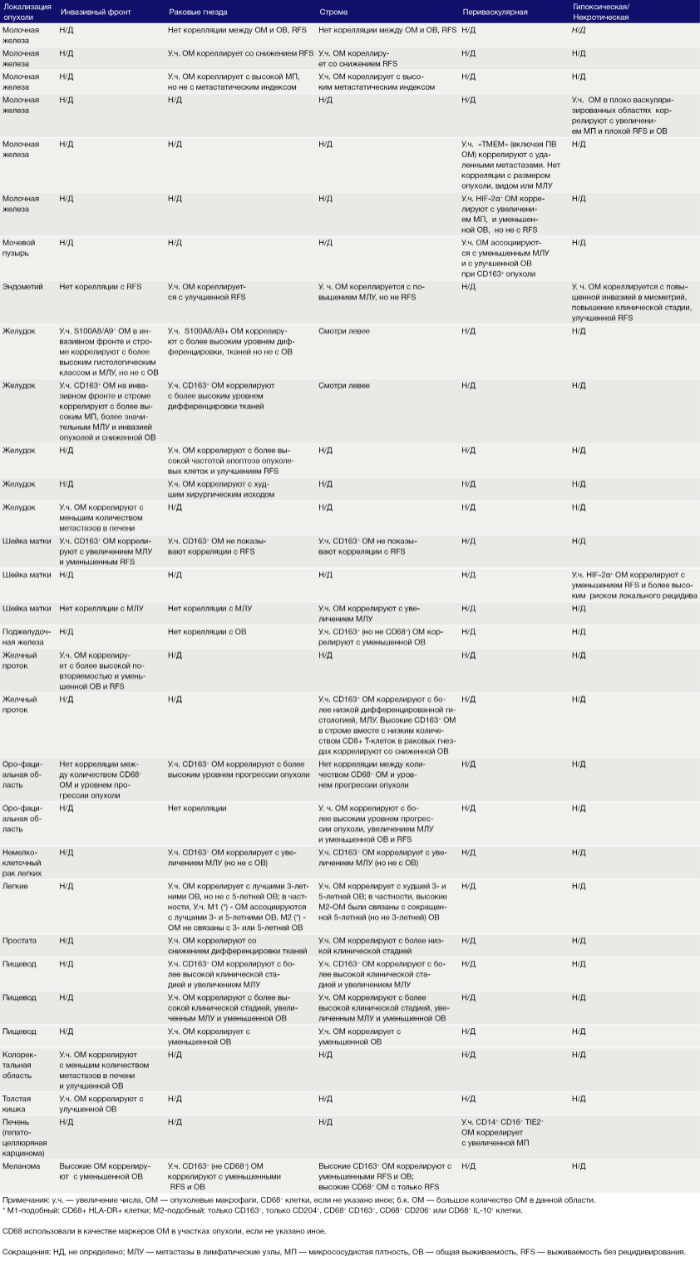
Следует отметить, что антитела против CD68 продолжают широко использоваться в качестве иммунных меток ОМ в опухолях (Таблица 1). Однако как и многие другие антитела, маркирующие отдельные типы клеток, человеческие анти-CD68 иногда маркируют клетки, отличные от ОM. Например, методом качественного анализа с помощью иммуноокрашивания удалось установить, что некоторые клетки CD68 + в опухолях молочной железы человека не экспрессируют рецептор к КСФ-1 (КСФ-1Р), CD45 или другие маркеры эпителиальных клеток, эндотелиальных клеток или клеток стенок сосудов (то есть гладкомышечных клеток, перицитов или фибробластов). Остается неизвестной как принадлежность этих клеток, так и то, маркируются ли они антителами к CD68 иного происхождения.
ОМ в ИФ опухоли поджелудочной железы RIP1-Tag2 мыши усиливают инвазивный потенциал раковых клеток посредством экспрессии катепсинов B и S, двух ферментов, регулируемых IL-4, высвобождаемым раковыми клетками и инфильтрирующими опухоль Т-клетками. Кроме того, было показано, что CD4 + Т-клетки в опухолях MMTV-PyMT увеличивают инвазивность раковых клеток благодаря IL-4, что затем стимулирует ОM экспрессировать эпидермальный фактора роста (EGF).
Эти экспериментальные данные хорошо согласуются с данными исследований, согласно которым ОM в ИФ опухолей желудка человека выделяют MMP9 — фермент, разрушающий матрикс, — и рецептор сериновых протеаз, урокиназный активатор плазминогена (УАП, урокиназа). Интересно, что ОМ вдоль ИФ первичной карциномы толстой кишки экспрессируют CD80 и CD86 (костимуляторные сигналы, необходимые для активации Т-клеток), что указывает на то, что они могут иметь потенциал для стимулирования противоопухолевого иммунитета при этом типе рака. Это может объяснить наблюдение, что повышенное количество CD68 + ОM в ИФ колоректальных опухолей человека коррелируют с более высокой выживаемостью без рецидива (RFS) (Таблица 1). Тем не менее, в ИФ опухолей могут присутствовать различные ОM-подмножества, причем некоторые из них являются иммуносупрессивными. Например, ОM в ИФ гепатоцеллюлярных карцином (ГЦК) экспрессируют более высокое количество лиганда иммуносупрессивной контрольной точки PD-L1, чем ОМ в других опухолевых гнездах, и связаны с плохой выживаемостью. Кроме того, было показано, что семафорин 4D (SEMA4D, CD100) — цитокин, экспрессия которого особенно выражена в ИФ опухоли толстой кишки Colon26, стимулирует ОM, которые экспрессируют иммуносупрессивный цитокин IL-10 в ИФ, и таким образом подавляют активированные CD8 + Т-клетки. Блокада антител SEMA4D подавляла ОМ в ИФ и повышала эффективность лечения ингибиторами контрольных анти-PD-1 и анти-CTLA4 (Рис.2).
Опухолевые гнезда
Возможные функции ОМ в непосредственной близости от раковых клеток в опухолевых «гнездах», по-видимому, варьируются в зависимости от типа опухоли. Например, ОM, экспрессирующие NOS2 — фермент, связанный с их цитотоксическим потенциалом, — обнаруживаются в тесном контакте с раковыми клетками в некоторых опухолях предстательной железы, а большое количество ОM в опухолевых гнездах коррелирует с улучшенным прогнозом при раке эндометрия, а также снижением количества рецидивов рака желудка (Таблица 1). Повышенное количество ОM коррелирует с уменьшенной общей выживаемостью и RFS при злокачественных меланомах, а также опухолях молочной железы и пищевода (Таблица 1). ОМ в гнездах ГЦК человека экспрессируют IL-10 и рекрутируют иммуносупрессивные клетки FoxP3 + Treg, хотя нет данных, что эти Treg влияют на исход заболевания (Рис. 2).
Интересно, что ОМ экспрессируют сигнальный регуляторный белок альфа (SIRP-α) на своей поверхности, который связывается с трансмембранным белком CD47 на злокачественных клетках. Когда это происходит, подавляется способность ОM обнаруживать и фагоцитировать опухолевые клетки. Различные исследования показали, что блокирование CD47 прерывает этот сигнал «не ешь меня» и вызывает разрушение опухолей при посредстве ОM у мышей, а высокая экспрессия CD47 обуславливает плохой прогноз рака мочевого пузыря, острого миелоидного лейкоза, неходжкинских лимфом и рака молочной железы. Так опухолевые клетки уклоняются от наблюдения ОМ.
Строма
В области стромы большинства солидных опухолей опухолевых клеток обычно мало либо нет вовсе. Она состоит из сложной сети макромолекул, формирующих внеклеточный матрикс(ВКМ), к которым относятся коллагеновые фибриллы, ламинин, фибронектин, тенасцин C и гиалуроновая кислоту (ГК). В нем часто находятся популяции различных клеток, включая фибробласты, эндотелиальные клетки, перициты, лимфоциты и миелоидные клетки. Ряд исследований показал, что компоненты ВКМ (и/или продукты его протеолиза), такие как фибронектин, ламинин-10, версикан (хондроитинсульфатсодержащий протеогликан) и фрагменты ГК, регулируют фенотип макрофагов. Пинто и его коллеги в исследованиях in vitro показали, что бесклеточный ВКМ, выделенный из колоректальных опухолей, стимулирует макрофаги экспрессировать IL-10, TGF-β и снижает экспрессию рецепторов хемокинов C-C 7 (CCR7), TNF-α и IL-6. Кроме того, повышенная экспрессия стромальными ОМ лигандов хемокинов C-C 18 (CCL18) связана с повышенным метастазированием и снижением выживаемости у пациентов при раке молочной железы. Это согласуется с рядом исследований, свидетельствующих о корреляции между большим количеством стромальных ОМ и низкой общей выживаемостью и RFS при опухолях молочной железы, пищевода, желудка, поджелудочной железы, орофациальных, кожных (Таблица 1). Существует зависимость от типа опухоли, поскольку такой корреляции при раке эндометрия, шейки матки и легких не выявлено, а при раке мочевого пузыря прослеживается уменьшение метастазирования в лимфатических узлах и улучшение выживаемости (Таблица 1).
Помимо описанных выше химических компонентов стромы опухоли, функции ОМ также регулируют ее биофизические свойства. Архитектоника и плотность ВКМ регулирует экспрессию различных провоспалительных генов макрофагами in vitro путем активации сигнальных путей TLR4 в этих клетках. Высокие уровни 22 общих составляющих матрикса («меток матрикса») положительно коррелируют как с плотностью опухоли, так и с инфильтрацией ОМ при метастазах рака яичников, хотя еще предстоит выяснить, есть ли причинно-следственная связь между инфильтрацией и структурой опухоли. Также следует отметить, что разные области стромы при данной опухоли могут различаться по своим химическим и биофизическим свойствам и влиять на ОМ по-разному (Рис. 2).
Периваскулярная ниша
Подмножество ОМ лежит близко или на поверхности кровеносных сосудов в опухолях мышей и человека. Эти клетки часто экспрессируют большое количество маркеров, связанных с M2: TIE2 (основной рецептор ангиопоэтина), MRC1 и CD163, — и играют ключевую роль в стимулировании ангиогенеза опухоли, метастазирования и рецидива после терапии первой линии. Из-за их относительно высокой экспрессии TIE2 эти клетки первоначально назывались «TIE2-экспрессирующие моноциты/макрофаги (TEM)». Частота TEM также положительно коррелирует с плотностью микрососудов (MVD) у некоторых типов опухолей человека (Табл. 1).
Генетическая делеция периваскулярных (ПВ) TIE2 + ОМ или фармакологическая блокада основного лиганда TIE2 — ангиопоэтина 2 (AGPT2), — продемонстрировали важную роль этого подмножества ОM в ангиогенезе опухоли и ее росте у различных мышиных моделей рака. Стимуляция экспрессии генов TEM, выделенных из опухолей мыши, привела к более высокой экспрессии ряда генов, способствующих развитию опухолей, включая Mmp9, Vegfa, Cxcl12, Tlr4 и Nrp1, чем TIE2- ОM из тех же опухолей.
ПВ TIE2 + ОM также участвовали в рецидиве первичных опухолей мыши после различных форм лечения. Они учащают рецидивы глиомы после местного облучения, а также при опухолях легких и молочной железы после химиотерапии. В такие моменты они экспрессируют большое количество CXCR4 и рекрутируются с помощью активированного CXCL12 в ПВ нише. Это подмножество ОМ затем стимулирует реваскуляризацию и рост опухоли посредством высвобождения VEGF-A. Позднее исследование подтвердило, что экспрессия TIE2 в ОМ необходима для стимуляции васкуляризации после химиотерапии у мышей. Кроме того, недавно рекрутированные моноциты также мигрируют вокруг опухолей, не подвергавшихся терапии, зависимым от CXCR4 образом. Меченые моноциты проникали в ПВ зону опухоли PyMT, где они затем подвергались воздействию TGFβ, выделяемого раковыми клетками, что стимулировало эти моноциты повышать свою экспрессию CXCR4 и мигрировать к CXCL12-экспрессирующим фибробластам вокруг опухолевых кровеносных сосудов в богатых коллагеном стромальных областях. Как только они примыкают к сосудам, моноциты дифференцируются в «метастаз-ассистирующие» ПВ ОM, участвующие в TMEM.
Наконец, в метастатических областях, таких, как легкие, подмножество макрофагов CCR2 + Ly6C + способствует выходу раковых клеток в кровеносное русло и образованию из них метастазов. Эти «метастаз-ассоциированные макрофаги» (MAM) были использованы в мышиных моделях опухолей, чтобы напрямую связать молекулу адгезии сосудистых клеток-1 (VCAM-1) с раковыми клетками через их α4-интегрины. Этот процесс впоследствии увеличивает выживаемость раковых клеток в таких метастатических областях. Кроме того, связывание CCL2 с CCR2 на MAM стимулирует высвобождение ими CCL3, который связывается с CCR1 на раковых клетках и облегчает их удержание в легких. Эти MAM также способствуют постоянному росту метастатических повреждений с помощью сигналов VEGFR1 и CSF-1R.
Гипоксические/некротические области
Гипоксия является отличительной чертой солидных опухолей и связана с увеличением инвазии и метастазов, сопротивлением терапии и плохим клиническим исходом. Гипоксические области обычно имеют парциальное давление кислорода (рО2) ниже 10 мм рт. ст. Они расположены более чем в 150 мкм от опухолевых кровеносных сосудов. Они образуются в опухолях, когда потребность клеток в кислороде опережает их снабжение плохо организованными опухолевыми сосудами. Эти области были идентифицированы в опухолевых срезах с использованием маркеров гипоксических клеток, например, пимонидазола, или иммуноблока для индуцируемой гипоксией альфа-субъединицы транскрипционных факторов HIF 1 и 2. Большое количество гипоксических ОМ ассоциируется с повышенным уровнем ангиогенеза опухолей, метастазами, сниженной RFS и/или снижением общей выживаемости при раке молочной железы, эндометрия и шейки матки (Таблица 1).
ОM в таких областях регулируют HIF 1 и 2 и различные гены-мишени HIF, такие как VEGF-A, GLUT1 и MMP7. Хемокины, усиливающие гипоксию, рекрутируют в гипоксические области ОМ, в том числе хемокин C-X-C 12 (CXCL12), полипептид-активирующий эндотелий-клеточный моноцит II (EMAP-II), эндотелин 2, VEGF-A и SEMA3A. Гипоксические ОМ иммобилизируются в этих областях прямым ингибирующим действием гипоксии на их подвижность и снижением экспрессии их рецепторов опухолевых хемокинов CCR2, CCR5 и NRP1.
Гипоксические ОМ способствуют ангиогенезу опухоли, уклонению от иммунитета и метастазированию в различных экспериментальных моделях. Например, они регулируют экспрессию большого количества проангиогенных и иммуносупрессивных цитокинов в гипоксических зонах опухоли, а когда их проникновение в гипоксические области опухолей затруднено сигнальной блокадой SEMA3A/NRP1, опухолевый ангиогенез заметно снижается и противоопухолевый иммунитет восстанавливается. Гипоксические ОМ также способны подавлять активацию Т-клеток различными способами, влияя на IL-10 и на контрольные точки, например, через лиганд PD-L1. Макрофаги, кокультивированные с клетками ГЦК в гипоксических условиях, увеличивают экспрессию индоламин 2,3-диоксигеназы (IDO), которая подавляет пролиферацию местных цитотоксических Т-клеток и увеличивает популяцию клеток Treg.
Хотя воздействие гипоксии само по себе не может изменить фенотип ОМ в отношении стимуляции роста опухоли, некоторые исследования показали, что низкий уровень рН и лактат (которые накапливаются в слабо васкуляризированных, гипоксических областях из-за плохого сосудистого питания) совместно индуцируют проангиогенный фенотип ОМ, который, в свою очередь, восстанавливает перфузию крови. Действительно, молочная кислота может стимулировать экспрессию VEGF-A макрофагами. Как упоминалось ранее, этот цитокин является не только проангиогенным в опухолях, но также способен стимулировать выход в сосуды раковых клеток.
Опухолевая гипоксия также может модулировать функции ОМ опосредованно, стимулируя раковые клетки выделить белок группы 1 с высокой подвижностью (HMGB1), который, в свою очередь, стимулирует продукцию IL-10 ОM. Гипоксия также индуцирует метаболические изменения в ОМ, которые затем непосредственно влияют на функции соседних клеток. Например, гипоксия стимулирует экспрессию REDD1, ингибитора mTOR и ключевого модулятора метаболизма в ответ на доступность питательных веществ и потребность в энергии. Ингибирование mTOR в ОM сильно снижает их поглощение глюкозы и активность гликолиза, оставляя больше глюкозы для соседних эндотелиальных клеток. Это повышает способность раковых клеток проникать в сосудистое русло, соответственно, приводит к формированию отдаленных метастазов.
Таблица 1. Опухолевые макрофаги в различных злокачественных новообразованиях человека: корреляция с клинико-патологическими проявлениями
Заключение
Ряд экспериментальных исследований на мышах подтвердил способность различных опухолевых популяций дифференцированно регулировать фенотип ОМ. Важность этого подчеркивается клиническими отчетами, показывающими, что число или фенотип ОМ в определенных областях опухоли коррелируют с RFS и выживаемостью (Таблица 1).
Имеются данные о роли подмножеств ОM в определенных областях опухолей, ограничивающих ответ опухолей на лечение. Например, облучение, сосудистые разрушающие агенты и цитотоксические препараты индуцируют пролиферацию ПВ ОM, что способствует ангиогенезу опухоли и рецидиву после терапии. Гипоксические ОМ также были вовлечены в устойчивость опухолей к противоопухолевой терапии и способствуют рецидиву.
Демонстрация того, что ОМ стимулируют ряд механизмов опухолеобразования на мышиных моделях опухолей, побудила к развитию терапевтических подходов к истощению или перепрограммированию ОМ. На сегодняшний день общие ингибиторы ОМ, включая те, которые нацелены на CSF-1-CSF-1R и CCL-CCR2, в значительной степени не показали эффективности в клинических испытаниях в качестве монотерапии рака, хотя они могут оказаться эффективными в сочетании с другими терапевтическими агентами. Ингибитор CSF-1-R PLX3397 показал значительную эффективность при лечении теносиновиальной гигантоклеточной опухоли, лечение также выявило побочное действие, вызванное долгосрочным истощением всех макрофагов.
Таргетная терапия в отношении определенных ОM-подмножеств в опухолях может стать отличным методом в качестве противоопухолевой терапии посредством истощения или перепрограммирования тех ОМ, которые способствуют с помощью различных механизмов опухолевой прогрессии, при этом она должна оставлять или усиливать те подмножества ОМ, которые способствуют противоопухолевому иммунитету. Прогресс в нашем понимании того, как фенотип подмножеств ОМ в различных областях опухоли зависит от их онтогенеза, статуса активации и сложного комплекса местных взаимодействий поможет разработать такой терапевтический подход. Раскрытие сложного массива влияний на поведение ОM потребует многогранного подхода к исследованиям, однако это может привести к появлению новых возможностей в лечении опухолевых заболеваний, появлению новых таргетных противоопухолевых препаратов.
Источник: Yang M. et al. Diverse Functions of Macrophages in Different Tumor Microenvironments //Cancer research. – 2018. – Т. 78. – №. 19. – С. 5492-5503.