Макрофаги что это такое в крови
Макрофаги
Что такое клетки макрофаги и откуда они берутся?
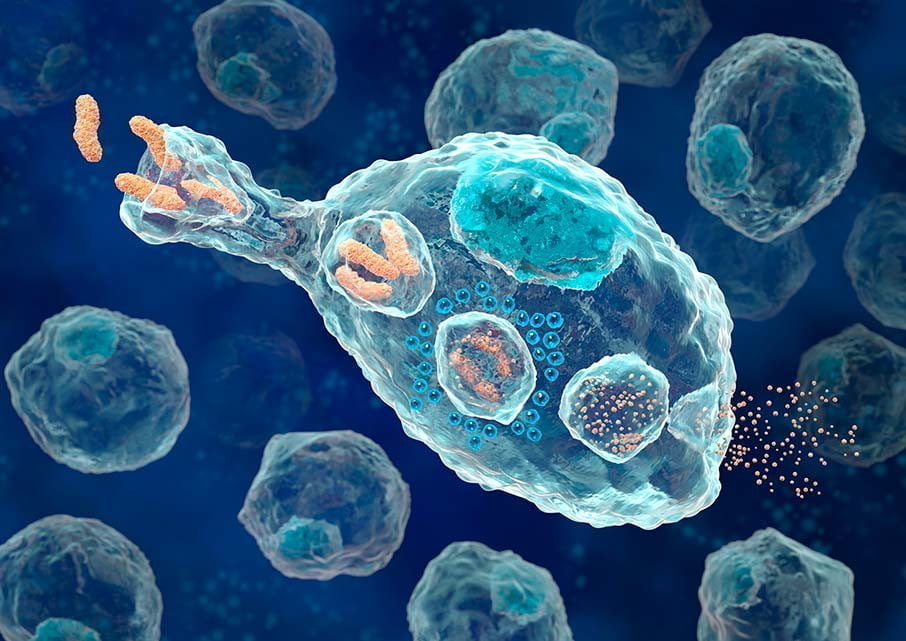
Клетки макрофаги в самом деле большие: хотя их размер составляет всего 15-80 мкм, и человеческому глазу они не видны, однако они гораздо больше их предшественников: максимальный размер моноцита составляет всего 20 мкм. У них неправильная, «плавающая», меняющаяся форма, а их мембрана может образовывать ложноножки. Внутри макрофага находится ядро, а еще в нем обнаруживаются «осколки» эритроцитов и других клеток, жировые капельки, фрагменты бактерий и прочий «мусор». Как все это туда попадает? Очень просто, ведь макрофаги – это клетки, которые осуществляют процесс фагоцитоза.
Функции макрофагов:
При попадании в тело чужеродного объекта, будь то микроб или инородное тело, иммунная система сразу «спускает на него собак»: его атакуют фагоциты. Эти клетки, среди которых и макрофаги, распознают, улавливают и пожирают чужаков, угрожающих благополучию внутренней среды организма.
Кроме того, макрофаги уничтожают погибшие клетки, которые завершили свое существование процессом апоптоза (запрограммированная, естественная, нормальная гибель клеток). Также функции макрофагов заключаются в обеспечении противоопухолевого иммунитета: зафиксировав появление в организме атипичных, раковых клеток, макрофаги нападают на них и поедают.
Виды макрофагов:
Макрофаги – тканевые фагоциты, и в разных типах тканей нередко 
1. Альвеолярные макрофаги – находятся в стенках альвеол легких, очищают вдыхаемый воздух от различных загрязняющих и вредоносных частиц.
2. Купферовские клетки – в печени. Их назначение в основном заключается в уничтожении старых клеток крови.
4. Селезеночные макрофаги – располагаются в синусоидных сосудах этого органа. Как и у клеток Купфера, их задача заключается в том, чтобы вылавливать из крови и уничтожать отжившие клетки крови. Недаром селезенка называется кладбищем погибших эритроцитов!
5. Дендритные клетки – макрофаги, находящиеся под слизистыми оболочками и в коже, то есть фактически на границе с внешней средой.
6. Перитонеальные макрофаги – фагоциты, «живущие» в брюшине.
7. Где находятся макрофаги лимфатических узлов, понятно по названию. Это благодаря им лимфоузлы известны в качестве фильтров, очищающих лимфу.
Макрофаги и иммунная система:
Клетки макрофаги не просто бездумно уничтожают вредоносные объекты: расщепляя их на фрагменты, они осуществляют процесс презентации их антигенов. Антигены – это молекулы вредоносных частиц, которые говорят об их генетической чужеродности и вызывают соответствующую защитную реакцию со стороны иммунитета. Сами по себе они не представляют угрозы заражения или иного негативного воздействия, но это – метка чужака, поэтому организм реагирует на их присутствие защитной реакцией, как на полноценных агрессоров.
К сожалению, иногда личного опыта наших макрофагов или других фагоцитов недостаточно для того, чтобы иммунная система работала должным образом и правильно реагировала на вредоносные объекты. Чтобы повысить ее эффективность и заодно улучшить состояние здоровья в целом, рекомендуется принимать препарат Трансфер Фактор. Он содержит цитокины, несущие в себе данные о всевозможных возбудителях заболеваний, токсинах и прочих вредоносных агентах. Препарат обучает иммунитет полноценной работе, что немедленно и благоприятным образом отражается на течении имеющихся заболеваний, состоянии обмена веществ и функции органов. Средство можно использовать в лечебных и профилактических целях.
Макрофаги что это такое в крови
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
В соответствии с «М1/М2» парадигмой выделяют два подтипа активированных макрофагов – классически активированные (М1) и альтернативно активированные (М2), которые экспрессируют различные рецепторы, цитокины, хемокины, факторы роста и эффекторные молекулы. Однако данные последних лет указывают на то, что в ответ на изменение сигналов микроокружения, макрофаги могут проявлять уникальные свойства, не позволяющие отнести их ни к одному из этих подтипов.
Макрофаги играют главную роль в реакции организма на имплантируемый материал – катетеры, стенты, эндопротезы, дентальные имплантаты. Макрофаги фагоцитируют частицы износа поверхности суставных протезов, инициируют воспаление в зоне протезирования и остеолиз, управляют процессами образования фиброзной капсулы вокруг инородных тел. Представлен краткий обзор факторов, вызывающих миграцию, адгезию и активацию макрофагов, анализ их функциональных характеристик на различных поверхностях, включая биодеградирующие и не деградирующие материалы in vivo и in vitro.
Введение
Современную медицину в настоящее время невозможно представить без применения имплантируемых изделий, устанавливаемых в организм на различные сроки с целью восстановления анатомии и функции утраченных или пораженных патологическим процессом органов и тканей. Биосовместимость синтетических материалов или тканеинженерных конструкций является основной проблемой, влияющей на результаты таких имплантаций. Реакция на протезирующий материал развивается в следующей последовательности: альтерация тканей, инфильтрация клетками острого, затем хронического воспаления с формированием грануляционной ткани и фиброзной капсулы. Степень выраженности этих реакций определяет биосовместимость имплантируемого изделия. Макрофаги играют главную роль в реакции организма на устанавливаемый материал – катетеры, стенты, эндопротезы, дентальные имплантаты и др.
Морфология макрофагов
Функции макрофагов
Миграция моноцитов/макрофагов
Тканевые макрофаги происходят преимущественно из моноцитов крови, которые мигрируют в ткани и дифференцируются в различные популяции. Миграция макрофагов направляется хемокинами: ССL2 CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, ССL15, ССL19, CXCL10, CXCL12; факторами роста VEGF, PDGF, TGF-b; фрагментами системы комплемента; гистамином; белками гранул полиморфноядерных лейкоцитов (ПМЯЛ); фосфолипидами и их производными.
Активация макрофагов
Эти исследования наглядно показывают, что формирующиеся в естественных условиях популяции макрофагов значительно отличаются от получаемых in vitro М1 и М2 популяций. Воспринимая множество активирующих сигналов, макрофаг отвечает «по запросу», секретируя медиаторы адекватно изменению окружающей среды, поэтому в каждом конкретном случае формируется свой фенотип, иногда, возможно, даже уникальный.
Реакция макрофагов на чужеродный материал
Адсорбция белков плазмы крови является первой стадией взаимодействия имплантируемых материалов с тканями организма. Химический состав, свободная энергия, полярность поверхностных функциональных групп, степень гидрофильности поверхности определяют количество, состав и конформационные изменения в связываемых белках, являющихся матриксом для последующей адгезии клеток, в том числе макрофагов. Наиболее значимыми в этом плане являются фибриноген, IgG, белки системы комплемента, витронектин, фибронектин и альбумин.
В этой связи существенное значение приобретают изучение клеточных популяций в зоне протезирования, разработка методов и подходов к блокированию чрезмерной воспалительной реакции с исходом в фиброз и стимуляция репаративной регенерации в месте имплантации различных материалов.
Заключение
Макрофаги – полиморфная популяция клеток, фенотип которых определяется сигналами микроокружения. Они играют решающую роль в реакции организма на чужеродный материал, используемый для эндопротезирования, катетеризации, стентирования и др. видов лечения. Характер реакции и степень ее выраженности зависят как от размера имплантируемого материала, так и от его физикохимических свойств и могут иметь как положительное, так и отрицательное значения для организма пациента. Для деградируемых материалов на основе коллагена показана зависимость типа активации макрофагов и скорости регенерации соединительной ткани от способа обработки коллагенового сырья. Это открывает широкие возможности для специалистов, разрабатывающих новые методы децеллюляризации тканей, химической модификации и стерилизации коллагеновых материалов в целях получения имплантатов для регенеративной медицины.
Проблемы, связанные с активацией макрофагов недеградирующими материалами, по-видимому, должны решаться иначе. Макрофаги, фагоцитирующие микрочастицы износа поверхности суставных эндопротезов, и макрофаги, мигрирующие к обширным поверхностям синтетических имплантов, инициируют длительно персистирующее воспаление, остеолиз в первом случае и фиброз во втором. Нивелирование этого эффекта, скорее всего, будет достигнуто путем блокады направленной миграции, адгезии и активации моноцитов/макрофагов, что потребует более глубоких знаний об этих процессах, чем те, которыми мы располагаем в настоящее время.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
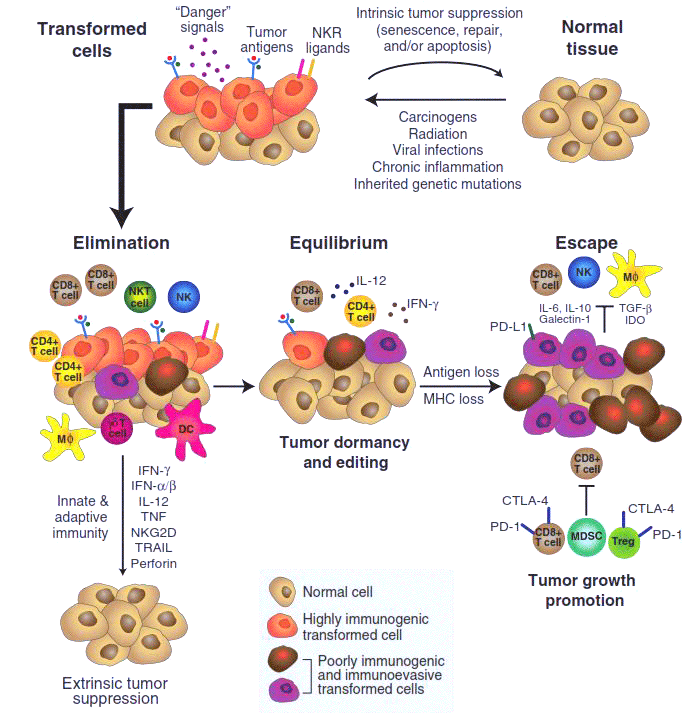
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
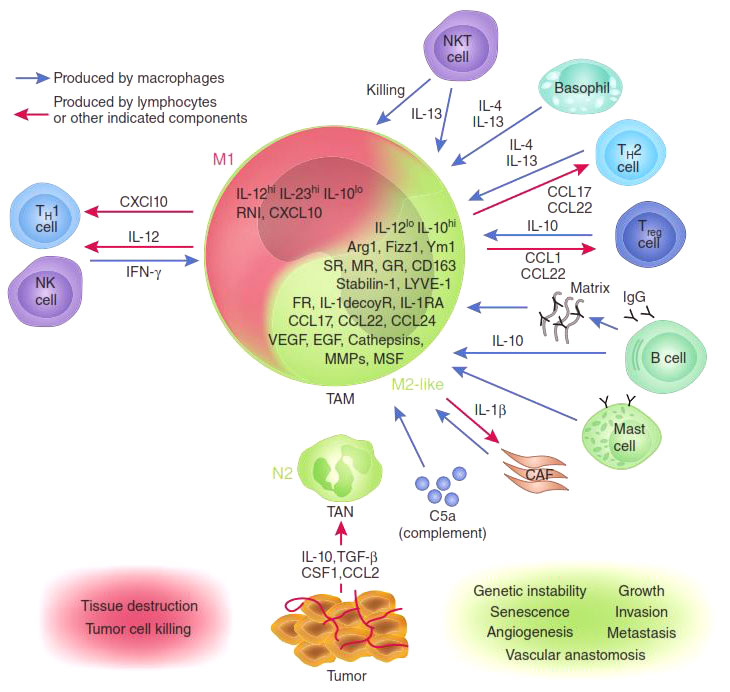
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
МАКРОФАГИ – ПЕРСПЕКТИВНАЯ МИШЕНЬ ДЛЯ РАЗРАБОТКИ НОВЫХ МЕТОДОВ ЛЕЧЕНИЯ РЯДА ТЯЖЕЛЫХ ЗАБОЛЕВАНИЙ
Более ста тридцати лет назад выдающийся русский ученый И. И. Мечников в опытах на личинках морских звезд из Мессинского пролива сделал удивительное открытие, круто изменившее не только жизнь самого будущего Нобелевского лауреата, но и перевернувшее тогдашние представления об иммунной системе – он открыл блуждающие клетки, которые назвал фагоцитами (от греч. Φάγος — пожиратель). Долгие годы считалось, что фагоциты выполняют в организме функции «войск быстрого реагирования». Однако исследования последних лет показали, что благодаря своей огромной функциональной пластичности эти клетки еще и «определяют погоду» многих метаболических, иммунологических и воспалительных процессов, как в норме, так и при патологии. Это делает фагоциты перспективной мишенью при разработке стратегии лечения ряда тяжелых заболеваний человека.
Подвижные клетки иммунной системы – фагоциты или макрофаги, присутствуют практически во всех тканях организма. Они осуществляют активный захват, переваривание и обезвреживание чужеродных микроорганизмов (вирусов, бактерий, одноклеточных, паразитов), а также утилизацию биологического «мусора», такого как «невостребованные» и погибшие клетки (например, «стареющие» эритроциты).
В зависимости от своего микроокружения тканевые макрофаги могут выполнять и различные специализированные функции. Но самым, пожалуй, удивительным свойством макрофагов оказалась их огромная пластичность, т. е. способность изменять свою транскрипционную программу («включение» тех или иных генов) и свой облик (фенотип). Следствием этой особенности является высокая разнородность клеточной популяции макрофагов, среди которых присутствуют не только «агрес¬сивные» клетки, встающие на защиту организма-хозяина; но и клетки с «полярной» функцией, отвечающие за процессы «мирного» восстанов¬ления поврежденных тканей [1].
В настоящее время макрофаги подразделяют на клетки М1, М2 и М0 типа или «классического» (провоспалительного), «альтернативного» (противовоспалительного) и неактивированного фенотипа соответственно [2]. О свойствах и функциях М1 и М2 макрофагов сообщается в ряде обзоров [3], [4].
Как отмечено выше, в ходе иммунного ответа макрофаги могут менять свой фенотип – этот процесс смены фенотипа получил название «репрограммирование».
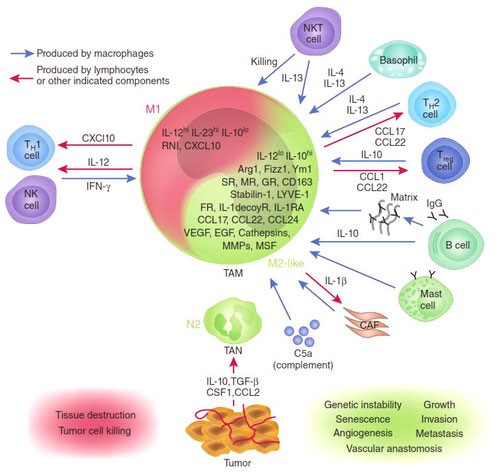
Известно, что присутствие в опухоли большого количества М1-макрофагов тормозит ее рост, а в некоторых случаях может вызвать даже практически полную ремиссию. И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки. Под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип. Они перестают синтезировать противоопухолевые цитокины, такие как интерлейкин-12 или фактор некроза опухолей (TNF), и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис.).
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [5]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50. Таким способом, опухоль превращает «агрессивные» М1-макрофаги в помощников, участвующих в ее развитии: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса их ингредиентов. Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять иммунитет, ученые могут разрабатывать контрмеры и сдвинуть баланс в сторону уничтожения опухолей.
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов.
Примером такого подхода служит технология, разработанная в новосибирском НИИ клинической иммунологии СО РАМН, при которой макрофаги, полученные из крови онкобольных, культивируют в присутствии стимулятора зимозана, который накапливается в клетках. Затем макрофаги вводят в опухоль, где зимозан освобождается и начинает стимулировать классическую активацию «опухолевых» макрофагов.
Сегодня становится все более очевидно, что соединения, вызывающие метаморфозы макрофагов, оказывают выраженное атеропротективное, антидиабетическое, нейропротективное действие, а также защищают ткани при аутоиммунных заболеваниях и ревматоидном артрите. За рубежом – в США, Китае, Швейцарии и Израиле уже проводятся дорогостоящие клинические испытания подобных соединений синтетического и природного происхождения. Несмотря на финансовые трудности, российские, в том числе и новосибирские, исследователи также вносят свой посильный вклад в решение этой проблемы.
Так, на кафедре химии Новосибирского государственного университета было получено безопасное соединение TS-13, стимулирующее образование М0 фагоцитов, которое обладает выраженным противовоспалительным эффектом и оказывает нейропротективное действие в экспериментальной модели болезни Паркинсона (Дюбченко и др., 2006; Зенков и др., 2009).
В Новосибирском институте органической химии им. Н. Н. Ворожцова СО РАН созданы безопасные антидиабетические и противоатеросклеротические препараты, действующие сразу на несколько факторов, благодаря которым «агрессивный» макрофаг Ml превращается в «мирный» М2 (Dikalov et al., 2011). Большой интерес вызывают и растительные препараты, получаемые из винограда, черники и других растений с помощью механохимической технологии, разработанной в Институте химии твердого тела и механохимии СО РАН (Dushkin, 2010).
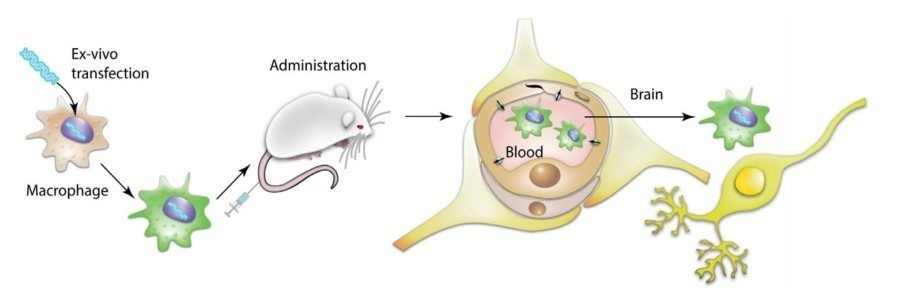
Еще один пример использования макрофагов – а именно генетически модифицированных аутологичных клеток для лечения пациентов с болезнью Паркинсона предложили в Center for Nanotechnology in Drug Delivery при университете Северной Каролины.
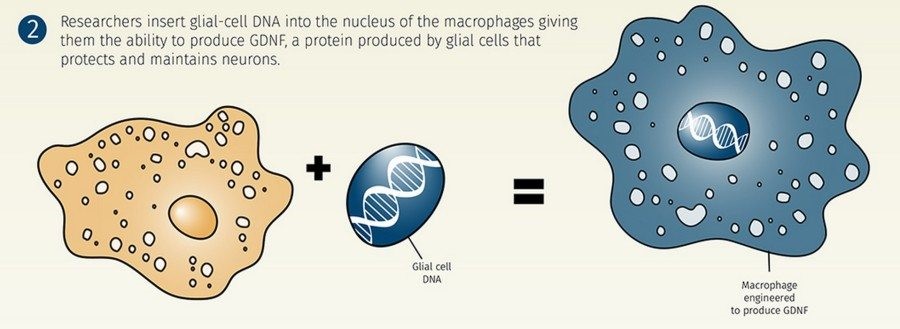
Болезнь Паркинсона (БП) – это самое частое нейродегенеративное заболевание, от которого страдает примерно 1% всех людей, достигших 60 лет. В основе БП лежит потеря (гибель, дегенерация) дофаминергических нейронов в структуре мозга substantia nigra pars compacta (SNpс) и появление телец Леви (это агломераты белка внутри нейронов). Группа Елены Батраковой в Center for Nanotechnology in Drug Delivery занимается разработкой методов клеточного транспорта ростовых факторов и антиоксидантов в структуры мозга через поврежденный гемато-энцефалический барьер с тем, чтобы уменьшить воспаление и защитить гибнущие нейроны. Для этой цели они берут (пока у животных) макрофаги и при помощи лентивирусного вектора вводят им ген, кодирующий ростовой фактор, обычно вырабатываемый глиальными клетками.
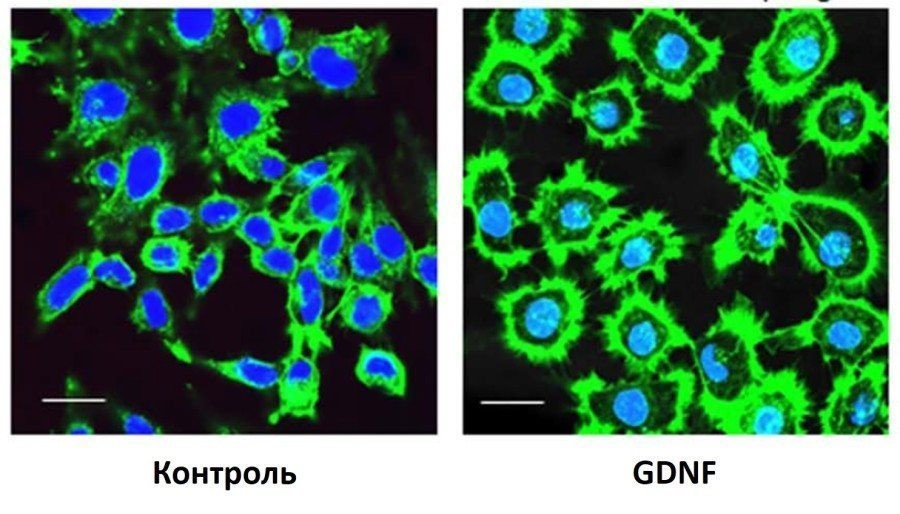
Этот фактор называется glial-derived neurotropic factor или GDNF. Известно, что GDNF уменьшает воспаление и улучшает способность нейронов выживать в тяжелой ситуации, в частности способствует восстановлению утраченных нервными клетками аксонов.
Так, на этой фотографии показано, как добавление GDNF в культуру нейронов стимулирует рост аксонов нервных клеток – зеленые ниточки, расходящиеся от тел нейронов.
Почему исследователи выбрали макрофаги? Эти клетки обладают хорошей способностью активно двигаться в сторону очага воспаления и проникать сквозь тканевые барьеры. Генетически-модифицированные макрофаги вводили внутривенно мышам с моделью БП и через некоторое время изучали у них симптоматику заболевания, а также влияние макрофагов на регенерацию поврежденных нейронов.
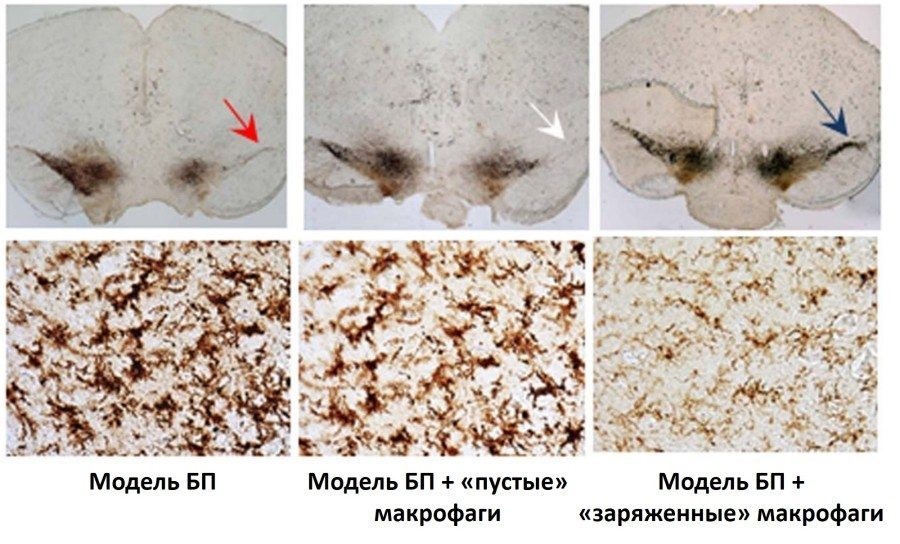
Исследования показали, что применение «заряженных» GDNF макрофагов улучшало двигательную активность и равновесие у животных с моделью БП. На тканевом уровне была показана регенерация нейронов в SNpc с одновременным снижением воспаления, оцененного по морфологии микроглиальных клеток.
Верхний ряд картинки – это срез головного мозга экспериментальных животных. Слева – нелеченые животные с моделью БП, посередине – БП мыши, получившие «пустые» макрофаги (то есть без гена GDNF), а справа – БП мыши, получившие «заряженные» GDNF макрофаги.
Стрелкой показана регенерация нервных клеток SNpc, у животных в группе исследуемого лечения. Темная полоска – это покрашенные специальным маркером дофаминергические нейроны. На двух левых срезах они погибли, справа – живы. В нижнем ряду интенсивность коричневого маркера показывает активированные микроглиальные клетки, которые, меняют свою форму, когда чувствуют повреждение и воспаление ткани. В группе «заряженных» макрофагов микроглиальные клетки выглядят значительно «спокойнее», а воспаление слабее.
Следует добавить, что GDNF выделяется из макрофагов не «просто так», а в особых маленьких мембранных пузырьках экосомах (рис. ниже), обеспечивающих стабильность молекулы GDNF во внеклеточном пространстве и прицельное движение в сторону нейронов.
В 1996 году выяснилось, что иммунные клетки посылают друг другу экосомы, а их содержимое может влиять на регуляцию адаптивного иммунного ответа. Кроме того, оказалось, что экзосомы способны распознать «адрес», по которому их «послали». Это происходит благодаря специфическому взаимодействию адгезиновых молекул на мембранах экзосом и их клеток-мишеней. Тогда возникла идея использовать экзосомы для регуляции клеточной жизнедеятельности.
О возможности терапии с использованием трансплантации макрофагов легких для лечения легочного альвеолярного протеиноза у детей сообщается в работе [6].
Поскольку пересадка костного мозга требует предварительного подавления иммунитета, что несет риск инфекций и повышает уровень смертности, то особый интерес представляет органная терапия, специфичная к отдельным типам клеток. Поэтому в данном исследовании использовали мышей с дефицитом β-рецептора колониестимулирующего фактора макрофагов и гранулоцитов GM-CSF. У таких мышей наблюдаются те же дефекты миелоидных клеток, что и при наследственном легочном альвеолярном протеинозе у детей с мутациями генов CSF2RA и CSF2RB. Это заболевание связано с избыточным накоплением сурфактанта в альвеолах вследствие нарушения его утилизации макрофагами. Было показано, что при легочном альвеолярном протеинозе пересадка легочных макрофагов дикого типа (предварительно проверенных на предмет экспрессии необходимых маркеров и способности утилизировать сурфактант) или с мутациями гена CFS2RB без предварительной иммуносупрессии не представляет опасности и практически полностью удаляет гистопатологические эффекты заболевания. Одно введение этих клеток принесло облегчение при вторичных системных проявлениях заболевания, устранив характерную полицитемию. Это лечение нормализовало экспрессию генов и содержание маркеров заболевания и снизило смертность, продлив среднюю продолжительность жизни больных мышей на 107 дней. Популяция альвеолярных макрофагов, полученных при пересадке, сохранялась в течение одного года, и все это время продолжали проявляться терапевтические эффекты. При этом макрофаги дикого типа проявили более высокую выживаемость и интенсивность пролиферации in vitro по сравнению с макрофагами с мутантным CFS2RB. При трансплантации они более эффективно накапливались у мышей с мутацией CFS2RB, нежели у животных дикого типа. Иммуногистохимическое окрашивание по маркеру пролиферации Ki67 после пересадки GFP-маркированных макрофагов мыши дикого типа к мыши с мутацией CFS2RB показало, что пересаженные клетки успешно продолжают размножаться в организме реципиента: через месяц после трансплантации доля Ki67+-клеток составляла в среднем 32,2%. Через год средний показатель снизился до 11,29%; при этом численность макрофагов, экспрессирующих CD131 — продукт гена CFS2RB — слабо различалась у дикого типа и мутантных мышей-реципиентов. Это позволяет предположить, что пересаженные макрофаги дикого типа способны постепенно вытеснять мутантные макрофаги.
С помощью поточной цитометрии и ПЦР было установлено, что пересаженные макрофаги локализуются в легких, преимущественно между альвеолами, и отсутствуют в крови, костном мозге и селезенке. В данном исследовании [6] объяснен механизм поддержания численности популяций альвеолярных макрофагов при трансплантации и показано значение рецептора GM-CSF для их выживаемости.
Полученные японскими учеными результаты свидетельствуют о возможности применения трансплантации макрофагов для лечения легочного альвеолярного протеиноза у детей.
Таким образом, макрофаги – перспективная мишень, которая может применяться для выработки стратегии лечения ряда тяжелых заболеваний человека. В результате фармакологических и генетических манипуляций с макрофагами появляется реальная возможность превращать эти иммунные клетки из агрессивных врагов в друзей, помогающих организму сохранить или вернуть здоровье.
Литература
1. Душкин М. И. Макрофаг/пенистая клетка как атрибут воспаления: механизмы образования и функциональная роль // Биохимия. – 2012. – Т. 77. – С. 419-432.
2. Mosser, D.M. Exploring the full spectrum of macrophage activation / D.M. Mosser, J.P. Edwards // Nat. Rev. Immunol. – 2008. – Vol. 8. – P. 958–969.
3. Murray, P.J. Protective and pathogenic functions of macrophage subsets / P.J. Murray, T.A. Wynn // Nat. Rev. Immunol. – 2011. – Vol. 11. – P. 723–737.
4. Малышев, Ю.И. Матричное репрограммирование иммунных клеток и роль его нарушения в патогенезе опухолей / Ю.И. Малышев //Вестник РОНЦ им. Н.Н. Блохина РАМН. – 2012. – Т. 23. – № 2. – С. 21–33.
5. Biswas, S.K. Macrophage plasticity and interaction with lymphocyte subsets: cancer as a paradigm / S.K. Biswas, A. Mantovani // Nat. Immunol. – 2010. – Vol.11. – P. 889–8967.
6. Pulmonary macrophage transplantation therapy /Takuji Suzuki [et al.] // Nature – 2014. – Vol. 514. – N 7523. – P. 453–470.
В статье использованы материалы сайта slipups.ru

© Елена Кадукова, старший научный сотрудник лаборатории комбинированных воздействий