Макрофаги в моче что это
Для врачей
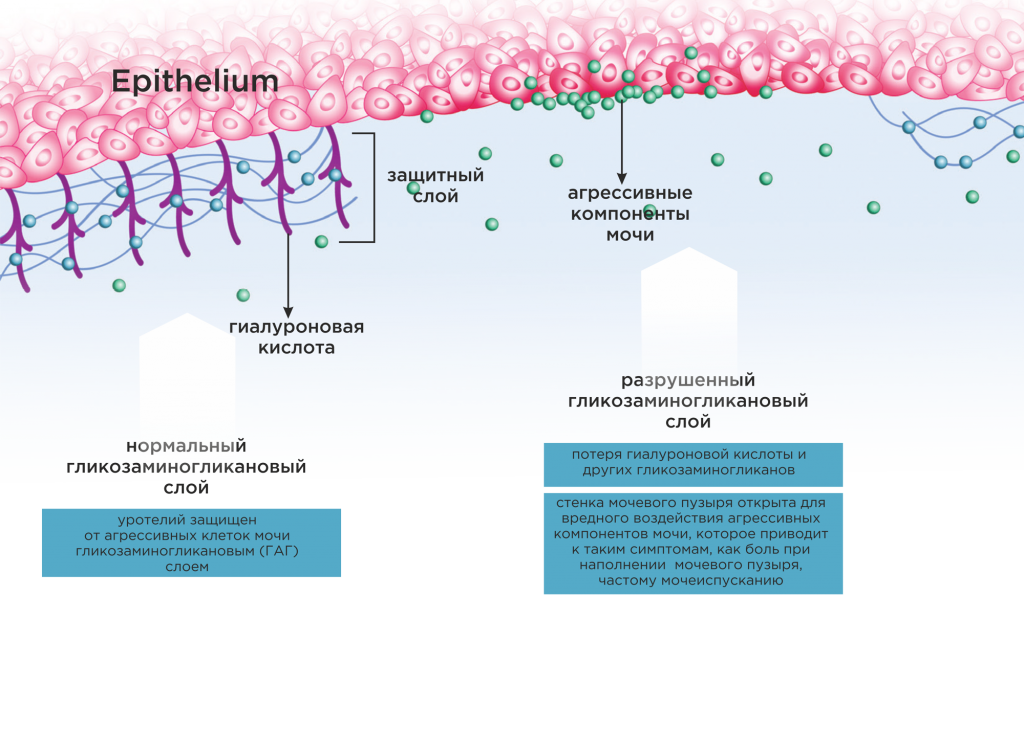
Современные представления о патогенезе интерстициального цистита (другое название – синдром болезненного мочевого пузыря) основаны на теории разрушения защитного слоя уротелия. Защитный слой мочевого пузыря состоит из так называемых гликозаминогликанов (гиалуроновой кислоты, хондроитинсульфата) и поэтому называется гликозаминогликановым.
Считается, что при разрушении гликозаминогликанового слоя мочевого пузыря, агрессивные компоненты проникают в подслизистый слой уротелия, воздействуют на нервные окончания вызывая симптомы, характерные для интерстициального цистита – боль при наполнении мочевого пузыря, частое мочеиспускание.
Однако, мы до сих пор не знаем – почему разрушается защитный слой эпителия мочевого пузыря.
На этот счет есть много разных теорий, но ни одна из них не подкреплена серьезными доказательствами.
Однако, мы точно знаем, что в эпителии мочевого пузыря при интерстициальном цистите обнаруживается много макрофагов (тучных клеток, mast cells), а в моче – вещества, которые тучные клетки выделяют и которые вызывают воспаление и боль (интерлейкин-6, Фактор Роста Нервов, гистамин). А еще нам известно, что макрофаги могут выделять гиалуронидазу и глюкуронидазу – ферменты, которые разрушают гиалуроновую кислоту. Но ведь гиалуроновая кислота является основным компонентом гликозаминогликанового слоя!
Этот процесс называется дегрануляцией тучных клеток.
Интересно то, что такой же процесс (мастоцитоз) происходит и при других заболеваниях:
— Синдроме Раздраженного Кишечника
Очень часто эти заболевания сочетаются с интерстициальным циститом у одного и того же человека.
Так может быть, это не разные заболевания, а проявления одной и той же болезни, но в разных органах?
Скорее всего, так и есть и эта болезнь называется: синдром активации макрофагов (mast cells activation syndrome).
Макрофаги (тучные клетки) – это настоящие нанороботы нашего организма. В них хранится несколько десятков биологически активных веществ для регуляции функций, ремонта нашего организма. Еще несколько десятков веществ они могут синтезировать за несколько минут или часов – в зависимости от задач, которые перед ними стоят.
Мы пока не знаем точно, что именно заставляет макрофаги так себя вести – почему ремонтные нанороботы начинают разрушать организм, вместо восстановления?
Известно несколько факторов, которые их активируют:
Женские гормоны (эстрогены) активируют макрофаги. У меня есть несколько пациенток, у которых симптомы интерстициального цистита усиливаются в первую фазу цикла. А вот при беременности уровень эстрогенов снижается и поэтому, во время беременности симптомы интерстициального цистита часто менее выражены.
Стресс, особенно хронический, также активирует макрофаги. Пациенты с интерстициальным циститом часто отмечают усиление боли при стрессе, нервных переживаниях.
Вирусы и патогенные бактерии, которые образуют колонии внутри уротелия, тоже могут выступать активаторами макрофагов.
Диагностика интерстициального цистита
Диагностика интерстициального цистита, как проявления синдрома активации тучных клеток основана на:
— Биопсии мочевого пузыря (повышенное число тучных клеток).
— Определении гистамина или Н-метилгистамина в моче.
— Определении Интерлейкина-6 в моче.
— Определении Фактора Роста Нервов в моче.
— Определении триптазы в моче.
Что касается терапии интерстициального цистита при синдроме активизации тучных клеток, необходимо:
1. Защитить уротелий от воздействия агрессивных компонентов мочи, поскольку они провоцируют дегрануляцию тучных клеток (инстилляции гиалуроновой кислоты, хондроитинсульфата, прием хондроитинсульфата внутрь).
2. Десенсибилизировать («успокоить») тучные клетки (инстилляции лидокаина, дексаметазона, гиалуроновой кислоты, димексида).
3. Снизить уровень стресса (легкие антидепрессанты, большие дозы магния, транскраниальная электростимуляция, йога, плавание, ходьба не менее 10 000 шагов в день).
4. Антигистаминные препараты 2-го или 3-го поколения.
Мы используем файлы cookie: это помогает сайту работать лучше. Если Вы продолжаете использовать сайт, то этим выражаете свое согласие с Пользовательским соглашением.
Макрофаги в моче что это
В прошлый раз мы рассказали о анализе осадка мочи при помощи технологии UriSed. Анализаторы, работающие по этой технологии, автоматически определяют 15 элементов осадка: RBC, WBC, WBCc, HYA, PAT, EPI, NEC, BAC, YEA, CRY (CaOxm, CaOxd, URI, TRI), MUC, SPRM. Рассмотрим их подробно.
Осадок мочи может содержать в себе различные типы клеток. Некоторые из них проходят в первичную мочу из крови, в то время как другие попадают в нее в результате отслоения эпителия мочевыделительной системы.
UriSed автоматически выполняет идентификацию эритроцитов, лейкоцитов, клеток плоского эпителия, а также других эпителиальных клеток (клеток неплоского эпителия) без последующей их классификации. Прибор также позволяет идентифицировать подтипы эритроцитов, макрофаги, клетки почечного эпителия, клетки поверхностного и глубокого слоя переходного эпителия, но для этого требуется участие оператора.
Эритроциты
Эритроциты — клетки со средним диаметром 7,0 мкм. Множество заболеваний может сопровождаться гематурией — присутствие в мочевом осадке повышенного количества эритроцитов. Самые распространенные причины макроскопической или микроскопической гематурии — урологические заболевания (например, рак почек, рак мочевого пузыря, мочекаменная болезнь), инфекции мочевыводящих путей и болезни, затрагивающие почечные клубочки (гломерулонефриты). При определении причины гематурии весьма полезным является анализ структуры содержащихся в моче эритроцитов.
Урологические болезни и инфекции мочевыводящих путей связывают с так называемой, изоморфоной (негломерулярной, непочечной) гематурией. При данном типе гематурии эритроциты характеризуются обычной формой и однотипным внешним видом, но даже при такой гематурии возможно идентифицировать подтипы эритроцитов: изоморфные (1), изоморфные с нормальным и низки содержанием гемоглобина (2), изоморфные со спикулами (3), изоморфные с темным центральным ореолом (4).



Поражения почечного клубочка, наоборот, связывают, с так называемой дисморфной (или гломерулярной, почечной) гематурией, при которой эритроциты характеризуются неправильной формой: кольцеобразные дисморфные с низким содержанием гемоглобина (5), кольцеобразные дисморфные с нормальным содержанием гемоглобина (6), дисморфные и изоморфные (7).


Дисморфные эритроциты включают в себя, так называемые, акантоциты и клетки G1, отличительной морфологической чертой которых является кольцеобразная форма с одним или несколькими выступающими выростами. Выросты могут отличаться по размеру и форме и могут выступать снаружи или внутри кольца (8, 9, 10). Акантоциты намного легче идентифицировать в отличие от других подтипов эритроцитов, благодаря их необычной форме. Таким образом, они являются ключевыми элементами при анализе морфологии эритроцитов в мочевом осадке. Многие исследователи доказали, что если акантоциты составляют не менее 5 % присутствующих в образце эритроцитов, то гематурия имеет гломерулярное происхожд ние с чувствительностью от 52 % до 100 % и специфичностью от 96 % до 100 %.


Намного реже в мочевом осадке могут быть обнаружены другие типы эритроцитов (дакриоциты (11) — слезоподобные клетки). Любопытно то, что их можно найти в моче пациента, в крови которого также обнаруживаются дакриоциты.
Иногда в моче можно обнаружить микроскопические сгустки крови (12). Утверждается, что обычно они присутствуют при кровотечениях из органов мочевыделительной системы (почечной лоханки, мочеточника или мочевого пузыря).

Лейкоциты
Лейкоциты часто обнаруживаются в моче. Большинство из них нейтрофилы, которые выглядят в виде округлых клеток с неоднородной структурой, придающих им вид клеток с гранулами (13). Они распознаются прибором с точностью 93 %.
Средний диаметр нейтрофилов составляет 10 мкм. Однако, их размер и структура могут варьироваться в зависимости от относительной плотности мочи. При низкой плотности (например, ≤ 1,005) размер клетки увеличивается, сокращается плотность распределения органоидов и мелкодольчатые ядра клеток видны более отчетливо (14); при высокой относительной плотности (например, ≥ 1,025) размер клетки наоборот сокращается, цитоплазма заполнена органоидами и ядро клетки еле видно.
Нейтрофилы также могут появляться в виде «скоплений» различного размера (15). Такие скопления нейтрофилов наиболее часто выявляются при инфекции мочевыводящих путей. Эти заболевания, вне всяких сомнений, являются причиной лейкоцитурии. Тем не менее, достаточно часто лейкоциты могут наблюдаться и при неинфекционных заболеваниях почек, например, гломерулонефритах, острых или хронических интерстициальных нефритах, поликистозе почек, при мочекаменной болезни и др.


У женщин наличие лейкоцитов в моче может быть обусловлено примесью к моче выделений из наружных половых органов. Часто это сопровождается появлением в моче большого количества клеток плоского эпителия вагинального происхождения с бактериями или без них, обнаружением грибков (Candidaе spp.) или простейших (Trichomonas vaginalis ).
Макрофаги
Макрофаги — клетки круглой формы, отличающиеся по диаметру и внешнему виду. Они могут иметь одно или несколько ядер, которые могут быть расположены в центре или на периферии (16). Однако, иногда ядро может быть плохо различимо из-за обильного содержимого цитоплазмы клетки. Цитоплазма макрофагов может содержать различное количество пузырьков разного размера, гранулы (17) или фагоцитированные частицы, такие как эритроциты или кристаллы.
Макрофаги также могут быть заполнены каплями липидов, в таком случае они идентифицируются как клетки в состоянии жировой дистрофии (пенистые клетки) с характерным внешним видом. Они являются типичным признаком нефротического синдрома, при котором их ассоциируют с каплями липидов, жировыми цилиндрами и/или кристаллами холестерина.
Макрофаги без включений липидов в моче наблюдаются при различных заболеваниях, таких как гломерулонефрит в активной фазе, IgA-нефропатия и полиомавирусная инфекция, вызванная ВК. При любом из них они имеют диагностическое значение.

О клетках плоского, почечного и переходного эпителия — через неделю.
Общие свойства мочи
Определение химических показателей мочи при помощи тест-полосок
Анализ осадка мочи при помощи технологии UriSed
Макрофаги в моче что это
Общий анализ мочи — это совокупность различных диагностических тестов, направленных на определение общих свойств мочи, а также физико-химического и микроскопического ее исследования. При этом определяются такие показатели, как цвет, запах, прозрачность, реакция (рН), плотность, содержание в моче белка, глюкозы, кетоновых тел, билирубина и продуктов его метаболизма. В осадке мочи определяется наличие клеточных элементов, а также солей и цилиндров.
Клинический анализ мочи, ОАМ.
Метод «сухой химии» + микроскопия.
Клет./мкл (клетка на микролитр).
Какой биоматериал можно использовать для исследования?
Среднюю порцию утренней мочи, первую порцию утренней мочи, третью порцию утренней мочи.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Моча – конечный продукт работы почек, который является одним из основных компонентов обмена веществ и отражает состояние крови и метаболизма. Она содержит воду, продукты метаболизма, электролиты, микроэлементы, гормоны, слущенные клетки канальцев и слизистой мочевыводящих путей, лейкоциты, соли, слизь. Совокупность физических и химических параметров мочи, а также анализ содержания в ней различных продуктов метаболизма дает возможность оценить не только функцию почек и мочевыводящих путей, но и состояние некоторых обменных процессов, а также выявить нарушения в работе внутренних органов. Эту информацию помогает получить расшифровка общего анализа мочи.
Микроскопия осадка мочи – это качественное и количественное определение в моче ряда нерастворимых соединений (органических и неорганических). Доступные для изучения показатели позволяют получить дополнительную информацию, касающуюся обмена веществ, а также инфекционных и воспалительных процессов.
В основе метода «сухой химии» лежит эффект изменения окраски реакционной зоны тест-полоски в результате реакции красителя, присутствующего в реакционной зоне с молекулами белка мочи. Реакционная зона представляет собой пористую полоску, пропитанную раствором реагентов и высушенную. В состав реагентов входят вещества, обеспечивающие стабилизацию рН (буфер), и краситель. Когда реакционная зона пропитывается мочой, сухие компоненты растворяются и происходит реакция с компонентами мочи. Если в моче отсутствует белок, то реакционная зона остается бесцветной либо слегка желтоватой, поскольку молекулы красителя поглощают свет в синей области спектра. Если в пробе мочи, которой пропитывается реакционная зона, присутствуют молекулы белка, то молекулы красителя образуют комплексы с последними и их спектр поглощения сдвигается в красную сторону, что позволяет осуществить оценку реакции и составить отчет по анализируемым показателям.
Необходимо помнить, что результаты общего анализа мочи может правильно интерпретировать, оценить их соответствие нормам только лечащий врач с учетом клинических и лабораторных данных, данных объективного осмотра и заключений инструментальных исследований.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Расшифровка общего анализа мочи:
Референсные значения (показатели нормы)
Цвет: от соломенно-желтого до желтого.
Белок: не обнаружено или менее 0,1 г/л.
Глюкоза: не обнаружено.
Билирубин: не обнаружено.
Уробилиноген: не обнаружено или следы.
Кетоновые тела: не обнаружено.
Нитриты: не обнаружено.
Реакция на кровь (гемоглобин): не обнаружено.
Лейкоцитарная эстераза:* не обнаружено или следы.
Исследование осадка мочи
Референсные значения
Референсные значения
Цвет мочи в норме колеблется от соломенного до насыщенного желтого. Он определяется присутствием в ней красящих веществ – урохромов, от концентрации которых в основном и зависит интенсивность окраски. Насыщенный желтый цвет обычно указывает на относительную высокую плотность и концентрированность мочи. Бесцветная или бледная моча имеет низкую плотность и выделяется в большом количестве.
Изменение окраски мочи иногда связано с рядом патологических состояний. Темный цвет может свидетельствовать о присутствии билирубина или высокой концентрации уробилиногена. Различные оттенки красного могут появляться при выделении крови с мочой. Некоторые лекарственные средства и пищевые продукты тоже придают моче различные оттенки красного и желтого. Белесый цвет мочи может быть обусловлен примесью гноя, выпадением в осадок солей, присутствием лейкоцитов, клеток и слизи. Сине-зеленые оттенки мочи могут быть следствием усиления процессов гниения в кишечнике, что сопровождается образованием, всасыванием в кровь и выделением специфических красящих веществ.
Кислотно-щелочная реакция (рН), как и некоторые другие показатели общего анализа мочи, зависит от пищи и некоторых метаболических процессов. Животная пища вызывает закисление мочи (рН менее 5), молочно-растительная – способствует ее защелачиванию (рН более 7). Почки тоже могут влиять на кислотность мочи.
Кроме того, к закислению мочи приводит нарушение солевого баланса крови (гипокалиемия) и некоторые заболевания (сахарный диабет, подагра, лихорадки и др.).
Чрезмерная щелочная реакция мочи может возникать при воспалительных/инфекционных заболеваниях почек и мочевыводящих путей, массивной потере солей (из-за рвоты, поноса), нарушении почечной регуляции кислотности мочи или примеси крови в ней.
Удельный вес мочи (относительная плотность) отражает способность почек к концентрированию и разведению мочи. Он существенно зависит от объема потребляемой жидкости.
Удельный вес мочи превышает норму, например, при ухудшении фильтрации крови через почки (заболевания почек, ослабление работы сердца), больших потерях жидкости (понос, рвота) и накоплении в моче растворимых примесей (глюкозы, белка, лекарств, а также их метаболитов). Снижаться он может из-за некоторых заболеваний почек и нарушений гормональной регуляции процесса концентрации мочи.
В норме моча должна быть прозрачной. Мутнеть она может из-за примеси эритроцитов, лейкоцитов, клеток эпителия мочевыводящих путей, жировых капель, кислотности и выпадения в осадок солей (уратов, фосфатов, оксалатов). При длительном хранении моча иногда становится мутной в результате размножения бактерий. В норме небольшая мутность обусловлена присутствием эпителия и слизи.
Цвет мочи в норме колеблется от соломенного до насыщенного желтого и зависит от содержания урохромов. Насыщенный желтый цвет обычно указывает на относительно высокую плотность и концентрированность мочи. Бесцветная или бледная моча имеет низкую плотность и выделяется в большом количестве. Темный цвет может свидетельствовать о присутствии билирубина или высокой концентрации уробилиногена. Различные оттенки красного появляются при выделении крови с мочой. Некоторые лекарственные средства и пищевые продукты тоже придают моче различные оттенки красного и желтого. Белесый цвет мочи бывает обусловлен примесью гноя, выпадением в осадок солей, присутствием лейкоцитов, клеток и слизи. Сине-зеленые оттенки бывают следствием усиления процессов гниения в кишечнике, что сопровождается образованием специфических красящих веществ, их всасыванием в кровь и выделением.
Билирубин появляется в моче при патологии печени, нарушении проходимости желчевыводящих путей.
Уробилиноген окрашивает мочу в желтый цвет.
Причины повышения: присутствие бактерий в моче.
Кетоновые тела в норме отсутствуют в моче. Повышаются при сахарном диабете и указывают на ухудшение состояния больного. Могут появляться в моче при голодании, резком ограничении употребления углеводов, продолжительных подъемах температуры (лихорадке).
Реакция на кровь (гемоглобин). В норме моча не содержит кровь или продукты ее распада (гемоглобин). Форменные элементы крови (эритроциты, лейкоциты и др.) могут попадать в нее из сосудистого русла через почечный фильтр (например, при заболеваниях крови или токсических состояниях, сопровождающихся гемолизом) и при фильтрации эритроцитов из крови (при заболевании почек или при кровотечениях из органов мочевыделения).
Плоский эпителий в норме встречается в виде единичных клеток. Увеличение их числа указывает на воспалительный процесс мочевыводящих путей.
Эритроциты в норме присутствуют в моче в незначительном количестве.
Лейкоциты в моче здорового человека встречаются в незначительном количестве.
Цилиндры (указывают на нарушения функции клубочка и канальцев). Высокочувствительный метод, применяемый при общем анализе мочи, может выявить минимальное количество цилиндров в моче здорового человека.
Причины появления появления цилиндров в моче:
Слизь выделяется клетками, выстилающими внутреннюю поверхность мочевыводящих путей, и выполняет защитную функцию, предотвращая химическое или механическое повреждение эпителия. В норме ее концентрация в моче незначительная, однако при воспалительных процессах она повышается.
Кристаллы появляются в зависимости от коллоидного состава мочи, рН и других свойств, могут указывать на нарушения минерального обмена, наличие камней или повышенный риск развития мочекаменной болезни, нефролитиаза.
Бактерии указывают на бактериальную инфекцию мочевыделительного тракта.
Что может влиять на результат?
Несоблюдение правил сдачи материала (например, невыполнение гигиенических процедур, сдача анализа в период менструации).
Кто назначает исследование?
Врач общей практики, терапевт, педиатр, уролог, нефролог, гастроэнтеролог, кардиолог, невропатолог, хирург, акушер-гинеколог, эндокринолог, инфекционист.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
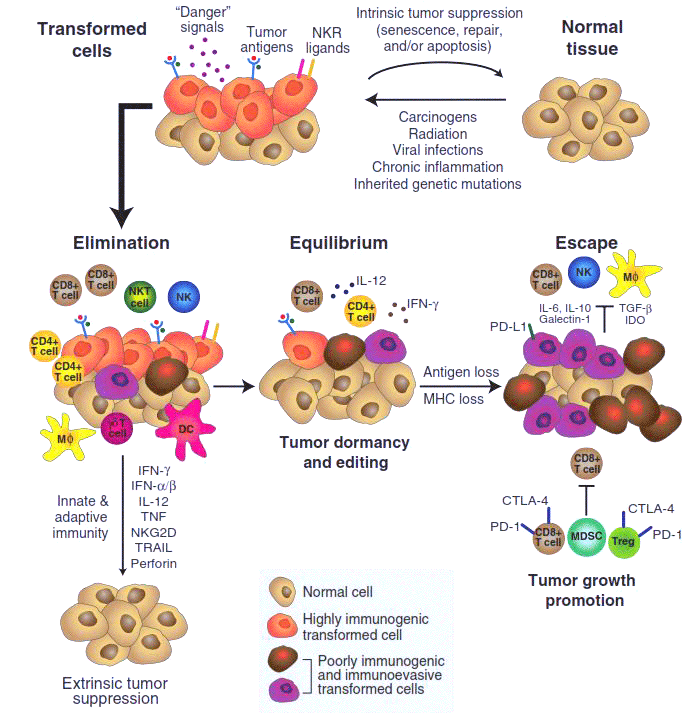
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
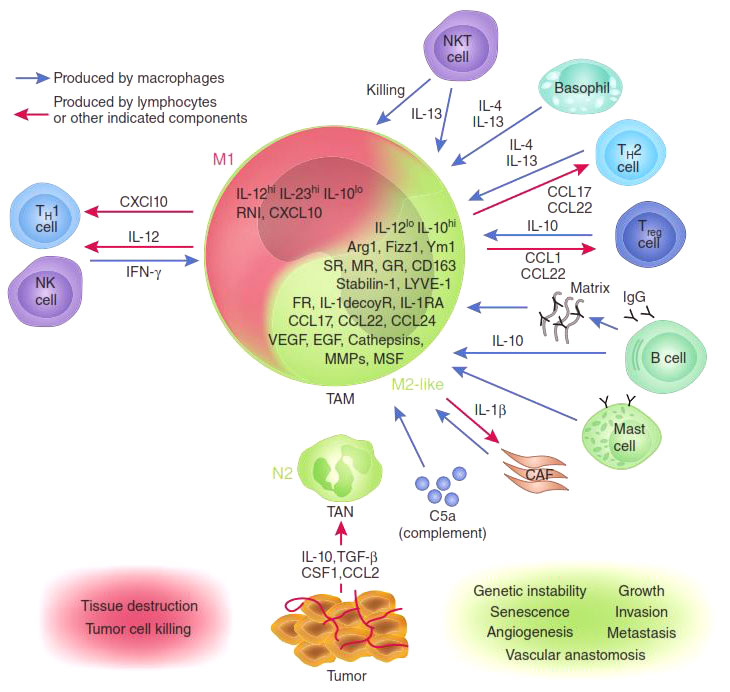
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.