Малигнизация опухоли что это означает
Чем отличается доброкачественная опухоль от злокачественной
В медицине понятие доброкачественности означает лёгкое течение болезни, хорошие результаты лечения и неопасность для жизни. Под злокачественным процессом подразумевают разрушительное течение, сложность терапии, высокий риск смертности.
Для опухолей такое разделение условно. Тем не менее пациентам и врачам крайне важно определить вид опухоли. От этого зависят тактика лечения и прогноз.
Характеристика доброкачественных и злокачественных опухолей
Существуют чёткие критерии:
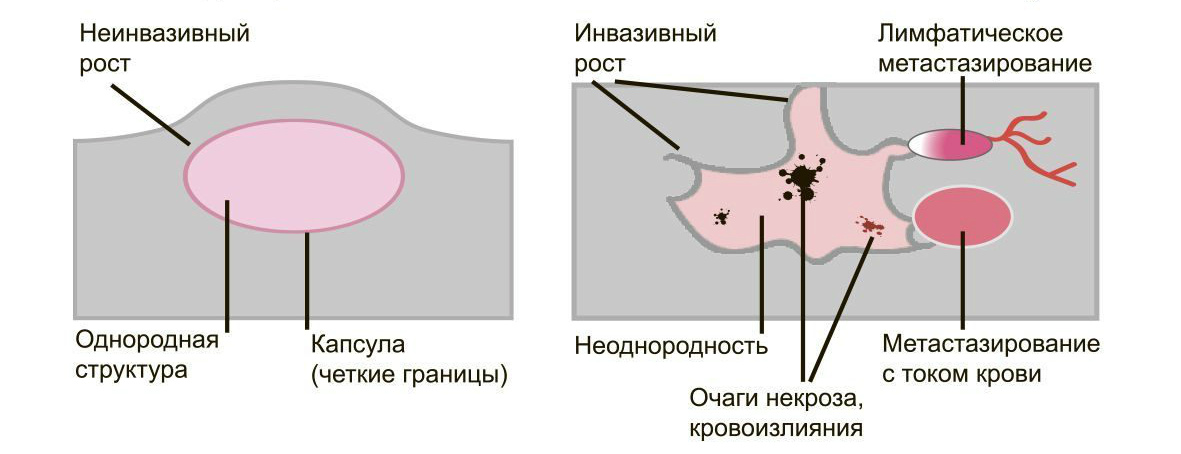
Доброкачественные опухоли чётко отграничены от здоровых тканей, часто имеют капсулу. Рак прорастает окружающие ткани, внедряется в сосуды, его контуры более аморфны.
Большинство доброкачественных опухолей могут расти годами, не проявляя симптомов. Карциномы растут быстро, нарушая функции органов и отравляя организм. Рост сопровождается утомляемостью, слабостью, потерей веса, болью.
Доброкачественные образования “сидят” на одном месте, постепенно растут и раздвигают здоровые ткани, подвижны при прощупывании. Раковые клетки слабо скреплены друг с другом, легко отделяются и разносятся лимфой и кровью по организму. Они оседают в лимфоузлах, костях, внутренних органах, образуя новые опухолевые очаги — метастазы. При пальпации узел спаян с тканями и не сдвигается.
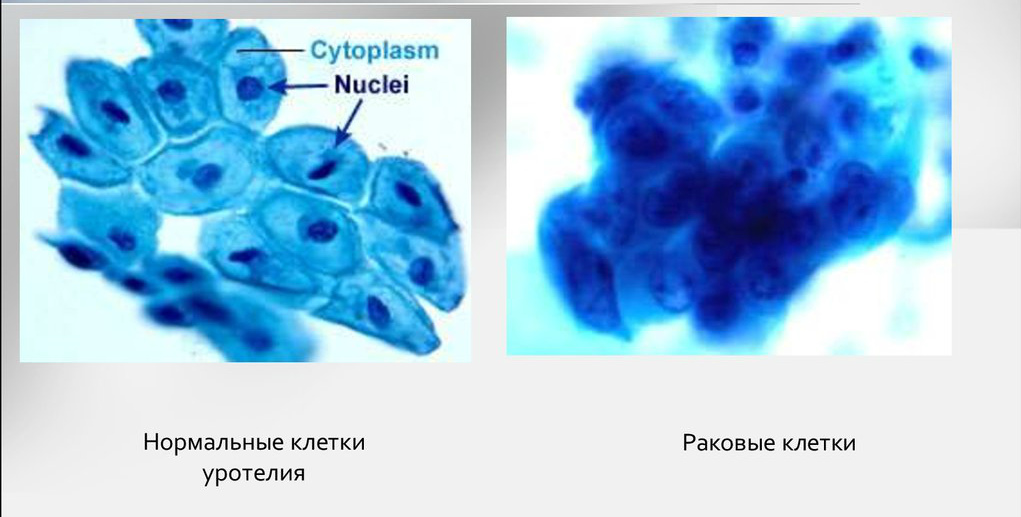
Много информации даёт биопсия. Исследование показывает, что доброкачественные клетки похожи на здоровые, их структура более чёткая. Структура злокачественных клеток сильно изменена из-за выраженных мутаций. Чем меньше клетки напоминают ткань, из которой выросли, тем хуже прогноз для лечения и жизни.
Доброкачественную опухоль, такую как аденома простаты, можно удалить и добиться полного излечения. Если возникнет рецидив, он будет на том же месте, где нашли первичный очаг. Злокачественные образования трудно удалить полностью. Даже одна оставшаяся клетка даст новую опухоль либо на старом месте, либо там, куда она попала по сосудам. Выживаемость больных существенно ниже.
Общие свойства доброкачественных и злокачественных опухолей
Есть моменты, объединяющие оба вида новообразований:
Тяжесть симптомов зависит не только от степени сдавления тканей опухолью, но и от неспособности новообразования выполнять функцию здоровых клеток.
Виды опухолей
Различия не всегда очевидны. Нужна тщательная диагностика для поиска атипичных клеток.
Может ли доброкачественная опухоль стать злокачественной
Любая опухоль способна к малигнизации. Миомы, липомы, фибромы редко переходят в рак. Кисты — крайне редко. Невусы, аденомы, полипы в желудке или кишечнике — очень часто. Многое зависит от условий, в которых находится опухоль, питания, экологии, уровня стресса, гормональных сбоев, наличия предраковых болезней.
В Клинике урологии имени Р. М. Фронштейна доступна современная диагностика опухолей, разработаны эффективные методики лечения. Обращайтесь на консультацию и наши специалисты вам помогут.
Малигнизация
Малигнизация – процесс трансформации доброкачественных клеток в злокачественные. Может происходить в любых нормальных тканях или тканях доброкачественных опухолей. Сопровождается снижением уровня дифференцировки, изменением морфологических свойств, нарушением функции и бурным размножением клеток, прогрессирующим ростом новообразования и развитием отдаленных метастазов. Малигнизацию подтверждают на основании клинических данных, результатов лабораторных и инструментальных исследований. В процессе лечения опухоли обычно применяют хирургические вмешательства, химиотерапию и радиотерапию. Возможно использование гормонов, иммуностимуляторов и других препаратов.
Общие сведения
Малигнизация (озлокачествление, злокачественное перерождение) – сложный патоморфологический процесс, в ходе которого доброкачественные клетки приобретают свойства злокачественных. Малигнизации могут подвергаться как нормальные клетки, так и уже измененные, но не проявляющие признаков злокачественности. Чаще всего очаги озлокачествления возникают в области язв, полипов и различных доброкачественных опухолей. Причиной малигнизации могут стать генетическая предрасположенность и вредные факторы окружающей среды.
На начальных стадиях малигнизация протекает бессимптомно, поэтому ранняя диагностика злокачественных новообразований сопряжена со значительными затруднениями, однако регулярные профилактические осмотры, использование современных лабораторных и инструментальных методов исследования позволяют частично решить проблему раннего выявления малигнизации. Диагностику и лечение осуществляют специалисты в области онкологии, гастроэнтерологии, пульмонологии, неврологии, дерматологии, отоларингологии, гинекологии, ортопедии и врачи других специальностей (в зависимости от локализации опухоли).
В настоящее время злокачественные опухоли являются второй по распространенности причиной смертности после сердечно-сосудистых заболеваний. В 2012 году от рака умерло более 8 миллионов человек. Вероятность малигнизации увеличивается с возрастом, однако, наряду с людьми преклонных лет, злокачественные опухоли нередко поражают детей и пациентов трудоспособного возраста. Самыми распространенными видами рака являются рак легких, рак желудка, рак молочной железы, рак печени и рак толстого кишечника.
Причины малигнизации
Причиной малигнизации клеток является сочетание нескольких факторов, в числе которых специалисты указывают химические канцерогены, особенности окружающей среды, некоторые вирусы, состояния гормонального дисбаланса, возраст, вредные привычки и неблагоприятную наследственность. При проведении исследований было установлено, что малигнизацию могут провоцировать более 2000 различных химических веществ, однако степень их влияния на процессы злокачественного перерождения клеток может сильно различаться.
В перечень химических соединений, безусловно, вызывающих малигнизацию клеток, входят полициклические ароматические углеводороды (источниками являются транспорт, промышленные предприятия и отопительные системы), нитрозамины (содержатся в сигаретах, некоторых сортах пива и амидопирине), производные гидразина (входят в состав гербицидов и некоторых лекарственных средств), асбест и другие минеральные волокна (источником являются промышленные производства), а также некоторые соединения металлов.
Самым значимым физическим фактором малигнизации является солнечное излучение, от уровня которого напрямую зависит вероятность развития рака кожи. Чем светлее кожа и волосы и чем дольше человек подвергается воздействию солнечных лучей – тем выше риск развития меланомы, базалиомы и плоскоклеточного рака кожи. Кроме того, малигнизацию может стимулировать ионизирующее излучение, провоцирующее возникновение лейкозов, костных опухолей (радиоактивный стронций) и рака щитовидной железы (радиоактивный цезий и йод).
Доказано, что вероятность малигнизации повышается при воздействии на клетки определенных вирусов, в частности – вируса ATLV (вызывает лейкоз), вируса Эпштейна-Барр (провоцирует развитие лимфомы Беркитта), вируса папилломы человека (играет определенную роль в возникновении рака шейки матки) и вируса герпеса II типа. Малигнизации также способствуют нарушения гормонального баланса. Гормоны могут напрямую провоцировать озлокачествление, действовать на клетки опосредованно, стимулируя их пролиферацию, оказывать негативное влияние на иммунитет и изменять метаболизм некоторых канцерогенов.
Существенную роль в процессе малигнизации играет генетическая предрасположенность. Описано множество наследственных заболеваний с высокой вероятностью малигнизации, например, системный полипоз кишечника, при котором у большинства пациентов к 40-50 годам развивается рак толстой кишки, или болезнь Дауна, при которой риск развития лейкоза в 11 раз выше, чем в среднем по популяции. Прослеживается связь между малигнизацией и врожденными пороками развития.
Выявляется зависимость между вероятностью малигнизации тканей определенных органов и полом пациента. Мужчины в 2,4 раза чаще страдают опухолями глаз, в 2,1 раза чаще – новообразованиями желудка, в 2 раза чаще – злокачественными поражениями носоглотки, в 1,7 раза – опухолями костей. У женщин вдвое чаще выявляется малигнизация тканей щитовидной железы. Первое место по распространенности у мужчин занимают опухоли дыхательных путей, у женщин – опухоли половых органов и молочной железы. В большинстве случаев вероятность малигнизации у пациентов обоих полов увеличивается с возрастом, однако некоторые виды новообразований чаще выявляются у детей или молодых людей.
В число привычек, оказывающих наиболее сильное влияние на малигнизацию клеток, входят курение, неправильное питание и прием алкоголя. У курящих рак легких развивается в 11 раз чаще; опухоли полости рта, гортани и глотки – в 7 раз чаще; новообразования мочевого пузыря – в 2,2 раза чаще; опухоли поджелудочной железы – 1,7 раз чаще, чем у некурящих. Основными пищевыми привычками, увеличивающими вероятность малигнизации, являются прием большого количества мясной, жирной, острой и пряной пищи, склонность к пересаливанию и употребление недостаточного количества растительной клетчатки. Алкоголь сам по себе не вызывает малигнизацию, но выступает в роли активатора, усиливая воздействие других факторов.
Стадии и этапы малигнизации
Начальной стадией малигнизации является инициация – мутация клеток под воздействием внутренних или внешних вредных факторов. В геноме клетки появляются клеточные или вирусные онкогены – измененные гены, вызывающие рост и размножение дефектных клеток. В организме человека постоянно образуются дефектные клетки, но в норме процесс малигнизации прерывается на этапе инициации, поскольку такие клетки подвергаются апоптозу – регулируемому процессу клеточной гибели. При одновременном выключении генов, вызывающих апоптоз, и активации генов, препятствующих апоптозу, дефектные клетки не погибают, а продолжают развиваться.
При повторном воздействии на клетки того же или другого вредного фактора наступает вторая стадия малигнизации – промоция. Онкогены активизируются, стимулируя пролиферацию дефектных клеток. Однако, даже этого недостаточно для развития злокачественной опухоли. Рост новообразования становится возможным только после прохождения третьей стадии малигнизации – уклонения дефектных клеток от процесса дифференцировки. Уклонение обычно происходит под влиянием определенных микроРНК.
Кроме того, переход на третью стадию малигнизации может быть обусловлен недостатком цитокининов, способствующих переходу клетки на более высокий уровень дифференцировки. Со временем количество низкодифференцированных клеток увеличивается, возникает микроскопический участок измененной ткани. Клетки с преобладающим набором хромосом формируют так называемую стволовую линию – основу опухоли. Одной из особенностей малигнизации является генетическая нестабильность клеток, из-за которой клеточный состав новообразования постоянно меняется, вместо одной стволовой линии появляются другие.
Измененные клетки, утратившие способность реагировать на внешние воздействия (влияние микросреды, иммунный надзор), продолжают активно делиться. Наступает четвертая стадия развития злокачественного новообразования – опухолевая прогрессия. Ткань, изменившаяся в процессе малигнизации, прорастает соседние органы, разрушает стенки кровеносных и лимфатических сосудов. Клетки новообразования попадают в кровь и лимфу, а затем разносятся по организму, «оседая» в лимфатических узлах и отдаленных органах. Из «осевших» клеток формируются новые очаги опухолевого роста – вторичные новообразования (метастазы).
С точки зрения свойств ткани можно выделить следующие этапы малигнизации: гиперплазия ткани, появление участков очаговой пролиферации, возникновение доброкачественной опухоли, образование участков дисплазии, рак in situ (злокачественная опухоль, не прорастающая окружающие ткани), инвазивное злокачественное новообразование. В ряде случаев этап доброкачественной опухоли может отсутствовать. Этапы очаговой пролиферации, доброкачественной опухоли и дисплазии рассматриваются, как предраковые состояния.
Свойства опухоли после малигнизации
Злокачественные новообразования обладают рядом свойств, отсутствующих у любых нормальных клеток и тканей организма:
Злокачественное новообразование: причины появления, виды и стадии развития
Существует более двухсот разновидностей онкологических заболеваний, которые могут развиваться в любой области человеческого организма. Болезнь провоцируется неконтролируемым появлением атипичных мутировавших клеток, что со временем вызывает нарушение работы отдельных органов и систем организма, а также ухудшает общее самочувствие человека.
Проявление симптомов зависит от того, где расположено злокачественное новообразование и какова стадия его развития. Основными симптомами становятся: общая слабость, ухудшение аппетита, резкая потеря веса, субфебрильная температура, чрезмерная потливость, озноб.
Лечение и шансы на полное выздоровление зависят от стадии злокачественных новообразований, их вида и реакции на различные препараты. Чтобы предотвратить появление онкологии или быстро ее обнаружить, важно знать причины болезни и первые симптомы. Если есть подозрения на злокачественное новообразование, рекомендуется обратиться за консультацией опытного врача-онколога. Наилучшую помощь оказывают в иностранных клиниках.
В Турции пациентам обеспечивается максимально эффективное лечение, быструю и точную диагностику, демократичные цены на услуги.
Причины злокачественных новообразований
Ученые определили ряд причин злокачественных новообразований, способных спровоцировать развитие рака. Для удобства их принято разделять на две большие группы: эндогенные и экзогенные.
Рассмотрим подробнее каждую из них.
Эндогенные причины злокачественных новообразований:
Экзогенные причины злокачественных новообразований:
Виды злокачественных новообразований
Злокачественное образование по строению в первую очередь зависит от тканей, в которых оно сформировалось. По этому признаку различают следующие виды злокачественных новообразований:
По принципу деления злокачественных клеток выделяют гистологические, клинические и морфологические виды опухолей.
По сложности строения бывают простые (образование из одного типа ткани) или сложные виды злокачественных новообразований. Также рак различают по органу или системе, в которых он сформировался: костей, кишечника, яичников, кожи, желудка, молочных желез, предстательной железы, шейки матки, легких и т.п.
Виды злокачественных новообразований по строению клеток, на основе которых они развиваются:
Стадии злокачественных новообразований
По степени агрессивности болезни и ее распространению по организму, различают 4 стадии злокачественных новообразований.
Рассмотрим признаки каждой из них:
Стадии злокачественных новообразований определяются после тщательного обследования и консультации врача-онколога.
Путь клетки «из греков в варяги». Малигнизация: причины и следствия
Малигнизация — один из самых загадочных процессов. Что же на самом деле направляет клетку на тернистый путь перерождения?
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Недуг, прозванный чумой XXI века. В наши дни рак является одним из самых страшных заболеваний. В 2010 году более семи миллионов людей по всему свету умерли от рака. В Соединенных Штатах каждая третья женщина и каждый второй мужчина рано или поздно заболеют раком. По прогнозам ВОЗ, число случаев заболевания будет продолжать расти от 14 миллионов в 2012 году до 22 миллионов в следующие десятилетия. Пугающие числа, от которых невольно бросает в дрожь. Однако процесс ракового перерождения, или малигнизации, не только страшен, но и интересен, и в этой статье мы разберемся, почему же некоторые «избранные» клетки решают свернуть не туда и как это влияет на самого «изменника».
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Гончие еще играют во дворе, но дичи не уйти,
как ни мчится она уже сейчас по лесам.
Франц Кафка
На «Биомолекуле» опубликовано немало статей о молекулярных основах канцерогенеза. Но каждая из них, как правило, посвящена какой-то одной стороне этого патологического процесса, в то время как среди наших читателей наверняка есть люди, которые хотели бы, прежде чем углубляться в детали, получить общее представление о раковой клетке. Обзорная статья Анны Батуевой удачно заполняет этот пробел и дает общее представления о ключевых молекулярных механизмах злокачественного перерождения. — Ред.
Под малигнизацией понимают приобретение здоровыми клетками черт злокачественности, которые мы подробно рассмотрим ниже. Процесс злокачественного изменения можно уподобить дичи из цитаты Кафки, ведь клетка, однажды встав на этот путь, не сможет вернуться и получить свое клеточное здоровье обратно. Важную роль в понимании основ перерождения клеток и их дальнейшего функционирования сыграла медицина, а следом за ней и молекулярная биология. Но начнем с истоков истории рака.
Часть 1. Биография рака
Первые упоминания о раке встречаются в папирусе Эдвина Смита, датируемом 16 веком до нашей эры [1]. Там же отмечается, что данное заболевание не поддается лечению.
Во времена Гиппократа, около 400 года до нашей эры, появилось специальное обозначение рака — karkinos. Разросшаяся опухоль напомнила Гиппократу краба, окутывающего все вокруг клешнями. Современное название онкологии произошло от греческого слова onkos, которое греки использовали для описания опухолей. Однако врачи того времени не различали доброкачественные и злокачественные новообразования, и karkinos Гиппократа не имеет ничего общего с истинным раком.
Гиппократ выдвинул гуморальную теорию, суть которой состояла в том, что каждый недуг является следствием переизбытка одного из четырех гуморов: крови, слизи, желтой желчи и черной желчи.
Гален, греческий врач, практиковавший в Риме около 160 года нашей эры, довел теорию Гиппократа до совершенства. Он заявил, что рак образуется из-за переизбытка черной желчи. Гален умер в 199 году нашей эры, но его «черная желчь» еще долго будоражила умы онкологов.
Только спустя пять столетий, в 1538 году, Андреас Везалий опроверг теорию Галена, делая вскрытия в Парижском университете. Окончательно похоронил галенову теорию лондонский анатом Мэтью Бейли, который в 1793 году опубликовал учебник «Патологическая анатомия некоторых наиболее важных частей человеческого тела» [2], в котором представил рисунки и описания раковых опухолей, где не было и следа «черной желчи».
Изобретение микроскопа повлекло за собой первые цитологические исследования рака. В 1801 году французский физиолог Франсуа Биша и в 1838 году Иоганн Мюллер определили, что опухоли имеют клеточную структуру. После этого Жан Крювелье высказал гипотезу «канцероматозной дегенерации», основанную на предположении, что клетка проходит несколько этапов, прежде чем окончательно превратиться в раковую. Немецкий хирург Карл Тирш доказал, что раковая опухоль происходит из эпителиальной ткани, а саркома — из соединительной.
Первая половина XX века породила еще одну теорию канцерогенеза, недалеко ушедшую от истины. В 1911 году Пейтон Раус, работая в Рокфеллеровском университете в Нью-Йорке, открыл вирус, способный вызывать опухоли у кур. Ученые по всему свету бросились искать вирусы, ответственные за рак именно у человека, однако ничего не могли найти. В 1974 году в Medical World News вирус рака у человека ставили в один ряд с НЛО, снежным человеком и лохнесским чудовищем. Вирус СВ-40 и вирус папилломы человека, вызывающие рак у людей, были открыты в 1960 и 1983 годах соответственно.
В 1970 году генетик Говард Темин, работавший в лаборатории Макардла в Висконсине и изучавший вирус саркомы Рауса (ВСР, или VSR), представил свою работу на Десятом Международном онкологическом конгрессе. Он открыл у ВСР обратную транскрипцию — синтез ДНК по РНК — и положил начало изучениям ретровирусов. Позднее он отказался от вирусной теории канцерогенеза, а в 1979 году ученые Майкл Бишоп и Харолд Вармус открыли первый протоонкоген — src (сарк), содержащийся в ВСР. Это положило начало новому этапу в истории онкологии, люди наконец-то поняли, как запускается процесс канцерогенеза. Но этого бы не произошло без изучения раковой клетки и ее странной физиологии.
Часть 2. Что заставляет клетку измениться?
В этой главе мы разберем причины злокачественного перерождения клетки. Первым толчком к началу этого изменения является мутация в ДНК.
Но не всякие повреждения ДНК обязательно приведут к появлению раковой клетки, а лишь те, что затронут определенные гены. Наиболее важную роль в канцерогенезе играют три группы генов: протоонкогены, онкогены и гены — супрессоры опухолей.
Протоонкогены
Протоонкогены — это «здоровые» предшественники онкогенов, которые в результате мутации могут вызвать развитие опухоли. Такими причинами являются различные мутации или суперэкспрессия гена. Как правило, протоонкогены кодируют белки, участвующие в процессах жизненного цикла клетки. В результате мутаций появляются сбои в регуляции клеточного деления и дифференцировки.
Основные изменения, происходящие с протоонкогенами:
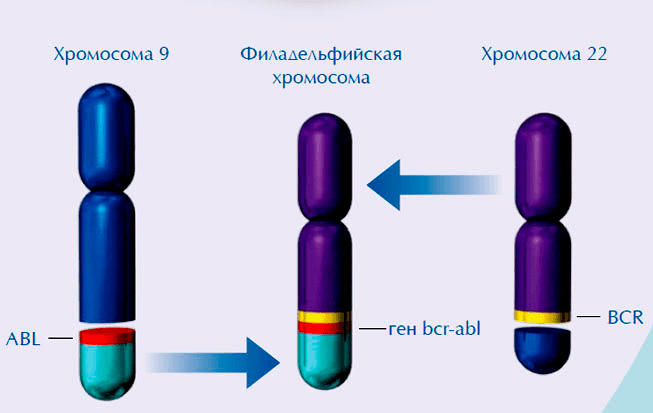
Рисунок 1. Химерный ген BCR-ABL образуется при слиянии участка 9 хромосомы, несущей ген ABL, с участком 22 хромосомы, несущей ген BCR
В некоторых случаях канцерогенез запускается вирусами. Онкогены в геноме вирусов являются ранее захваченными в клетках-хозяевах нормальными генами, которые со временем превратились в злокачественные. Когда такие онкогенные вирусы попадают в клетку, начинается считывание информации с вирусной ДНК или РНК, в цитоплазме накапливаются онкогенные белки и начинается процесс перерождения.
Онкогены
Онкогены — это гены, активность которых стимулирует образование и развитие злокачественной опухоли. Как уже было упомянуто выше, первый вирусный онкоген был открыт в 1979 году.
Биохимические продукты онкогенов
Онкогены кодируют белки с различной структурой и функциями. К основным продуктам деятельности онкогенов относят:
Все вышеперечисленные продукты онкогенов являются сигналами к запуску неконтролируемого клеточного деления. Внешние факторы больше не играют никакой роли в жизни клетки, потому что пролиферацию запускают внутренние сигнальные белки.
Гены и белки — супрессоры
В здоровой клетке существуют защитные механизмы, следящие за процессами и регулирующие клеточный цикл. К таким механизмам относят деятельность белков — супрессоров опухолей: p21, p53, pRb, PTEN и др.
Белок p53 — наиболее изученный белок-супрессор. Он является продуктом гена TP53, мутации которого обнаруживаются в клетках многих опухолей [7]. p53 синтезируется во всех клетках организма, но активируется только при повреждениях ДНК. Этот белок способен остановить клеточный цикл и не допускать дальнейшее деление клетки, пока не произойдет репарация ДНК. При сильных повреждениях он также может запускать процесс апоптоза.
Одной из главных функций p53 является сохранение генетической идентичности всех клеток организма. При неправильной работе этого белка клетка получает возможность делиться даже при поврежденной ДНК, что увеличивает вероятность мутаций и накопления дефектных онкогенов. Важную роль в подавлении p53 играет белок MDM2, который в норме регулирует активность p53. Однако при повышенном синтезе он связывается с p53 и ингибирует его противоопухолевое действие.
Эпигенетические факторы рака
Важными факторами канцерогенеза являются эпигенетические события. Эпигенетика изучает процессы, затрагивающие активность генов, но не изменяющие структуру ДНК. К ним относится изменение метилирования ДНК.
Метилирование — это присоединение метильной группы к нуклеотидам в особых, строго определенных участках генома, называемых CpG-островками. Такое изменение не влияет на структуру молекулы, однако может влиять на экспрессию отдельных генов. В частности, если в участке ДНК много метильных групп, то транскрипция этого участка прекращается.
Особенно активно метилирование проходит в эмбриональный период жизни, а у взрослого человека метилировано около 2% генома. В норме баланс между метилированием и деметилированием строго регулируется и соблюдается, однако в старости начинают преобладать процессы метилирования, что может в итоге привести к канцерогенезу. В процессе онкогенеза происходит гиперметилирование CpG-островков, что приводит к общей геномной нестабильности и накоплению еще большего количества мутаций. В большинстве случаев метилированные участки являются промоторами и влияют на активацию или, наоборот, инактивацию генов, что с виду похоже на действие точечных мутаций.
Однако хотя нарушения в эпигенетической регуляции сопровождают развитие злокачественного перерождения, они, как правило, не являются его первопричиной, а лишь одним из сопутствующих факторов.
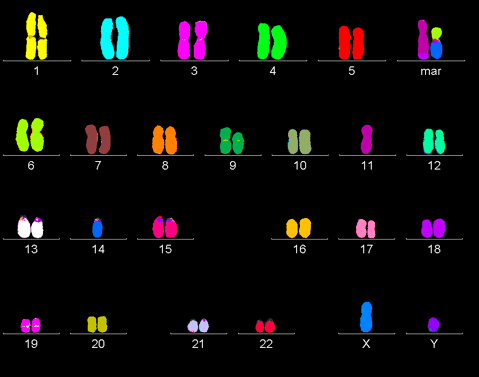
По отдельности каждое из вышеперечисленных нарушений не может спровоцировать раковое перерождение. Все они работают совместно и слаженно. Так, онкогенез запускается, только если одновременно активированы онкогены и инактивированы гены-супрессоры в обеих копиях ДНК. Впервые теорию двойного канцерогенеза высказал Альфред Кнудсон, изучавший ретинобластому: «По всей видимости, — писал он, — в возникновении рака у детей ключевую роль играют два типа генов. Первый, онкогены, действует посредством повышенной, аномальной активности. Второй же класс, антионкогены, в онкогенезе рецессивен: рак происходит лишь тогда, когда обе нормальные копии удалены или изменены» [8]. В процессе жизнедеятельности раковая клетка накапливает все большее количество мутаций, поэтому раковый геном часто очень сильно отличается от генома здоровой клетки (рис. 2).
Рисунок 2. Раковый геном. В процессе жизнедеятельности раковая клетка накапливает огромное количество мутаций и нередко характиризуется полиплоидностью.
Часть 3. Физиологические последствия малигнизации
Основное последствие малигнизации — клеточное бессмертие. Оно может поддерживаться несколькими способами: активацией фермента теломеразы, блокировкой регуляторов митохондриального пути апоптоза и в некоторых случаях активацией механизма ALT (alternative lengthening of telomeres, альтернативного удлинения теломер [14]).
Обратная сторона «вечной молодости»
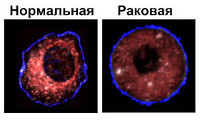
Впервые клеточное бессмертие раковых клеток было продемонстрировано в 1951 году на клеточной линии HeLa, взятой у Генриетты Лакс, вскоре скончавшейся от рака шейки матки (рис. 3) [9].
Рисунок 3. Клеточная линия HeLa — «бессмертная» линия раковых клеток. С 50-х годов прошлого столетия используется для изучения поведения раковых клеток и выявления новых противораковых препаратов.
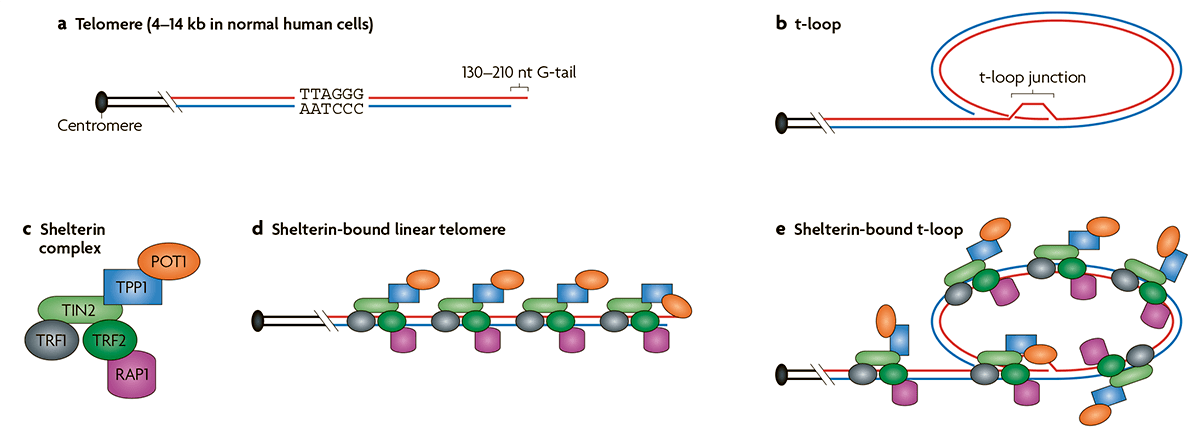
Как правило, малигнизация сопровождается активацией фермента теломеразы. На концах хромосом находятся короткие повторяющиеся участки ДНК, названные теломерами [10]. После каждого деления теломеры укорачиваются, что в итоге приводит к их полному исчезновению и невозможности продолжать деление. Количество возможных делений для клетки названо пределом Хейфлика. Действие теломеразы заключается в восстановлении теломер и превращении клетки в фактически бессмертную, позволяя ей делиться бесконечно долго. Существуют нормальные клетки, в которых также экспрессируется теломераза. Это клетки, которым надо часто делиться: половые, стволовые и клетки эпителия кишечника. Однако теломераза активна в подавляющем большинстве раковых клеток, что играет важную роль в их жизненном цикле.
С другой стороны, в некоторых злокачественных клетках, наравне с активной теломеразой, существует так называемое альтернативное удлинение теломер, или сокращенно ALT [11]. При ALT происходит гомологичная рекомбинация концевых участков хромосом (рис. 4). В норме рекомбинация происходит в процессе мейоза, однако раковые клетки научились достраивать теломеры, используя теломеры другой хромосомы как матрицу [12].
Рисунок 4. Принцип действия ALT, основанный на гомологичном достраивании концов теломер. Такой механизм «бессмертия» является основным для ряда опухолей.
Важно отметить, что раковое бессмертие контролируется не только теломерами, но и ингибированием путей апоптоза, главным из которых является митохондриальный путь. В норме, из митохондрий в цитоплазму выходят митохондриальные белки и образуют апоптотический комплекс — апоптосому, которая и запускает апоптоз. При неправильной работе регуляторных белков, а к ним относятся белки семейства BCL-2, нарушается выход апоптотических белков, что приводит к сбою в процессе апоптоза. В раковых клетках обнаружены нарушения в работе белков BAX и BAK, а также экспрессия ингибиторов клеточной смерти.
Часть 4. Заключение
Ежедневно в нашем организме появляются клетки, вступившие на путь ракового перерождения. Но далеко не все из них дойдут до конца и образуют злокачественную опухоль. С другой стороны, интересно клеточное поведение в процессе малигнизации, когда клетка способна «выключать» отдельные гены, мешающие ее перерождению. Современные исследования в области молекулярной онкологии и раковой геномики дают повод надеяться на окончательное понимание основ малигнизации и физиологии злокачественных клеток. Также в последнее время проводятся разработки новых противораковых препаратов, направленных на исправление дефектных сторон «больных» клеток. Возможно, изучение именно особенностей раковой клетки приведет к созданию лекарства, способного снизить страшные прогнозы Всемирной организации здравоохранения.