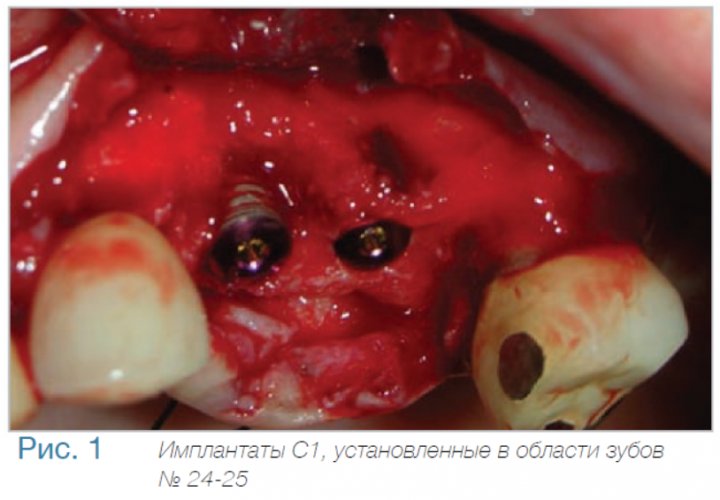
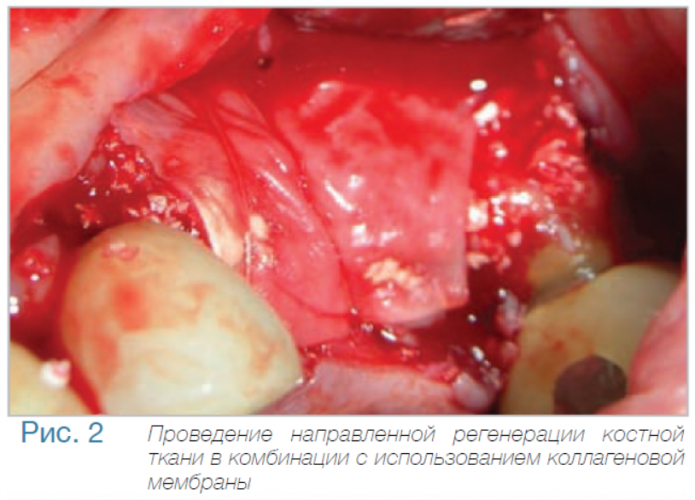
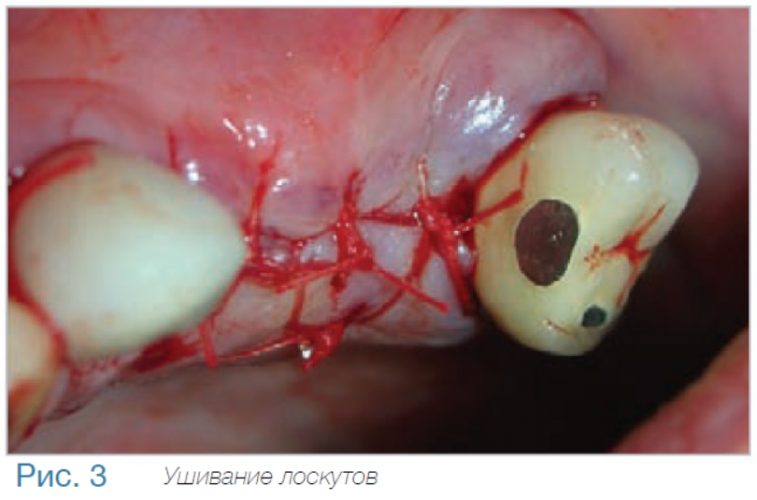
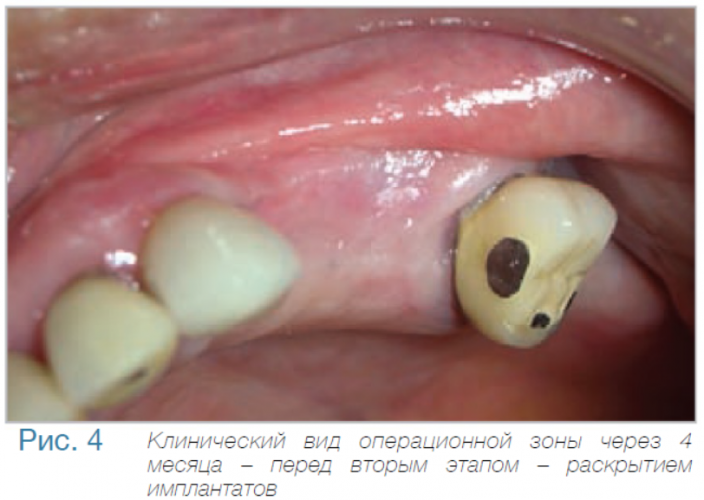
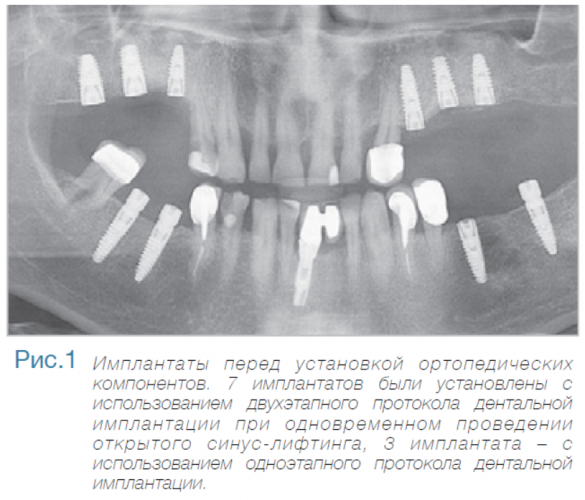
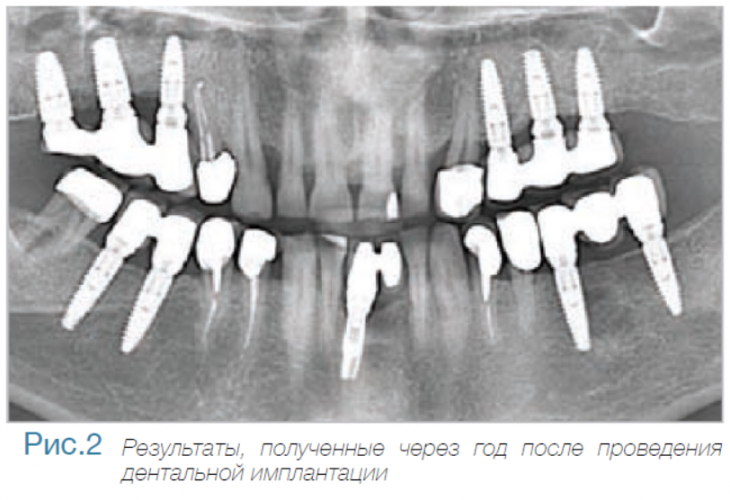
Маргинальная кость что это
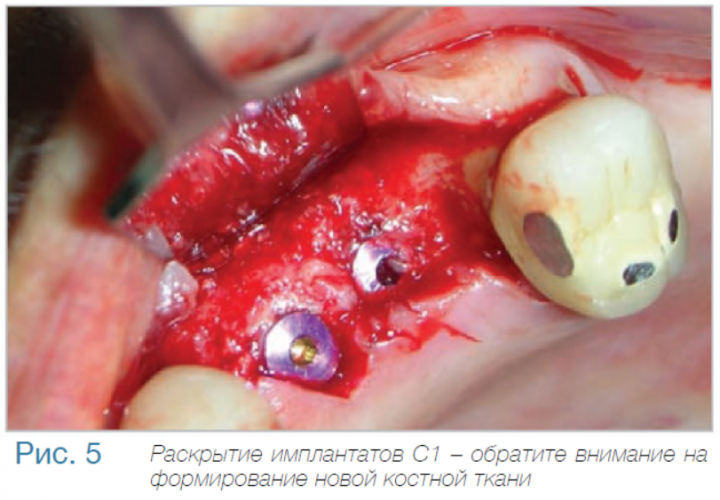
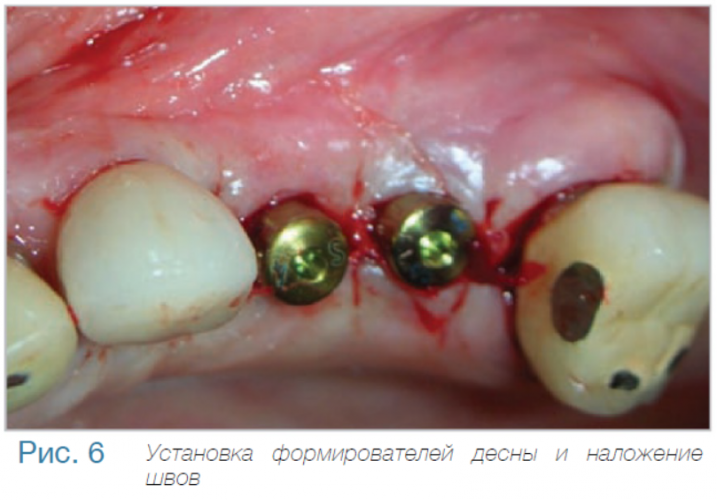
Уровень маргинальной костной ткани вокруг имплантата C1 с коническим соединением и переключением платформ: (годовой период наблюдения).
Предпосылки и цель
Согласно данным многочисленных долгосрочных клинических исследований с использованием различных систем имплантатов с плоскостным соединением, утрата маргинальной костной ткани вокруг имплантатов может составлять 1,5 — 2 мм через год после их установки. В последние годы были разработаны специальные концепции, позволяющие минимизировать резорбцию костной ткани вокруг имплантатов в области вершины альвеолярного гребня. Одной из таких концепций является принцип переключения платформ. В его основе лежит метод использования абатментов с диаметром меньшим, чем диаметр платформы имплантата. Максимальная герметичность в имплантатах с коническим соединением также обеспечивает решение проблемы наличия микрозазора на уровне имплантата/абатмента, характерного для имплантатов с плоскостным соединением. Переключение платформы на имплантатах с коническим соединением позволяет дополнительно минимизировать резорбцию костной ткани вершины альвеолярного гребня (в крестальном отделе).
Целью данного исследования было: выявить возможность повлиять на уровень крестальной кости альвеолярного гребня, вокруг имплантата с коническим соединением и переключением платформы, а также сохранить устойчивым уровень кости в течение первого года эксплуатации.
Материалы и методы
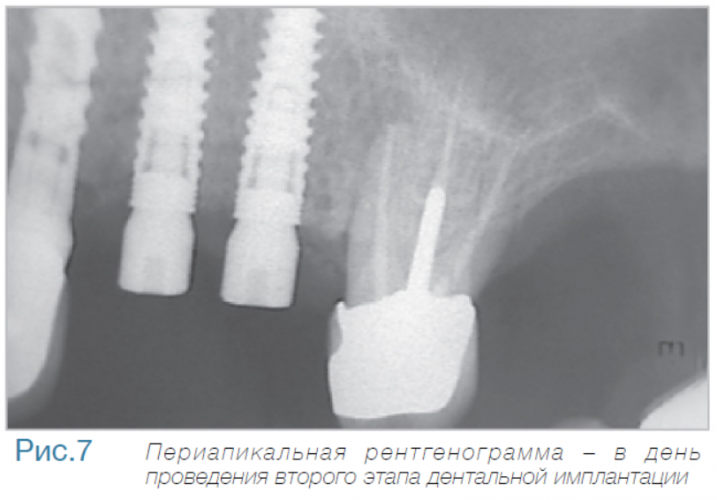
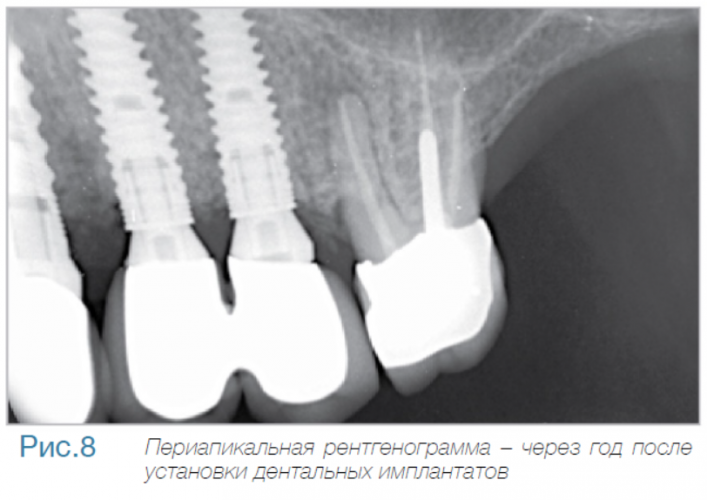
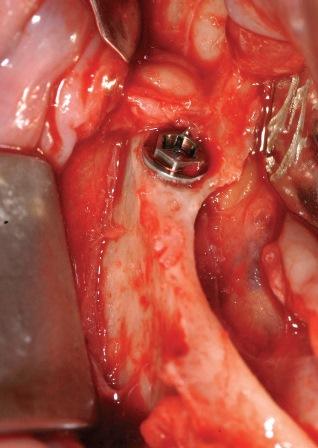
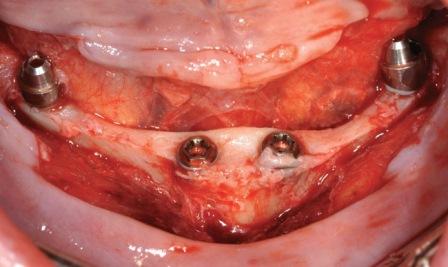
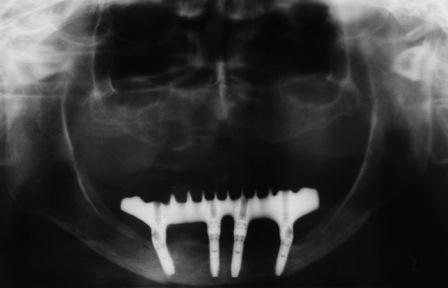
В частной практике (LS) были установлены 30 имплантатов MIS С1 (конических, с внутренним коническим соединением с переключением платформ). В исследовании приняли участие 10 мужчин и 8 женщин, при этом средний возраст пациентов составил 57 лет (возрастной диапазон 35-75 лет). 6 пациентов были курильщиками. 9 имплантатов установили на верхней челюсти, 21 – на нижней челюсти, 13 – во фронтальной области, 17 — в области боковых зубов. Для 10 имплантатов был использован одноэтапный протокол имплантации, для 20 — двухэтапный. Керамические реставрации были зафиксированы на имплантатах через 3 (18) и 6 (12) месяцев после их установки. Уровень маргинальной костной ткани с мезиальной и дистальной сторон имплантатов измерили с помощью рентгенограмм непосредственно в день установки дентальных имплантатов (исходный уровень), в день раскрытия (через 3 или 6 месяцев после установки) и ровно через год после проведения дентальной имплантации.
Клинический случай №1
Клинический случай №2
Результаты
Ни один из имплантатов не был утрачен в течение первого года после установки, что означает 100% уровень приживаемости по прошествии года. Сокращение маргинальной кости за этот промежуток времени от имплантата до крестальной кости составило 0.7 ± 0.47 мм. Так же отсутствовала разница в сокращении уровня маргинальной кости между имплантатами, установленными по одноэтапному и двухэтапному протоколам.
Заключение
Данное исследование, проведенное в частных клиниках, выявило минимальную потерю маргинальной кости, а также 100% приживаемость спустя год после установки для имплантатов С1 с коническим соединением и абатментом с переключением платформы. Результаты показали значительно большую устойчивость крестальной кости для имплантатов с коническим соединением и переключением платформ, в сравнении с имплантатами с плоскостным соединением, описанными в научной литературе.
Дополнительная информация
Имплантаты и ортопедические компоненты были любезно предоставлены компанией MIS Implants. Финансовая поддержка исследования со стороны компании отсутствовала.
* Департамент пародонтологии, Еврейский университет – Хадас факультет стоматологии, Иерусалим Израиль.
Немедленная реабилитация нижней челюсти с атрофией тяжелой степени при помощи полного протеза с фиксацией на четыре имплантата
Немедленная нагрузка установленных имплантатов протезом полного зубного ряда на верхней и нижней челюстях сегодня становится предсказуемой процедурой, ассоциируемой с высоким уровнем удовлетворенности пациентов касательно эстетики, фонетики и функциональности.
Реабилитация нижней челюсти с тяжелой атрофией при помощи протеза с опорой на имплантаты часто весьма затруднительна по причине плохого качества и недостаточного количества оставшейся костной ткани, особенно у пациентов, долго живших с полным отсутствием зубов. Большинство пациентов, использующие полные съемные протезы, жалуются на прогрессирующую потерю стабильности конструкции при жевании разговоре, поэтому они требуют провести несъемное протезирование. Более того, прогрессирующая убыль костной ткани в боковом сегменте нижней челюсти может привести к постепенному обнажению альвеолярного нерва, что также способствует развитию болевого синдрома при носке протеза. В приведенном клиническом случае постановка имплантатов, даже коротких по длине, может быть расценена как противопоказания из-за опасности повредить нерв. Костная аугментация представляет собой возможное решение для постановки имплантатов в заднем сегменте, но такая форма вмешательства часто принимается пациентами отрицательно.
Комбинирование применение аксиально и наклонно расположенных имплантатов также может служить возможной альтернативой для лечения беззубой челюсти, что отражалось в литературе несколько лет назад. Инклинация имплантата тщательно планируется хирургом для предотвращения травмы важных анатомических структур. В тоже самое время, при подходящей длине имплантатов и правильной оси внедрения достигается высокая стабильность имплантатов, что обеспечивает немедленную реабилитацию.
Весьма удовлетворительным для пациента может считаться лечения фиксированным протезом на небольшом количестве имплантатов.
Цель данной статьи сообщить предварительные выводы клинического исследования немедленной реабилитации нижней челюсти с тяжелой атрофией при помощи фиксированного протеза полного зубного ряда с опорой на четыре имплантата.
Материалы и методы
Клинически исследование было проведено согласно принципам Хельсинской декларации 1975 года в пересмотре 2000. Все пациенты были проинформированы о целях исследования, а возможном альтернативном лечении, после чего получено их письменное согласие. Лечение производилось в двух различных стоматологических клиниках. Все хирургические операции были проведены хирургом с достаточным опытом работы по постановке имплантатов.
Критерии отбора пациентов
Критерии отбора включали пациентов, которые:
1. Достигли 18-летнего возраста любой расы и пола
2. Пациенты с хорошим состоянием общего здоровья, способные подвергнуться хирургическим и восстановительным процедурам (ASA-1/ASA-2).
3. Полное отсутствие зубов на нижней челюсти или с наличием зубов с плохим прогнозом
4. Адекватная высота и толщина кости в интерфораминальном пространстве, позволяющие установить имплантаты по крайней мере длинной 10 мм и 4 мм шириной.
5. Наличие тяжелой атрофии в заднем сегменте нижней челюсти (IV-VI класс по классификации Cawood&Howell), при которой высоты и толщины кости для постановки имплантата недостаточно без предварительной костной аугментации
6. Пациенты, которые проявляют желание провести несъемное протезирование, но отказываются от костной аугментации
7. Все конструкции должны быть установлены с окончательным торком по крайней мере 30 Ncm
Если один из имплантатов не может быть установлен с торком >=30 Ncm, а другие имплантаты выполняют данный условия, то немедленная нагрузка по-прежнему возможна. Если два или более имплантата не достигают требуемой стабильности, то все имплантаты оставляются на 2 месяца для заживления до постановки временной конструкции.
Из исследования исключались пациенты, если отмечалось наличие: острой инфекции в месте имплантации, гематологического заболевания, серьезных проблем с коагуляцией, заболеваний иммунной системы, некомпенсированных диабетов, метаболических заболеваний, поражающих кость, беременность или лактация, тяжелых формы бруксизма или стираемости, иррадиирующих болей головы и шеи последние 60 месяцев, неадекватного уровня гигиены, плохой мотивации участвовать в исследовании.
Перед вмешательством выполнены снимки ОПТГ, КТ, а также проведен тщательный клинический осмотр. Все пациенты из исследования будут находиться под мониторингом в течение следующих 5 лет. На фото 1 изображена ортопантомограмма пациента с полностью беззубой нижней челюстью с наличие атрофии в заднем сегменте, которая будет применяться в качестве примера описания техники.
Фото 1: ОПТГ до вмешательства с беззубой нижней челюстью и тяжелой атрофией заднего сегмента. Отмечается близкое расположение нижнего альвеолярного нерва.
Протокол хирургического вмешательства
За три дня до вмешательства и затем в течение 7 дней после пациентам было назначено полоскание полости рта раствором хлоргексидина 0,2% (Curasept, Curaden Healthcare s.r.l., Milan, Italy). Все операции проводились под местной анестезией артикаина с адреналином 1:100 000 (Alfacaina N, Weimer Pharma, Rastat, Germany) и внутривенной седации диазепамом (Valium 5 mg, Roche, Milan, Italy). За час до вмешательства назначено 2 г амоксициллина и клавулановой кислоты (Augmenin, Roche, Milan, Italy) и затем по 1 г дважды в день в течение 7 дней. При болях после операции рекомендовано принимать анальгетики (Naprossene Sodico Synflex Forte), Recordati, Milan, Italy).
Фото 2 демонстрирует клиническую ситуацию вскоре перед началом хирургического этапа. Разрез выполнен с лингвальной стороны гребня для предотвращения повреждения альвеолярного нерва. Размер разреза сохраняется максимально малым, чтобы не допустить крупного кровотечения и уменьшить дискомфорт пациента. После отделения лоскута и идентификации подбородочного отверстия, хирург определяет длину ментального нерва и форму кости атравматичным инструментом.
Фото 2: Фотография нижней челюсти того же пациента до хирургического вмешательства, показывающая сокращенную ширину заднего гребня.
Все зубы с плохим прогнозом были удалены, а лунки тщательно кюретированы. Где необходимо, проведена пластика альвеолярного гребня вращающимися борами и фрезами. Каждому пациенту установлено по четыре интерфораминальных имплантата (Branemark System MKIV или NobelSpeedy Groovy, Nobel Biocare AB, Goteborg, Sweden). Один имплантат установлен в позицию латерального резца, обходя ментальный нерв. Два наиболее дистальных имплантата установлены в первую очередь (Фото 3). Для того чтобы задействовать максимальное количество доступной кости и сократить консольность протеза, место под имплантат препарировано с расположением бора дистально примерно в 30 градусов к окклюзионной плоскости, вблизи альвеолярного нерва.
Фото 3: Фото дистального имплантата под наклоном вскоре после постановки
Два передних имплантата фиксированы аксиально (Фото 4).
Фото 4: Четыре имплантата в полости рта после постановки
В начале просверливания отверстия клиницист определяет плотность кости. Место под имплантат может быть оставлено слегка недопрепарировано, чтобы избежать прокручивание и достигнуть максимальной стабильности.
Для постановки имплантатов использован контролер торка с лимитом в 50 Ncm (Osseocare, Nobel Biocare AB), а также ручной ключ в случаях неполной посадки имплантата.
К имплантатам были подсоединены абатменты multi-unit (MUA Nobel Biocare AB). На дистальных имплантатах установлены имплантаты с ангуляцией 17-30 градусов по отношению к продольной оси для получения оптимальной ориентации при фиксации протеза, в то время как на передние имплантаты фиксированы прямые абатменты. После позиционирования аналогов, мягкие ткани ушиты 5-0 резорбируемым шовным материалом (Monocryl или Vicryl, Johnson and Johnson Intl, St.Stevens Woluwe, Belgium), а затем изготовлены слепки силиконовой массой из поливинисилоксана (Elite Implant Impression Material, Zhermack, Badia Polesine, Rovigo, Italy). После этого на абатменты надеты заживляющие колпачки.
Через 48 часов после операции пациенту предоставлен акриловый временный протез с 10 зубами с ограниченными центральными и латеральными контактами в интерклыковой зоне. Выполнена ОПТГ для контроля позиции имплантатов и положения протеза.
После оперативного вмешательства пациенты были проинструктированы избегать чистки и любой травмы в зоне операции. Холодная пища рекомендована на первый день и щадящая диета на первую неделю.
Спустя 4-6 месяцев нагрузки, при отсутствии боли и признаков воспаления, пациенты получили постоянные протезы, изготовленные из акрила при использовании системы CAD-CAM Procera (Nobel Biocare AB).
Сбор информации и наблюдение
Все данные по поводу качества и количества костной ткани, характеристик имплантатов, торка, наличие расхождения или фенестрации отмечены в специальной форме в момент операции.
Контрольные осмотры пациентов назначены раз в неделю в течение первого месяца после операции. Во время каждого визита производилась оценка функциональности и степени заживляемости тканей. Уровень гигиены полости определялся каждые три месяца в течение первого года.
Каждый 6 месяцев первые два года, а затем ежегодно в течение 5 лет, выполнялись ОПТГ и, если возможно, прицельные рентгеновские снимки, для определения уровня кости вокруг имплантата. Фото 5 – ОПТГ, выполненная через 1 год, демонстрирующая стабильность уровня костного гребня.
Фото 5: ОПТГ спустя 1 год, очевидна стабильность уровня костного гребня
На каждом контрольном визите определялся уровень налета и кровоточивости на уровне имплантата. Каждый имплантат оценивался с 4-х плоскостей (мезиальной, дистальной, вестибулярной и лингвальной), в целом 16 оценок для каждого пациента. В любом месте, где налет мог быть выявлен невооруженным взглядом или при помощи зонда, вне зависимости от количества налета, засчитывалось 6,25% (1/16) от общей суммы (100%). Тоже самое производилось при оценке кровоточивости при зондировании.
Также производилась проверка окклюзии и подвижности протеза. Все жалобы касательно протеза тщательно регистрировались.
Удовлетворенность пациентов функцией, эстетикой и фонетикой оценивались при помощи анкет на этапе 6, 12 и 24 месяцев. Ответы базировались на 5 бальной шкале от 1(плохо) до 5 (отлично).
Спустя 1 год протезы сняты, и стабильность каждого имплантата проведена при помощи надавливания двумя инструментами.
Итоговые значения в данном исследовании оценивались следующим образом:
1. Стабильность протеза: протез находится в функции, отсутствует подвижность и боль. Стабильность проверяется надавливанием двумя инструментами.
2. Неудача протезирования: ситуация, когда протез должен быть удален по какой-либо причине
3. Приживаемость имплантата: отсутствие зоны просветления в тканях вокруг имплантата, отсутствие боли и подвижности в зоне имплантации, а также любого патологического процесса, жалоб, невропатий, парестезией
4. Изменение маргинального уровня кости: Каждая рентгенограмма сканирована на 600 dpi (Epson Perfectio Pro, Epson Italia, Cinisello Balsamo MI, Italy), а затем маргинальный уровень кости оценен при помощи аналитических программ (UTHSCSA Image Tool версия 3.00 для Windows, University of Texas Health Science Center in San Antonio, TX, USA) отдельным независимым наблюдателем. Шейка имплантата являлась отсчетом для каждого измерения. Утрата ткани вокруг имплантата подсчитывалась как разница между изначальным уровнем маргинальной кости и уровнем, выявленным на контрольном осмотре. Утрата кости вокруг наклоненных и аксиальных имплантатов сравнивалась при помощи парного t-теста. P=.05 считалось статистически значимым значением.
Результаты
С февраля 2005 по июнь 2007 20 пациентов с атрофией альвеолярного гребня нижней челюсти тяжелой степени (8 мужчин и 12 женщин, средний возраст на момент хирургического вмешательства 60,8+-8,8 лет, интервал 44-77 лет) получили реабилитацию с немедленной нагрузкой протеза полного зубного ряда с опорой на четыре интерфораминальных имплантата. Четыре участника являлись курильщиками и в среднем выкуривали 15 сигарет в день. Зубы-антагонисты представляли собой: съемные протезы (11 случаев), собственные зубы и несъемные протезы (4 случая), протезы с опорой на имплантаты (5 случаев).
Всего установлено 80 имплантатов : 12 Branemark System MKIV и 68 NobelSpeedy Groovy. Все имплантаты имели диаметр 4 мм, в то время как длина варьировала от 11,5 до 15 мм. Тринадцать имплантатов были установлены в свежие лунки удаленных зубов у семи пациентов. Все имплантаты фиксировались при торке по крайней мере 50 Ncm.
Все пациенты получили временный протез через 48 часов после операции. В процессе оперативно вмешательства и изготовления протезов не зафиксировано никаких осложнений.
Процесс мониторинга проводился в период 20-48 месяцев (среднее 30,1+- 8,6 месяцев). На время написания статьи получены данные по 12 пациентам со сроком после вмешательства 2 года. Все пациенты наблюдались на запланированных визитах. Не получено ни одного случая отторжения, что привело к 100% общему уровню приживляемости. Все протезы стабильны и участвовали в функции. Побочных эффектов не выявлено.
Изменение маргинального уровня кости
Другие параметры
Прогрессивное повышение количества налета и кровоточивости наблюдалось в течение первого года. Индекс налета составил 11,8+-4,9% и 8,1+-6,0% на этапе 6 и 12 месяцев соответственно. Индекс кровоточивости в среднем 3,8+-4,1% и 2,0+-2,2% на этапе 6 и 12 месяцев соответственно.
Восемнадцать пациентов участвовали в опросе на удовлетворенность лечением спустя 12 месяцев: эстетика (форма зубов, цвет, облик улыбки) оценена как отлично или очень хорошо 66,7% пациентов, фонетика и жевание признаны как отличные или очень хорошие 77,8 и 88,9% пациентов соответственно. Средняя длина консоли в постоянном протезе составила 15,2+-1,4 мм.
Обсуждение
Данное исследование было проведено с целью выявления оптимальной техники реабилитации пациентов в тяжелой формой атрофии заднего сегмента нижней челюсти. Предварительные итоги лечения этих пациентов показали, что такая техника может иметь прекрасный прогноз, по крайней мере, на короткий срок.
Потеря премоляров и моляров, а также восстановление жевательной функции при помощи полного съемного протеза на протяжении многих лето приводит к тяжелой атрофии альвеолярной кости в ретрофораминальной зоне с постепенным обнажением нижнего альвеолярного нерва. Это может обуславливать болевой синдром и неприятные ощущения при жевании вместе с прогрессирующей убылью доступной кости, что само по себе является неблагоприятным условием для постановки имплантатов согласно стандартному протоколу.
В данной ситуации хирургическое вмешательство с целью постановки имплантатов должно запланировано согласно индивидуальным анатомическим особенностям пациента в заднем сегменте нижней челюсти. Обычная техника разреза посередине гребня может повредить нерв, повышая риск невропатий, парестезий или вызвать анестезию нижней губы и подбородка. Поэтому при работе в опасной близи к нерву, работа скальпелем должна проводиться вдоль язычной стороны гребня, чтобы предотвратить повреждение.
По этим причинам становится важным определить и изолировать место выхода нерва, а также отследить ход нерва диагностическими способами.
Для реабилитации полностью беззубой нижней челюсти, особенно в случаях полной убыли гребня, идеальный подход должен преследовать следующие цели: минимизация количества имплантатов, сокращения длины консоли без снижения функциональности, сокращение времени и стоимости лечения. Последнее может быть достигнуто протокол с немедленной нагрузкой имплантатов. Полный съемный протез может стать весьма экономичным решением для быстрой реабилитации полностью беззубой нижней челюсти. Однако из-за опоры на слизистую в заднем сегменте пациенты могут ощущать боль в результате сдавления ретрофораминальной зоны в процессе жевания.
Представленная техника является модификацией техники «Все на четырех», предложенной ранее Malo и его коллегами. Главное отличие заключается в отборе пациентов только с тяжелой формой атрофией нижней челюсти. Это требует введение задних имплантатов под наклоном и с индивидуальной адаптацией. Ось введения имплантата выбирается согласно анатомическим условиям и ходу нижнечелюстного нерва для каждого отдельного пациента. Также особенность таких пациентов заключается в ом, что из-за тонкости альвеолярного отростка, прицельные рентгеновские снимки не всегда возможно выполнить, так как пленка зачастую размещается некорректно. В таких ситуациях для оценки костной ткани могут применяться только ОПТГ. Даже хотя разрешение прицельных снимков выше, чем у панорамных, последние хорошего качества могут свободно использоваться для оценки контакта имплантата и кости. В описанном случае, данные полученные от прицельных снимков и ОПТГ практически одинаковые.
Анализ опросов пациентов показал высокую удовлетворенность таким методом лечения. Многие из участвовавших пациентов носили съемные протезы долгое время, при этом имели желание провести несъемное протезирование. Для них предложенное лечение оказалось оптимальным решением со стороны функции, времени и общей стоимости.
Состояние полного отсутствия зубов часто негативно влияет на общее здоровье и качество жизни из-за недостаточного жевания, плохой фонетики, боли и неудовлетворенности эстетикой. Терапия имплантатами часто предлагает значительные преимущества у пациентов с беззубыми челюстями. Результаты настоящего исследования находятся в согласии с другими исследованиями, которые ставили задачу оценить качество реабилитации пациентов при протезировании протезом полного зубного ряда с опорой на имплантаты.
Высокие результаты лечения, описанного в данной статье, можно также соотнести с регулярными визитами пациентов для контрольных осмотров. Было отмечено снижение скопления налета и уровня кровоточивости, что отражает должное следование инструкциям по гигиене полости рта. В данном примере роль гигиенистов заключалась не только в тщательной очистке, но и созданию должной мотивации и просвещению.
Заключение
Данный протокол реабилитации с немедленной нагрузкой может считаться как рекомендуемая техника при протезировании нижней челюсти с тяжелой атрофией, приводящая к высоким клиническим результатам и полной удовлетворенности пациентов. Для подтверждения эффективности данной хирургической техники необходима оценка отдаленных результатов.
Авторы:
Roberto Weinstein, MD, DDS
Enrico Agliardi, MD, DDS
Massimo D. Fabbro, BSc, PhD
Davide Romeo, DDS, PhD
Luca Francetti, MD, DDS
Измерение стабильности имплантатов методом частотно-резонансного анализа: биологические и биомеханические аспекты и клиническое значение
Остеоинтегрированные имплантаты для протезирования беззубых челюстей имеют высокий процент успеха в тех случаях, когда соблюдаются определенные условия. Стабильность имплантатов играет критическую роль для успеха результата лечения, особенно в случаях применения коротких имплантатов и при имплантации в мягкую костную ткань, когда имеется повышенный риск неудач. Согласно оригинальным протоколам имплантации первичная стабильность имплантатов обеспечивалась за счет формирования и ремоделирования новой кости, названных остеоинтеграцией, которые происходили на начальных этапах периода заживления, в течение которого имплантат оставался ненагруженным, чтобы обеспечить беспрепятственное формирование новой кости на его поверхности. Процесс остеоинтеграции повышает жесткость костной ткани вокруг имплантата, а костное сцепление с поверхностью имплантата предотвращает микроподвижность имплантата и формирование фиброзной рубцовой ткани при его нагрузке. Разработка новых поверхностей имплантатов и новых клинических технологий позволила значительно уменьшить продолжительность начального периода заживления вплоть до немедленной/ранней нагрузки имплантатов, обладающих высокой первичной стабильностью. Однако, успех техники немедленной/ранней нагрузки зависит от способности врача определить степень первичной стабильности имплантата и изменение его стабильности в ходе формирования и ремоделирования новой костной ткани.
Клиническая оценка первичной стабильности имплантатов часто основана на сопротивлении имплантата в процессе его установки в костную ткань. Чувство «хорошей» стабильности может усиливаться при наличии резкой остановки в процессе введения имплантата. Конусные имплантаты, повторяющие форму корня зуба, благодаря своей геометрии дают ощущение полной остановки имплантата в процессе его вкручивания в костную ткань, что может дать ошибочное впечатление о высокой стабильности имплантата. Для оценки первичной стабильности имплантатов также могут использоваться перкуссионные тесты. Перкуссионный тест состоит в постукивании ручкой стоматологического зеркала по имплантату. Звонкий звук при постукивании считается показателем хорошей стабильности или остеоинтеграции. Однако, такие тесты скорее всего дают больше информации о перкуссионном инструменте, чем о самом имплантате, и не являются достоверными. Иногда для оценки первичной стабильности имплантатов используют значения инсерционного торка, а также обратного или развинчивающего торка в процессе подсоединения абатмента. Считается, что имплантаты, которые вращаются при приложении определенного торка, подлежат удалению. Однако, поверхность имплантатов в процессе остеоинтеграции может разрушится под действием торковой нагрузки. Кроме того, после того, как исследования на животных продемонстрировали повторную интеграцию подвижных имплантатов, техника обратного торка для оценки стабильности имплантатов оказалась несостоятельной. Другие техники, такие как Periotest и частотно-резонансный анализ, стремятся обеспечить объективную оценку стабильности имплантатов и остеоинтеграции, при этом не являясь инвазивными и не повреждая соединение имплантата с костью. Техника частотно-резонансного анализа широко используется в экспериментальных и клинических исследованиях последних 10 лет. Целью данной обзорной статьи является представить современные знания о технике частотно-резонансного анализа и обсудить клиническую пользу частотно-резонансных показателей.
Что такое стабильность имплантатов?
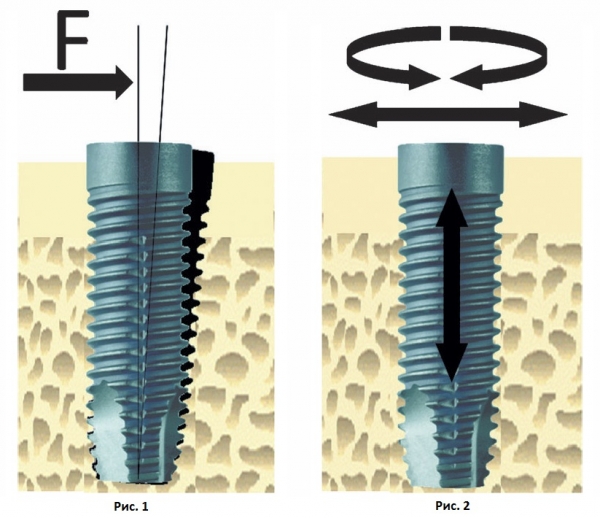
Стабильность имплантатов можно определить как отсутствие клинической подвижности, что также является определением остеоинтеграции. Достижение и сохранение стабильности имплантатов является условием успешного клинического результата имплантации. Тем не менее, клинически стабильные имплантаты также обладают микро-подвижностью при их нагрузке. Например, при приложении латеральной нагрузки (изгиб) на остеоинтегрированный имплантат, имплантат смещается, но возвращается в исходное положение сразу же после устранения нагрузки (Рис. 1). Таким образом, стабильный имплантат может иметь разную степень стабильности (т.е. разную степень смещения или устойчивости к нагрузке) в зависимости от факторов, связанных с качеством костной ткани, хирургической техникой и дизайном имплантата. В процессе клинического функционирования нагрузка прилагается в аксиальном, латеральном и ротационном направлениях (Рис. 2). Более того, аксиальная нагрузка может быть интрузионной и экструзионной, а латеральная нагрузка может быть приложена практически в любом из направлений в радиусе 360о вокруг имплантата. Ротационная нагрузка может быть по часовой стрелке и против. Поэтому результат оценки стабильности имплантата во многом зависит от метода оценки и от вида прилагаемой силы.
Рис. 1 Схематичное изображение, показывающее смещение имплантата после приложения латеральной нагрузки. F – сила.
Рис. 2 Схематичное изображение, показывающее разные направления нагрузки, действующей на имплантат в процессе его функционирования в полости рта.
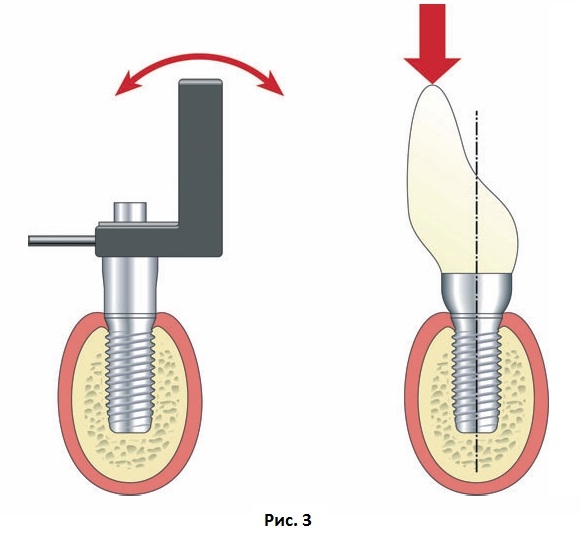
Измерение стабильности имплантатов методом частотно-резонансного анализа обычно включает приложение сгибающей нагрузки, которая симулирует клиническую нагрузку и дает информацию о прочности соединения имплантата с костной тканью (Рис. 3). Измерения стабильности имплантатов также могут включать применение сдвигающей силы, например, как при тесте обратного торка, которая также позволяет оценить прочность соединения имплантат-кость, однако, может быть потенциально деструктивной. Недавно установленный имплантат может обладать высокой степенью латеральной стабильности, но в то же время может легко выкручиваться при приложении обратного торка, когда костная ткань еще не сформирована и не создано соединение с поверхностью имплантата. Латеральная стабильность имплантатов также увеличивается по мере формирования и ремоделирования новой костной ткани. Поскольку большинство имплантатов будут соединены с каркасом, тесты с применением обратного торка имеют меньшее значение, чем оценка латеральной стабильности.
Измерение стабильности имплантатов методом частотно-резонансного анализа обычно включает приложение сгибающей нагрузки, которая симулирует клиническую нагрузку и дает информацию о прочности соединения имплантата с костной тканью (Рис. 3).
Рис. 3 Схематичное изображение, демонстрирующее принципы частотно-резонансного анализа. К датчику прилагают микроскопическую сгибающую силу для измерения резонансной частоты. Сгибающая сила – это наиболее распространенный вид нагрузки, действующей на дентальный имплантат.
Измерения стабильности имплантатов также могут включать применение сдвигающей силы, например, как при тесте обратного торка, которая также позволяет оценить прочность соединения имплантат-кость, однако, может быть потенциально деструктивной. Недавно установленный имплантат может обладать высокой степенью латеральной стабильности, но в то же время может легко выкручиваться при приложении обратного торка, когда костная ткань еще не сформирована и не создано соединение с поверхностью имплантата. Латеральная стабильность имплантатов также увеличивается по мере формирования и ремоделирования новой костной ткани. Поскольку большинство имплантатов будут соединены с каркасом, тесты с применением обратного торка имеют меньшее значение, чем оценка латеральной стабильности.
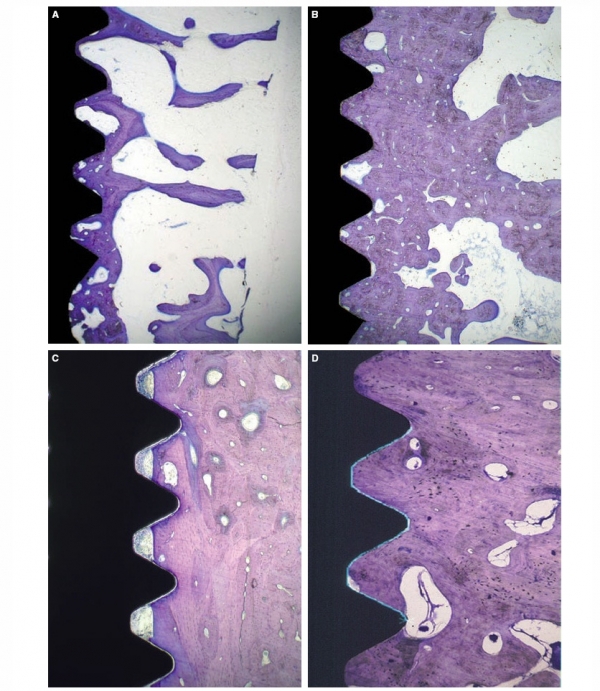
Определяющими факторами стабильности имплантата являются механические свойства костной ткани в области имплантации и насколько хорошо имплантат «внедрен» в эту кость. Механические свойства костной ткани определяются ее составом и могут улучшаться в процессе заживления, поскольку в этот период происходит трансформация трабекулярной кости вблизи имплантата в плотную кортикальную кость (Рис. 4A-D).
Рис. 4 (А) Имплантат, установленный в мягкую трабекулярную кость. (В) Со временем трабекулярная кость трансформируется в более кортикальную структуру, что приводит к повышению прочности соединения имплантата с костью. (С) Имплантат, установленный в плотную кортикальную кость. (D) C течением времени плотность костной ткани существенно не изменяется. Пустоты на границе соединения имплантата с костью были заполнены костной тканью.
Прочность соединения имплантата с костью также зависит от хирургической техники постановки имплантата и от типа самого имплантата. Например, применение последней фрезы меньшего диаметра или использование имплантата большего диаметра или конусной формы способствует более плотному прямому контакту резьбы имплантата с окружающей костной тканью. Кроме того, процесс заживления позволяет повысить прочность соединения имплантата с костью за счет формирования костных мостиков между поверхностью имплантата и окружающей костной тканью.
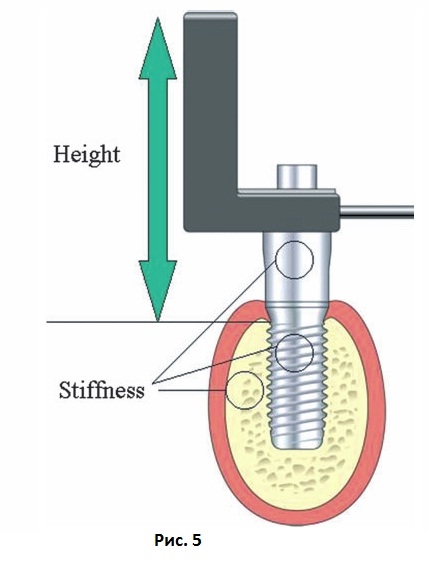
Метод частотно-резонансного анализа оценивает первую резонансную частоту небольшого датчика, прикрепленного к имплантату или абатменту. Резонансная частота зависит от трех основных факторов: во-первых, от типа самого датчика; во-вторых, от жесткости имплантата и прочности его соединения с тканями и окружающей костью; и в-третьих, от общей эффективной длины системы над уровнем маргинальной костной ткани (Рис. 5).
Рис. 5 Схема, иллюстрирующая принципы частотно-резонансного анализа. На результат анализа оказывают влияние жесткость датчика, прочность соединения имплантата с костью, а также эффективная длина имплантата над уровнем альвеолярного гребня (высота).
Эффективная длина включает длину датчика, которая является фиксированной, длину абатмента, которая может варьировать в определенном интервале, и расстояние между вершиной имплантата и уровнем костной ткани. Частотно-резонансный анализ – это тест на изгиб комплекса имплантат-кость, при котором датчик действует на имплантат с чрезвычайно небольшой сгибающей силой. Сгибающая сила оказывает фиксированную латеральную нагрузку на имплантат и измеряется его смещение, таким образом симулируя клиническую нагрузку, хотя и в намного уменьшенной величине.
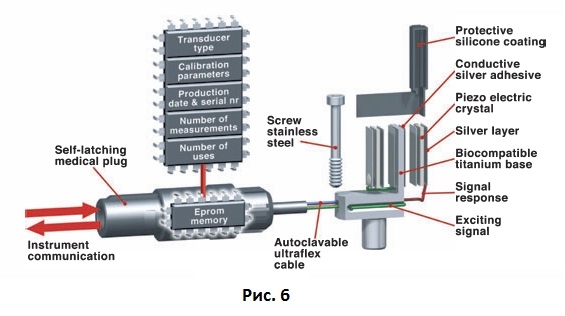
Частотно-резонансный датчик первого поколения был разработан как простая смещенная консольная балка, которая прикручивалась к имплантату или к абатменту (Рис. 6).
Рис. 6 Схема, иллюстрирующая строение датчика частотно-резонансного анализа.
Датчик реагировал на колебания выше определенной частоты. Регистрировался первый изгибный резонанс. Датчик был изготовлен из нержавеющей стали или коммерчески чистого титана и состоял из небольшой смещенной консольной балки с двумя подсоединенными пьезокерамическими элементами (Рис. 7А). Балка начинала вибрировать за счет возбуждения одного из пьезокерамических элементов синусоидным сигналом различной частоты. Сигнал генерировался частотным анализатором, который программировался с помощью персонального компьютера (Рис. 7В).
Рис. 7 (А) Датчик системы частотно-резонансного анализа первого поколения. (В) Оборудование первого поколения, включающее персональный компьютер, осциллограф и анализатор частотного ответа.
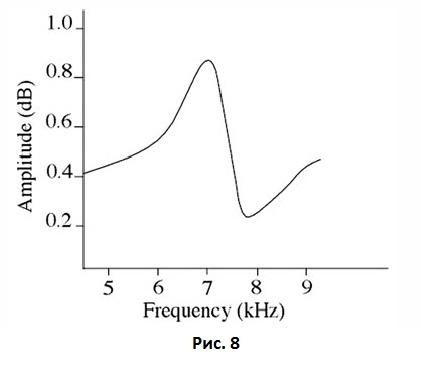
Второй пьезокерамический элемент измерял ответную реакцию балки на колебание и генерируемый сигнал усиливался с помощью электрометрического усилителя сравнением с оригинальным сигналом с помощью анализатора частотного ответа. Возбуждающий сигнал представлял собой синусоидное колебание с частотой в пределах от 5 до 15 кГц и пиком амплитуды 1 В. При первом резонансе датчика отмечалось существенное увеличение амплитуды и изменение фазы принимаемого сигнала. Это можно представить графически в виде частотно-амплитудной диаграммы Бодэ (Рис. 8).
Рис. 8 График частоты-амплитуды частотно-резонансного анализа. Резонансная частота определяется на пике графика.
К недостаткам этой системы частотно-резонансного анализа первого поколения относят большое количество проводов, крупные размеры и большой вес оборудования, высокую стоимость, а также время развертки частотного анализатора. Развертка по частоте 5-15 кГц с шагом 100 Гц и точностью развертки в 25 точек вокруг резонансного пика обычно занимало более 1 минуты. Поэтому было принято решение разработать специальный частотный анализатор (Рис. 9). Ключевыми параметрами этого прибора были скорость, легкость и портативность, полная безопасность для пациента и легкость программирования и скачивания данных. Эти требования были выполнены в ходе разработки специального частотного анализатора, который использовал стандартный медицинский прибор электропитания. Прибор был соединен с персональным компьютером через серийный порт. Компьютер использовался как для программирования развертки по частоте и частотных пределов, так и для сбора и хранения данных на жестком диске.
Рис. 9 Анализатор частотного ответа второго поколения.
Одним из основных недостатков приборов для частотно-резонансного анализа как первого, так и второго поколения, было то, что каждый датчик имел собственную основную резонансную частоту. Поэтому для сравнения показателей разных датчиков необходимо было проводить их калибровку. Невозможно было интерпретировать результаты частотно-резонансного анализа в клинике, например, при сравнении стабильности имплантата у одного и того же пациента с течением времени. Кроме того, система анализатора ответа и персональный компьютер были слишком тяжелыми и не простыми в использовании.
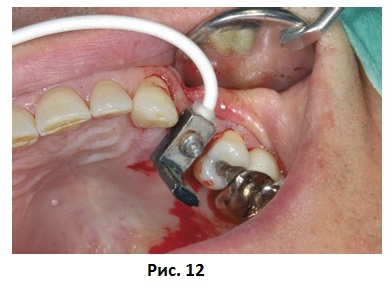
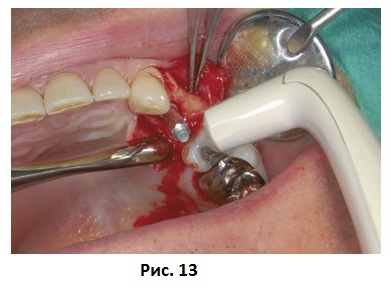
Приборы для частотно-резонансного анализа третьего поколения должны были иметь небольшие размеры, питание от батареек и обеспечивать быстрые и простые измерения с возможностью интерпретации непосредственно у кресла пациента (Рис. 10). Новая система частотно-резонансного анализа (Ostell™, Ostell AB, Gothenburg, Швеция) состоит из анализатора частотного ответа, работающего на батарейках, и датчика нового поколения, предварительно калиброванного на заводе производителя. Получаемые в результате измерения представляют собой отдельный параметр – коэффициент стабильности имплантата. Коэффициент стабильности имплантата определяется по резонансной частоте и может находиться в интервале от 1 (самая низкая стабильность) до 100 (самая высокая стабильность). Датчики выпускаются для различных систем имплантатов и абатментов (Рис. 11 и 12), что делает все показатели частотно-резонансного анализа сравнимыми друг с другом вне зависимости от типа имплантата или абатмента. Кроме того, результаты анализа могут передаваться на персональный компьютер для дальнейшего анализа и хранения через серийный кабель или инфракрасный порт.
Рис. 10 Аппарат для частотно-резонансного анализа третьего поколения, первый из коммерческих аппаратов (Osstell).
Рис. 11 Алюминиевые блоки с различной резонансной частотой, используемые для калибровки датчиков третьего поколения для измерения единиц коэффициента стабильности имплантата (ISQ).
Рис. 12 Клиническое применение датчика Osstell.
Наиболее последние версии аппаратов для частотно-резонансного анализа представляют собой беспроводные системы, в которых металлический стержень (штифт) прикрепляется к имплантату с помощью винтового соединения (Osstell Mentor, Osstell AB) (Рис. 13). К верхней части штифта прикреплен небольшой магнит, который возбуждается магнитными импульсами, передаваемыми от ручного компьютера. Штифт вибрирует в двух направлениях, которые примерно перпендикулярны друг другу. Вибрация происходит в направлении, которое дает наибольшую резонансную частоту (первый режим) и в направлении, которое дает наименьшую резонансную частоту (второй режим). Таким образом получают два значения коэффициента стабильности имплантата, одно высокое и одно низкое (Рис. 14). Например, имплантат с обнаженной с вестибулярной поверхности резьбой может иметь одно низкое значение коэффициента стабильности, отражающее отсутствие костной ткани в вестибуло-оральном направлении, и одно высокое значение, отражающее хорошую костную поддержку в мезио-дистальном направлении.
Рис. 13 Клиническое применение аппаратов Smartpeg и Mentor, систем для частотно-резонансного анализа четвертого поколения.
Рис. 14 В некоторых системах имплантатов аппарат Mentor дает одно низкое и одно высокое значение коэффициента стабильности, отражая самый высокий и самый низкий показатели стабильности имплантата.
Факторы, оказывающие влияние на показатели частотно-резонансного анализа
Жесткость соединения имплантата с костью
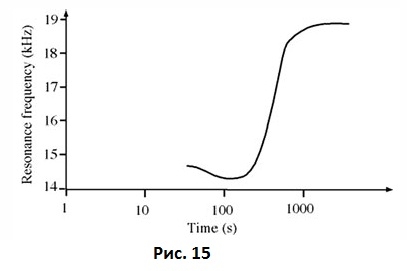
В исследованиях in vitro сложно воспроизвести изменения механических свойств и жесткости, происходящие в костной ткани в процессе ремоделирования и заживления. Полимеризация пластмассы является достаточно простой и воспроизводимой моделью, хотя и не полностью сопоставимой с костью, с помощью которой можно проводить оценку поведения датчиков частотно-резонансного анализа в соотношении с изменяемой жесткостью системы кость-имплантат. По мере полимеризации пластмассы, когда она переходит из жидкого или гелиевого состояния в твердое, отмечается существенное повышение ее жесткости. Было проведено измерение с определенным временным интервалом частотного ответа системы датчик-имплантат, помещенной в различные пластмассы (Рис. 15).
Рис. 15 Изменение резонансной частоты со временем у имплантата, установленного в пластмассу в процессе ее твердения.
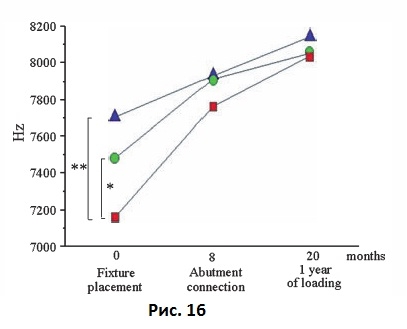
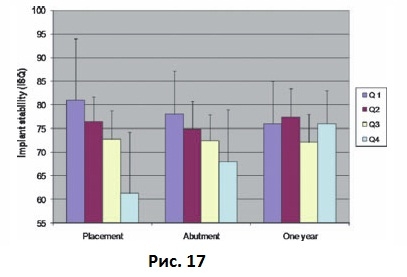
Ранние клинические исследования показали наличие взаимосвязи между плотностью костной ткани и первичной стабильностью имплантата. Friberg и соавт. связывали сопротивление имплантата при введении в костную ткань (т.е. плотность костной ткани) с первичной стабильностью имплантатов, установленных на верхней челюсти (Рис. 16). Измерения, проведенные во время фиксации абатмента (через 6-8 месяцев после имплантации) и через 1 год после имплантации, показали, что все имплантаты, вне зависимости от их первичной стабильности, со временем достигали приблизительно одинакового уровня стабильности. Andersson и соавт. исследовали 102 имплантата Neos и обнаружили обратное соотношение между торком при установке имплантата (плотностью костной ткани) и изменениями стабильности имплантата в течение 12 месяцев. Они также установили взаимосвязь между качеством костной ткани, измеренной согласно методике Lekholm и Zarb, и первичной стабильностью имплантата. Имплантаты, внедренные в мягкую кость, с низким уровнем первичной стабильности показали существенное увеличение стабильности с течением времени по сравнению с имплантатами, установленными в плотную костную ткань (Рис. 17).
Рис. 16 Резонансная частота имплантатов, установленных на верхней челюсти в костную ткань различной плотности.
Рис. 17 Значения коэффициента стабильности имплантата для 102 имплантатов, установленных в костную ткань различной плотности, отслеженных с момента имплантации до фиксации абатмента и через год после имплантации. ISQ – коэффициент стабильности имплантата.
У имплантатов, внедренных в кость типа 1 и типа 2, напротив, отмечалось некоторое снижение стабильности, возможно, в результате ремоделирования маргинальной кости, однако, все имплантаты достигали схожего уровня стабильности через год после установки. Подобные данные были получены и другими исследователями. Данные показали, что жесткость соединения имплантат-кость выше в плотной костной ткани, чем в мягкой. Кроме того, было установлено, что процесс заживления и ремоделирования мягкой трабекулярной кости приводит к увеличению жесткости костной ткани вокруг имплантата.
Техника частотно-резонансного анализа также применялась в исследованиях на животных для изучения процесса заживления нормальной костной ткани, костной ткани после подсадки и постмембранной костной ткани. У кроликов резонансная частота увеличивалась со временем как функция от повышения жесткости системы в результате формирования и ремоделирования новой костной ткани. Однако, при очень высокой первичной стабильности имплантатов, как, например, на нижней челюсти у собак, существенных изменений жесткости соединения имплантат-кость не отмечается. Результаты исследования in vitro на человеческой кости выявили наличие линейной связи показателей частотно-резонансного анализа с инсерционным торком, а также с единицами Hounsfield, оцененными по срезам компьютерной томографии, что еще раз доказывает способность частотно-резонансного анализа к измерению механических свойств костной ткани. В эксперименте in vitro Ito и соавт. использовали три винта для стабилизации имплантата на четырех разных уровнях. Резонансная частота уменьшалась при отвинчивании винтов, установленных в коронковой части имплантата, и не изменялась при отвинчивании винтов, установленных в апикальной части. Это позволяет предположить, что маргинальная область является наиболее критичной для результатов частотно-резонансного анализа. Результаты исследования Ito и соавт. также продемонстрировали, что длина имплантата может не оказывать существенного влияния на показатели частотно-резонансного анализа. Это было подтверждено клиническими исследованиями и исследованиями in vitro.
Исследования, проведенные на одноэтапных имплантатах с немедленной нагрузкой, показали первоначальное снижение первичной стабильности, которая увеличивалась через 3 месяца после имплантации. Первоначальное снижение стабильности имплантатов возможно связано с началом процессов заживления и ремоделирования, которые включают резорбцию костной ткани, а следовательно и временное ослабление кости. Кроме того, это может быть связано с дополнительной нагрузкой имплантатов в этот период времени. Однако, недавнее исследование, проведенное с использованием конусных имплантатов по протоколу немедленной нагрузки, не выявило начального снижения стабильности имплантатов. Напротив, показатели частотно-резонансного анализа увеличивались с момента имплантации до 1 года после нагрузки. Форма и структура поверхности имплантата могут оказывать влияние на его стабильность в начальном периоде заживления. Например, Rompen и соавт. в исследовании на собаках показали, что имплантаты с модифицированной поверхностью сохраняли свою стабильность, в то время как стабильность фрезерованных имплантатов снижалась на начальном этапе периода заживления. Glauser и соавт. сравнивали фрезерованные и окисленные имплантаты, установленные по протоколу немедленной нагрузки, и обнаружили более выраженное снижение стабильности фрезерованных имплантатов в течение первых трех месяцев после нагрузки.
Большинство исследований не выявили взаимосвязи между степенью контакта имплантат-кость и показателями частотно-резонансного анализа. Это может быть связано с природой теста, поскольку степень контакта с костной тканью не обязательно отражает жесткость окружающей кости. В современной дентальной имплантологии, использующей имплантаты с умеренно грубой поверхностью, имплантаты обычно покрываются тонким слоем кости, что, возможно, не имеет значения для биомеханической фиксации имплантатов. Большинство исследователей не подтверждают влияния грубой или гладкой поверхности имплантатов на их стабильность, хотя, как уже отмечалось выше, некоторые исследователи установили различную стабильность имплантатов с различным типом поверхности.
Myiamoto и соавт. наблюдали сильную положительную корреляцию между толщиной кортикальной кости, оцененной по данным компьютерной томографии, и начальными значениями коэффициента стабильности 225 имплантатов, установленных на верхней и на нижней челюсти. Nkenke и соавт. и Gedrange и соавт. также отметили положительную корреляцию между высотой крестальной кортикальной кости и значениями коэффициента стабильности имплантатов в исследованиях на трупах.
Расстояние до первого контакта с костью/атрофия маргинальной кости
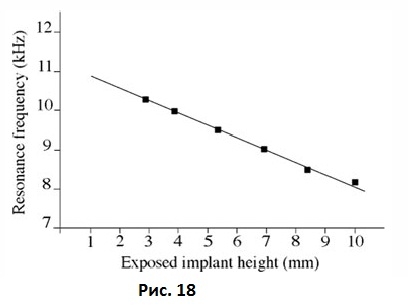
Соотношение между длиной абатмента имплантата и показателями частотно-резонансного анализа изучались в различных экспериментальных моделях. Meredith и соавт. измеряли частотный ответ датчика, прикрепленного к имплантату в алюминиевом блоке, используя абатменты разной длины (Рис. 18).
Рис. 18 Взаимосвязь между резонансной частотой и эффективной длиной имплантата над альвеолярным гребнем.
В исследовании по изучению резорбции костной ткани вокруг имплантатов, проведенном на собаках, Sennerby и соавт. не обнаружили взаимосвязи между потерей костной ткани, выявляемой рентгенологически, и резонансной частотой. Следует отметить, что в этом исследовании маргинальная резорбция костной ткани начиналась после заживления и интеграции имплантатов.
Meredith и соавт. изучали 52 имплантата, установленных на верхней челюсти, через как минимум 5 лет после нагрузки, и установили достоверную положительную связь между эффективной длиной имплантатов (длина абатмента + атрофия костной ткани) и резонансной частотой. В данном исследовании стабильность имплантатов через 5 лет после нагрузки существенно не изменилась. Результаты исследования, изучавшего одноэтапную технику имплантации на нижней челюсти, выявили небольшое, но достоверное снижение стабильности имплантатов через 15 недель после их установки, что возможно было связано с потерей маргинальной кости и увеличением длины имплантата над уровнем альвеолярного гребня.
Turkylmaz и соавт. установили негативную корреляцию между повышенной атрофией маргинальной кости вокруг имплантатов на нижней челюсти и снижением стабильности имплантата в течение первых 6 месяцев после операции. Однако, этой взаимосвязи обнаружено не было между 6 и 12 месяцами после имплантации. Авторы предположили, что эффект атрофии костной ткани компенсировался повышением жесткости соединения имплантат-кость в результате формирования и ремоделирования костной ткани. Однако, Fischer и соавт. не обнаружили взаимосвязи между потерей маргинальной кости и показателями частотно-резонансного анализа в течение 1 года после имплантации. Продолжающийся процесс заживления может нейтрализовать и маскировать эффект атрофии маргинальной кости. Однако, через 3 и 5 лет после имплантации, когда процесс заживления уже должен считаться завершенным, та же группа исследователей обнаружила сильную положительную корреляцию между резорбцией маргинальной кости и низкими значениями коэффициента стабильности имплантатов. Это согласуется с данными Meredith и соавт., которые предположили, что изменение стабильности имплантатов через 5 лет после установки может быть связано с изменением высоты маргинальной кости.
Turkylmaz и соавт. обнаружили отрицательную корреляцию между высотой имплантата над альвеолярным гребнем и значениями коэффициента стабильности имплантатов, установленных непосредственно после удаления зубов. Авторы предложили проводить наблюдения за периодом заживления имплантатов, установленных непосредственно после удаления зубов, с помощью техники частотно-резонансного анализа.
Ориентация датчика частотно-резонансного анализа
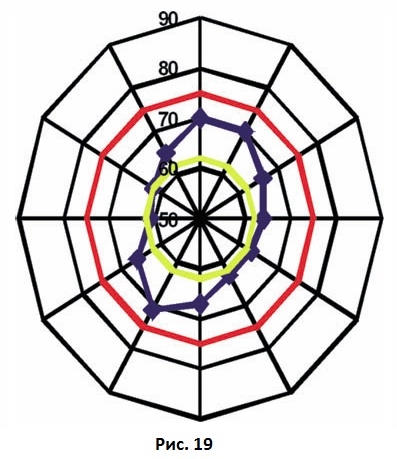
Ориентация датчика оказывает влияние на показатели частотно-резонансного анализа. Veltri и соавт. и Fischer и соавт. обнаружили, что значения коэффициента стабильности имплантата повышались примерно на 10 единиц при расположении датчика параллельно, а не перпендикулярно альвеолярному гребню. Вполне вероятно, что комплекс имплантат-кость имеет разную степень жесткости при различных направлениях нагрузки. Низкие значения коэффициента стабильности имплантата, полученные в вестибуло-оральном направлении, свидетельствуют о том, что в этом направлении костная ткань тоньше, чем в мезио-дистальном направлении. Согласно инструкции производителя, новый беспроводной прибор для частотно-резонансного анализа (Mentor, Osstell AB) измеряет самую высокую и самую низку резонансную частоту в тех случаях, когда отмечаются различия более чем в 3 единицы. Это может объяснить наблюдаемые различия в показателях стабильности между новыми и старыми техниками частотно-резонансного анализа. Valderrama и соавт. установили, что две техники частотно-резонансного анализа могут давать различия в показателях до 10 единиц коэффициента стабильности. При этом наиболее высокие показали стабильности получают в мезио-дистальном направлении с помощью беспроводной техники, а наиболее низкие показатели – в вестибуло-оральном направлении с помощью старой техники. Особая ориентация старого датчика частотно-резонансного анализа может быть причиной разных показателей прибора. На рис. 19 представлены результаты измерений стабильности в 12 различных направлениях с помощью старой техники частотно-резонансного анализа и датчика, зависящего от направления ориентации. Измерения с помощью новой техники частотно-резонансного анализа, как показано на Рис. 19, дают два разных показателя: наиболее высокое и наиболее низкое значение коэффициента стабильности.
Рис. 19 Показатели частотно-резонансного анализа имплантата в 12 направлениях с помощью прибора Osstell. Красный и желтый круги показывают результаты одного измерения с помощью нового беспроводного аппарата Mentor™. Очевидно, что показатели стабильности имплантатов варьируют в зависимости от направления приложения нагрузки. Новая техника частотно-резонансного анализа определяет самый высокий и самый низкий показатели стабильности имплантата.
Таким образом, необходимо учитывать, что показатели частотно-резонансного анализа могут варьировать в зависимости от направления, в котором проводятся измерения.
Применение техники частотно-резонансного анализа для прогноза потери имплантата
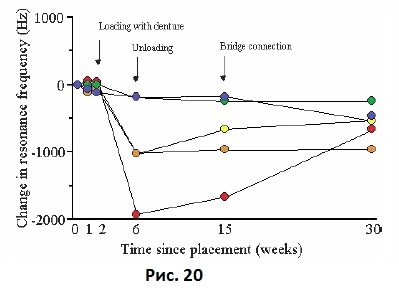
Friberg и соавт. в 1999 провели оценку с помощью частотно-резонансного анализа 75 одноэтапных имплантата, установленных на беззубой нижней челюсти. У одного имплантата было отмечено уменьшение стабильности в период со 2 по 15 неделю и наблюдалась клиническая подвижность имплантата. У второго пациента у трех из пяти имплантатов отмечалось выраженное уменьшение стабильности в период со 2 по 6 неделю, в то время, когда имплантат был нагружен временным протезом после перебазировки. После того, как пациента попросили не носить временный протез, стабильность двух имплантатов увеличилась, а одного имплантата – сохранилась на том же уровне (Рис. 20).
Рис. 20 Стабильность имплантатов у одного и того же пациента с пятью непогруженными имплантатами на нижней челюсти. У трех имплантатов отмечалось выраженное снижение стабильности, которая, тем не менее, была восстановлена после разгрузки имплантатов, когда пациент прекратил использовать съемный протез.
Та же исследовательская группа изучала стабильность 56 имплантатов на верхней челюсти у 9 пациентов и установила, что у всех, кроме двух выпавших имплантатов, в период от установки до фиксации абатмента отмечалось повышение стабильности. Данные свидетельствуют о том, что со временем происходит повышение жесткости соединения имплантата с костью, за исключением неудачных имплантатов, инкапсулированных в мягких тканях.
Glauser и соавт., изучая немедленную нагрузку имплантатов, оценивал стабильность 81 имплантата с помощью техники частотно-резонансного анализа с момента установки и до 1 года после нагрузки. В течение периода наблюдения (1 год) в общей сложности выпали 9 имплантатов. Все имплантаты имели высокие показатели первичной стабильности (коэффициент стабильности около 70), однако, имплантаты, которые впоследствии выпали, показывали прогрессивное снижение стабильности. Через 1 месяц после имплантации среднее значение коэффициента стабильности у имплантатов, которые в дальнейшем претерпели неудачу, составил 52, что достоверно ниже, чем в группе успешных имплантатов, средний коэффициент стабильности которых составил 68. Кроме того, было отмечено, что при значении коэффициента стабильности в пределах 49-58 риск неудач составляет 18,2%. Чем нижнее коэффициент стабильности имплантата через 1 месяц после немедленной нагрузки, тем выше риск неудачного результата. Некоторые из имплантатов в категории риска были «спасены», устранив нагрузку на период заживления. Тем не менее, следует учитывать, что Glauser и соавт. в своем исследовании оценивали показатели частотно-резонансного анализа ретроспективно и не имели возможности клинической коррекции. В исследовании, проведенном на имплантатах, установленных непосредственно после удаления и по протоколу немедленной/ранней нагрузки, Vanden Boagerde и соавт. (58) продемонстрировали возможность предотвращения выпадения имплантата на основании показателей частотно-резонансного анализа. У этого имплантата было отмечено выраженное снижение стабильности от 67 ISQ до 53 ISQ в течение первых шести недель. Имплантат был разгружен, после чего произошло восстановление стабильности до 72 ISQ в течение 6 месяцев.
Sjostrom и соавт. выявили низкую первичную стабильность (коэффициент стабильности 54.6) у 17 имплантатов, которые выпали в течение первого года после нагрузки, по сравнению с 195 имплантатами, которые были успешно установлены на верхней челюсти после подсадки костной ткани (коэффициент стабильности 62.0). Nedir и соавт. сравнивали имплантаты, установленные по протоколу немедленной нагрузки, с имплантатами, нагруженными через 3 месяца заживления, и заключили, что техника частотно-резонансного анализа не позволяет точно выявить подвижные имплантаты. В то же время, стабильность имплантатов может быть достоверно определена в тех случаях, когда коэффициент стабильности больше 47. Одним из возможных объяснений неспособности выявления некоторых подвижных имплантатов может быть природа частотно-резонансного анализа, которая измеряет стабильность в зависимости от жесткости системы. Клинически подвижные имплантаты имеют чрезвычайно низкую жесткость, что не дает системе частотно-резонансного анализа определить первую резонансную частоту, в результате чего коэффициент стабильности оказывается очень высоким, поскольку определяется по второй резонансной частоте.
Huwiler и соавт. оценивали стабильность 17 имплантатов с помощью техники частотно-резонансного анализа в течение 12 месяцев после операции. Один имплантат выпал, и его коэффициент стабильности снизился от 68 до 45. Поскольку подвижность имплантата наблюдается при низких значениях коэффициента стабильности, авторы заключили, что частотно-резонансный анализ нельзя использовать для прогноза выпадения имплантатов.
Fischer и соавт. изучали стабильность 53 имплантатов в течение 1 года после операции. Имплантаты были нагружены одиночными коронками (n = 16) или частичными мостовидными протезами (n = 16) на верхней челюсти непосредственно после или через 16 дней после операции. Среднее значение первичной стабильности имплантатов составило 63.3. Один выпавший имплантат имел коэффициент стабильности 56, что является пятым самым низким значением из всех 56 имплантатов.
Fischer проводил частотно-резонансный анализ у 24 пациентов с 139 имплантатами на верхней челюсти через 3 и 5 лет после операции. Четыре имплантата были потеряны в период от 3 до 5 лет. На 3 году выпавшие имплантаты имели более низкий коэффициент стабильности по сравнению со средним коэффициентом стабильности в исследуемой группе (44, 53, 54 и 54; средний коэффициент 57.7). Оценка риска выпадения имплантатов показала, что значения коэффициента стабильности ниже 44, 53 и 54 были связаны с риском выпадения 100%, 6,7% и 9,5% соответственно. Ни один из 97 имплантатов с коэффициентом стабильности выше 54 не выпал в период исследования с 3 до 5 лет.
Возможное клиническое применение
Техника частотно-резонансного анализа потенциально может предоставить важную информацию о состоянии соединения имплантат-кость на любом этапе лечения. Вопрос в том, как максимально воспользоваться информацией, полученной при каждом отдельном частотно-резонансном измерении в клинической практике. К настоящему времени имеется недостаточно исследований, четко документирующих клинические преимущества терапевтических решений, принятых на основании данных частотно-резонансного анализа. Очевидно, что основной задачей дентальной имплантации является предотвращение выпадения имплантатов. Хотя процесс выпадения имплантатов, установленных по двухэтапному протоколу, достаточно низкий, имплантаты с немедленной нагрузкой или после подсадки костной ткани имеют более высокий риск неудач. Кроме того, имплантация все больше проводится недостаточно опытными врачами, которые сталкиваются с различными осложнениями в процессе своего обучения. Поскольку выпадение имплантатов часто связано с биомеханическими факторами, оценка стабильности имплантатов может существенно снизить риск неудач. Исследования продемонстрировали, что высокие показатели частотно-резонансного анализа свидетельствуют об успехе имплантации с невысоким риском неудачи в будущем. Низкие или снижающиеся показатели стабильности, напротив, говорят о повышенном риске осложнений, хотя и четкий порог значений частотно-резонансного анализа еще предстоит определить.
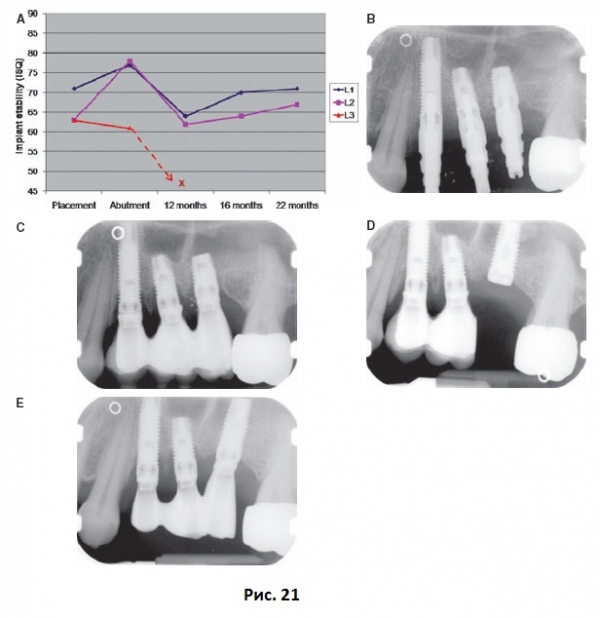
Кажется, что имплантаты любой системы со временем достигают схожего уровня стабильности, что для имплантатов типа Branemark выражается в коэффициенте стабильности 65-75, а для имплантатов типа Straumann – 55-65. Обоснованно предположить, что такой уровень стабильности в любой период после имплантации будет указывать на безопасную стабильность. Коэффициент стабильности ниже 55 для имплантатов Branemark и ниже 45 для имплантатов Straumann должен рассматриваться как тревожный знак, который говорит о том, что необходимо принять меры для повышения стабильности имплантата. Первичную стабильность можно повысить за счет модификации хирургической техники или выбора более широкого, длинного или конусного имплантата. Например, применение более тонких фрез и более широкого и конусного имплантата позволяет повысить первичную стабильность. В настоящее время отмечается тенденция к уменьшению продолжительности периода заживления даже для двухэтапных протоколов имплантации, что может привести к неадекватному заживлению имплантатов, установленных в мягкую костную ткань. Увеличение продолжительности периода заживления после имплантации является простым способом повышения стабильности имплантата. Низкие показатели коэффициента стабильности имплантата после нагрузки могут говорить о дезинтеграции соединения имплантат-кость и риске выпадения имплантата (Рис. 21).
В таких случаях рекомендуется снять протезную конструкцию для определения стабильности самого имплантата. Заживление имплантата в течение дополнительных 6 недель без нагрузки является достаточным временем для восстановления стабильности имплантата. Снижение коэффициента стабильности имплантата также может быть результатом резорбции маргинальной кости, поэтому необходимо проводить рентгенологическое исследование для оценки состояния пародонта. Для имплантатов типа Branemark снижение коэффициента стабильности на 10 единиц от 75 до 65 не так угрожающе, как снижение от 60 до 50. Производители отмечают, что следует ожидать снижения стабильности имплантатов в пределах трех единиц. При периимплантите стабильность имплантата может оставаться высокой, однако в этих случаях будущее имплантата находится под угрозой из-за прогрессирующей и нелеченной потере маргинальной кости. Суммируя все вышесказанное, техника частотно-резонансного анализа может использоваться для оценки стабильности имплантатов при контрольных посещениях. Только при выявлении низкой или снижающейся стабильности имплантата следует проводить рентгенологическое исследование. Одним из недостатков такого подхода является то, что для проведения частотно-резонансных измерений необходимо снимать протезные конструкции.
Техника частотно-резонансного анализа может быть полезной для оценки имплантатов, установленных по протоколу немедленной нагрузки, на различных этапах лечения. Например, определенные значения коэффициента стабильности могут быть использованы как критерии исключения из протокола немедленной нагрузки. Ostman и соавт. отмечают низкий процент выпадения имплантатов в тех случаях, когда одним из критерием включения в протокол немедленной нагрузки имплантатов, установленных на беззубой верхней челюсти и в боковых участках на нижней челюсти, был коэффициент стабильности 60. Авторы данного исследования считают технику частотно-резонансного анализа полезной для принятия решения о том, когда следует заменять временный немедленный протез на постоянный протез. Значения коэффициента стабильности выше 65 указывают на благоприятный ответ на немедленную нагрузку, в то время как низкие значения коэффициента стабильности свидетельствуют о перегрузки имплантата и о риске его выпадения. В этих случаях перед фиксацией постоянного протеза рекомендуется разгрузка имплантата и, возможно, установка дополнительных имплантатов.
И наконец, частотно-резонансный анализ может служить важным инструментом для документирования клинического результата имплантации. Это может быть особенно важно с медико-легальной точки зрения. Также, имплантологам, которым направляют пациентов для установки имплантатов с последующим протезированием у лечащего врача, техника частотно-резонансного анализа может помочь убедить врача, направившего пациента, и самого пациента в достаточной стабильности имплантата перед тем, как отправить его на протезирование. Другими словами, техника частотно-резонансного анализа может служить своеобразным отпечатком пальцев для установленных имплантатов.
Техника частотно-резонансного анализа может предоставить врачу важную информацию о состоянии области соединения имплантат-кость на любом этапе лечения или при контрольных посещениях. Частотно-резонансный анализ оценивает стабильность имплантатов как функцию от жесткости соединения имплантат-кость, которая зависит от таких факторов, как плотность костной ткани, сроки заживления и высота имплантата над уровнем альвеолярного гребня. Исследования показали, что имплантаты с высокими значениями коэффициента стабильности на контрольных посещениях являются успешно интегрированными, в то время как низкие и снижающиеся показатели стабильности могут быть признаком неудачи имплантации и/или потери уровня маргинальной кости.
Авторы: Lars Sennerby и Neil Meredith