Метаболические нарушения в миокарде на экг что это
Что такое метаболические изменения в миокарде
Метаболические изменения в миокарде у 60% пациентов являются случайной находкой при рутинном выполнении ЭКГ. Это происходит вследствие зачастую бессимптомного течения патологии, которую даже самостоятельным заболеванием назвать нельзя. Такое нарушение обмена в сердечной мышце может наблюдаться и при переутомлениях, и при различных эндокринных патологиях. В этой статье я постараюсь по возможности доступно рассказать, с помощью какого метода диагностики распознать данное состояние.
Описание процесса
Метаболические изменения в миокарде – это патологическое состояние, сопровождающееся нарушением обмена:
Подобные изменения не считаются отдельным заболеванием, а возникают на фоне других патологий.
Нарушение питания клеток миокарда приводит к снижению его сократительной способности, а также утраты электрического автоматизма. Поэтому состояние часто сопровождается различными аритмиями.
Причины
Причин метаболических изменений в миокарде достаточно много. Среди них и рутинные состояния (переутомление, стресс, употребление энергетических напитков). В этих случаях нарушение обмена в кардиомиоцитах не требует срочного медицинского вмешательства, так как исчезает самостоятельно через несколько часов после устранения фактора.
Чаще причиной метаболических расстройств становятся болезни сердца или внесердечные патологии:
Совет специалиста
Нередко гипокалиемия (снижение уровня калия в крови), которая приводит к нарушению работы сердечной мышцы, возникает вследствие неконтролируемого или неправильно приёма петлевых диуретиков («Лазикс», «Фуросемид»). Я всегда акцентирую внимание своих больных на том, что на фоне данной терапии увеличивается выведение из организма электролитов. Поэтому необходимо искусственно восполнять их объём, в частности принимая «Панангин» или «Кальдиум».
Симптомы
Признаки метаболических нарушений в миокарде часто отсутствуют, поэтому патологию находят случайно, благодаря характерным изменениям на ЭКГ. Иногда дискомфорт со стороны сердца «затмевают» признаки основного заболевания.
К примеру, я наблюдала, как при увеличении секреции гормонов щитовидной железы, пациентов в большей степени беспокоят тремор в руках, бессонница, постоянная жажда. Поэтому на периодические неприятные ощущения за грудиной они могут попросту не обратить внимания.
Среди симптомов обменных нарушений в сердечной мышце я бы отметила:
Такую клиническую картину очень трудно назвать строго специфичной. Подобные состояния могут возникнуть при многих соматических, неврологических, инфекционных заболеваниях и даже при обыкновенном стрессе. Настойчиво советую не откладывать на потом консультацию врача. Ранее выявление — скорое выздоровление.
Диагностические критерии
Чтобы выявить метаболические изменения в миокарде, необходимо исключить гипоксически-ишемические процессы в нём.
В пользу обменных нарушений говорят следующие признаки:
Обращаю ваше внимание на то, что перечисленные критерии должны рассматриваться комплексно.
Характерные изменения на ЭКГ
Наиболее простым скрининговым методом для диагностики метаболических нарушений в миокарде считается электрокардиограмма. В таблице представлены частые обменные дисфункции и их признаки на пленке.
Увеличение концентрации кальция в крови
Снижение уровня кальция в организме
Помните, что расшифровка ЭКГ — непростая задача, которая требует глубокого физического анализа. Заниматься этим должен только квалифицированный специалист с соответствующим навыком.
Клинический случай
В приёмное отделение поступила пациентка П., 45 лет. Доставлена каретой «Скорой помощи» из магазина, где потеряла сознание. Предъявляет жалобы на слабость, раздражительность, дрожь в руках, сердцебиение. Из анамнеза: год назад диагностирован тиреотоксикоз, назначенную терапию не принимает. Обморочные состояния возникают 1-2 раза в месяц, также беспокоит периодическая головная боль и головокружения, повышение артериального давления. За медицинской помощью не обращалась. Объективно: щитовидная железа увеличена, давление: 150/90 мм рт.ст., ЧСС 100 уд./мин, тремор в пальцах рук, ИМТ 18, тоны сердца приглушены, границы расширены на 0,5-0,7 мм. Предварительный диагноз: «Тиреотоксикоз, тиреотоксическая миокардиодистрофия».
Были проведены ЭКГ в динамике, Эхо-КГ, пробы с нагрузкой, анализ крови на ТТГ и свободный Т4, УЗИ щитовидной железы, клинический анализ крови и мочи. Диагноз подтвердился, после чего пациент был отправлен на лечение к эндокринологу. После двухнедельного пребывания в стационаре состояние улучшилось. Больная была выписана на амбулаторное наблюдение по месту жительства.
Консультацию каких врачей назначали Вам при метаболических изменениях в миокарде? Делитесь опытом в комментариях.
Для подготовки материала использовались следующие источники информации.
ДИАГНОСТИКА И ЛЕЧЕНИЕ миокардита
Миокардит — это клинический синдром, для которого характерно множество возможных причин и проявлений. Полагают, что вирусная инфекция является самой частой причиной миокардита, но аналогичные изменения могут вызывать и другие инфекционные и неинфекционны
Миокардит — это клинический синдром, для которого характерно множество возможных причин и проявлений. Полагают, что вирусная инфекция является самой частой причиной миокардита, но аналогичные изменения могут вызывать и другие инфекционные и неинфекционные факторы, воздействие которых приводит к воспалительной инфильтрации между кардиомиоцитами.
Весьма разнообразны не только причинные факторы этого патологического состояния, но и его проявления. Диагноз ясен при наличии ярких и характерных признаков острой дисфункции сердца, возникшей в связи с вирусным заболеванием, но при стертой клинической картине диагностика миокардита представляет собой весьма сложную задачу.
Определение. Миокардит — это такое патологическое состояние, при котором в миокарде протекает активный воспалительный процесс с некрозом и дегенеративными изменениями кардиомиоцитов; патоморфологическая картина отличается от изменений, наблюдаемых при инфаркте. Наблюдается гибель клеток и фиброз. Воспалительная инфильтрация может быть представлена любым типом иммунных клеток, при этом гистологическая природа воспалительной реакции нередко указывает на этиологический фактор.
Заболеваемость. Трудно назвать точные цифры, касающиеся миокардита, т. к. это патологическое состояние весьма гетерогенно: в ряде случаев оно протекает скрыто и поэтому не попадает в поле зрения врачей; его хроническая форма может привести к дилатационной кардиомиопатии с манифестацией через много лет после начала заболевания.
Миокардит обнаруживается в 1—4% случаев рутинных аутопсий. В Европе и Северной Америке вирусные инфекции считаются самой частой причиной миокардитов. Кардиальная патология, по некоторым оценкам, развивается в 5% всех случаев вирусных заболеваний; при этом клинически выраженное поражение сердца, согласно крупным исследованиям, наблюдается в 0,5—5,0% случаев.
На заболеваемость оказывают влияние экстремальные факторы, среди которых возраст, а также беременность и время года. Частота миокардита высока у грудных младенцев, второй пик приходится на подростковый возраст.
Этиология. Воспалительная реакция в миокарде может возникать от ряда различных воздействий, повреждающих кардиомиоциты (см. табл.). Вирусные инфекции считаются наиболее частой причиной возникновения миокардита.
Механизмы повреждения кардиомиоцитов при вирусных инфекциях активно исследуются: в настоящее время полагают, что вирусы изменяют антигены, экспрессируемые кардиомиоцитами, поэтому, кроме непосредственной репликации возбудителя, на эти клетки оказывает повреждающее воздействие постоянно текущая клеточная иммунная реакция.
Если это так, то иммунная реакция у данного больного определяет клинические проявления инфекции.
Вирусы Коксаки А и В, энтеровирусы и вирусы гриппа — наиболее частые этиологические факторы миокардита. Приблизительно у 25—40% пациентов, инфицированных ВИЧ (вирусом иммунодефицита человека), наблюдаются признаки дисфункции сердца, которая в 10% случаев проявляется клинически.
В последнее время находит все большее признание тот факт, что патология сердца может развиваться и как отдаленное осложнение лучевой терапии, при этом повреждаются миокард, клапаны или артерии — иногда через много лет после облучения. Более совершенные методики лучевой терапии призваны защитить от таких осложнений.
Патоморфология. Непосредственное воздействие ионизирующего облучения, влияние токсина (например, при дифтерии) или реакции аутоиммунного типа (такой как при инфекции Mycoplasma pneumoniae) способны привести к повреждению кардиомиоцитов и вызвать сердечную недостаточность и нарушения ритма, при этом клиническая картина зависит от степени повреждения.
Воспаление придает миокарду бледный оттенок с редкими мелкими кровоизлияниями. При микроскопии выявляется нарушение структуры мышечных волокон из-за интерстициального отека и изолированных очагов некроза. Воспалительный инфильтрат обычно представлен лимфоцитами.
В зависимости от этиологического фактора могут обнаруживаться более специфические гистологические признаки — такие как неказеозная гранулема при саркоидозе (см. рис. 1). В дальнейшем часто происходит полное разрешение процесса без остаточного фиброза, но в некоторых случаях наблюдается фокальное заживление с интерстициальным фиброзом.
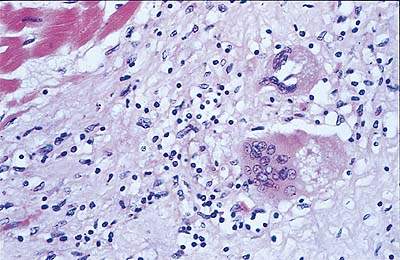 |
| Рисунок 1. Препарат биопсии миокарда при саркоидозе (окраска гематоксилином и эозином): видна воспалительная лимфоцитарная инфильтрация и неказеозная гранулема |
Клинические признаки. Клинические проявления очень разнообразны и зависят от степени дисфункции сердца и от природы этиологического фактора.
Вирусному миокардиту может предшествовать продромальная фаза с гриппоподобными симптомами, лихорадкой, болями в мышцах и суставах и высыпаниями. Между проявлением этих признаков и возникновением симптомов сердечной патологии может пройти от нескольких недель до нескольких лет. Вирус Коксаки представляется самым кардиотоксичным, особенно у детей.
Поражение миокарда впервые проявляется в виде утомляемости, одышки, болей в груди и сердцебиения, иногда в виде обмороков. Эти симптомы объясняются недостаточностью систолы и повреждением проводящей системы.
При физикальном обследовании выявляются признаки сердечной недостаточности: тахикардия (в классических случаях она выражена больше, чем можно было бы объяснить лихорадкой), ритм галопа, а в более тяжелых случаях — отек легких или периферические отеки. Размеры сердца обычно нормальные, может выслушиваться шум митральной регургитации. Иногда развивается фибрилляция предсердий. В некоторых случаях можно услышать шум трения перикарда.
Диагностика. Не существует специфических клинических признаков, на основании которых можно было бы поставить данный диагноз. Сочетание острого инфекционного заболевания и симптомов патологии миокарда дает основание заподозрить миокардит.
О патологии миокарда можно судить на основании данных ЭКГ (см. рис. 2), рентгенографии органов грудной клетки, эхокардиографии и определения уровня кардиальных ферментов. Патологические признаки на ЭКГ наблюдаются часто в виде неспецифических изменений сегмента SТ и зубца Т.
При рентгенографии органов грудной клетки выявляются признаки отека легочной ткани, сердце может быть увеличено. При эхокардиографии нередко обнаруживается дисфункция левого желудочка, причем это изменение может носить регионарный, а не диффузный характер. Неспецифические показатели воспаления: лейкоцитоз, скорость оседания эритроцитов и С-реактивный белок — также помогают поставить диагноз.
Наличие острой вирусной инфекции подтверждается при анализе мазков из зева, кала, а также на основании серологических тестов (которые могут выявить четырехкратное увеличение титра антител). Иногда удается выделить возбудитель из жидкости, взятой из полости перикарда.
Среди более сложных методов исследования можно отметить сканирование с галлием-67, которое способно выявить активный воспалительный процесс.
Некоторые специализированные центры пропагандируют биопсию миокарда.
Лечение миокардита проводится с целью:
В идеале всех больных с подозрением на поражение миокарда следует помещать в стационар и следить, насколько эффективно проводимое лечение.
Общие поддерживающие мероприятия включают постельный режим и ограничение физической активности. Эксперименты на животных ясно показали, что физическая нагрузка во время острого миокардита вредна; в период выздоровления надо рекомендовать больным ограничение занятий спортом. Это важно, учитывая, что многие пациенты, страдающие данным заболеванием, молодые люди.
В острой фазе миокардита за состоянием больных необходимо тщательно наблюдать. При застойной сердечной недостаточности эффективно обычное лечение диуретиками и ингибиторами ангиотензин-превращающего фермента, а также антикоагулянтная терапия — когда имеются признаки эмболии периферических или легочных сосудов, тяжелая желудочковая недостаточность или фибрилляция предсердий.
В некоторых случаях наблюдается клиническая картина кардиогенного шока и низкого желудочкового выброса — при этом необходима адекватная интенсивная терапия.
Может возникать аритмия, требующая специфической терапии. Изредка появляется необходимость во временном или постоянном вживлении искусственных водителей ритма. Общепризнанно, что после миокардита повышается риск внезапной кардиальной смерти, особенно у молодых пациентов.
Специфическая терапия, направленная на причинный фактор, носит ограниченный характер. Поскольку в большинстве случаев миокардит развивается на фоне вирусных инфекций и в его основе лeжaт иммунологические реакции, то в некоторых исследованиях изучалась роль антивирусной и иммунодепрессивной терапии. Многие из этих исследований плохо контролировались, и их результаты оказались неубедительными. В настоящее время нет четких данных, на основании которых можно было бы рекомендовать иммуномоделирующую терапию.
Лучше всего не назначать нестероидные противовоспалительные препараты, так как, по данным некоторых экспериментов на животных, при их применении усиливается повреждение сердца.
Большинство пациентов полностью выздоравливают без признаков остаточной кардиальной дисфункции. Эхокардиография позволяет точно и неинвазивно оценивать функцию сердца, и, по крайней мере пока работа сердца не вернется к норме, все больные должны получать ингибиторы ангиотензин-превращающего фермента.
При остаточной дисфункции миокарда требуется непрерывное лечение и наблюдение специалиста, так как в небольшом проценте случаев заболевание рецидивирует. Часто причинный фактор не удается выяснить, но когда он известен, необходимо его адекватным образом устранить.
Раджеш К. Харбанда, член Королевской коллегии врачей, Британский фонд по исследованиям сердца
Хауэрд Свонтон, доктор медицины, член Королевской коллегии врачей Больница Мидлсекса
Диагностика и лечение метаболических кардиомиопатий, возникающих при нарушениях обмена жирных кислот, у детей
Рассмотрены причины метаболических кардиомиопатий (КМП), возникающих на фоне нарушений обмена жирных кислот. Выделены экстракардиальные и кардиальные критерии диагностики. Ранняя диагностика позволяет своевременно начать специфическое лечение, направленно
Are examined the reasons for metabolic cardiomyopathy (KMP), disturbances of the exchange of fatty acids appearing against the background. The extracardial and cardiac criteria of diagnostics are listed. Early diagnostics makes it possible to begin the specific treatment in proper time, directed toward the correction of metabolic disorders.
Кардиомиопатии (КМП) — гетерогенная группа заболеваний сердца, характеризующихся структурной перестройкой миокарда, с непрерывно прогрессирующим течением и неблагоприятным прогнозом. В большинстве случаев диагностика КМП основывается на клинических симптомах и данных функционального обследования, в первую очередь эхокардиографии [1–3]. При этом истинная этиология КМП не всегда устанавливается. По данным наиболее крупного регистра КМП у детей США и Канады среди группы, в которой причина КМП была установлена, в 29,1% был диагностирован миокардит, в 24,2% — семейная изолированная КМП, в 22,2% — нейромышечные заболевания, в 15,4% — врожденные нарушения метаболизма и в 8,8% — различные генетические синдромы [3–6].
Причинами метаболических КМП являются врожденные нарушения обмена веществ или нарушения функции органелл клетки. Нарушения метаболизма жирных кислот являются наиболее частой причиной развития метаболических КМП. По данным педиатрического регистра при гипертрофических КМП в 20% случаев выявлены нарушения транспорта карнитина или дефекты окисления жирных кислот, нарушения окислительного фосфорилирования [7]. При дилатационных КМП дефекты транспорта карнитина/нарушения оксидации жирных кислот встречаются в 40% [8]. Наследственные дефекты обмена жирных кислот являются причиной не менее 5% случаев внезапной детской смерти [9].
Нарушения метаболизма жирных кислот могут возникать вследствие дефицита карнитина, нарушения транспорта карнитина при недостаточности ферментов, обеспечивающих перенос соединений карнитина, а также при дефектах оксидации жирных кислот [10].
Дефицит карнитина можно определить как дефицит внутриклеточного содержания карнитина, при котором концентрация карнитина в плазме менее 20 мкмоль/л, а содержание карнитина в тканях менее 20% от нормы. В зависимости от причины дефицита карнитина выделяют первичный дефицит карнитина, возникающий при генетически детерминированных дефектах метаболизма карнитина, и вторичный дефицит карнитина, связанный с нарушением обмена органических кислот, дефицитом ацил-КоА-дегидрогеназ, дефектами в цепи дыхательных ферментов митохондрий, рядом соматических заболеваний и патологических состояний [11].
Первичный дефицит карнитина может проявляться в двух формах: системной [13, 14] и мышечной [11, 16]. Системный дефицит карнитина обусловлен мутацией гена SLC22A5, локализованного на длинном плече 5-й хромосомы (5q319), продуктом которого является белок, переносящий карнитин (OCTN2). Результатом этой мутации является дефицит карнитина в тканях. Заболевание наследуется по аутосомно-рецессивному типу [13–14]. При гомозиготной форме сроки манифестации заболевания варьируют от 1 месяца до 7 лет, в среднем 2 года. При гетерозиготной форме манифестация заболевания возникает в подростковом возрасте [14–16].
При раннем дебюте заболевания первыми признаками являются отказ от кормления, раздражительность, низкая прибавка в весе, отставание в физическом и психомоторном развитии. Характерным признаком является гипокетотическая гипогликемическая энцефалопатия (вялость, сонливость, повторная рвота), имеющая приступообразное течение. Во время гипогликемического криза возникают общая слабость, тахикардия, церебральная дисфункция (повышенная возбудимость, раздражительность). В дальнейшем развиваются гепатомегалия, стеатоз печени, нарушения желудочно-кишечного тракта (боли в животе, диарея), скелетная миопатия (мышечная слабость, гипотония), синдром Рейе. Как правило, дети часто болеют интеркуррентными заболеваниями: инфекционные заболевания верхних дыхательных путей и острый гастроэнтерит. У ряда пациентов возникает гипохромная анемия. Тяжесть заболевания варьирует от легких до крайне тяжелых вариантов. При легком течении отставание в физическом и психомоторном развитии может быть единственным проявлением заболевания [14–16].
На ЭКГ определяется высокий вольтаж комплексов QRS за счет компенсаторной гипертрофии субэпикардиальных слоев миокарда. Обязательным признаком являются смещение сегмента ST ниже изолинии в стандартных и левых грудных отведениях, отрицательный зубец Т в этих отведениях, однако могут быть «гигантские» зубцы Т, превышающие по величине зубец R желудочкового комплекса (специфичный признак карнитиновой КМП); признаки гипертрофии левого желудочка, левого предсердия. Рентгенологически определяется кардиомегалия преимущественно за счет увеличения левого желудочка и левого предсердия. Данные эхокардиографии (ЭХО-КГ) выявляют резкое снижение фракции выброса, значительную дилатацию левого желудочка и левого предсердия, гипокинезию межжелудочковой перегородки, смещение митрального клапана к задней стенке левого желудочка, уплотнение эхосигнала от эндокарда.
У гетерозиготных носителей мутации гена SLC22 A5 карнитиновая недостаточность может проявиться в более старшем возрасте в виде гипертрофической КМП [16].
Лабораторные признаки системного дефицита карнитина: низкий уровень карнитина в тканях (печени, мышцах); приступы гипогликемии, не сопровождающиеся кетозом; повышение активности трансаминаз, уровня аммиака в крови; гипохромная анемия. Уровень свободного карнитина в крови обычно резко снижен. При исследовании методом тандемной масс-спектрометрии содержание свободного карнитина (С0) 70–100. В фибробластах снижена активность карнитинпальмитоилтрансферазы I (около 10% от нормы), окисление пальмитата составляет около 5% от нормы [23, 24].
Дефицит карнитинпальмитоилтрасферазы II. Наследование аутосомно-рецессивное, вызывается мутациями в гене карнитинпальмитоилтрансферазы II. Заболевание может протекать в трех формах: неонатальной (летальной), детской (инфантильной) и поздней (форма взрослых).
Неонатальная (летальная) форма характеризуется манифестацией с первых дней жизни, прогрессирующим течением, очень тяжелым состоянием детей и плохим прогнозом. Заболевание проявляется полиорганным поражением. У новорожденных развиваются гипотермия, летаргия, судороги, гипотония, гиперрефлексия и гепатомегалия, почечная недостаточность. Характерны дисморфии лица, контрактуры коленей и локтей, длинные сужающиеся пальцы рук и ног, гепатомегалия (макровезикулярный стеатоз), поликистоз почек, дисплазия почечной паренхимы, гидронефроз, тубулярные расстройства (проксимальный и дистальный канальциевый ацидоз), грубые изменения ЦНС (вентрикуломегалия, кальцификаты, дисплазия мозолистого тела, полимикрогирии, кисты паравентрикулярные и базальных ядер) [25].
Поражение сердца проявляется с рождения в виде гипертрофии левого желудочка или бивентрикулярной гипертрофии, реже возможно развитие кардиомегалии с низкой сократительной способностью сердца. В большинстве случаев регистрируются нарушения ритма сердца, возникновение желудочковой тахиакардии часто является причиной внезапной смерти [25].
Лабораторные признаки: некетотическая гипогликемия, увеличение в сыворотке, моче и тканях длинноцепочечных ацилкарнитинов (С16, С18), снижение плазменного общего и свободного карнитина, длинноцепочечная дикарбоновая ацидурия, гипераммониемия, увеличение общего билирубина, трансаминаз печени, кретинфосфокиназы, высокое содержание дикарбоксильных кислот в моче. Заболевание верифицируется выраженным снижением активности (менее 10% от нормы) карнитинпалмитоилтрансферазы II в большинстве тканей, отсутствием белка CPT II [24, 25].
При морфологическом исследовании обнаруживается накопление липидов в ткани печени, почек, скелетных мышц, легких, надпочечников и др.
Инфантильная форма манифестирует с 3 месяцев, провоцируется лихорадочными состояниями и нарушениями питания. Характерны гепатомегалия, миопатический синдром, судороги. Поражение сердца — по типу дилатационной КМП. Миопатическая форма (поздняя) протекает благоприятно, может дебютировать как в детском возрасте, так и у взрослых. Основные проявления: боли в мышцах, обычно сопровождающиеся миоглобинурией. Характерна высокая активность креатинфосфокиназы в крови, при голодании может возникать умеренный кетоз. Изменения со стороны сердца минимальны [24].
Дефицит карнитинацилкарнитинтранслоказы — редкое аутосомно-рецессивное заболевание, приводящее к нарушению утилизации длинноцепочечных жирных кислот [24]. Выделяют две формы заболевания: неонатальная и инфальтильная. Неонатальная форма характеризуется высокой летальностью вследствие сердечно-легочной недостаточности. Основные проявления: нарушение общего состояния и психомоторного развития, расстройства дыхания, изменения со стороны ЦНС в виде мышечной слабости, судорог, возможно развитие комы на фоне голодания, гепатомегалия с нарушением функции печени.
Поражение сердца встречается чаще по типу дилатационной КМП, характерно снижение систолической функции, возможны нарушения ритма: брадикардия, атриовентрикулярная блокада, желудочковая экстрасистолия, тахикардия. На ЭКГ — признаки гипертрофии левого желудочка. У новорожденных описаны случаи внезапной смерти вследствие апноэ, кардиореспираторного ареста. Если заболевание возникает в более позднем возрасте, то КМП протекает на фоне мышечной слабости и энцефалопатии [10, 26].
Отклонения в лабораторных показателях включают гипогликемию при отсутствии кетоза, увеличение в крови уровня аммиака, иногда калия и мочевой кислоты, высокую активность креатинфосфокиназы, трансаминаз, дикарбоксильную и гидроксидикарбоксильную ацидурию, а также увеличение уровня ацилкарнитинов в крови (С16–С18) в сочетании с низким уровень свободного карнитина (С0). Патология верифицируется низкой активностью карнитин-ацилкарнитин-транслоказы.
Дефекты окисления жирных кислот. Карнитин-ацилтрансферазы осуществляют перенос карнитина к ацильным компонентам коротких, средних и длинных цепей. Ацил-КоА-дегидрогеназы длинных цепей обеспечивают внутримитохондриальную бета-оксидацию жирных кислот с длинными карбоновыми цепями. Ацил-КоА-дегидрогеназы средних цепей регулируют внутримитохондриальное окисление жирных кислот средней длины карбоновых цепей. Ацил-КоА-дегидрогеназы коротких цепей обуславливают внутримитохондриальное окисление жирных кислот с короткой длиной карбоновых цепей, являются буфером ацильных групп, регулируя их поступление в цикл Кребса [27–29].
Дефицит ацил-КоА-дегидрогеназы жирных кислот с очень длинной углеродной цепью возникает в результате мутации гена дегидрогеназы очень длинной цепи ацил-КоА, наследование аутосомно-рецессивное. Мультисистемная патология: поражаются печень (гепатомегалия, стеатоз печени, гепатоцеллюлярный некроз), мышцы. Симптомами поражения мышц являются гипотония, мышечная слабость, связанная с голоданием или инфекцией, боль в мышцах при физической нагрузке, ригидность мышц, рабдомиолиз при физической нагрузке. Миопатические эпизоды вызваны физическими упражнениями, голоданием, инфекцией, воздействием низких температур. По срокам появления первых признаков выделяют 3 формы заболевания: неонатальную, детскую и позднюю [27–29].
Неонатальная форма характеризуется ранней манифестацией, в течение первых дней жизни, с развитием КМП и ранней смерти. Поражение сердца по типу гипертрофической КМП в сочетании со сниженной контрактильной способностью, часто возникают жизнеугрожающие нарушения сердечного ритма. Во время гипогликемической комы возможно развитие асистолии и внезапной смерти [30].
При детской форме (около 40% больных) начальные симптомы обычно появляются на протяжении первого года жизни. Поздняя форма характеризуется более благоприятным течением, манифестирует в подростковом возрасте, клинически проявляется болями в мышцах, как правило, сердце не вовлекается в патологический процесс.
Лабораторные признаки: некетоновая гипогликемия, дикарбоновая ацидурия, повышение концентрации лактата в крови. Диагностический маркер — снижение свободного карнитина при увеличении ацилкарнитинов (С14:1 и С14, С16OH), повышение активности креатинфосфокиназы, ацидурия дикарбоксильных кислот с длинной углеродной цепью (С14–С18) [23]. Специфична низкая активность дегидрогеназы очень длинной цепи ацил-КоА в фибробластах или мононуклеарных лейкоцитах.
Дефицит ацил-КоА-дегидрогеназы жирных кислот со средней длиной углеродной цепи возникает в результате мутации гена средней цепи ацил-КоА-дегидрогеназы, наследования аутосомно-рецессивное. Наиболее распространенное нарушение окисления жирных кислот [27, 29].
Характер поражения сердца аналогичен таковому при карнитиновой КМП. Часто возникают тяжелые нарушения сердечного ритма, остановка синусового узла, желудочковая тахикардия (по типу приступов пируэтной тахикардии (torsades de pointes)) [10, 30]. Дефицит ацил-КоА-дегидрогеназы жирных кислот со средней длиной углеродной цепи является в 1–3% причиной внезапной смерти у детей раннего возраста [10].
Лабораторные признаки: гипогликемия, метаболический ацидоз, дикарбоновая ацидурия средних цепей, ацилглицинурия, низкое содержание плазменного карнитина. Может отмечаться умеренная кетонурия. В крови повышен уровень среднецепочечных ацилкарнитинов (С6–С10). В моче определяется специфическая органическая ацидурия с преобладанием среднецепочечных дикарбоновых кислот, глициновых конъюгатов [27–28].
Дефицит ацил-КоА-дегидрогеназы жирных кислот с короткой длиной углеродной цепи. Возникает в результате мутации гена короткой цепи ацил-КоА-дегидрогеназы, наследование аутосомно-рецессивное.
Генерализованная форма может проявиться у новорожденных или детей первого года жизни, течение неблагоприятное, возможен летальный исход. Характерны судороги, задержка развития, микроцефалия, повторные приступы рвоты, прогрессирующая мышечная слабость, вялость, сонливость. Поражение сердца характеризуются дилатационной КМП, осложненной тяжелой СН. При мышечной форме первые признаки болезни появляются в старшем возрасте. В клинической картине на первый план выступают миопатические расстройства, низкая толерантность к физической нагрузке. Поражение сердца по типу дилатационной КМП протекает субклинически и выявляется обычно у подростков [29, 30].
Множественный дефицит ацил-КоА-дегидрогеназ описан как глутаровая ацидурия 2-го типа, наследование аутосомно-рецессивное. Патология обусловлена дефектом электронно-транспортного флавопротеина и дефицитом нескольких флавопротеин-содержащих дегидрогеназ, что значительно снижает эффективность митохондриального бета-окисления. Нарушены функции изовалерил-, изобутирил-, метилбутирил-, глутарил-КоА-дегидрогеназ, участвующих в метаболизме ряда аминокислот и холина.
Выделяют несколько клинических форм: неонатальную форму с врожденными аномалиями (летальную), неонатальную форму без врожденных аномалий, позднюю форму.
Метаболические проявления включают тяжелый метаболический ацидоз, гипогликемию, гипераммониемию. Кетоз выражен умеренно или отсутствует, гиперлактат- и гиперпируватемия с увеличением их соотношения до 20 и выше (норма
И. В. Леонтьева, доктор медицинских наук, профессор
Ю. М. Белозеров, доктор медицинских наук, профессор
ФГБУ НИИ педиатрии и детской хирургии Минздравсоцразвития России, Москва