Мезентериальные артерии что это
Острые сосудистые болезни кишечника (K55.0)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
В данную подрубрику включены:
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Причины, приводящие к развитию острой ишемии кишечника
— гиперкоагуляция (дефицит, диспропорции или аномалии факторов свертывающей системы): истинная полицитемия (наиболее распространенная причина), тромбоцитоз, серповидно-клеточная анемия, беременность, использование оральных контрацептивов;
— неопластические процессы, вызывающие сжатие вен или гиперкоагуляцию (паранеопластический синдром);
— инфекции, как правило, внутрибрюшной локализации (например, аппендицит, дивертикулит или абсцесс);
— венозный застой вследствие цирроза печени (портальная гипертензия);
— травмы вен вследствие несчастных случаев или хирургических вмешательств, особенно наложение портокавальных анастомозов;
— повышение внутрибрюшного давления при выполнении пневмоперитонеума для проведения лапароскопических операций;
— панкреатит;
— декомпрессионная болезнь.
В дальнейшем реализуются последовательно три патогенетические стадии: ишемия, инфаркт, перитонит (некоторые авторы выделяют также стадию функциональной кишечной непроходимости). Реализация стадий находится в зависимости от варианта течения: с компенсацией кровотока, с субкомпенсацией кровотока, с декомпенсацией кровотока.
Примечание
1. Исследователи обнаружили значительно более высокой риск острой брыжеечной ишемии у пациентов с воспалительными заболеваниями кишечника (отношение рисков 11,2, P
Эпидемиология
Возраст: преимущественно пожилой
Признак распространенности: Редко
Соотношение полов(м/ж): 1
Острая ишемия кишечника составляет около 0,1% всех госпитализаций.
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
I. Общие проявления
Стадии развития острых ишемий кишечника:
1. Гиперактивная фаза. Первичные симптомы: сильные боли в животе и примесь крови в стуле. Симптомы раздражения брюшины отсутствуют.
Фаза считается спонтанно обратимой в ряде случаев и не приводит к развитию осложнений.
II. Особенности, связанные с типом ишемии
Возможные провоцирующие факторы возникновения тромбоза мезентериальной артерии:
— внезапное падение сердечного выброса вследствие инфаркта миокарда, застойной сердечной недостаточности, разрыва атеросклеротической бляшки;
— обезвоживание (рвота или диарея, связанные с другим заболеванием).
Неокклюзионная брыжеечная ишемия возникает у пожилых пациентов чаще, чем эмболия и тромбоз.
III. Особенности клиники, связанные с локализацией
Эмболия и тромбоз верхней мезентериальной артерии
Верхняя мезентериальная артерия отвечает за кровоснабжение всей тонкой кишки, слепой, восходящей и частично поперечно-ободочной кишки.
Основные клинические признаки эмболии верхней мезентериальной артерии: острая внезапная боль в области пупка или правом верхнем квадранте живота, иногда во всей правой половине живота.
При тромбозе боли менее интенсивные и не носят схваткообразного характера. Однако в дальнейшем, по мере нарастания ишемии кишечника, боли быстро становятся все более явными.
При поражениях верхней брыжеечной артерии в начале заболевания наблюдается 1-2-кратный жидкий стул (ишемическое опорожнение кишечника). При отсутствии кишечного содержимого может возникнуть только чувство позыва на дефекацию.
Тромбоз брыжеечных вен
Клинически проявляется нелокализованной болью в животе, иногда в верхней части живота. Для тромбоза вен характерно сегментарное поражение кишечника в виде небольших участков ишемии и некроза.
Диагностика
Диагноз ишемии кишечника почти никогда не ставится только на основании анамнеза, клиники и лабораторных исследований. Основными методами диагностики являются инструментальные методы.
6. Магнитно-резонансная томография (МРТ) и магнитно-резонансная ангиография (МРА) аналогичны по диагностической ценности КТ и являются методами первой линии, особенно при подозрении на венозный тромбоз. MРA имеет чувствительность 100% и специфичностью 91%. Основными недостатками являются стоимость и время, необходимое для проведения исследования.
7. Эхокардиография может подтвердить источник эмболизации или визуализировать клапанную патологию сердца.
8. Электрокардиография может диагностировать инфаркт миокарда или фибрилляцию предсердий. Обнаружение фибрилляции предсердий увеличивает вероятность диагноза на 17,5%. Кроме этого ЭКГ необходима для дифференциальной диагностики с острым инфарктом миокарда.
9. Назогастральный зонд производит декомпрессию верхних отделов желудочно-кишечного тракта и помогает диагностировать кровотечение из его верхних отделов.
10. Диагностический перитонеальный лаваж может показать наличие серозной жидкости, связанной с наличием инфаркта кишечника, но не является предпочтительным методом диагностики при острой ишемии кишечника, хотя может быть использован для дифференциальной диагностики.
11. Катетеризация мочевого пузыря позволяет измерять диурез, контролировать инфузионную терапию и проводить дифдиагностику с заболеваниями почек.
Лабораторная диагностика
1. Общий анализ крови может быть в пределах нормы на начальном этапе. Лейкоцитоз и/или сдвиг лейкоцитарной формулы влево наблюдается более чем в 50% случаев в финальных стадиях, по мере прогрессирования заболевания и развития осложнений. Гематокрит сначала повышен но быстро уменьшается при развитии желудочно-кишечных кровотечений.
3. Коагулограмма. Повышение уровня Д-димера может свидетельствовать об острой ишемии, но клинических данных пока недостаточно для оценки чувствительности и специфичности признака.
Мезентериальные артерии что это
Содержание:
Проявление мезентериальной ишемии
Данное патологическое состояние характеризуется нарушением кровотока в бассейне мезентериальных сосудов (кровоснабжающих тонкий кишечник) в результате различных причин. Проявления мезентериальной ишемии малоспецифичны, а основным и часто единственным симптомом служит выраженный болевой синдром в области живота при отсутствии значительных физикальных изменений. Ишемия тонкого кишечника трудно диагностируется, что служит одной из основных причин частого развития осложнений и смертности от этого заболевания. Грозным осложнением мезентериальной ишемии является развитие распространенного перитонита, а также присоединение венозной окклюзии.
Для развития клинической картины мезентериальной ишемии поражение должно захватывать крупный сосуд (верхнюю брыжеечную артерию), потому что кровеносная сеть тонкого кишечника образует огромное количество коллатералей, которые способны компенсировать нарушения кровотока. К факторам риска развития ишемии следует относить такие патологические состояния, как наличие мерцательной аритмии, распространенного атеросклероза, пороков сердца, сердечной недостаточности, цирроза печени и других. В зависимости от механизма развития нарушения кровообращения выделяют окклюзионную форму артериальной интестинальной ишемии и неокклюзионную. В первом случае в основе нарушения кровотока лежит либо процесс образования тромба в сосуде, либо эмболия тромботическими массами из левых отделов сердца. Во втором случае – ишемия происходит из-за вторичных нарушений в микроциркуляторном русле на фоне тяжелых соматических состояний (в частности, шоковых). Венозный мезентериальный тромбоз возникает в результате образования тромба в венозном русле на фоне повышенной свертываемости крови или застоя в системе воротной и нижней полой вен.
Клиническая картина артериальной ишемии кишечника зависит от стадии, локализации, распространенности поражения, вида нарушения кровообращения. В первой стадии (собственно ишемии) появляется сильная диффузная боль в животе, тошнота, рвота и жидкий стул. Боль приводит к тому, что пациенты не могут найти себе места, мечутся, стонут. Во второй стадии (инфаркт кишки) боль становится локализованной, уменьшается ее интенсивность, появляется стул с примесью слизи и крови, после чего появляются симптомы раздражения брюшины (напряжение мышц брюшной стенки, положительные перитонеальные симптомы), исчезает перистальтика кишечника. Следующая стадия характеризуется присоединением перитонита с симптомами системной воспалительной реакции организма. Симптомы венозной ишемии обычно не патогномоничны: не резко выраженная боль в животе может сохраняться несколько дней, после чего развивается перитонит и присоединяется клиника системной воспалительной реакции организма.
Диагностика заболевания
Диагностикой и лечением острой мезентериальной ишемии как артериальной, так и венозной этиологии, занимаются хирурги, а в случае необходимости выполнения сложных сосудистых оперативных вмешательств – и сосудистые хирурги.
Что необходимо предпринять при подозрении на мезентериальную ишемию
При подозрении на данное заболевание пациенты должны быть госпитализированы в стационар, в котором есть соответствующие специалисты и возможность оказания специализированной помощи. При проведении экстренной диагностики необходимо выполнить комплексное обследование, позволяющее в достаточной степени опровергнуть или предположить данный диагноз. В диагностический минимум входит выполнение общего анализа крови, общего анализа мочи, измерение давления, пульса и температуры, выполнение обзорной рентгенограммы брюшной и грудной полости, ЭКГ и ультразвукового исследования брюшной полости. При подозрении на нарушение кровотока в мезентериальном русле необходимо выполнить КТ- или МРТ-ангиографию, по возможности – прямую аортомезентерикографию.
Действия при отсутствии признаков
При отсутствии признаков начинающегося перитонита показана консервативная терапия до выполнения ангиографии и уточнения распространенности процесса – показаны антикоагулянты, антибиотики, инфузионная терапия. Для уточнения диагноза и решения вопроса о тактике лечения показана лапароскопия (введение лапароскопа в брюшную полость через проколы). При указании на перитонеальную симптоматику показана экстренная операция. При эмболии или тромбозе на стадии ишемии может быть показана операция по восстановлению кровотока. В стадии инфаркта определяют границы нежизнеспособного кишечника и проводят резекцию погибшего участка после вмешательства на сосудах или без такового. При тотальном поражении и гангренизации тонкого и толстого кишечника операция не выполняется.
Острый мезентериальный тромбоз
Данное заболевание встречается у мужчин и женщин примерно с одинаковой частотой. Тромбоз и эмболия мезентериальных сосудов развивается преимущественно в среднем и пожилом возрасте.
Клинические проявления мезентериального тромбоза.
1. Первым симптомом тромбоза и эмболии мезентериальных сосудов является резкая, интенсивная боль. Локализация болей зависит от уровня поражения брыжеечных сосудов. При поражении основного ствола верхней брыжеечной артерии боли чаще всего определяются в области. При поражении подвздошно-ободочной артерии боли локализуются в правой подвздошной области. В этом случае мезентериальный тромбоз необходимо дифференцировать с острым аппендицитом. При тромбозе и эмболии нижней брыжеечной артерии характерно появление болей в левой подвздошной области. Боли при данной патологии чаще всего постоянные, имеют интенсивный характер. Иногда боли имеют схваткообразный характер. В этом случае мезентериальный тромбоз можно спутать с острой кишечной непроходимостью, или же с кишечной коликой.
2. Вторым по частоте симптомом у больных с мезентериальным тромбозом является тошнота, иногда переходящая в рвоту. Тошнота и рвота встречается более чем у 50% больных с данной патологией.
3. При мезентериальном тромбозе возможен жидкий стул, иногда с примесью крови.
4. Тахикардия.
5. В начале заболевания температура тела будет нормальной. При развитии некроза кишечника температура может повышаться до 38 и более градусов.
6. По мере развития заболевания начинает развиваться клиническая картина паралитической кишечной непроходимости. При этом будет наблюдаться вздутие живота, отсутствие перистальтики, задержка стула, возможна рвота.
Лечение мезентериального тромбоза.
Необходимо помнить, что развитие мезентериального тромбоза угрожает жизни больного. Поэтому, чем раньше будет поставлен правильный диагноз, тем больше шансов спасти жизнь больному.
Наиболее целесообразно применение хирургической тактики лечения. Опреция проводится под эндотрахеальным наркозом. При отсутствии некроза кишечника возможно применение эндартерэктомии, эмболэктомии, протезирования брыжеечных артерий. В случае запущенности процесса развивается некроз кишечника, и в этом случае необходимо выполнить резекцию некротизированного участка кишки.
В качестве консервативной терапии применяется:
1. Парентеральное введение антикоагулянтов (Гепарин). Антикоагулянтную терапию необходимо проводить под контролем МНО, протромбинового индекса.
2. Парентеральное введение дезагрегантов (Реополиглюкин, Трентал, Гемодез)
Прогноз при мезентериальном тромбозе.
Летальность при этом заболевании может достигать 70-90%.
Некроз тонкого кишечника при остром тромбозе верхней брыжеечной артерии. Операция по резекции прожженного участка.
Острая окклюзия мезентериальных сосудов
Острая окклюзия мезентериальных сосудов – острое нарушение кровообращения в брыжеечных сосудах, приводящее к ишемии кишечника. Заболевание проявляется резкой, нестерпимой болью в животе, рвотой и поносом с примесью крови, шоковым состоянием. Диагноз острой окклюзии мезентериальных сосудов определяют на основании клинической картины, данных селективной ангиографии, рентгенографии брюшной полости, лапароскопии. Острая окклюзия мезентериальных сосудов требует экстренного оперативного вмешательства (эмбол- или тромбэндартериоэктомии, резекции пораженных отделов кишечника), профилактики перитонита и повторных окклюзий.
Общие сведения
Локализация и протяженность ишемического поражения кишечника при острой окклюзии мезентериальных сосудов зависит от вида и уровня обструкции, наличия коллатеральных путей компенсации кровотока. В 90% случаев наблюдается окклюзия основного ствола или одной из ветвей верхней брыжеечной артерии, в большей степени обеспечивающей кровоснабжение пищеварительного тракта. Нижняя брыжеечная артерия имеет хорошие коллатеральные связи, поэтому при ее окклюзии редко возникают серьезные нарушения мезентериального кровообращения. Окклюзия брыжеечных вен встречается реже; возможно также смешанное поражение брыжеечных артерий и вен, при котором острой окклюзии одного из сосудов предшествует хроническая обструкция другого.
Острая окклюзия мезентериальных сосудов встречается преимущественно у лиц мужского пола в возрасте старше 50-60 лет.
Причины острой окклюзии мезентериальных сосудов
Острая окклюзия мезентериальных сосудов развивается как осложнение различных сердечно-сосудистых заболеваний (атеросклероза, пороков сердца, системных аллергических васкулитов, ревматизма, гипертонической болезни, аневризмы брюшной аорты, аритмии), предшествующих операций на сердце и аорте, злокачественных опухолей, травм.
Непосредственной причиной острой окклюзии мезентериальных сосудов являются тромбоз и эмболия. При тромбозе просвет сосудов брыжейки перекрывается тромбом, образовавшимся вследствие изменения сосудистых стенок на фоне повышенной свертываемости крови и замедленного кровотока (патогенетическая триада Вихрова). При эмболии наблюдается обструкция брыжеечных сосудов частицей тканью опухоли, инородным телом или пузырьком воздуха, мигрировавшими от первичного источника поражения с током крови.
Острая окклюзия мезентериальных сосудов может протекать с компенсацией, субкомпенсацией и декомпенсацией мезентериального кровотока. При компенсации мезентериального кровотока (спонтанно или под воздействием консервативной терапии) все функции кишечника восстанавливаются полностью. Субкомпенсация мезентериального кровотока ввиду недостаточного кровоснабжения может приводить к ряду заболеваний кишечника: брюшной жабе, язвенным энтеритам и колитам и др. Декомпенсация мезентериального кровообращения вызывает распространенный гнойный перитонит и развитие тяжелого абдоминального сепсиса.
Симптомы острой окклюзии мезентериальных сосудов
Развернутой клинической картине острой окклюзии мезентериальных сосудов могут предшествовать предвестники заболевания, сходные с предынфарктным состоянием, – так называемая «брюшная жаба».
В большинстве случаев острая окклюзия мезентериальных сосудов имеет внезапное начало и на стадии ишемии (первые 6-12 часов) характеризуется невыносимыми, схваткообразными болями в животе. Пациент испытывает беспокойство, не находит себе места, принимает вынужденную позу с приведенными к животу ногами. Возникают тошнота и рвота с примесью желчи и крови, позднее рвота с каловым запахом, неоднократный жидкий стул с примесью крови («ишемическое опорожнение кишечника»).
Наблюдается резкая бледность кожных покровов, цианоз, шоковое состояние, повышение артериального давления на 60-80 единиц (симптом Блинова), брадикардия. Для острой окклюзии мезентериальных сосудов характерно несоответствие между тяжестью состояния больного и данными его осмотра: в первые часы живот остается мягким, брюшная стенка участвует в дыхании, отмечается незначительная болезненность без симптомов раздражения брюшины.
В стадии инфаркта (через 6-12 часов от начала острой окклюзии мезентериальных сосудов) болевые ощущения немного уменьшаются, но нарастает локальная (в зоне поражения кишки) болезненность при пальпации, между пупком и лобком может прощупываться тестовидная припухлость (симптом Мондора), ухудшается состояние больного. Эвакуаторная функция кишечника сохраняется, артериальное давление нормализуется, пульс учащается.
Стадия перитонита начинается через 18-36 часов от момента острой окклюзии мезентральных сосудов, характеризуется резким ухудшением состояния: усилением болей (особенно при движении), выраженной интоксикацией, признаками перитонита, паралитической кишечной непроходимостью.
Диагностика
Распознавание острой окклюзии мезентериальных сосудов опирается на анализ клинической картины заболевания: острый болевой абдоминальный синдром, поражение сердца и сосудов в анамнезе. Важное диагностическое значение имеет исследование коагулограммы, определение количества тромбоцитов, холестерина крови.
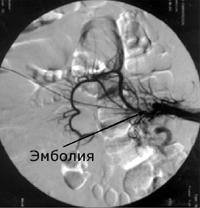
При обзорной рентгенографии брюшной полости определяется пневматизация кишечника, наличие горизонтальных уровней жидкости в брюшной полости. Специфическим методом диагностики острой окклюзии мезентериальных сосудов является селективная мезентерикография, которая уже на ранней стадии заболевания может выявить отсутствие кровотока в стволе и ветвях брыжеечной артерии. При наличии технической возможности выполняется магнитно-резонансная ангиография мезентериальных сосудов.
Диагностическая лапароскопия позволяет обнаружить изменения кишечника и брюшной полости, наличие признаков анемического и геморрагического инфаркта кишки. Острую окклюзию мезентериальных сосудов дифференцируют от прободной язвы желудка и двенадцатиперстной кишки, острого аппендицита, кишечной непроходимости, острого панкреатита и острого холецистита.
Лечение острой окклюзии мезентериальных сосудов
При острой окклюзии мезентериальных сосудов показано экстренное хирургическое вмешательство, целью которого служит ревизия кишечника с оценкой его жизнеспособности, ревизия основных брыжеечных сосудов, устранение причины сосудистой непроходимости и восстановление мезентериального кровотока, резекция некротизированных отделов кишечника, профилактика перитонита.
Реваскуляризация кишечника выполняется путем непрямой эмбол- или тромбэндартериоэктомии, в трудных случаях проводится реконструктивное обходное шунтирование с использованием сосудистых протезов (протезирование верхней брыжеечной артерии).
При некрозе кишечника реваскуляризация дополняется частичной или обширной резекцией пораженных участков кишечника и активным назоинтестинальным дренированием для лечения послеоперационного пареза кишечника. Через 24-48 часов возможно выполнение релапаротомии с целью контроля состояния брюшной полости или наложения отсроченного анастомоза.
Пред- и послеоперационное ведение больного с острой окклюзией мезентериальных сосудов включает назначение антитромботических препаратов для профилактики повторной эмболии и ретромбоза; мероприятия интенсивной терапии с целью восстановления ОЦК, устранения интоксикации, улучшения кровотока и тканевого метаболизма, стабилизации сердечной деятельности. Проводится антибактериальная терапия, дренирование и санация брюшной полости для предупреждения гангрены и перитонита.
Прогноз и профилактика
Восстановление кровотока в брыжеечных артериях в течение первых 4-6 часов («золотой период») может предотвратить инфаркт кишечника и восстановить его функции. Как правило, оперативное вмешательство приходится на II и III стадии острой окклюзии мезентериальных сосудов, поэтому летальность после операции достигает 80-90%. Прогноз ухудшает наличие основного заболевания, приведшего к острому нарушению мезентериального кровообращения.
Профилактика острой окклюзии мезентериальных сосудов заключается в своевременном устранении потенциального источника тромбоэмболии, т. е. первичного заболевания (атеросклероза, мерцательной аритмии, ревматического порока сердца, аневризм и др.).
Ультрасонографическая оценка аорты и мезентериальных артерий
Margarita V. Revzin,MD, MS, John S. Pellerito, MD
ОСНОВНЫЕ ПОЛОЖЕНИЯ
ВВЕДЕНИЕ
В этой статье рассматривается сонографическая оценка брюшной аорты и мезентериальных артерий. В статье рассмотрена соответствующая анатомия и гемодинамика для нормальных сосудов, а также при патологии, в том числе аневризме брюшной аорты (АБА), стенозе сосудов, расслоении и окклюзии. Представлены также различные методы допплеровских исследований, протоколов и диагностических критериев, используемых при оценке аорты и мезентериальных артерий. Читателям представлена необходимая информация для правильной диагностики и показаны потенциальные ошибки, которых необходимо избегать.
АНАТОМИЯ БРЮШНОЙ АОРТЫ И ЕЕ ОСНОВНЫХ ВЕТВЕЙ
Базовые знания анатомии брюшной аорты и ее основных ветвей имеют важное значение для правильной интерпретации ультразвуковых находок и для понимания патологических состояний, поражающих эти сосуды.
Брюшная аорта
Анатомия мезентериальных артерий и коллатеральных путей
Существует богатая коллатеральная сеть между всеми мезентериальными артериями, которая обеспечивает кровоток в жизненно важных органах и кишечнике, если один или более сосудов скомпрометированы. Связь между чревным стволом и системой ВБА осуществляется через гастродуоденальную артерию. Гастродуоденальная артерия формируется из верхней панкреатодуоденальной артерии – ветви системы чревного ствола и нижней панкреатодуоденальной артерии, ветви ВБА. Системы ВБА и НБА соединяются дугой Риолана, объединяющей среднюю толстокишечную артерию – веточку ВБА с левой толстокишечной артерией – веточкой НБА. Она (дуга) образует короткую петлю, которая проходит рядом с корнем брыжейки. Кроме того, ВБА и НБА анастомозируют с помощью краевой артерии Драммонда, которая является продолжением артериального круга или аркады вдоль внутреннего края толстой кишки, образованной анастомозами терминальной ветви подвздошно-толстокишечной артерии, правой и средней толстокишечной артерии (от ВБА) с левой толстокишечной и сигмовидной артериями НБА. Кроме того, есть связь НБА и системы внутренней подвздошной артерии через анастомоз верхней прямокишечной артерии (ветви НБА) с нижней прямокишечной артерией (ветвь внутренней подвздошной артерии).
Существует значительные различия в анатомии коллатеральной циркуляции – варианты со слабой или отсутствием связи между брыжеечными артериями, что встречается до 30% населения.
ГЕМОДИНАМИКА БРЮШНОЙ АОРТЫ И МЕЗЕНТЕРИАЛЬНЫХ АРТЕРИЙ
Гемодинамика аорты
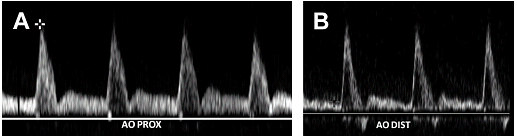
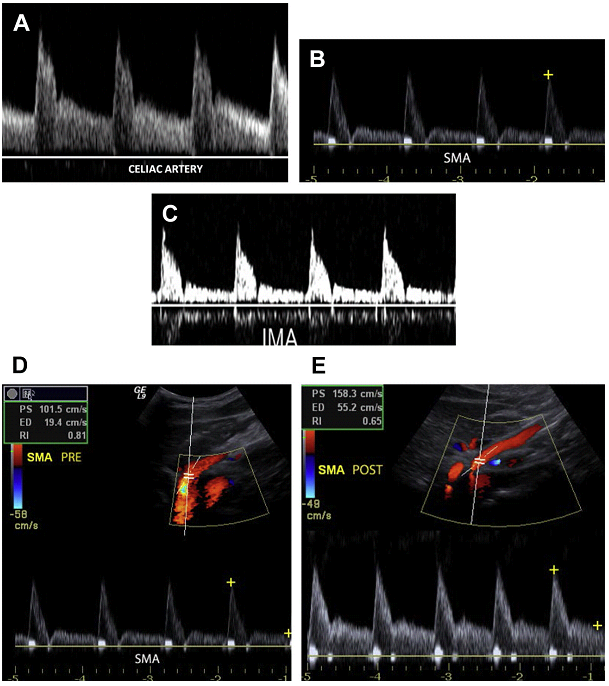
Брюшная аорта является эластичной структурой, обеспечивающая движение крови на периферию в течение сердечного цикла, расширяясь в систолу и сокращаясь в диаметре в диастолу. Эта физиология отражается в изменениях пульсации, которые наблюдаются на диаграмме волны в течение сердечного цикла. Формы волны, полученные в проксимальной брюшной аорте отличаются от полученных в дистальной аорте. Хотя оба сегмента показывают трехфазные формы волны, форма волны проксимальной брюшной аорты имеет большую длительность во время диастолы (Рис. 2 А).
Рис. 2. Аортальная волновая диаграмма. (A) Импульсный допплер проксимального отдела аорты показывает сигнал с низким сопротивлением и наличием потока в диастолу. (Б) Сигнал дистальной аорты имеет периферическую трехфазную форму.
Это явление обусловлено наличием нескольких крупных ветвей брюшной аорты, кровоснабжающих печень, селезенку и почки. Эти органы имеют кровоток с низким сопротивлением и требуют непрерывного тока крови в течение всей систолы и диастолы для их функционирования. Ниже почечных артерий, форма сигнала брюшной аорты имитирует периферические артерии, характеризующиеся трехфазным сигналом с минимальным диастолическим потоком и более заметным изменением направления потока в начале диастолы (см. Рис. 2B). Средняя систолическая пиковая скорость (СПС) в брюшной аорте составляет 110 см/с в популяции со средним возрастом 12 лет. С увеличением возраста, СПС уменьшается, варьируя от 70 до 100 см/с.
Гемодинамика мезентериальных судов
ВБА и НБА кровоснабжают слои тонкой кишки и толстой кишки с переменным сопротивлением и, таким образом волновая диаграмма имеет разную форму: с высоким сопротивлением в препрандиальном состоянии и низким сопротивлением потока в постпрандиальном состоянии (см. Рис. 3B-Е). Эта состояние связано с расширением ветвей мезентериальных сосудов в ответ на повышенные требования в кислороде кишечником после употребления пищи. Как результат, пик систолической и конечной диастолической скорости увеличивается после употребления еды, богатой липидами. Средняя СПС в брыжеечных артериях следующая: в чревном стволе диапазоны СПС от 98 до 105 см / с; в ВБА – от 97 до 142 см / с и в НБА – от 93 до 189 см / с.
Техника
Ультразвуковое исследование брюшной аорты и висцеральных сосудов преимущественно осуществляется после 8-12 часового голодания, чтобы уменьшить кишечный газ. Перед исследованием не дают лекарств.
Используется современное ультрасонографическое оборудование с высококачественным цветным, энергетическим и чувствительным импульсным допплером. Учитывая то, что аорта и брыжеечные артерии расположены глубоко в брюшной полости, у взрослых используется допплеровский аппарат с конвексным низкочастотным датчиком от 2 МГц до 5 МГц.
Рис. 3. Волновая диаграмма мезентериальных артерий. (A) Импульсный допплер чревной артерии показывает низкорезистивный сигнал с высокой диастолической скоростью. (B, C) Препрандиальный импульсный допплер от ВБА и НБА отражает сигнал высокого сопротивления с минимальным потоком в диастолу. (D, E) Препрандиальный и постпрандиальный импульсный допплер от ВБА отражает увеличение диастолической скорости в ВБА после еды.
ПРОТОКОЛ
Брюшная аорта
Стандартный протокол сканирования брюшной аорты первоначально включает оценку с использованием серой шкалы и цветного допплеровского режима для выявления любых патологических состояний, таких как атеросклероз сосудов, сужение просвета, расслоение или аневризма. Продольные и поперечные изображения брюшной аорты последовательно получают от уровня диафрагмы до уровня ее бифуркации, с визуализацией общих подвздошных артерий. Измерения диаметра сосуда должны быть выполнены на нескольких уровнях: проксимальном, среднеабдоминальном, дистальном и проксимальных сегментах обеих общих подвздошных артерий. На продольных и поперечных сканах аорты и общей подвздошной артерии измеряется наружный диаметр к наружному диаметру в передне-задней и поперечной плоскостях. Измерительные метки должны быть размещены вдоль внешней границы стенки аорты. Поперечный размер аорты также может быть оценен во фронтальной плоскости. Обе общие подвздошные артерии особенно хорошо визуализируется во фронтальной плоскости у пациентов в положении на левом боку. Затем выполняется последовательное цветное допплеровское сканирования средней части аорты и спектрометрия.
Мезентериальные (брыжеечные) артерии
Стандартный протокол сканирования сосудов внутренних органов начинается с оценки брюшной аорты в серой шкале и цветным допплером, после чего выполняется импульсное допплеровское исследование аорты на уровне брыжеечных артерий. Эти измерения служат базовыми показателями скорости для сравнения с СПС брыжеечной артерии. СПС впоследствии измеряется у начала, проксимального и среднего сегментов чревного ствола, ВБА, и НБА. Дистальные сегменты брыжеечных артерий не видны при ультрасонографии, хотя это не считается значительным ограничением, потому что большинство атеросклеротических поражений происходит вблизи истоков этих судов.
АТЕРОСКЛЕРОЗ И ОККЛЮЗИОННЫЕ ПОРАЖЕНИЯ АРТЕРИЙ
Структура стенки аорты
Чтобы понять патофизиологию развивающейся атеросклеротической бляшки в брюшной аорте, клиницисты должны иметь четкое понимание структуры стенки аорты. Внутренний слой называется интимой и состоит из эндотелиальных клеток с минимальным количеством субэндотелиальной соединительной ткани. Его функция заключается в предотвращении агрегации тромбоцитов и тромбоза, регулирование тонуса гладкой мускулатуры глубоких слоев, модуляция роста гладкомышечных клеток и их миграции, и контроль внедрения липопротеинов в стенку сосуда. Внешний слой стенки аорты называется адвентицией и отвечает за общую прочность на разрыв. Ваза-вазорум и мелкие нервы проходят через этот слой. Между интимой и адвентицией находится средняя оболочка, которая состоит из отдельных пучков гладкомышечных клеток, эластичных волокон и коллагена. Мышечный компонент поддерживает тонус стенки сосуда. Внутренняя и внешняя эластическая мембрана отделяют интиму от средней оболочки и, соответсвеноо, среднюю оболочку от адвентициального слоя, соответственно.
Формирование атеросклеротической бляшки
Атеросклероз является наиболее распространенным типом артериальных окклюзионных заболеваний, характеризующихся развитием бляшки вдоль стенки артерии с последующем сужением просвета сосуда. Это заболевание является хроническим и прогрессирующим, что может привести к почти полной или полной окклюзии сосуда. Образование бляшек в первую очередь является результатом повреждения эндотелиальных клеток интимы с отложение липидов в стенке и развитием клеточной гипоксии (9).
Наиболее ранним проявлением атеросклероза является медленное, прогрессирующее утолщение интимы, вызванное повышенной ее проницаемостью с последующей миграцией лейкоцитов, воспалительным клеточным ответом и постепенным отложением пенистых клеток в интиме. Этот процесс приводит к миграции клеток гладких мышц и развитие жировых прослоек, которые являются зонами первоначального накопления липидов. Жировые прослойки постепенно развиваются в фиброзные бляшки, которые являются очаговыми поражениями на поверхности просвета артерии, покрытой неповрежденным эндотелием. Бляшки становятся уязвимыми, когда фиброзная покрышка разрывается и на ее поверхности образуется тромб. Этот тромб – нестабильный и может привести к эмболии.
В отличие от этого, стабильная бляшка – гиалинизированная, содержит больше фиброзной ткани, кальцинированна, с высоким содержанием липидов. Она поражает более мелкие сосуды, вызывает меньшее воспаление и имеет гладкую поверхность. Частота эмболии при стабильной бляшке очень низкая.
Сонографическая оценка атеросклеротической бляшки и ассоциированного стеноза просвета сосуда
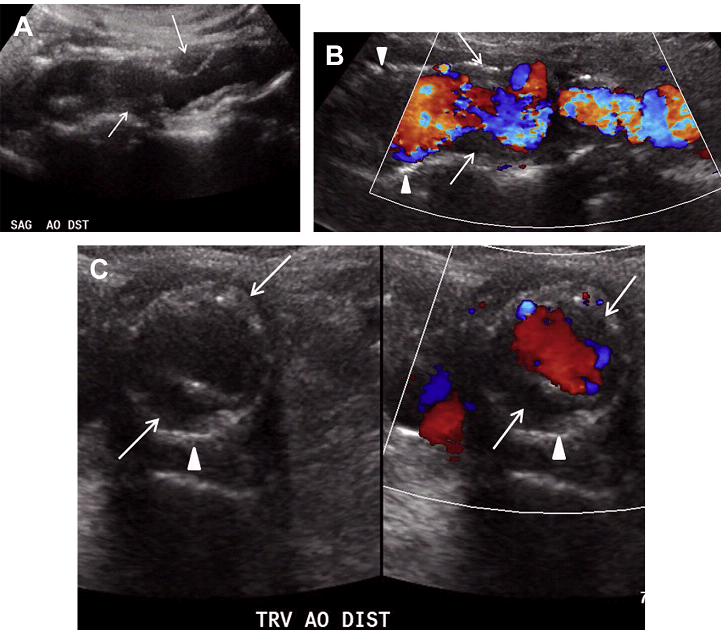
Сонография играет важную роль в выявлении атеросклеротических бляшек и оценке степени стеноза, связанного с их развитием. На изображении в серой шкале, геморрагическая бляшка обычно гипоэхогенная, может быть с неровной поверхностью, которая выступает в качестве очага для агрегации тромбоцитов. В отличие от этого, стабильная бляшка, как правило, – более гиперэхогенная на изображении в серой шкале из-за большого отложения кальция и различий структурного содержимого бляшки. Некоторые бляшки более неоднородны по эхогенности: за счет эхогенных и гипоэхогенных компонентов мягких тканей, которые отражают изменчивость их состава (Рис. 4А, В).
В аорте, основная часть атеросклеротических бляшек возникает у истоков ее основных судов и в месте бифуркации. Наиболее распространенным местом развития атеросклеротической бляшки является грудная аорта, а второе по частоте место – аортоподвздошный сегмент. Большинство атеросклеротических бляшек асимметричны в поперечном сечении. Эти данные лучше всего оценивать при тщательном обследования бляшки в разных плоскостях, чтобы точно определить степень стеноза (Рис. 4C).
При ультрасонографии, обнаружение стеноза усиливается цветным допплеровским изображением при наложении его на место очевидного стеноза сегмента (Рис. 5).
Для того чтобы увеличить чувствительность диагностики аортального стеноза, клиницисты должны настроить параметры цветного допплера к ламинарному току в непораженном сегменте аорты, а затем искать любые очаговые нарушения кровотока вдоль брюшной аорты. После того, как обнаружено нарушение кровотока, проводится изучение объемного кровотока в центре гемодинамически аномального сосуда. Спектральный допплеровский анализ покажет не только заметное возрастание СПС в зоне стеноза, но также может показать наличие медленной и малой формы пульсовой волны дистальнее стенозированного сегмента, как в основном сосуде, так и его ветвях (Рис. 6 и 7).
Рис. 4. Атеросклероз и бляшки. Сагиттальный скан в серой шкале (А) и цветной допплер (B) дистального отдела брюшной аорты свидетельствуют о значительных мягких (стрелки) и кальцинированных (наконечники стрел) бляшек, ассоциированных с легким до умеренной неравномерным сужением просвета. (C) Поперечный скан в серой шкале (D) и цветной допплер подтверждают степень сужения просвета в зоне мягких (стрелки) и кальцинированных (наконечники стрел) бляшек.
Окклюзия аорты
Развитие стеноза высокой степени является медленным и прогрессирующим процессом, который, как правило, сопровождается развитием каналов коллатерального кровотока. Пациенты обычно обращаются при ухудшении симптома нижних конечностей, такого как хромота, вторичного по отношению к развитию прогрессирующего окклюзионного сужения аорты. Когда сужение аорты является существенным, симптомы могут появляться в состоянии покоя, что также может привести к болям в ягодицах и бедрах. У мужчин также может развиваться импотенция. Окклюзия дистальной аорты, сопровождающаяся этими симптомами, называется синдромом Лериша.
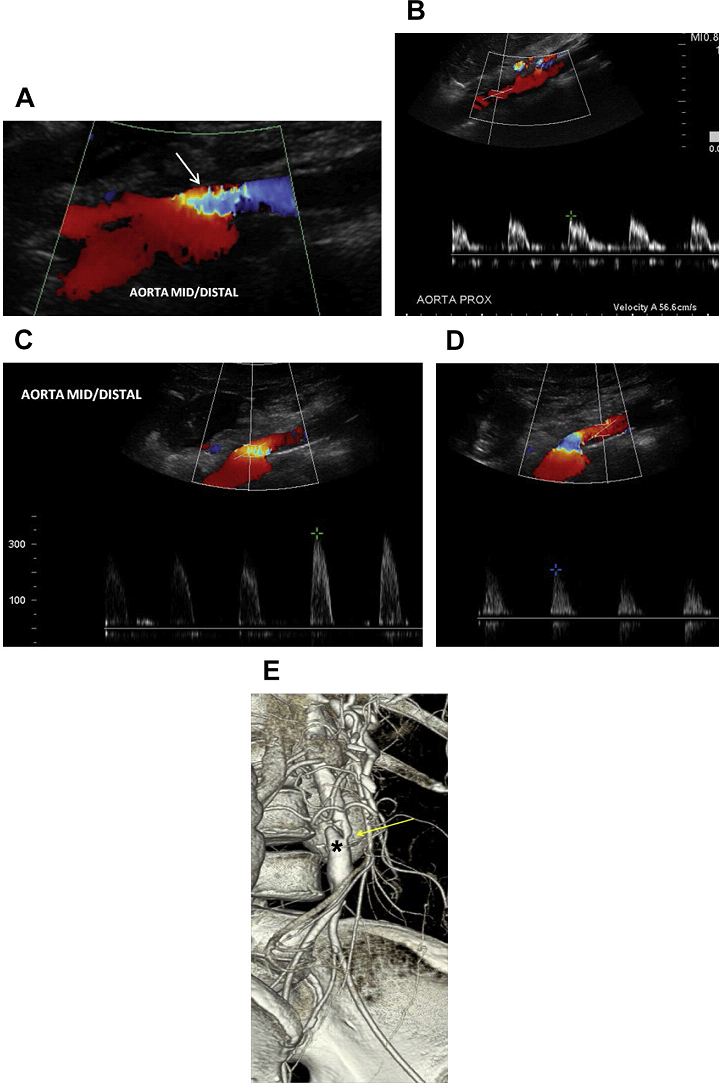
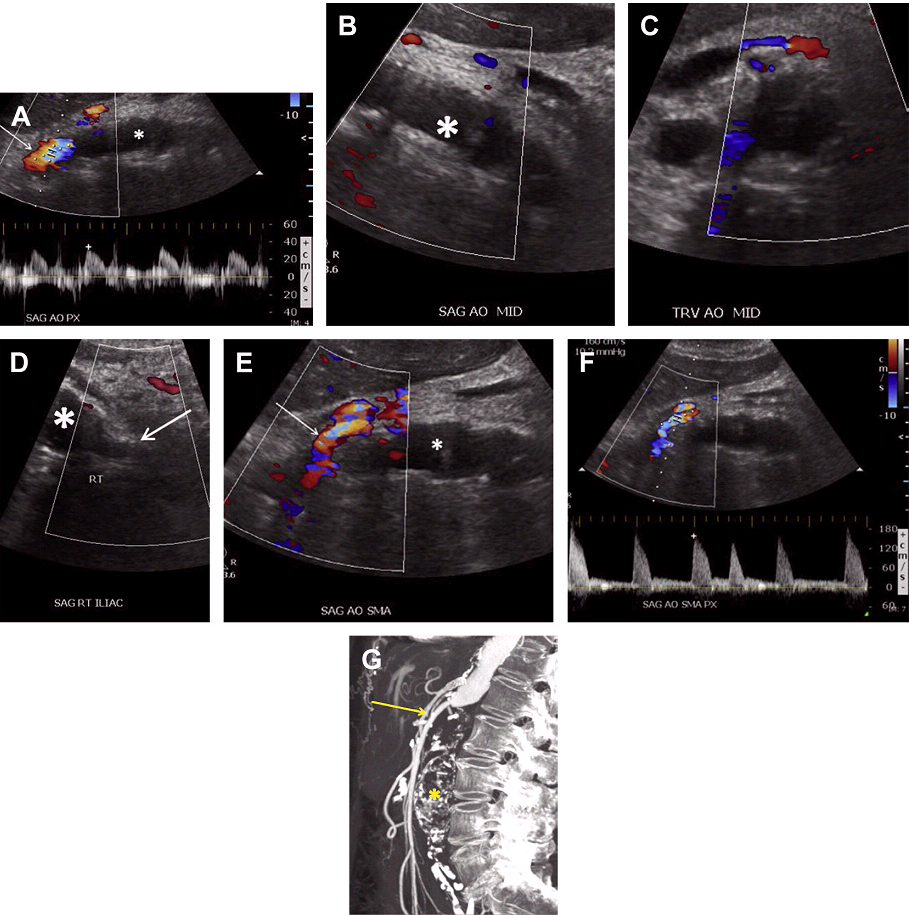
Полная окклюзия аорты чаще всего происходит в нижней части брюшной аорты (Рис. 8 A-D). В большинстве случаев тромб распространяется вверх до уровня почечных артерий без окклюзии почечных артерий. ВБА и ее ветви служат в качестве коллатерального источника для восстановления кровотока в общих подвздошных артериях через анастомозы с толстокишечными ветвями НБА (см. Рис. 8 E-G).
Рис. 5. Аортальный стеноз, вызванный, скорее всего, атеросклеротической бляшкой. (A) Цветной допплер среднего/дистального отдела аорты показывает локальное наложения цветных спектров (стрелка) – стеноз аорты на этом уровне. (B) Спектральный допплер проксимальной брюшной аорты показывает низкоскоростные (57 см / с), высокорезистивные волны. (C) Высокоскоростной поток (> 300 см / с) в средней части аорты соответствует наличию стеноза. (D) Наличие медленной и малой формы пульсовой волны идентифицированы дистальнее области стеноза. (Е) Соответствующая объемная КТ брюшной аорты показывает выраженный стеноз среднего/дистального отдела аорты (желтая стрелка) с постстенотической дилатацией (звездочка).
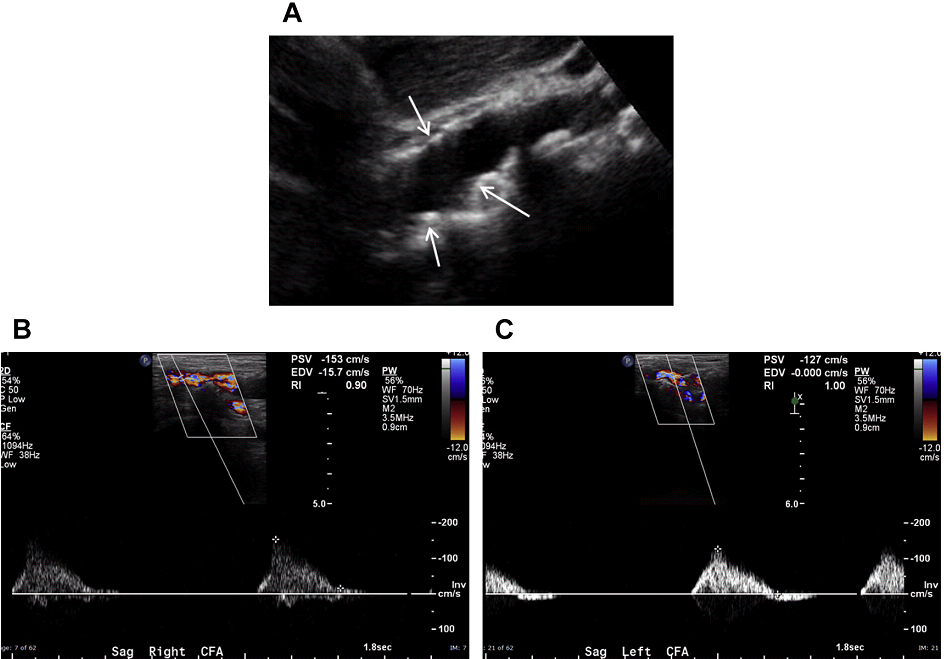
Рис. 6. Аортальный стеноз. (А) Сагиттальный скан в серой шкале средней части брюшной аорты показывает значительное количество атеросклеротических бляшек (стрелки); тем не менее, на этом изображении степень стеноза трудно оценить. (B, C) Спектральный допплер обеих общих бедренных артерий показывает наличие медленной и малой формы пульсовой волны, подразумевающих наличие значительного поражения кровотока, вероятно, вызваного аортальным стенозом.
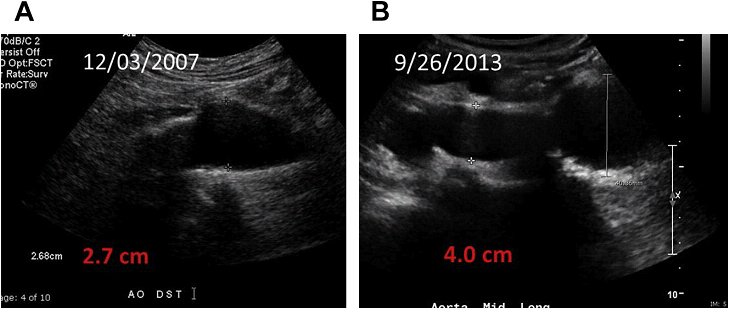
Нормальные размеры брюшной аорты
Размеры брюшной аорты зависят от пола и возраста, у мужчин этот сосуд более крупный, чем у женщин и детей. Диаметр аорты увеличивается с возрастом. Средний размер брюшной аорты у мужчин составляет приблизительно 27 мм в переднезаднем размере на уровне диафрагмы перерыва, и постепенно сужается до 21 мм на уровне подвздошной бифуркации. У женщин диаметр аорты меньше на 3-5 мм.
Рис. 7. Коарктация аорты. (A) Предпроцедурный сагиттальный скан в серой шкале брюшной аорты показывает нормальный диаметр брюшной аорты. (B-D) Предпроцедурный спектральный допплеровский анализ показывает наличие медленной и малой формы пульсовой волны по всей брюшной аорте и обеим почечным артериям. (E) После стентирования магниторезонансная (МР) ангиография грудной клетки показывает постоянное очаговое сужение просвета нисходящей грудной аорты (стрелки), соответствующее остаточной коарктации.
Рис. 8. Окклюзия аорты. Спектральный (А), цветной и энергетический допплер, сагиттальное (В, D, Е), и поперечное (C) изображения аорты показывает кровоток только в проксимальном отделе брюшной аорты (стрелки А). Кровотока не видно ниже уровня ВБА, в соответствии с окклюзией аорты (звездочка А, В, D, Е) и правой подвздошной (звездочка D) артерии. ВБА служит коллатеральным источником для восстановления артериальных систем нижней конечности (стрелка в Е). (F) Высокорезистивные волны у пациента с СПС в ВБА до 180 см / с. (G) Сагиттальный КТ скан аорты показывает значительно кальцинированные бляшки по всей длине обтурированной брюшной аорты (звездочка). ВБА – расширена и продолжается до уровня таза (стрелка).
Развитие АБА
АБА обычно встречается при атеросклеротической болезни. Наиболее распространенными факторами риска являются: пожилой возраст, курение и гипертония. Другие факторы риска включают: семейный анамнез, заболевания соединительной ткани, гиперхолестеринемия, травма и инфекция. АБА связана с высокой смертностью, вызванной разрывом аневризмы. Разрыв АБА – 10-я по значимости причина смерности в Соединенных Штатах. АБА определяется, как увеличение переднезаднего (ПЗ) размера просвета аорты более чем на 30 мм. Большинство аневризм варьируют в диапазоне от 30 до 40 мм в ПЗ диаметре.
Патофизиология АБА и разрыв AБA
Знание патофизиологии аневризм имеет важное значение для понимания механизма развития аневризмы и ее разрыва. Образование АБА – результат дегенеративного процесса, который характеризуется ослаблением стенки брюшной аорты. Сначала происходит активация воспалительного процесса, отвечающего за продукцию и выделение матричных разрушающих ферментов, которые приводят к укорочению полураспада эластина и апоптозу клеток гладких мышц с развитием адгезивного мурального тромба. Деградация эластических волокон и коллагена приводит к ослаблению и, в конечном итоге, к разрыву стенки аорты. АБА более чем 5,5 см, связаны с 10% ежегодным риском разрыва, поэтому эти пациенты обычно нуждаются в хирургическом вмешательстве. Небольшие аневризмы также могут привести к разрыву, хотя ежегодный риск существенно меньше (1% в год).
Разрыв аневризмы вызывается неравномерным напряжением и деформацией аномально ослабленной стенки аневризмы. Высказывалось предположение, что внутристеночный тромб, обычно встречающийся в просвете АБА, связан с более высокой частотой разрыва, вызванного ослаблением брюшной стенки. Есть несколько факторов, которые способствуют прогрессированию аневризмы и последующему разрыву, в том числе напряжение брюшной стенки (соотношение между диаметром аорты и пульсовым давлением), напряжение и деформация стенки аневризмы и ее прочность на разрыв. Неравномерное распределение нагрузки на аорту приводит к очаговым различиям в прочности на разрыв, что ведет к неоднородной взаимосвязи между прочностью стенки и силой воздействия на нее. Если аневризма разрывается в области патологии стенки аорты, то силой воздействия на сосудистую стенку превышает предел ее прочности на разрыв. Эта закономерность определяется законом Лаплас, в котором говорится, что риск разрыва аневризмы напрямую связан с размером аневризмы, так как сила воздействия на стенку аорты является результатом суммации радиуса сосуда и кровяного давления.
Темпы роста аневризм
АБА скрининг и наблюдение
Скрининг аневризм и регулярное последующее наблюдение известной аневризмы имеет важное значение, в связи с хроническим прогрессирующим характером роста аневризмы, высоким риском разрыва и последующей смерти при крупных аневризмах. Ультрасонография наиболее часто используется как метод скрининга и наблюдения за поциентами с АБА, с точностью исследования почти 100%. В настоящее время скрининг предлагается для мужчин старше 65 лет, а также людей с анамнезом курения. Различные исследования показали значительное снижение смертности от АБА в результате скрининга с 21% до 68%. Интервалы между проведением исследований зависят от размера аневризмы, хотя в настоящее время не существует единого мнения об оптимальных интервалах времени между наблюдениями. АБА, как правило, бессимптомна до момента разрыва.
Как упоминалось ранее, риск разрыва для малых АБА низкий, что говорит в пользу ожидательной тактики в таком случае. Исключения из этого правила включают пациентов с сахарным диабетом или заядлых курильщиков, чей риск разрыва выше. Более низкий порог выполнения операции для женщин также рассматривается, учитывая то, что у них более высокие темпы роста аневризмы и риск разрыва.
Типы АБА
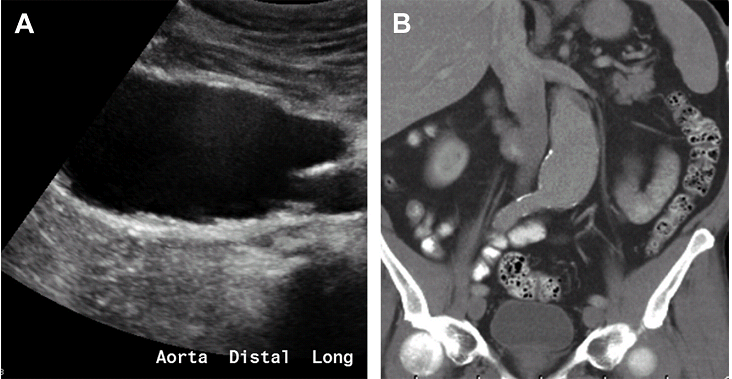
АБА можно разделить по местоположению, морфологии и причине. Что касается расположения, АБА могут быть класифицированны на супраренальные (наименее встречающиеся: травмы, инфекции, ятрогенные причины), юкстаренальные и инфраренальные (наиболее распространенные). Морфологические подкатегории включают: мешотчатые, веретеновидные, или по типу песочных часов (2 смежные, прерывающиеся аневризмы, разделенные нормальным сегментом аорты) аневризмы (Рис. 9).
Рис. 9. Веретенообразная аневризма аорты. Сагиттальный (А) и коронарный (В) КТ скан без контраста дистальной аорты показывает веретенообразное расширение аорты.