Миастения gravis что это за болезнь
Миастения
Миастения – это аутоиммунное заболевание, вызывающее слабость мышц из-за нарушения в работе нервно-мышечной передачи. Чаще всего нарушается работа мышц глаз, лицевых и жевательных мышц, иногда – дыхательной мускулатуры. Это определяет характерные для миастении симптомы: опущение нижнего века, гнусавость голоса, нарушения глотания и жевания. Диагноз миастении устанавливается после прозериновой пробы и анализа крови на наличие антител к рецепторам постсинаптической мембраны. Специфическое лечение миастении заключается в назначении антихолинэстеразных препаратов, таких как амбенония хлорид или пиридостигмин. Эти средства восстанавливают нервно-мышечную передачу.
Общие сведения
Миастенией (или ложным/астеническим бульбарным параличом, или болезнью Эрба-Гольдфлама) называют заболевание, основным проявлением которого является быстрая (болезненно быстрая) утомляемость мышц. Миастения – это абсолютно классическое аутоиммунное заболевание, при котором клетки иммунной системы, по той или иной причине уничтожают другие клетки собственного же организма. Такое явление можно считать обычной реакцией иммунитета, только направлена она не на чужеродные клетки, а на свои.
Патологическая утомляемость мышц была описана клиницистами в середине XVI века. С тех пор заболеваемость миастенией стремительно растет и выявляется у 6-7 человек на каждые 100 тыс. населения. Женщины болеют миастенией в три раза чаще мужчин. Самое большое количество случаев развития заболевания наблюдается у людей в возрасте от 20 до 40 лет, хотя болезнь может развиться в любом возрасте или быть врожденной.
Причины миастении
Как уже упоминалось, миастения – это заболевание аутоиммунной природы. Механизм развития болезни основан на выработке организмом антител к белкам-рецепторам, которые находятся на постсинаптической мембране синапсов, осуществляющих нервно-мышечную передачу.
Схематически это можно описать так: отросток нейрона имеет проницаемую мембрану, через которую могут проникать специфические вещества – медиаторы. Они нужны для передачи импульса от нервной клетки к мышечной, на которой есть рецепторы. Последние на мышечных клетках теряют способность связывать медиатор ацетилхолин, нервно-мышечная передача значительно затрудняется. Именно это и происходит при миастении: антитела разрушают рецепторы на «второй стороне» контакта между нервом и мышцей.
Симптомы миастении
При глазной форме миастении болезнь затрагивает только глазодвигательные мышцы, круговую мышцу глаза, мышцу, поднимающую верхнее веко. Как следствие, основными проявлениями будут: двоение в глазах, косоглазие, сложность в фокусировке взгляда; невозможность долго смотреть на объекты, расположенные очень далеко или очень близко. Кроме этого, почти всегда присутствует характерный симптом – птоз или опущение верхнего века. Особенность этого симптома при миастении заключается в том, что он появляется или усиливается к вечеру. Утром же его может не быть вовсе.
Патологическая утомляемость лицевой, жевательной мускулатуры и мышц, ответственных за речь, приводит к изменению голоса, трудностям с приемом пищи и речью. Голос у больных миастенией становится глухим, «носовым» (такая речь звучит примерно так же, как если бы человек просто говорил, зажав нос). При этом говорить очень тяжело: короткий разговор может настолько утомить больного, что ему необходимо будет несколько часов на восстановление. То же самое касается и слабости жевательных мышц. Жевание твердой пищи может оказаться для человека с миастенией физически непосильной задачей. Больные всегда стараются четко планировать время еды, чтобы принимать пищу в момент максимального действия принимаемых лекарств. Даже в периоды относительного улучшения самочувствия, больные предпочитают есть в первой половине дня, поскольку к вечеру симптомы усиливаются.
Поражение мышц глотки – более опасное состояние. Здесь проблема, напротив, состоит в невозможности принимать жидкую пищу. При попытке выпить что-то больные часто поперхиваются, а это чревато попаданием жидкости в дыхательные пути с развитием аспирационной пневмонии.
Все описанные симптомы заметно усиливаются после нагрузки на ту или иную группу мышц. Например, длительный разговор может стать причиной еще большей слабости, а жевание твердой пищи часто приводит к дополнительному ухудшению работы жевательных мышц.
И, наконец, несколько слов о самой опасной форме миастении – о генерализованной. Именно она обеспечивает стабильный 1% смертности среди больных данной патологией (за последние 50 лет показатель смертности снизился с 35% до 1%). Генерализованная форма может проявляться слабостью дыхательных мышц. Расстройство дыхания, которое возникает по этой причине, приводит к возникновению острой гипоксии и смерти, если больному вовремя не была оказана помощь.
Миастения со временем неуклонно прогрессирует. Темп ухудшения может существенно различаться у разных больных, возможно даже временное прекращение прогрессирования болезни (впрочем, это встречается достаточно редко). Ремиссии возможны: как правило, они возникают спонтанно и заканчиваются так же – «сами по себе». Обострения миастении могут носить эпизодический или длительный характер. Первый вариант называется миастеническим кризом, а второй – миастеническим состоянием. При кризе симптомы проходят достаточно быстро и полностью, то есть во время ремиссии никаких остаточных явлений не наблюдается. Миастеническое состояние – это длительно существующее обострение с наличием всех симптомов, которые, тем не менее, не прогрессируют. Продолжаться такое состояние может в течение нескольких лет.
Диагностика миастении
Наиболее показательное при миастении исследование, которое может дать неврологу массу информации о заболевании – это прозериновая проба. Прозерин блокирует работу фермента, расщепляющего ацетилхолин (медиатор) в пространстве синапса. Таким образом, количество медиатора увеличивается. Прозерин обладает очень мощным, но кратковременным эффектом, поэтому для лечения этот препарат почти не используется, а вот в процессе диагностики миастении прозерин необходим. При помощи последнего проводится несколько исследований. Сначала больного осматривают, чтобы оценить состояние мышц до пробы. После этого подкожно вводится прозерин. Следующий этап исследования производится через 30-40 минут после приема препарата. Врач повторно осматривает больного, выясняя тем самым реакцию организма.
Кроме того, подобная же схема применяется для электромиографии – регистрации электрической активности мышц. ЭМГ проводится дважды: до введения прозерина и через час после него. Исследование позволяет определить, действительно ли проблема заключается в нарушении нервно-мышечной передачи или нарушена функция изолированно мышцы или нерва. Если даже после ЭМГ остаются сомнения в природе заболевания, может понадобиться проведение ряда исследований проводящей способности нервов (электронейрографии).
Важно исследование анализа крови на наличие в ней специфических антител. Их обнаружение – достаточный повод для постановки диагноза миастении. При необходимости делают биохимический анализ крови (по индивидуальным показаниям).
Ценную информацию может дать компьютерная томография органов средостения. В силу того, что большой процент случаев миастении можно связать с объемными процессами в вилочковой железе, КТ средостения таким больным проводят достаточно часто.
В процессе диагностирования миастении необходимо исключить все прочие варианты – заболевания, которые имеют сходную симптоматику. В первую очередь это, конечно, уже описанный выше бульбарный синдром. Помимо этого, проводится дифференциальная диагностика с любыми воспалительными заболеваниями (энцефалит, менингит) и опухолевыми образованиями в области ствола мозга (глиома, гемангиобластома и др.), другой нейро-мышечной патологией (БАС, синдром Гийена, миопатии). В ряде случаев похожие на миастению симптомы может давать нарушение мозгового кровообращения (ишемический инсульт) в бассейне позвоночной артерии.
Лечение миастении
Цель лечения при миастении – увеличить количество ацетилхолина в нервно-мышечных синапсах. Это делается не путем увеличения синтеза этого вещества (это достаточно сложно), а путем угнетения его разрушения. Для этого в практической неврологии используются препараты из той же группы, в которую входит неостигмин. Для длительного лечения выбираются препараты другого типа: оптимальным вариантом здесь считается средство с мягким и длительным действием. Наиболее часто сейчас используются производные пиридостигмина и амбенония.
В случае тяжелого течения и стремительного прогрессирования болезни назначаются препараты, угнетающие иммунный ответ. Как правило, используют глюкокортикоиды, реже – классические иммунодепрессанты. При подборе стероидов всегда стоит проявлять максимальную осторожность. Больным с миастенией противопоказаны препараты, содержащие фтор, поэтому спектр лекарств для выбора оказывается не очень большим. Всем больным миастенией старше 69 лет проводится удаление вилочковой железы. Также к этому методу прибегают при обнаружении в тимусе объемного процесса и в случае резистентной к лечению миастении.
Прогноз и профилактика
Прогноз при миастении зависит от массы факторов: от формы, времени начала, типа течения, условий, пола, возраста, качества или наличия/отсутствия лечения и т. д. Легче всего протекает глазная форма миастении, тяжелее всего – генерализованная. На данный момент при строгом соблюдении рекомендаций врача почти все больные имеют благоприятный прогноз.
Миастения
Миастения – это патология, которая проявляется чрезмерной утомляемостью мускулатуры. В основе развития заболевания лежат аутоиммунные процессы, то есть выработка организмом антител против собственной ткани. Болезнь чаще всего возникает у молодых пациентов и без своевременной помощи врачей нередко приводит к глубокой инвалидизации и даже летальному исходу.
Общая информация
Любая мышца сокращается под влиянием нервного импульса. Он передается от нерва к мышечному волокну через специальное соединение, которое называется синапс. Во время прохождения импульса в нем выделяется большое количество ацетилхолина, который служит медиатором процесса. Повышение его концентрации приводит к возбуждению рецепторов мышцы и провоцируют сокращение волокна.
При миастении организм начинает активно вырабатывать антитела к рецепторам, реагирующим на повышение концентрации ацетилхолина. В результате они постепенно разрушаются, и качество реакции мышцы на возбуждение постоянно ухудшается. Чем интенсивнее работает мускулатура, тем заметнее снижается качество работы синапса. По мере прогрессирования патологического процесса разрушение захватывает все большее количество рецепторов, что может привести к полной потере способности к сокращению, т.е. параличу.
Причины возникновения
В настоящее время врачи и ученые не смогли найти точную причину развития миастении. Среди наиболее распространенных теорий, объясняющих биомеханизм развития заболевания, популярностью пользуется тимогенная. Считается, что антитела вырабатываются в тимусе (вилочковой железе). Она играет важную роль в формировании детского иммунитета, но по мере взросления подвергается обратному развитию вплоть до полной атрофии. У многих больных с миастенией обнаруживается увеличение вилочковой железы или опухоль в ее ткани, что говорит о высокой вероятности связи между этими патологиями.
Существует ряд факторов риска, которые повышают вероятность развития миастении:
Формы и симптомы
Врачи выделяют несколько форм миастении, которые отличаются друг от друга происхождением или особенностями течения. Причина и время появления специфического синдрома, характерного для нарушения нервно-мышечной проводимости, позволяют выделить две разновидности:
Среди практикующих врачей более востребована клиническая классификация миастении, которая позволяет выделить три основных формы.
Глазная миастения
Поражение захватывает мышцы, расположенные в непосредственной близости от глазного яблока. Они отвечают за процесс открытия и закрытия глаз, их повороты в ту или иную сторону, а также настройку на близкое и дальнее расстояние. В результате пациент жалуется на:
Все симптомы становятся особенно яркими к вечеру на фоне утомления мускулатуры, а утром проходят полностью или частично.
Бульбарная миастения
В первую очередь страдают мышцы, ротовой полости, глотки, гортани, а также мимическая мускулатура. В результате у пациента существенно нарушается дикция, речь становится неразборчивой, а голос – гнусавым и хриплым. Во время жевания и глотания быстро нарастает усталость, что делает прием пищи нелегкой задачей.
Если в патологический процесс вовлекается мимическая мускулатура, мимика становится бедной и неестественной. У пациента возникают затруднения при попытке улыбнуться или оскалить зубы.
Генерализованная миастения
Эта форма заболевания встречается наиболее часто и характеризуется последовательным поражением мускулатуры всего тела. Сначала пациент начинает быстро уставать при ходьбе, а затем затрудняются движения, связанные с подъемом рук. Способность к передвижению и самообслуживанию постепенно ухудшается, что в конечном итоге приводит к инвалидизации пациента.
Все виды миастении характеризуются нарастанием симптоматики к вечеру. Это связано с физической активностью пациента в дневные часы и постепенным утомлением мышц. Чем тяжелее заболевание, тем быстрее возникают затруднения движений.
Диагностика
Миастения относится к неврологическим заболеваниям, вот почему при появлении любых подозрительных симптомов необходимо обратиться к неврологу. Нередко специалисту достаточно взглянуть на мимику и походку пациента, чтобы заподозрить патологию. Затем проводится подробный опрос, в ходе которого уточняются:
Затем врач проводит подробный осмотр с оценкой мышечного тонуса и силы, чувствительности отдельных частей тела, выраженности рефлексов. Как правило, этого хватает для постановки предварительного диагноза, который затем подтверждается объективными исследованиями:
Диагностика дополняется стандартными тестами: общий анализ крови, общий анализ мочи, электрокардиография и т.п. При необходимости список исследований расширяется.
Лечение миастении
В настоящее время врачи не имеют возможности полностью остановить процесс разрушения ацетилхолиновых рецепторов и избавить человека от симптомов миастении. Основное лечение направлено на остановку патологического процесса и достижение ремиссии, а также снижение утомляемости мускулатуры.
Основу терапии составляют средства, тормозящие работу иммунной системы: гормоны (преднизолон), цитостатики (циклоспорин), а также иммуноглобулины. Специфические препараты прозерин и калимин тормозят разрушение ацетилхолина, что позволяет увеличить его концентрацию в нервно-мышечном синапсе и, соответственно, улучшить передачу нервного импульса. Для ускорения процесса возбуждения используют препараты калия.
Специфическое лечение миастении дополняется общими средствами, в частности, антиоксидантами, стабилизирующими работу нервной системы. В зависимости от ситуации также назначаются лекарства, устраняющие побочные эффекты основных медикаментов.
При выявлении в ходе диагностики опухоли вилочковой железы проводится ее хирургическое удаление, иногда в сочетании с лучевой терапией. Показаниями к операции выступает неуклонное прогрессирование заболевания и его генерализованная форма у пациентов младше 70 лет. При идеальном результате после удаления тимуса человек практически полностью отказывается от медикаментов, а симптомы контролируются диетой и образом жизни.
При запредельно высокой концентрации антител в крови может назначаться ее искусственная очистка: плазмаферез, криофероз, иммуносорбция. Во время ремиссии проводятся курсы физиопроцедур (электрофорез, электромиостимуляция), массаж, санаторно-курортное лечение.
Осложнения
Главная опасность миастении – это миастенический криз. Как правило, это осложнение провоцируется самим пациентом, например, при самовольной отмене или замене препаратов, изменении их дозировки. Вызвать криз также могут острые инфекции, запредельные физические или психические перегрузки. В результате утомляемость мышц повышается до такой степени, что пациент не может встать с постели, принимать пищу и даже говорить.
При крайне тяжелом течении миастенического криза страдает также дыхательная мускулатура, обеспечивающая движения грудной клетки. Это состояние может стать причиной летального исхода, вот почему пациент экстренно госпитализируется в реанимационное отделение. Врачи проводят мероприятия, направленные на снижение количества антител, при необходимости человека подключают к аппарату искусственного дыхания.
Первые признаки надвигающегося миастенического криза включают:
В случае появления подобных симптомов необходимо как можно быстрее обратиться за медицинской помощью.
Профилактика
Специфической профилактики возникновения заболевания не существуют. Основные профилактические меры рассчитаны, в первую очередь, на людей, у которых уже имеется миастения, и направлены на предотвращение ухудшения. Необходимо следовать следующим правилам:
Диета
Важным аспектом профилактики миастении является соблюдение диеты. Ежедневный рацион должен быть сбалансированным по основным нутриентам (белкам, жирам, углеводам) и обладать достаточным, но не чрезмерным калоражем. Если у человека имеется избыток массы тела, рекомендуется придерживаться дефицита калорий (не более 10-15% от ежедневной нормы). В меню должны присутствовать продукты с высоким содержанием калия (картофель, бананы и т.п.). По назначению врача допускается прием поливитаминных препаратов.
Лечение в клинике «Энергия здоровья»
Миастения – это тяжелое заболевание, но врачи клиники «Энергия здоровья» имеют огромный опыт работы с такими пациентами. Это позволяет нам добиваться значительного улучшения состояния и стойкой ремиссии. Вот основные преимущества лечения в нашем медицинском центре:
Преимущества клиники
«Энергия здоровья» – это современный многопрофильный медицинский центр, оборудованный в соответствии с самыми строгими стандартами. Мы делаем все, чтобы каждый пациент получил максимально полную и эффективную медицинскую помощь вне зависимости от диагноза. К Вашим услугам:
Совсем недавно диагноз миастения звучал как приговор. Человек был по умолчанию обречен на летальный исход от постепенной парализации дыхательной мускулатуры. Современные методы лечения, хотя и не дают возможности полностью избавиться от патологии, но позволяют добиться стойкой ремиссии на долгие годы. Если Вы сами или Ваш близкий человек стали замечать беспричинную слабость мышц, особенно заметную в вечерние часы, не тяните с обращением к неврологу. Врачи клиники «Энергия здоровья» ждут вас!
Миастения Гравис: атака против нейромышечного синапса
Миастения гравис (МГ) — аутоиммунное заболевание, обусловленное образованием аутоантител против рецепторов ацетилхолина (AChR), мышечно-специфической киназы (MuSK) или других связанных с ацетилхолиновыми рецепторами белков постсинаптической мембраны нервно-мышечного синапса.
Основным проявлением заболевания является локальная или генерализованная мышечная слабость.
Эпидемиология
Патофизиология
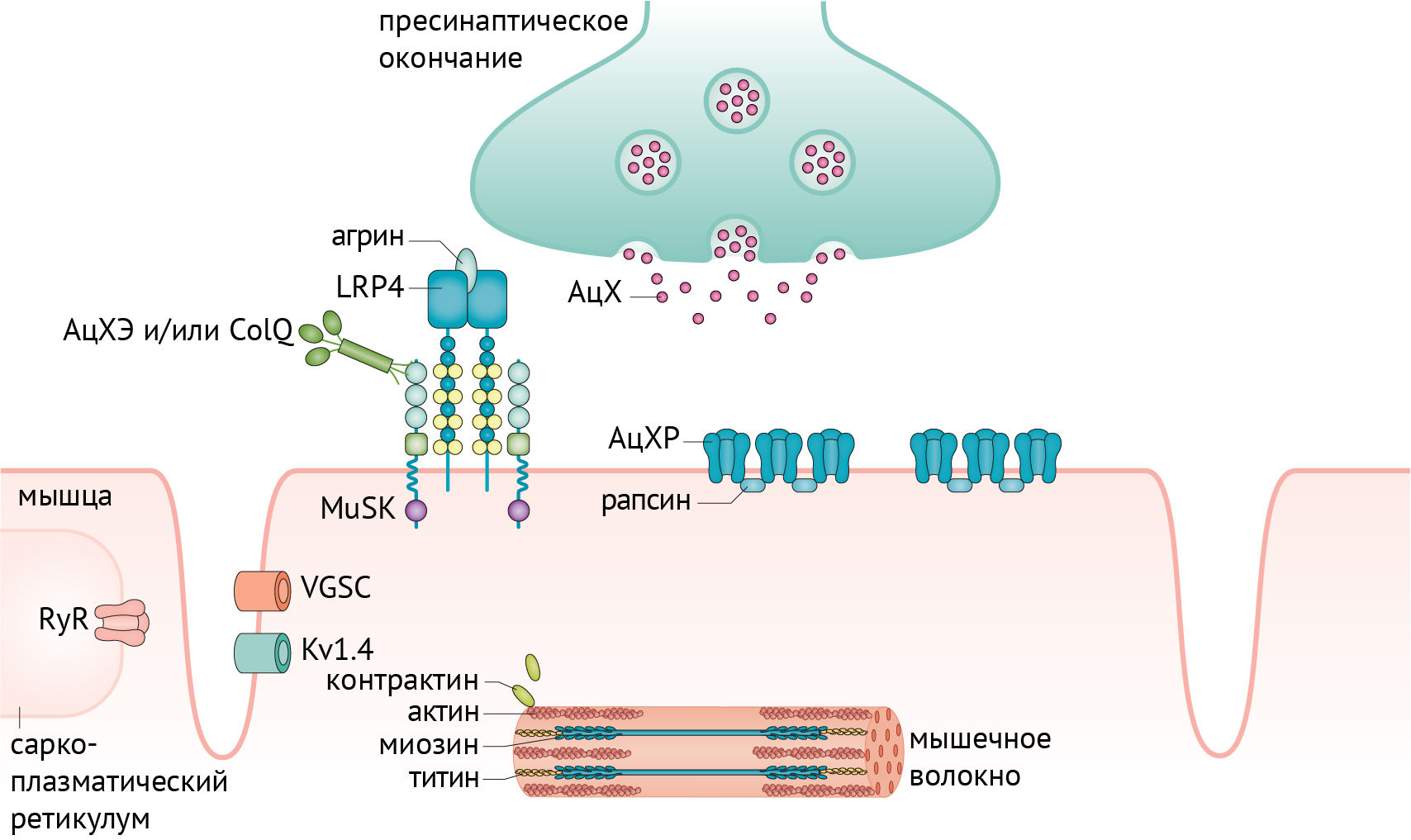
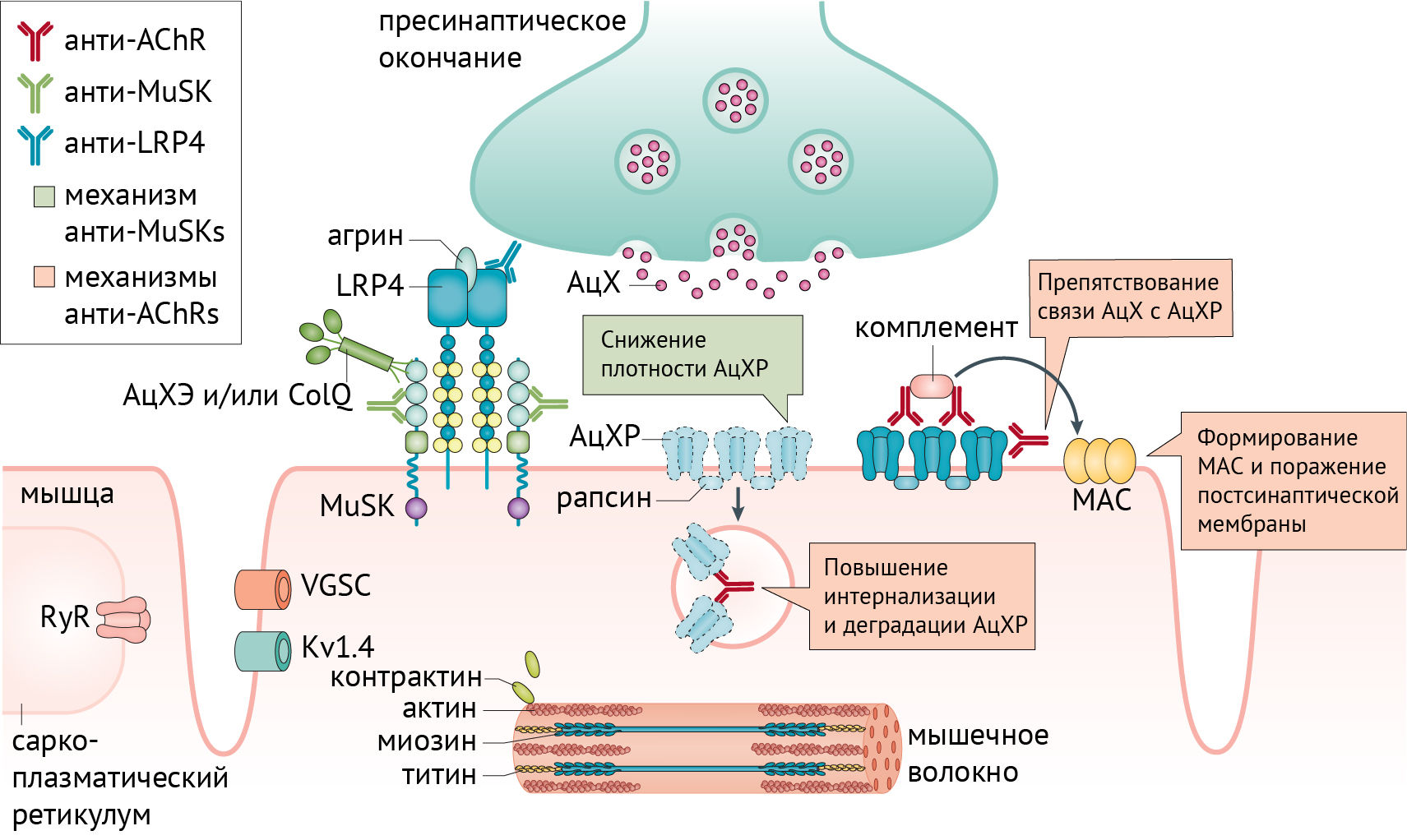
МГ — заболевание, характеризующееся слабостью скелетной мускулатуры. Его причиной является нарушение нормального функционирования нейромышечного синапса вследствие образования аутоантител против структур, отвечающих за холинергическую передачу и сокращение мышечного волокна. Для лучшего понимания патогенеза следует рассмотреть работу нейромышечного синапса в норме (рис. 1) и в патологии (рис. 2) [1].
Аутоантитела, ассоциированные с МГ
MuSK — трансмембранный белок, состоящий из одной субъединицы, функция которого заключается в структурировании АцХР и связывания его с рапсином — белком, служащим мостиком между рецептором и цитоскелетом. MuSK активируется после фосфорилирования, индуцированного LRP4-агриновым комплексом, после чего и происходит кластеризация АцХР.
Анти-MuSK антитела выявляются в 1–10 % случаев. В основном они связываются с иммуноглобулино-подобным доменом тирозинкиназы. Большинство этих антител относится к IgG4 субклассу, что делает невозможным активацию комплемента и антигенную модуляцию, так как анти-MuSK функционально моновалентны, а для антигенной модуляции необходимо связать 2 молекулы с антителом.
Так образом, негативное явление секреции этих антител проявляется перекрыванием сайта связывания MuSK, предотвращая его активацию через LRP4 и коллаген (ColQ). В результате происходит снижение плотности АцХР на постсинаптической поверхности и нарушение их расположения.
LRP4 — трансмембранный белок, состоящий из одной субъединицы с крупным внеклеточным доменом, содержащим множество повторов липопротеидов низкой плотности. Как уже было описано выше, связь LPR4 с агрином обуславливает активацию MuSK.
Анти-LPR4 антитела не являются строго специфичными для МГ. В 10–23 % случаев они также обнаруживаются у пациентов с боковым амиотрофическом склерозом.
Агрин связывается с белками мышечной мембраны, такими как LRP4, дистрогликан и ламинин, структурируя поддерживающий и способствующий регенерации нейромышечный синапс. Аутоантитела к агрину ингибируют фосфорилирование MuSK, вероятно, через подавление образования комплекса LRP4-агрин.
Коллаген Q (коллагеновый хвост ацетилхолинэстеразы, ColQ) концентрирует и удерживает ацетилхолинэстеразу, которая способствует деградации ацетилхолина, во внеклеточном матриксе нейромышечного синапса. Анти-ColQ антитела выявляются среди 3 % пациентов с МГ и у 2,3 % здоровых людей (не больных МГ). Мутации гена, кодирующего ColQ, также приводят к заболеваниям, одним из синдромов которых является миастения. Точный патофизиологический аспект развития МГ при секреции аутоантител к ColQ неизвестен.
Антитела к вольтаж-зависимым калиевым каналам скелетных мышц Kv1.4 выявлялись в японских и европейских группах больных с МГ в 10–20 % случаев. Также среди только японской группы проявлялись нарушения ритма сердца, ввиду наличия Kv1.4 в эндокарде.
Наличие антител к внутриклеточным белкам является отягчающим прогностическим фактором в отношении выраженности МГ и наличия тимомы. К таким внутриклеточным белкам относятся тинтин, кортактин и рианодиновые рецепторы.
Тинтин (Tintin) является обязательным компонентом мышечных сокращений. Анти-тинтиновые антитела выявляются среди 20–30 % пациентов с анти-АХР антителами, при часто сопутствующей тимоме либо при позднем дебюте МГ. Анти-тинтиновые антитела являются высоко чувствительными и специфичными маркерами тимомы.
Кортактин (Cortactin) связывается с актином в скелетных мышцах, способствуя его сборке, а также кластеризации АцХР. Антитела к кортактину в 20 % случаев встречаются среди дважды серонегативных пациентов с МГ и в 5–10 % случаев среди пациентов с антителами к АцХР. Однако эти антитела могут встречаться среди здоровых (5 %), а также больных другими аутоиммунными заболеваниями, включая полимиозит (20 %), что делает этот маркер малоспецифичным для выявления МГ.
Рианодиновые рецепторы (RyR) — это кальциевые каналы саркоплазматического ретикулума. Они открываются при деполяризации, обеспечивая мышечное сокращение путем предоставления кальция из сарколеммы в цитоплазму. Анти-риадиновые антитела выявляются у 70 % больных МГ с тимомой и среди 14 % пациентов с поздним началом МГ. Антитела к RyR можно также использовать как индикатор тимомы и тяжелой МГ.
МГ часто ассоциируется с тимомой. Вероятно, аутоиммунная агрессия связана с нарушением формирования периферической толерантности в результате патологии тимуса. Механизмы работы тимуса изображены на рисунке 3.
Патогенез образования аутоантител
Механизмы, приводящие к избирательной продукции мышечных аутоантител при МГ, неясны. Тимус поражен у большинства пациентов с антителами к АцХР, с тимомой (10 % случаев) либо с фолликулярной гиперплазией тимуса (более чем в 80 % случаев с ранним началом МГ). Тимэктомия у пациентов с гиперплазией часто приводит к значительному клиническому улучшению. Гиперплазия характеризуется наличием большого количества зародышевых центров (участков развития и созревания В-клеток). В норме зародышевые центры находятся в органах, ответственных за продуцирование В-клеток, почти отсутствуют в нормальном тимусе и не наблюдаются в скелетных мышцах. Однако в рамках заболевания, наличие многих зародышевых центров с В-клетками в тимусе, продуцирующих анти-АцХР антитела, наводит на предположение о ключевом аспекте воспалительной патологии тимуса и потери иммунной толерантности. Эпителиальные клетки тимуса, миоидные клетки и профессиональные антигенпрезентирующие клетки вносят свой вклад в процесс иммунизации, что приводит к образованию зародышевых центров.
Тимус является органом созревания Т-клеток и отвечает за развитие центральной толерантности за счет делеции аутореактивных Т-клеток (рис. 3). Аутореактивные Т-клетки обычно контролируются регуляторными Т-клетками (Тreg-клетки, Treg cell) путем формирования периферической толерантности (рис. 3). Такие аутореактивные Т-клетки, направленные против мышечных антигенов, можно обнаружить во всех подгруппах пациентов с МГ, но также они наблюдаются и у здоровых людей. CD8+-лимфоциты представляют собой важные эффекторные клетки, необходимые для инициации МГ. Иммунорегуляторные дефекты, наблюдаемые у пациентов с антителами к АцХР и MuSK, обусловлены нарушением функционирования как Treg-клеток, так и обычных клеток. Дефекты работы Treg-клеток были продемонстрированы практически при всех аутоиммунных заболеваниях, включая МГ с гиперплазией тимуса. Стоит отметить, что для МГ на первый план выходит дисфункция Тreg-клеток, нежели подавление активация кластеров дифференцировки или других маркеров. Однако независимо от того, является ли дисфункция Treg-клеток причиной или следствием заболевания, дефектный противовоспалительный ответ очень важен для инициации и/или прогрессирования МГ. Тимус больных МГ обогащен подмножеством Т-клеток, экспрессирующих высокие уровни Fas (трансмембранные белки, относящиеся к семейству факторов некроза опухоли), участвующих в аутоагрессии к АцХР. На данный момент можно утверждать потерю центральной толерантности вследствие опухоли вилочковой железы. Отсутствие внутри опухоли миоидных клеток, Treg-лимфоцитов и экспрессии AIRE, вероятно, приведет к ненормальному отбору Т-клеток. Клинические проявления МГ наступают спустя долгое время после развития опухоли тимуса, что предполагает вовлечение других факторов регуляции, таких как цитокины, интерфероны и антигены класса II главного комплекса гистосовместимости (ГКГС). Неясна роль тимуса в случаях позднего дебюта миастении, а также секреции других аутоантител.
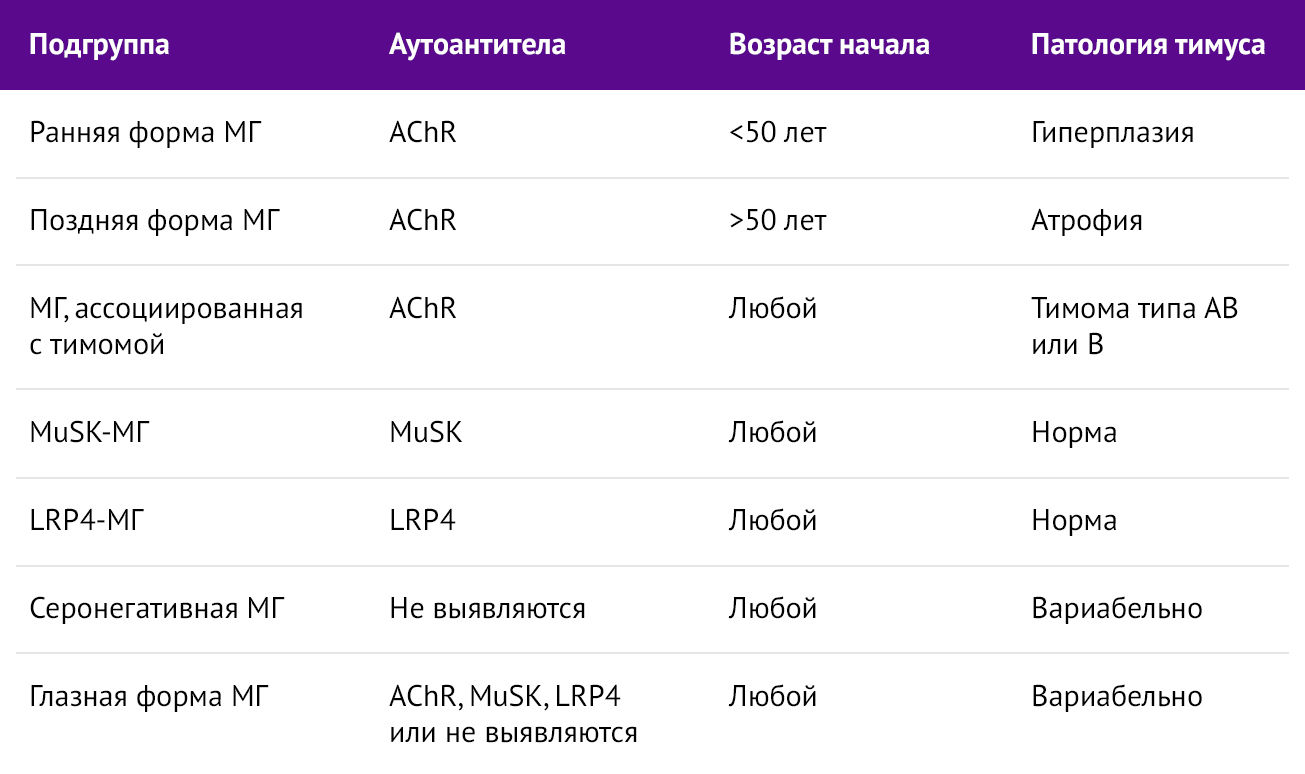
В зависимости от типа секреции аутоантител, возраста начала и наличия/отсутствия патологии тимуса, МГ дифференцируется на подгруппы. Ознакомиться с ними можно, рассмотрев таблицу 1.
Таблица 1 | Подгруппы миастении гравис
Определенные генетические факторы также вносят вклад в развитие заболевания, в частности, ассоциации таких HLA, как HLA-B8, DRw3, DQw2 с МГ и DR14, DQ5 для MuSK-позитивных пациентов. Кроме того, для этих пациентов характерна повышенная вероятность приобретения других аутоиммунных заболеваний, таких как аутоиммунный тиреоидит, ревматоидный артрит, системная красная волчанка, а также, в отличие от общей популяции, наличие в семейном анамнезе упоминаний об аутоиммунных заболеваниях среди родственников [2,3].
Клиника
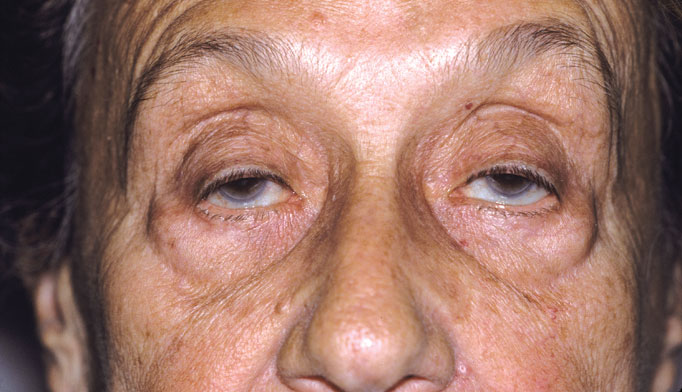
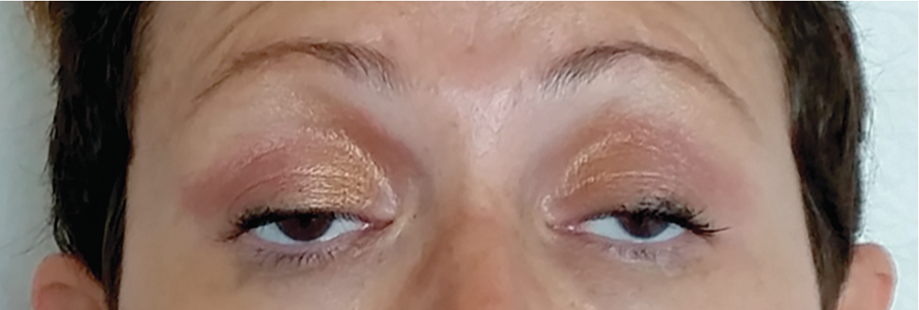
Мышечная слабость усиливается при повторных мышечных сокращениях. Частое вовлечение глазодвигательных мышц обусловливает развитие диплопии и птоза, которые обычно асимметричные (рис. 4).
Рисунок 4 | Типичное проявление глазной формы МГ (либо генерализованной с вовлечением глазодвигательных мышц), проявляющееся в виде двустороннего асимметричного птоза
Лицо, шея, конечности и туловище также могут быть вовлечены при генерализованной форме заболевания; слабость чаще симметричная.
Слабость бульбарных и дыхательных мышц является жизнеугрожающим состоянием и требует интенсивной терапии.
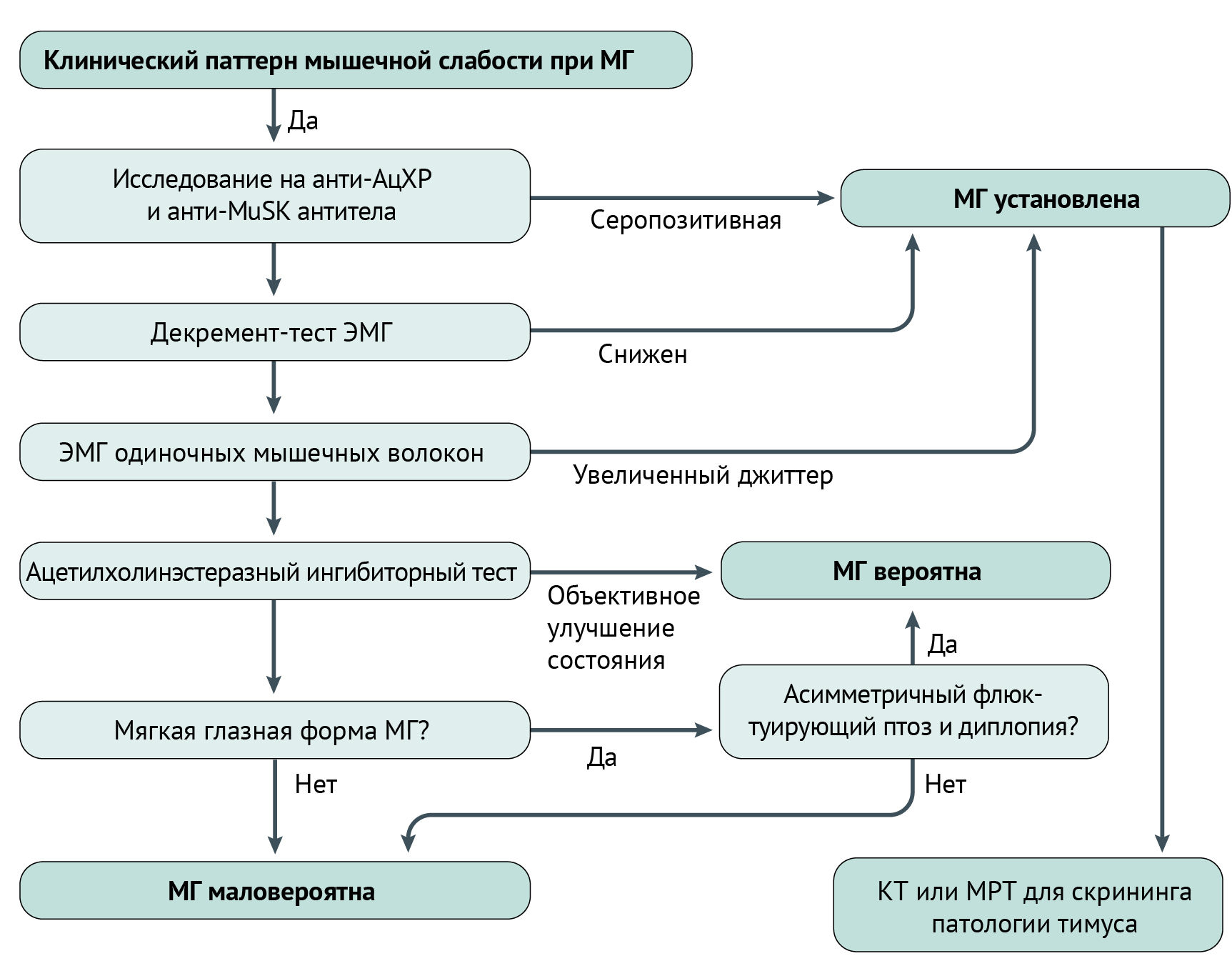
Диагностика
Клиническая:
Иммунологические исследования на выявления аутоантител к AChR, MuSK и LPR4.
Декремент-тест ЭНМГ — декремент амплитуды М-ответа более чем на 10 % от первого к четвертому ответу рассматривается как патология. Тест высоко специфичен, но его чувствительность варьируется от 80 до 50 % при анти-MuSK МГ.
Электромиография одиночных мышечных волокон (ЭМГ ОМВ) более чувствительна, чем декремент-тест, но менее специфична; положительна и для других неврологических заболеваний, в частности, для митохондриопатий и болезней мотонейрона. ЭМГ ОМВ разделяется на два теста: волевой и стимуляционный. Волевой состоит в измерении вариабельности скорости активации (измеряется в «джиттерах») между мышечными волокнами, иннервируемыми одним аксоном во время волевого мышечного сокращения, тогда как стимуляционный измеряет вариабельность стимуляции нерва и скорости мышечного ответа (джиттер).
Дифференциальная диагностика
Врожденный синдром миастении — редкая группа заболеваний, манифестирующих обычно во младенчестве, чаще наследственных. Однако встречаются формы дебюта в подростковом и раннем взрослом периодах, а в некоторых случаях и аутосомно-рецессивное наследование может мимикрировать под проявления МГ.
В отличие от наследственных миастений, при МГ отмечается наличие асимметричного птоза и глазодвигательных нарушений, отсутствие слабости тыльного сгибания стопы и положительный ответ на иммунотерапию.
Кроме того, симптом усиления слабости на фоне приема пиридостигмина примечателен для заболеваний медленных каналов, ColQ- или DOK7-синдромов.
Синдром Ламберта — Итона — паранеопластическое (приблизительно в 60 %) или аутоиммунное заболевание, характеризующееся секрецией антител против пресинаптических потенциал-зависимых кальциевых каналов (выявляются в > 90 % случаев) и проявляющееся мышечной слабостью. Слабость выражена в проксимальных отделах конечностей, сильнее в нижних конечностях; также наблюдается автономная дисфункция и гипо/арефлексия с ахилловых сухожилий. Мышечная слабость уменьшается после повторных мышечных напряжений, при ЭНМГ наблюдается обратный МГ паттерн.
Психиатрические, постинфекционные, аутоиммунные (полимиозит), а также эндокринные заболевания (гипотиреоз/гипертиреоз) могут вызывать мышечную слабость и имитировать МГ.
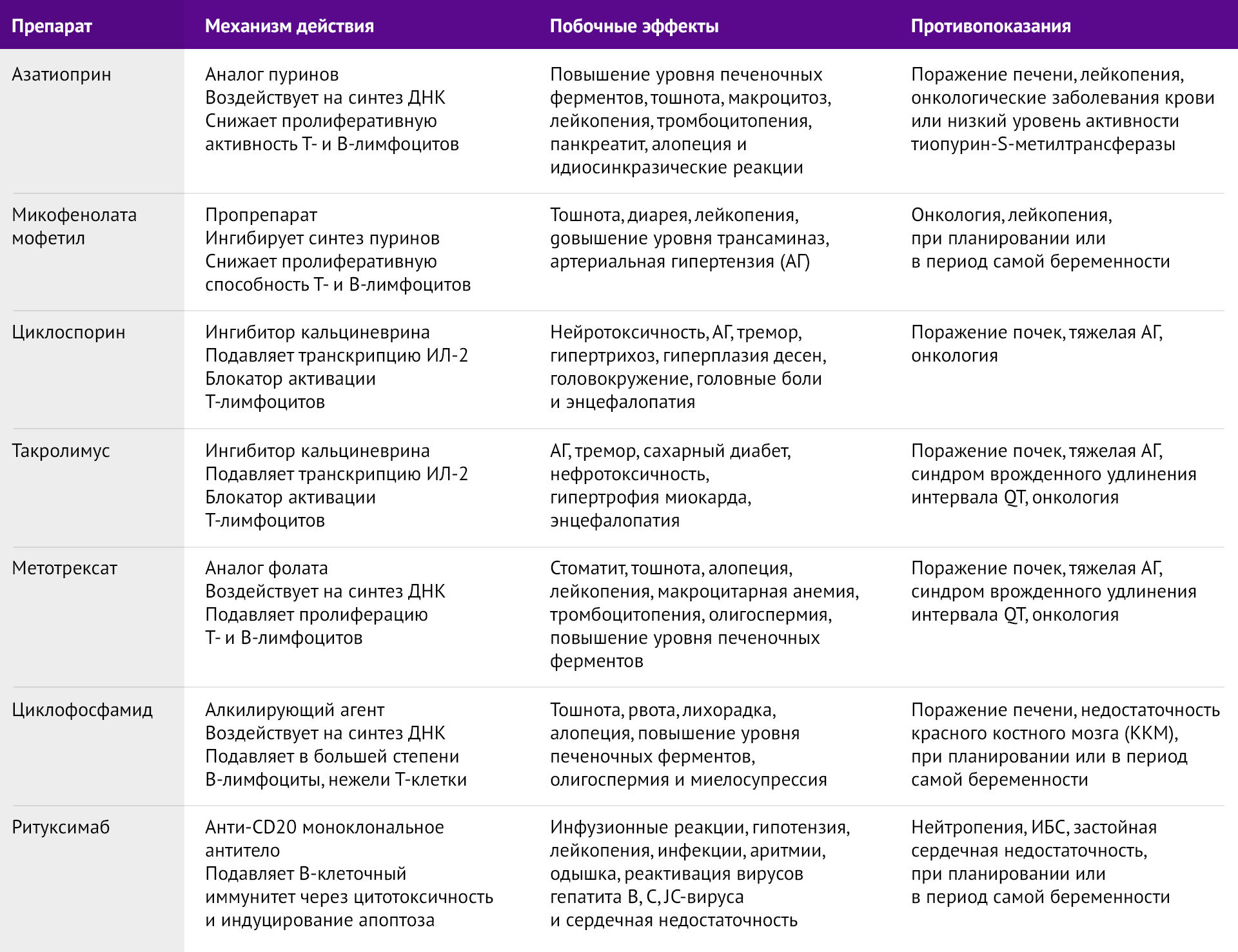
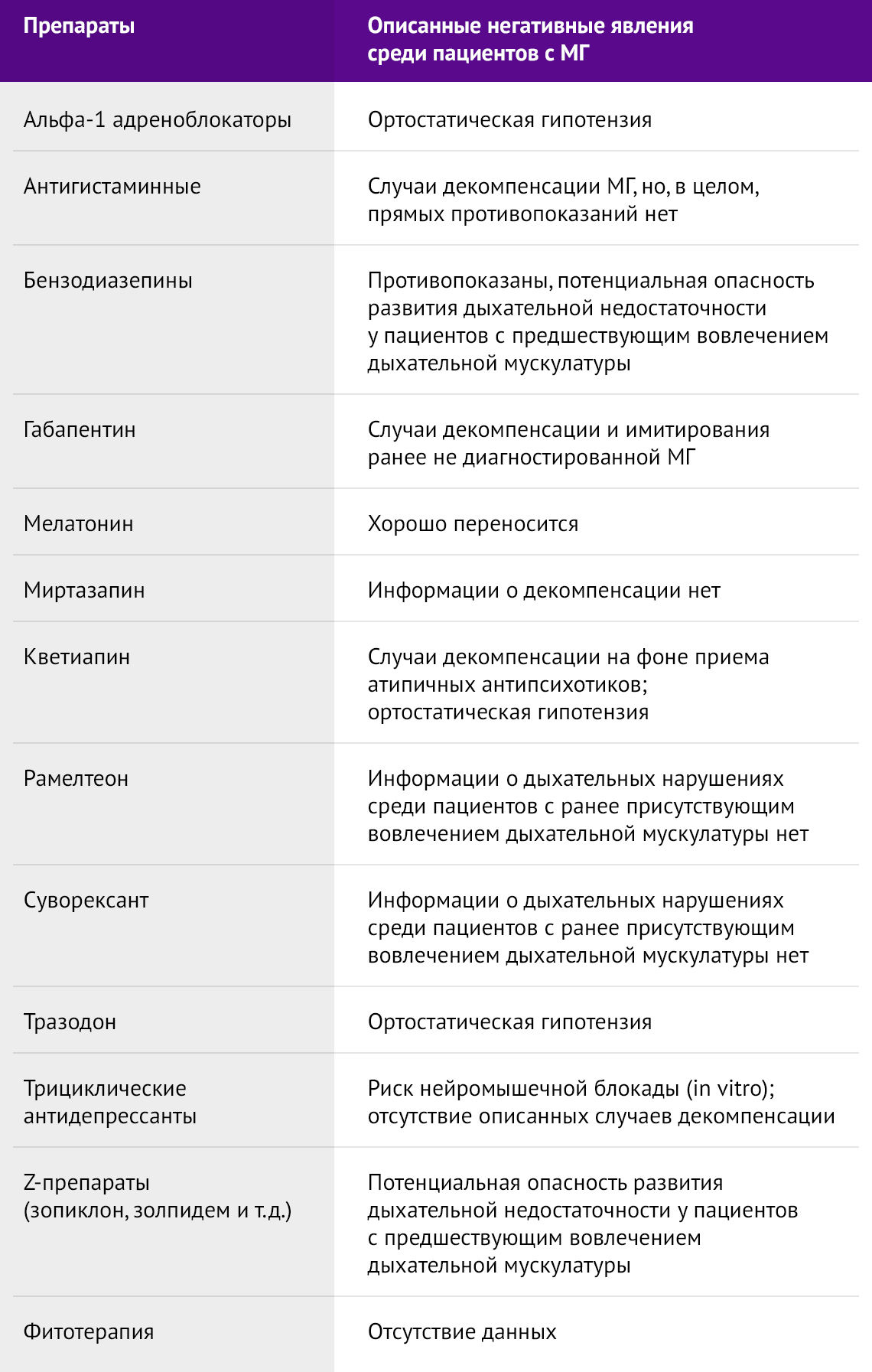
Кроме того, существует довольно-таки большой спектр различных препаратов, способных имитировать или усугубить течение МГ (таб. 2 и 3). Необходимо учитывать эти препараты при сборе анамнеза, дабы выявить возможную причину усугубления течения МГ у пациента либо предотвратить ятрогению.
Таблица 2 | Препараты, которые могут имитировать, либо усугубить МГ
Таблица 3 | Препараты, которые обычно хорошо переносятся, но могут быть ассоциированны с экзацербацией МГ*
* Это неполный список всех препаратов, которые у отдельных пациентов могут отрицательно влиять на нервно-мышечную передачу.
¶ Только при необходимости среди госпитализированных пациентов и с особой осторожностью при слабости дыхательных мышц.
Δ При внутривенном введении.
◊ Противопоказан при миастении.
§ Также используется как противорвотное средство.
¥ Хотя глюкокортикоиды являются средством лечения миастении, в высоких дозах они могут вызвать значительное обострение симптомов данного заболевания на ранних этапах лечения. По этой причине глюкокортикоиды следует назначать в высоких дозах только среди госпитализированных пациентов с возможностью получения плазмафереза или ВВИГ по поводу миастенического криза, а также перевода на ИВЛ.
В перечень препаратов, применение которых следует ограничить при МГ, следует также добавить депрессантов дыхательного центра (напр., барбитураты, бензодиазепины, опиоиды, седатики).
Диагностика МГ основывается на вышеописанных методах клинического, инструментального и лабораторного исследований. Для упрощения можно придерживаться алгоритма, представленного ниже (схема 1).
Схема 1 | Упрощенный алгоритм диагностики МГ
Градация тяжести основывается на сравнении выраженности мышечной слабости аксиальной и/или конечностей либо орофарингеальной и/или дыхательной областей (таблица 4).
Таблица 4 | Классификация Оссермана (MGFA)
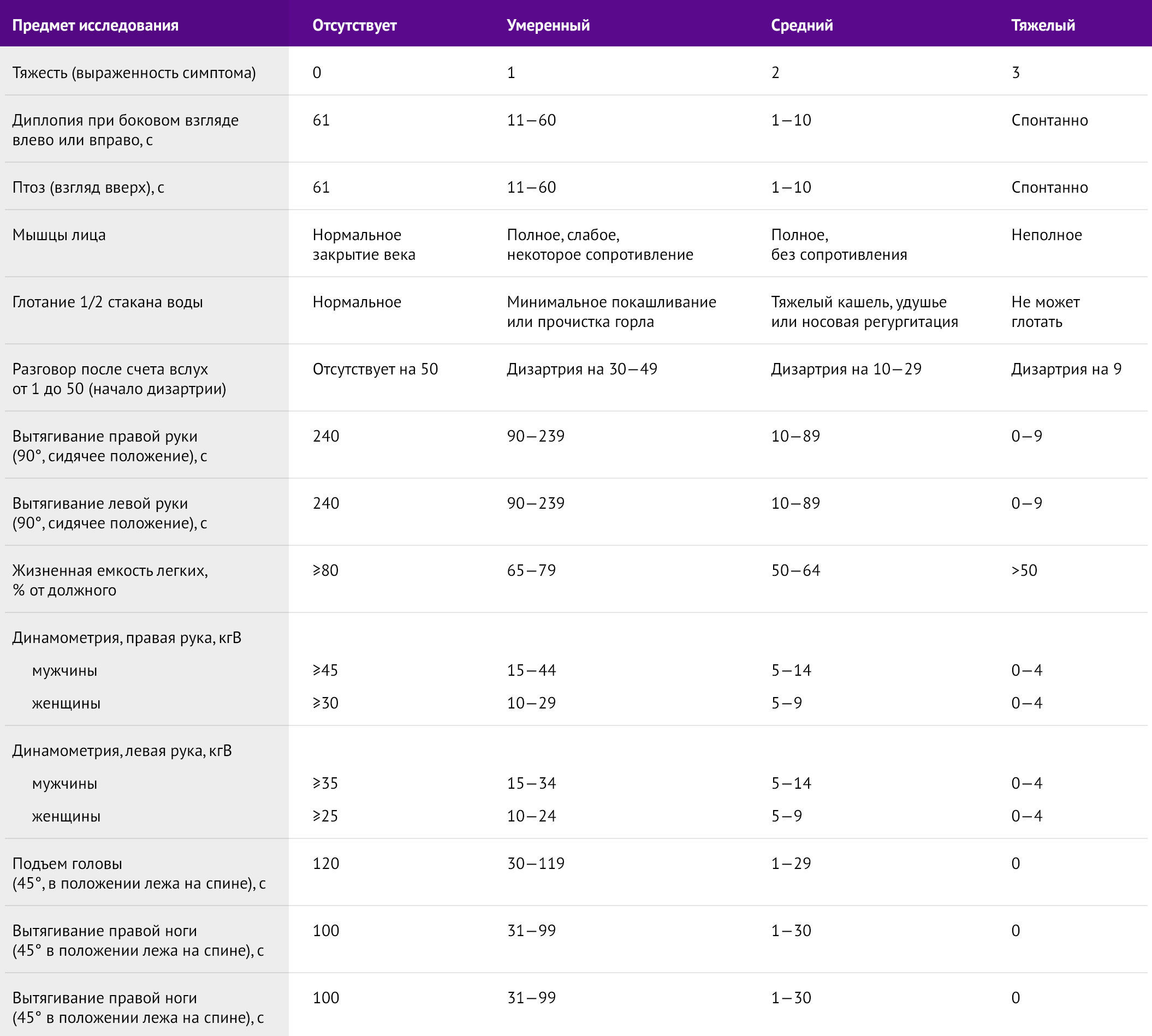
Шкала количественной оценки тяжести миастении (QMGS) полезна для достоверной оценки тяжести состояния пациентов с миастенией гравис, согласно классификации MGFA, а также позволяет оценить динамику клинических проявлений при проведении фармакологических проб с введением антихолинэстеразных препаратов (табл. 5) [4].
Таблица 5 | Шкала количественной оценки тяжести МГ
Терапия
Основные методы терапии МГ:
Схема 2 | Тактика назначения лекарственных средств при установленной миастении гравис
Симптоматическая терапия
Ингибитор ацетилхолинэстеразы пиридостигмин является наиболее предпочтительным препаратом в симптоматической терапии МГ, ответ на который проявляется среди большого количества пациентов, за исключением разве что больных с MuSK-позитивной МГ. Существуют как внутривенная, так и пероральная формы.
Пероральная форма препарата начинает действовать через 15–30 мин, достигая пиковой концентрации через 2 часа, продолжительность действия до 3–4 часов, иногда дольше [5].
Несмотря на малую продолжительность действия некоторым пациентам достаточно применять его каждые шесть или восемь часов в день. Другим необходима доза каждые три часа для поддержания эффекта.
Для взрослых и подростков старшего возраста обычной начальной дозой является прием 30 мг пиридостигмина трижды в день во время еды в течение 2–3 дней c целью определения холинергических побочных эффектов. При развитии чрезмерных побочных эффектов следует добавить M-холинолитики, чтобы уменьшить выраженность этих симптомов.
Тем, кто хорошо переносит пиридостигмин с антихолинергическими средствами или без них, стоит пошагово увеличивать дозу на 30 мг до хорошего терапевтического эффекта либо до развития выраженных побочных явлений. Максимальная доза обычно составляет 120 мг каждые четыре часа во время бодрствования. Иногда пациенту может потребоваться принимать его каждые три часа. Почти всем взрослым пациентам требуется общая суточная доза ≤960 мг, разделенная на 4–8 приемов.
Для детей и подростков начальная доза составляет от 0,5 до 1 мг/кг каждые 4–6 часов во время еды. Ее можно постепенно увеличивать в зависимости от терапевтического ответа и побочных эффектов. Максимальная суточная доза составляет 7 мг/кг в сутки, ее делят на 5–6 приемов.
Побочные явления приема антихолинэстеразных препаратов можно разделить на 2 типа: мускариновые и никотиновые. Среди мускариновых наиболее неприятные проявляются спазмами в животе и диареей. К другим относятся гиперсаливация, повышенное выделение бронхиального секрета, тошнота, гипергидроз и брадикардия. Также часты никотиновые побочные эффекты, включая фасцикуляции и мышечные спазмы. Однако они обычно менее обременительны, чем желудочно-кишечные проявления.
Мускариновые побочные эффекты можно контролировать, используя пероральные антихолинергические средства, оказывающие незначительное влияние на никотиновые рецепторы или не оказывающие такового (т. е. не вызывающие повышенной слабости).
К ним относятся следующие препараты:
Эти антихолинергические препараты можно принимать с профилактической целью три раза в день или вместе с пиридостигмином.
Выраженную диарею можно уменьшить путем использования лоперамида с другими антихолинергическими препаратами или без них.
Потенциальным основным побочным эффектом чрезмерного приема антихолинэстеразных препаратов является слабость, которую трудно отличить от ухудшения МГ. Холинергический криз настолько редок, что он не может быть предполагаемой причиной усиления слабости, если известно, что принятые дозы не превышают 120 мг каждые три часа или общую суточную дозу (960 мг).
В противном случае даже при наличии холинергических побочных эффектов следует предположить ухудшения основного заболевания и начать соответствующее лечение.
Патогенетическая терапия
У пациентов, слабость которых в значительной степени сохраняется в ответ на пиридостигмин, следует применять иммуносупрессивную терапию. Первоначально используются глюкокортикоиды, однако некоторым пациентам может потребоваться добавление к терапии нестероидных иммунодепрессантов (например, азатиоприна или микофенолата мофетила) с терапевтической целью и с целью профилактики побочных эффектов длительной терапии глюкокортикоидами.
Тактика ведения пациентов описана в схеме 2.
Терапия миастенического криза происходит в отделении интенсивной терапии, при необходимости подключают ИВЛ. Применяются иммуноглобулины (2–5 дней) в/в или плазмаферез (5 процедур 7–14 дней), либо пульс-терапия глюкокортикоидами в течение 1–2 дней, после чего может наступить транзиторное усиление мышечной слабости с последующим улучшением. Следует избегать одновременного назначения ИГ в/в или плазмафереза с использованием в/в метилпреднизолона, так как это может спровоцировать развитие миопатии критических состояний.
Терапию преднизолоном можно начать с 20 мг в день, затем увеличивать на 5 мг каждые 3–5 дней до целевой дозы 60 мг в день (или 1 мг/кг в день, максимум 80 мг в день). Часто это занимает от четырех до восьми недель. К этому времени обычно становится ясно, есть ли ответ на глюкокортикоиды. Снижение дозировки следует проводить примерно через месяц. При любом режиме суточная доза может снижаться на 5–10 мг каждый месяц до уровня не ниже 30 мг, а затем еще более медленно (например, 5 мг в месяц или менее). Кроме того, возможно использование терапии по типу “качелей”. Например, для снижения дозы с 80 мг сначала чередуется 80 мг и 60 мг в день, затем (через месяц) 80 мг и 40 мг в день, и в конечном итоге 80 мг и 0 мг в день. Затем идет сокращение высоких доз. Может потребоваться вернуться к более высокой дозе (как минимум на 10–20 мг), если симптомы возвращаются [6].
Тем не менее ежедневный прием предпочтителен в случае терапии детей и пациентов с сахарным диабетом.
Основные побочные эффекты приема глюкокортикоидов хорошо известны и зависят от дозы и длительности применения. К ним относят увеличение массы тела, кушингоидное лицо, стрии, асептический некроз головки плечевой или бедренной костей, стероидный диабет, артериальную гипертензию, остеопороз, желудочно-кишечное кровотечение и т. д.
С целью снижения выраженности побочных явлений следует проводить тщательный мониторинг, а также рекомендовать пациенту диету, прием витамина D и кальция, возможно, бисфосфонатов, проводить своевременную терапию АГ, использовать гастропротекторы.
Нестероидные иммунодепрессанты
В случае развития рефрактерной к стероидам МГ, а также развития осложнений и при наличии противопоказаний к терапии глюкокортикостероидами используются нестероидные иммунодепрессанты (табл. 6).
Таблица 6 | Характеристика основных иммунодепрессантов, использующихся при МГ
Параллельно с симптоматическим лечением пиридостигмином и иммунодепрессантами тимэктомия играет терапевтическую роль в зависимости от показаний:
Ведение пациентов вне стационаров также включает в себя профилактику развития инфекционных осложнений при возможной экзацербации заболевания. Пациентам показана и пневмококковая вакцинация, и вакцинация против гриппа. Однако следует избегать использования живых вакцин, особенно среди пациентов, находящихся на иммуносупрессивной терапии.
Психиатрическая коморбидность
Среди пациентов с МГ аффективные расстройства и нарушения сна встречаются гораздо чаще, чем в общей популяции, по разным источникам, более чем на 40 % [7,8,9]. Данные расстройства могут усугублять течение заболевания, а в некоторых случаях при неправильном подходе к терапии привести к экзацербации может и само лечение. Препараты, побочные явления которых могут усугублять течение МГ, представлены в таблице 7.
Таблица 7 | Препараты, использующиеся при нарушениях сна и психических расстройствах, и их потенциальные негативные проявления среди пациентов с МГ [10]
Качество жизни пациентов, разумеется, страдает. Учитывая необходимость приема препаратов, развитие побочных явлений, коморбидность по аутоиммунным заболеваниям, аффективным расстройствам и нарушениям сна, следует проводить тщательное исследование качества жизни больных МГ. Для этих целей подойдут шкалы, состоящие из 15 или 60 параметров оценки качества жизни пациентов (MG-QoL15/60), индекс оценки нарушений при МГ (MGII), неспецифические опросники SF-36, шкалы оценки депрессии, тревоги, нарушений сна.
Миастения гравис — одно из немногих аутоиммунных заболеваний, для которых известны подробные сведения как об антигенах-мишенях, так и о влияющих факторах, включая патологию тимуса, генетическую предрасположенность и внешние причины, такие как беременность и роль некоторых лекарств.
Основной задачей, стоящей перед исследователями, является поиск новых чувствительных и специфических диагностических инструментов и биомаркеров для прогнозирования течения заболевания и реакции на терапию, а также определение основной причины заболевания и разработка специфической терапии, направленной на восстановление иммунной толерантности.