Миелиновая оболочка что это
Миелин и его роль в работе нейрона

Миелин – это вещество, образующее миелиновую (мякотную) оболочку, которая отвечает за электроизоляцию нервных волокон и скорость передачи электрического импульса.
Анатомия миелина в строении нерва
Главная клетка нервной системы – нейрон. Тело нейрона называется сома. Внутри нее находится ядро. Тело нейрона окружено короткими отростками, которые называются дендриты. Они отвечают за связь с другими нейронами. От сомы отходит один длинный отросток – аксон. Он несет импульс от нейрона к другим клеткам. Чаще всего на конце он соединяется с дендритами других нервных клеток.
Всю поверхность аксона покрывает миелиновая оболочка, которая представляет собой отросток клетки Шванна, лишенный цитоплазмы. По сути, это несколько слоев клеточной мембраны, обернутые вокруг аксона.
Шванновские клетки, обволакивающие аксон, разделяются перехватами Ранвье, в которых отсутствует миелин.
Функции
Основными функциями миелиновой оболочки являются:
Как работают импульсы
Нервные клетки изолированы благодаря своей оболочке, но все же взаимосвязаны между собой. Участки, в которых клетки соприкасаются, называются синапсы. Это место, где встречаются аксон одной клетки и сома или дендрит другой.
Электрический импульс может передаваться внутри одной клетки или от нейрона к нейрону. Это сложный электрохимический процесс, который основан на перемещении ионов через оболочку нервной клетки.

Изменение напряжения из-за движения ионов калия и натрия называется «потенциал действия». Он распространяется медленно, но миелиновая оболочка, обволакивающая аксон, ускоряет это процесс, препятствуя оттоку и притоку ионов калия и натрия из тела аксона.
Проходя через перехват Ранвье, импульс перескакивает с одного участка аксона на другой, что и позволяет ему двигаться быстрее.
После того, как потенциал действия пересекает разрыв в миелине, импульс останавливается, и возвращается состояние покоя.
Такой способ передачи энергии характерен для ЦНС. Что касается вегетативной нервной системы, в ней часто встречаются аксоны, покрытые малым количеством миелина или вообще не покрытые им. Скачки между шванновскими клетками не осуществляются, и импульс проходит гораздо медленнее.
Состав
Миелиновый слой состоит из двух слоев липидов и трех слоев белка. Липидов в нем гораздо больше (70-75%):
Большое содержание жиров обусловливает белый цвет миелиновой оболочки, благодаря чему нейроны, покрытые ей, называются «белым веществом».
Белковые слои тоньше липидных. Содержание белка в миелине – 25-30%:
Существуют простые и сложные белки нервной ткани.
Роль липидов в строении оболочки
Липиды играют ключевую роль в строении мякотной оболочки. Они являются структурным материалом нервной ткани и защищают аксон от потери энергии и ионных потоков. Молекулы липидов обладают способностью восстанавливать ткани мозга после повреждений. Липиды миелина отвечают за адаптацию зрелой нервной системы. Они выступают в роли рецепторов гормонов и осуществляют коммуникацию между клетками.
Роль белков
Немаловажное значение в строении миелинового слоя имеют молекулы белков. Они наряду с липидами выступают в роли строительного материала нервной ткани. Их главной задачей является транспортировка питательных веществ в аксон. Также они расшифровывают сигналы, поступающие в нервную клетку и ускоряют реакции в ней. Участие в обмене веществ – важная функция молекул белка миелиновой оболочки.
Дефекты миелинизации

Почему происходит разрушение
Наиболее частыми причинами разрушения мякотной оболочки являются:
Заболевания вследствие демиелинизации
Демиелинизирующие заболевания центральной нервной системы:
Демиелинизирующие заболевания периферической нервной системы:
Это лишь часть заболеваний, возникающих из-за разрушения миелинового слоя. Симптомы в большинстве случаев схожи. Точный диагноз можно поставить лишь после проведения компьютерной или магнитно-резонансной томографии. Немаловажную роль в постановке диагноза играет уровень квалификации врача.
Принципы лечения дефектов оболочки
Заболевания, связанные с разрушением мякотной оболочки, очень сложно лечить. Терапия направлена в основном на купирование симптомов и остановку процессов разрушения. Чем раньше диагностировано заболевание, тем больше шансов остановить его течение.
Возможности восстановления миелина
Благодаря своевременному лечению можно запустить процесс восстановления миелина. Однако, новая миелиновая оболочка не будет так же хорошо выполнять свои функции. Кроме того, болезнь может перейти в хроническую стадию, а симптомы сохранятся, лишь слегка сгладятся. Но даже незначительная ремиелинизация способна остановить ход болезни и частично вернуть утраченные функции.
Современные лекарственные средства, направленные на регенерацию миелина более эффективны, но отличаются очень высокой стоимостью.
Терапия
Для лечения заболеваний, вызванных разрушением миелиновой оболочки, используются следующие препараты и процедуры:
Прогноз по заболеваниям
В настоящее время лечение демиелинизации не дает стопроцентного результата, но учеными активно ведутся разработки лекарственных средств, направленных на восстановление мякотной оболочки. Исследования проводятся по следующим направлениям:
Возможно, в скором времени заболевания, связанные с разрушением миелина, перестанут быть неизлечимыми.
Как толщина миелина и эпигенетика помогают устойчивости к стрессу
Результаты экспериментов Валентины Боннефил и коллег показывают, что толщина миелина влияет на устойчивость к стрессу — истончение волокна ведет к социальному поражению у мышей
Автор
Редакторы
Статья на конкурс «био/мол/текст»: В недавней работе Валентины Боннефил и коллег были получены новые данные касательно молекулярных и опосредованных ими морфологических различий в мозге. По предположениям исследователей, именно они обусловливают различия реакций на сильный стресс. Для изучения этого явления была использована модель социального поражения, когда к испытуемой мыши подводят агрессивную мышь. После десяти дней исследуемые грызуны начинают вести себя по-разному — одни продолжают проявлять интерес к общению с другими особям, в то время как другие «замыкаются» в себе. Авторы работы показали, что вторая группа мышей характеризуется более высоким уровнем нарушений в нервной ткани из-за медленного ее восстановления, что, по-видимому, связано с эпигенетическими особенностями.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Согласно опросу 2017 года, проведенному Американской психологической ассоциацией, три из четырех американцев сообщают о симптомах стресса в течение тридцати дней, предшествующих опросу [1]. Мы сталкиваемся со всевозможными стрессами — личными, финансовыми, карьерными, новостными и т.д. — все чаще и чаще. Более того, с популярностью интернета появляются и новые виды потребностей и связанных с ними стрессов, например, в 2016 году было проведено исследование по изучению «синдрома упущенной выгоды» (fear of missing out) у подростков. Результаты показали, что увеличившаяся потребность в популярности связана с возросшим использованием Facebook и что эта связь опосредована страхом пропустить какое-либо событие. Появление этого страха, в свою очередь, вызывает повышение уровня стресса [2].
Но растет научное понимание влияния избыточного стресса в долгосрочной перспективе. Исследования показывают, что воздействие стрессовых факторов, начиная от физического насилия и заканчивая социальными конфликтами, значительно увеличивает риск возникновения нарушений психики, таких как депрессия или посттравматическое стрессовое расстройство (ПТСР).
Однако люди по-разному реагируют на один и тот же уровень стресса: некоторые могут проявить устойчивость и быстро восстановиться, в то время как другие борются за выживание и ощущают себя подавленными и потерянными. Механизмы этого различия всё еще вызывают вопросы. Кроме того, исследователи всё еще оценивают, как развиваются долгосрочные последствия индивидуального воздействия стресса.
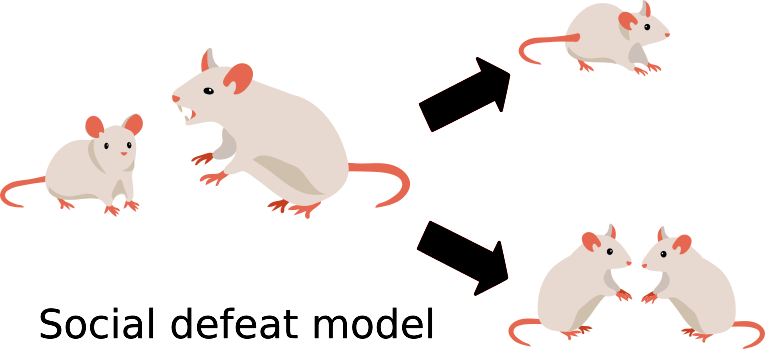
В работе Валентины Боннефил и коллег 2019 года показано, что поведение, характерное для депрессии, может быть выявлено после социального поражения (рис. 1) в виде повторных атак агрессивных мышей по пять минут в день в течение десяти дней, а также после очаговой демиелинизации в медиальной префронтальной коре [3].
Миелин — защитное покрытие из отростков ненервных клеток (олигодендроцитов), которое изолирует нейроны, а также способствует увеличению скорости проведения сигнала между ними. Разрушение миелина (иначе — демиелинизация) связывают с прогрессией нарушения координации и равновесия и многими другими заболеваниями. Подробнее можно почитать в статье на «Биомолекуле» «Обертка для аксона» [4].
Рисунок 1. Модель социального поражения основана на различной реакции мышей на агрессора.
иллюстрация автора статьи
Ученые, в основном сосредоточившись на роли нейронов, давно проводят исследования того, как различия в реакции на стресс могут найти объяснение в биологических процессах. Тем не менее нейроны представляют собой только один тип клеток головного мозга, и появляется все больше доказательств того, что взаимодействия между нейронными и ненейронными клетками играют важную роль в ответе на стресс.
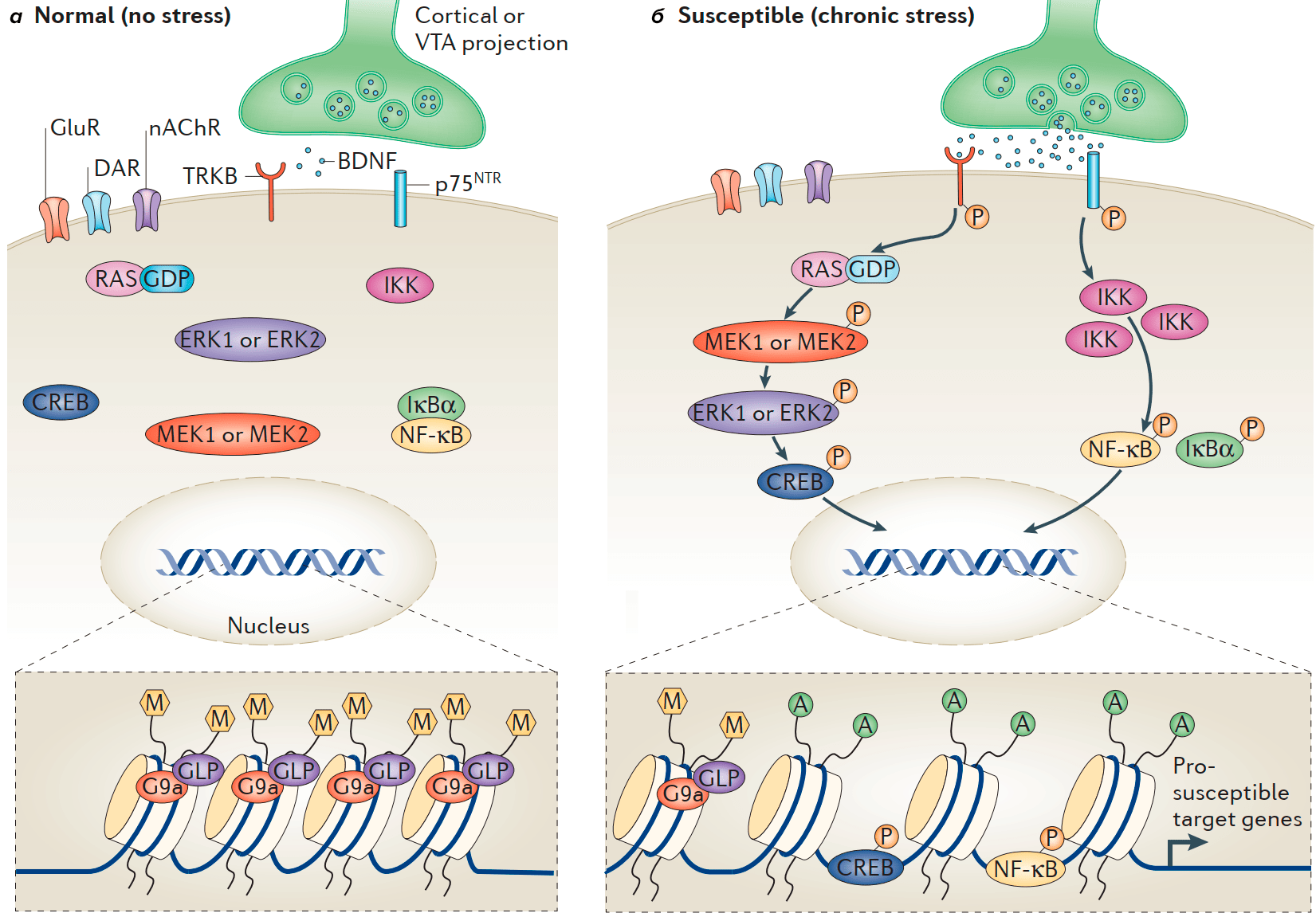
Исследования выявили, что умеренный уровень ацетилирования гистонов требуется для дифференцировки олигодендроцитов, в то время как высокие уровни ацетилирования гистонов связаны с нарушением миелинизации (из-за отсутствия молодых олигодендроцитов, создающих миелин) [5], [6]. Позднее обнаружили, что уровень миелинизации связан с приспосабливаемостью к изменяющимся условиям (в статье — к социальной изоляции) [7]. В той же работе показано, что истончение миелина связано с незрелым ядерным хроматином, а также повышенным уровнем ацетилирования и пониженным уровнем метилирования. Все изменения в данном исследовании были зафиксированы в префронтальной коре.
Что было сделано?
Сотрудники Центра перспективных научных исследований (ASRC) выяснили, что олигодендроциты, которые образуют миелиновые оболочки в центральной нервной системе, являются ключевыми факторами, определяющими, влияет ли на нас стресс. Эпигенетика позволяет объяснить всё больше вещей, которые ранее не смогла объяснить генетика (подробнее в статье «Эпигенетика: невидимый командир генома» [8]). И дифференцировка олигодендроцитов может зависеть от понижения уровня метилирования (а конкретно, метки H3K9me3 — метилирования гистона H3 в положении 9), сопряженного с разрыхлением (снижением плотности) хроматина и запуском экспрессии генов, специфичных для взрослых олигодендроцитов [9].
Исследователи подвергли мышей (10 — в экспериментальной группе; и 8 — в контрольной) воздействию социального поражения [3]. В итоге мышь либо оставалась социально вовлеченной (активно контактировала с другими особями) и потому была классифицирована как «устойчивая», либо избегала социальных контактов после встречи с агрессором, что позволяло отнести ее к группе «восприимчивых» животных. При этом невосприимчивые мыши были практически неотличимы от контрольной группы, которая не контактировала с агрессором.
Пристальное внимание было уделено прилежащему ядру (NAc) и медиальной префронтальной коре (mPFC), поскольку результаты предыдущих исследований свидетельствуют, что именно эти зоны определяют реакцию на стресс [10].
Что это за области мозга и что про них известно?
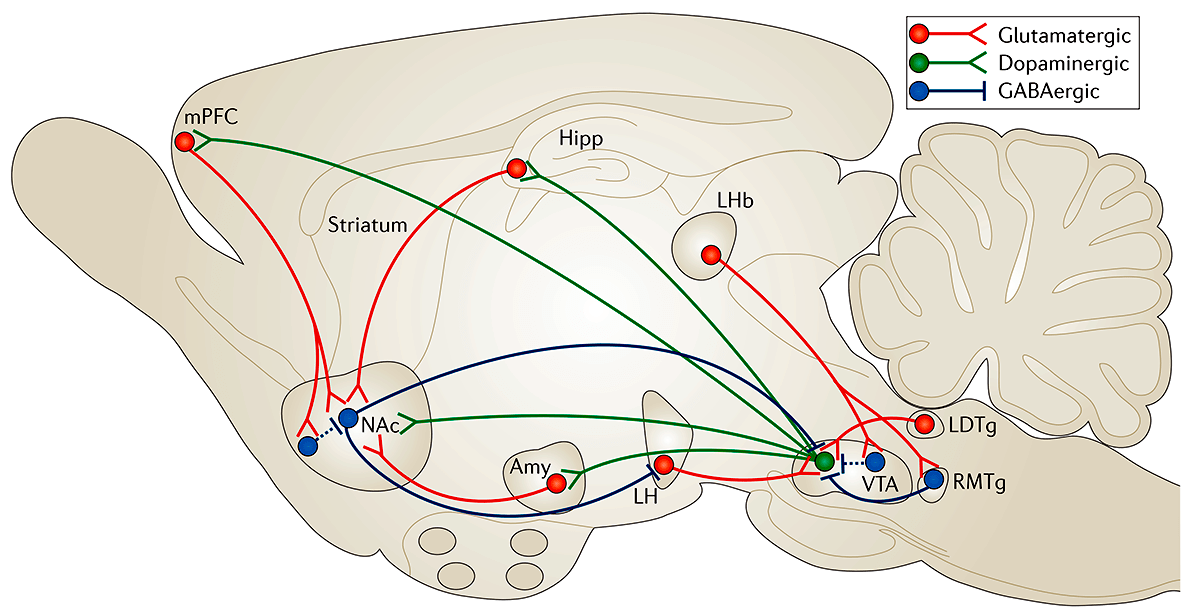
Прилежащее ядро является частью взаимосвязанной системы вентральной области — прилежащего ядра (VTA—NAc). Эта система имеет решающее значение для получения «наград» за счет выделения дофамина. VTA-дофаминергические нейроны также иннервируют несколько областей префронтальной коры (PFC), центральной миндалины, базолатеральной миндалины (BLA) и гиппокампа, а также другие области (рис. 2). Все эти так называемые области вознаграждения мозга сложным образом взаимосвязаны: например, NAc получает плотную глутаматергическую иннервацию из PFC, миндалины и гиппокампа; PFC, миндалина и гиппокамп образуют взаимные глутаматергические связи друг с другом. Функциональный выход каждой из этих областей модулируется несколькими типами ГАМКергических интернейронов.
Рисунок 2. Схема системы вознаграждения вентральной области — прилежащего ядра (VTA—NAc). Упрощенная схема основных дофаминергических, глутаматергических и ГАМКергических связей вокруг вентральной области (VTA) и прилежащего ядра (NAc) в головном мозге грызунов. Первичная схема системы вознаграждения включает дофаминергические связи из VTA в NAc, которые высвобождают дофамин в ответ на стимулы, связанные с вознаграждением (и в некоторых случаях стимулы, связанные с отвращением). Есть также ГАМКергические проекции от NAc до VTA; NAc также получает плотную иннервацию из глутаматергических моносинаптических контуров медиальной префронтальной коры (mPFC), гиппокампа (Hipp) и миндалины (Amy), а также из других областей. VTA получает глутаматергические стимулы от латерального дорсального сегмента (LDTg), латерального поводка эпиталамуса (LHb) и латерального гипоталамуса (LH). Эти различные глутаматергические входы контролируют аспекты восприятия и памяти, связанные с вознаграждением. Пунктирные линии показывают внутренние тормозные проекции. Красные линии — глутаматергические связи; зеленые — дофаминергические; синие — ГАМКергические.
Выделение дофамина в прилежащее ядро — это способ, с помощью которого мозг получает сигналы удовольствия. Чувство удовольствия побуждает нас повторять поведение, жизненно важное для выживания [11], а нарушения в получении дофаминовой награды связаны с такими симптомами, как ангедония и нарушение восприятия и воспоминаний, связанных с вознаграждением [12].
Медиальная префронтальная кора — часть префронтальной коры, которая также связана с системой вознаграждений, как было показано выше. Согласно результатам исследований, пациенты с депрессией имеют меньший объем коры, включая уменьшенный объем белого вещества в этой области, что и ведет к нарушению восприятия событий, которые раньше приносили радость [13].
Что обнаружили и какие сделали выводы?
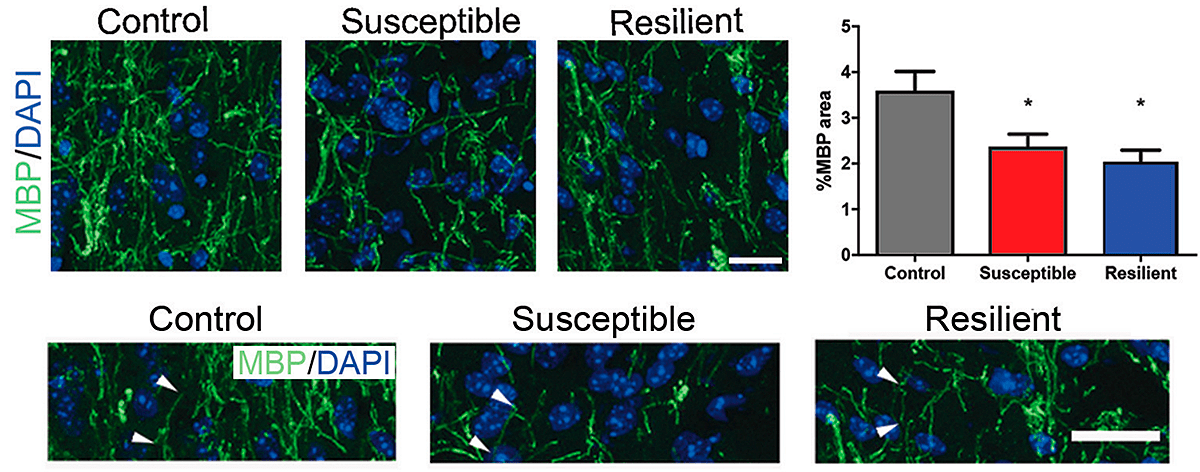
В обсуждаемой работе было показано, что поведение, связанное с социальным избеганием, может быть выявлено после социального поражения, а также после очаговой демиелинизации в mPFC, и поэтому может быть вызвано гипомиелинизацией. Обнаружили также, что миелин в прилежащем ядре истончается у обеих групп мышей (рис. 3). Но только у «восприимчивых» мышей выявили меньшее количество зрелых олигодендроцитов, а охват миелином оказался короче и тоньше.
Рисунок 3. Изображения с конфокального микроскопа и количественные оценки, показывающие иммуногистохимию основного белка миелина (МВР), контрастирующего с DAPI (4′,6-диамидино-2-фенилидолом, флюоресцентным красителем), 20-кратное увеличение. Control — контрольная группа; susceptible — «восприимчивая» группа; resilient — «устойчивая» группа. Статистический анализ проведен по одностороннему ANOVA с тестом Тьюки.
Более того, исследователи обнаружили снижение уровня метилирования гистонов (а именно метки H3K9me3, связанной с дифференцировкой незрелых олигодендроцитов) в предшественниках олигодендроцитов у «восприимчивых» мышей.
Метилирование гистонов представляет собой присоединение метильных групп к положительно заряженной аминокислоте лизину или аргинину с целью нейтрализации заряда. Связывание происходит с помощью фермента гистонметилтрансферазы. Это универсальный эпигенетический механизм, так как он приводит к активации или репрессии гена в зависимости от функции последнего. Метилирование гистонов в разных остатках служит маркером для связывания различных белковых активаторов/репрессоров, которые регулируют экспрессию гена.
Снижение уровня метилирования гистонов у предшественников олигодендроцитов, по-видимому, указывает на то, что эпигенетическая модификация может быть как причиной нарушения программы дифференцировки, так и ее следствием. Полученные данные позволяют нам говорить только о корреляции этих двух наблюдений, но не о причинно-следственной связи. Авторы говорят о возможности существования механизма эпигенетического переключения. Согласно этой концепции, стресс способен влиять на эпигенетическую модификацию предшественников олигодендроцитов, контролируя их развитие, а также отражается в миелиновых паттернах человека. В пользу этого говорит тот факт, что при образовании нового миелина его характеристики возвращаются к норме. Это свидетельствует о том, что изменения в результате этого стресса зачастую не вызывают повреждения ДНК, а только (обратимые) эпигенетические изменения.
Лизолецитин (иначе — лизофосфатидилхолин) является сильнодействующим растворяющим мембрану химическим веществом, которое обычно вводят в белое вещество мозга в виде 1%-ного раствора, чтобы вызвать очаговую демиелинизацию. В 1972 г. Сьюзан Холл была первой, кто продемонстрировал использование лизолецитина для создания демиелинизирующих поражений в белом веществе спинного мозга взрослой мыши [14].
Таким образом, мы можем говорить о том, что дефектная миелинизация воспринимается как дезадаптивный механизм (нарушение адаптации), возникающий только у «восприимчивых» мышей после воздействия повторяющегося социального стресса. Ранее было обнаружено, что дефекты миелинизации появляются у социально изолированных взрослых мышей еще до проявлений поведения социального избегания, что связано с нарушениями в системе получения удовольствия, вплоть до ангедонии [7].
Ангедония — неспособность чувствовать удовольствие, по определению французского физиолога Теодюля Рибо [15]. Сейчас определение включает также пониженную мотивацию к действиям, которые раньше вызывали радость [16]. Это различие важно, например, для животных моделей ангедонии, в которых эмоциональный опыт удовольствия сложно измерить, но мотивацию получения вознаграждения гораздо легче исследовать [17]. Ангедонию встречают у людей с различными психическими заболеваниями и состояниями — депрессией, шизофренией, болезнью Альцгеймера; она также играет важную роль в посттравматическом стрессовом синдроме и расстройствах пищевого поведения.
Почему у мышей различная устойчивость к стрессу?
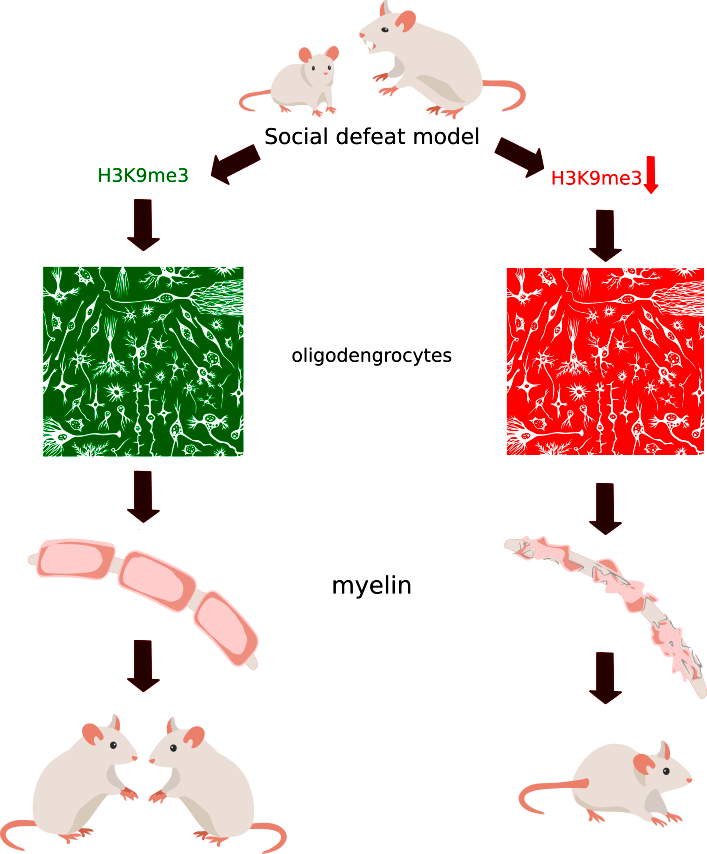
По-видимому, потому что у них различно число зрелых олигодендроцитов. Снижение уровня метилирования гистонов в предшественниках олигодендроцитов связано с нарушением дифференцировки (превращению в функциональные клетки), которая связана (коррелирует, по неподтвержденной гипотезе, ведет к) с истончением миелиновых волокон, что, в свою очередь, приводит к отсутствию адаптации к стрессу. Вот картинки с одной из гипотез о том, как все устроено (рис. 4).
Рисунок 4. Возможная схема различий реакции на социальное поражение, когда у одних мышей наблюдается пониженный уровень метилирования гистона H3 в положении 9, сниженный уровень зрелых олигодендроцитов и истончение миелина, а потому и избегание контактов с другими особями. В это же время другие мыши имели неотличимый от контрольных уровень метилирования гистона, их миелин не подвергся сильным изменениям, и они продолжали выражать интерес к общению с другими мышами. Social defeat model — модель социального поражения; oligodendrocytes — олигодендроциты; myelin — миелин.
иллюстрация автора статьи
Устойчивость к стрессу может возникнуть в результате активных стратегий преодоления, а не пассивного бездействия, определяемого как отсутствие адаптивного ответа. Одна из возможностей образования нового миелина в качестве стратегии преодоления связана с повышенной нейронной активностью у устойчивых мышей в нейронах префронтальной коры после социального поражения. Было показано, что оптогенетическая стимуляция префронтальной коры помогает формированию «устойчивого» фенотипа у мышей с социальным поражением.
Оптогенетическая стимуляция — использование света для контроля клеток на участке нервной ткани. Подконтрольные клетки предварительно генетически модифицированы для экспрессии светочувствительных ионных каналов. Метод позволяет осуществить оптическую модуляцию нейронной активности с высокой временной и пространственной разрешающей способностью, доходящей до размера единичного нейрона.
В то же время снижение качества и количества олигодендроцитов не является постоянным. Это говорит о том, что также вовлечен какой-то другой механизм, помимо обусловленного генетически, который централизованно регулирует развитие олигодендроцитов.
Глия — ненейронные клетки нервной системы, осуществляющие поддержание гомеостаза нейронов, обеспечивая их защиту и питание, а также формирование миелина. В центральной нервной системе к глиальным клеткам относят, например, олигодендроциты, астроциты и микроглию.
А что про воспаление, связанное со стрессом?
Альтернативный механизм может быть основан на различиях в воспалительных компонентах между двумя группами. Изучение интерлейкинов при расстройствах настроения ведется уже более двадцати лет [20]. Центральный вопрос заключается в том, в какой из частей нервной системы — периферической или центральной — синтезируются цитокины, играющие главную роль в формировании воспалительного компонента расстройств настроения.
Интерлейкины — группа цитокинов, изначально известных как часть иммунного воспалительного ответа; но также найдено, что они регулируют нейронную функцию в центральной и периферической нервных системах.
Анализ маркеров периферического воспаления последовательно выявляет увеличение интерлейкинов-6 (IL-6), интерлейкинов-1β (IL-1β) и фактора некроза опухолей-α (TNFα) у пациентов с расстройствами настроения. Измененные центральные уровни этих факторов также были определены.
Известно, что снижение уровня синтеза IL-6 во всем организме или только в лейкоцитах способствует развитию «устойчивого» фенотипа [21]. Используя компьютерное моделирование, Скотт Руссо с коллегами показал, что одновременная тревожность, уменьшение объема гиппокампа и повышение уровня системного интерлейкина-6 характеризовали восприимчивый фенотип, у которого развились поведенческие и нейробиологические нарушения после социального поражения [22].
Транскрипционный фактор — белок, связывающий ДНК в особых участках и регулирующий или инициирующий транскрипцию гена.
Например, в гиппокампе активация NF-κB участвует в нарушении нейрогенеза и индукции ангедонии [25]. В NAc хронический стресс после социального поражения увеличивает уровни киназы ингибитора NF-κB (IKK), что способствует активации NF-κB, который связывается с ДНК и изменяет транскрипцию группы генов. Одновременно меняется и эпигенетика — снижается уровень метилирования и повышается уровень ацетилирования. Это стимулирует образование новых незрелых шипиков на дендритах NAc. Данный процесс происходит только у восприимчивых животных, но не наблюдается у устойчивых особей (рис. 5). Прямое ингибирование IKK в NAc «обрезает» эти новые синапсы и обращает вспять связанные с ними депрессивные фенотипы [26]. Текущие исследования фокусируются на внутриклеточных сигнальных путях, посредством которых цитокины регулируют активность NF-κB, связанную со стрессом, а также нацелены на выявление транскрипционных мишеней NF-κB, которые опосредуют эти эффекты.
Шипики — выросты мембраны дендритов, играют важную роль в формировании и регуляции глутаматного синапса.
Другим механизмом, связывающим воспаление с развитием депрессивной симптоматики, является влияние цитокинов на гипоталамо-гипофизарную ось (HPA). Цитокины могут действовать на глюкокортикоидные рецепторы и косвенно активировать синтез кортикотропин-рилизинг-гормона (CRH), адренокортикотропного гормона (ACTH) и кортизола [27]. Степень, в которой цитокины индуцируют высвобождение ACTH и кортизола, является прогностическим фактором развития симптомов депрессии [28]. Это означает, что чувствительность оси HPA к воспалительной стимуляции особенно важна для развития аффективно-когнитивных симптомов депрессии.
Заключение
Отцом исследований стресса считают Ганса Селье, который определял стресс как «неспецифическую реакцию организма на любую потребность» и впервые предположил о наличии связи между стрессом и развитием заболеваний. Сейчас исследования стресса базируются на стыке фармакологии, патологии и нейронаук и направлены на изучение на молекулярном уровне.
Понимание изменений, которые вызывают стресс в организме, позволяет исследователям начать составлять карту потенциальных клинических вмешательств с конечной целью снижения его негативных последствий и предотвращения психических расстройств. Большинство современных методов лечения фокусируются на здоровье нейронов, но это исследование подтверждает возможность вмешательства в глиальные клетки, по крайней мере, в случае психических заболеваний, связанных со стрессом.
Несмотря на то, что данная статья добавляет ясности в наше понимание формирования двух групп в реакциях на социальное поражение, при переносе результатов на людей мы должны помнить о невозможности полностью смоделировать депрессию у животного по ряду причин. Во-первых, депрессия у людей — это не одно заболевание, а очень неоднородный синдром. Во-вторых, ключевые симптомы человеческой депрессии (то есть вина, суицидальность и грусть) не могут быть оценены (и могут не существовать вовсе в зависимости от того, как мы эти эмоции определяем [29]) у животных. И в-третьих, биология, лежащая в основе многих типов человеческой депрессии, остается плохо изученной. Однако ясно, что воздействие стресса увеличивает риск депрессии у людей, и, следовательно, большинство моделей депрессии грызунов полагаются на стрессовые факторы окружающей среды, чтобы вызвать симптомы, подобные депрессии, которые можно изучать механически.
Важное предостережение в отношении работы, описанной в этой статье (и в большинстве работ, использующих мышиные модели), заключается в том, что было использовано небольшое количество мышей, недостаточное для высокой достоверности результатов. Более того, исследование проводили исключительно на самцах грызунов, несмотря на тот факт, что в человеческом мире женщины в два раза чаще страдают расстройством настроения, чем мужчины [30]. И модели грызунов демонстрируют, что особи женского пола испытывают более депрессивное поведение после хронического стресса [31]. Было высказано предположение, что различия в развитии связанных с вознаграждением нейронных цепей могут предрасполагать женщин к депрессии [32]. Кроме того, прямое воздействие циркулирующих половых гормонов на систему вознаграждения может изменить чувствительность женщины к стрессу во время менструального цикла [33]. Исследования на грызунах действительно показали, что гормоны яичников изменяют пороги вознаграждения за стимуляцию мозга, что означает, что во время определенных фаз эстрального цикла женщины более склонны к ангедонии [34]. Это должно быть чрезвычайно высоким приоритетом для будущих исследований; мы должны определить, в какой степени рассмотренные выше механизмы применимы к моделям женской депрессии.
Важно также помнить, что наши реакции часто обусловлены опытом наших предков, который закодирован в эпигеноме (на «Биомолекуле» этому посвещена статья «Эпигенетика поведения: как бабушкин опыт отражается на ваших генах» [35]), что позволяет напомнить о важности поддержания психического здоровья во всех поколениях. И самый простой, ставший почти скучным совет (который все еще работает): достаточное количество сна, отдых и режим питания — это то, что мы уже сейчас можем сделать для улучшения своей эпигенетики.