Миелоидный лейкоз что это такое сколько живут
Хронический миелолейкоз
Хронический миелолейкоз – это злокачественное миелопролиферативное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка. Может долгое время протекать бессимптомно. Проявляется склонностью к субфебрилитету, ощущением полноты в животе, частыми инфекциями и увеличением селезенки. Наблюдаются анемия и изменение уровня тромбоцитов, сопровождающиеся слабостью, бледностью и повышенной кровоточивостью. На заключительной стадии развиваются лихорадка, лимфоаденопатия и кожная сыпь. Диагноз устанавливается с учетом анамнеза, клинической картины и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10
Общие сведения
Хронический миелолейкоз – онкологическое заболевание, возникающее в результате хромосомной мутации с поражением полипотентных стволовых клеток и последующей неконтролируемой пролиферацией зрелых гранулоцитов. Составляет 15% от общего количества гемобластозов у взрослых и 9% от общего числа лейкозов во всех возрастных группах. Обычно развивается после 30 лет, пик заболеваемости хроническим миелолейкозом приходится на возраст 45-55 лет. Дети до 10 лет страдают исключительно редко.
Хронический миелолейкоз одинаково распространен у женщин и у мужчин. Из-за бессимптомного или малосимптомного течения может становиться случайной находкой при исследовании анализа крови, взятого в связи с другим заболеванием или во время профилактического осмотра. У части больных хронический миелолейкоз выявляется на заключительных стадиях, что ограничивает возможности терапии и ухудшает показатели выживаемости. Лечение проводят специалисты в области онкологии и гематологии.
Причины
Хронический миелолейкоз считается первым заболеванием, при котором достоверно установлена связь между развитием патологии и определенным генетическим нарушением. В 95% случаев подтвержденной причиной хронического миелолейкоза является хромосомная транслокация, известная как «филадельфийская хромосома». Суть транслокации заключается во взаимной замене участков 9 и 22 хромосом. В результате такой замены формируется устойчивая открытая рамка считывания. Образование рамки вызывает ускорение деления клеток и подавляет механизм восстановления ДНК, что увеличивает вероятность возникновения других генетических аномалий.
В числе возможных факторов, способствующих появлению филадельфийской хромосомы у больных хроническим миелолейкозом, называют ионизирующее облучение и контакт с некоторыми химическими соединениями.
Патогенез
Итогом мутации становится усиленная пролиферация полипотентных стволовых клеток. При хроническом миелолейкозе пролиферируют преимущественно зрелые гранулоциты, но аномальный клон включает в себя и другие клетки крови: эритроциты, моноциты, мегакариоциты, реже – В- и Т-лифоциты. Обычные гемопоэтические клетки при этом не исчезают и после подавления аномального клона могут служить основой для нормальной пролиферации кровяных клеток. Для хронического миелолейкоза характерно стадийное течение.
Источником бластов становятся лимфатические узлы, кости, кожа, ЦНС и т. д. В фазе бластного криза состояние больного хроническим миелолейкозом резко ухудшается, развиваются тяжелые осложнения, завершающиеся гибелью больного. У некоторых пациентов фаза акселерации отсутствует, хроническая фаза сразу сменяется бластным кризом.
Симптомы хронического миелолейкоза
Клиническая картина определяется стадией заболевания. Хроническая фаза в среднем продолжается 2-3 года, в некоторых случаях – до 10 лет. Для этой фазы хронического миелолейкоза характерно бессимптомное течение или постепенное появление «легких» симптомов: слабости, некоторого недомогания, снижения трудоспособности и чувства переполнения живота. При объективном осмотре больного хроническим миелолейкозом может обнаруживаться увеличение селезенки. По анализам крови выявляется повышение количества гранулоцитов до 50-200 тыс./мкл при бессимптомном течении заболевания и до 200-1000 тыс./мкл при «легких» признаках.
На начальных стадиях хронического миелолейкоза возможно некоторое снижение уровня гемоглобина. В последующем развивается нормохромная нормоцитарная анемия. При исследовании мазка крови пациентов с хроническим миелолейкозом отмечается преобладание молодых форм гранулоцитов: миелоцитов, промиелоцитов, миелобластов. Наблюдаются отклонения от нормального уровня зернистости в ту или иную сторону (обильная или очень скудная). Цитоплазма клеток незрелая, базофильная. Определяется анизоцитоз. При отсутствии лечения хроническая фаза переходит в фазу акселерации.
О начале фазы акселерации может свидетельствовать как изменение лабораторных показателей, так и ухудшение состояния пациентов. Возможно нарастание слабости, увеличение печени и прогрессирующее увеличение селезенки. У больных хроническим миелолейкозом выявляются клинические признаки анемии и тромбоцитопении или тробоцитоза: бледность, быстрая утомляемость, головокружения, петехии, кровоизлияния, повышенная кровоточивость. Несмотря на проводимое лечение, в крови пациентов с хроническим миелолейкозом постепенно увеличивается количество лейкоцитов. При этом отмечается возрастание уровня метамиелоцитов и миелоцитов, возможно появление единичных бластных клеток.
Бластный криз сопровождается резким ухудшением состояния больного хроническим миелолейкозом. Возникают новые хромосомные аномалии, моноклоновое новообразование трансформируется в поликлоновое. Отмечается нарастание клеточного атипизма при угнетении нормальных ростков кроветворения. Наблюдаются ярко выраженные анемия и тромбоцитопения. Суммарное количество бластов и промиелоцитов в периферической крови составляет более 30%, в костном мозге – более 50%. Пациенты с хроническим миелолейкозом теряют вес и аппетит. Возникают экстрамедуллярные очаги незрелых клеток (хлоромы). Развиваются кровотечения и тяжелые инфекционные осложнения.
Диагностика
Диагноз устанавливается на основании клинической картины и результатов лабораторных исследований. Первое подозрение на хронический миелолейкоз часто возникает при повышении уровня гранулоцитов в общем анализе крови, назначенном в порядке профилактического осмотра или обследования в связи с другим заболеванием. Для уточнения диагноза могут использоваться данные гистологического исследования материала, полученного при стернальной пункции костного мозга, однако окончательный диагноз «хронический миелолейкоз» выставляется при выявлении филадельфийской хромосомы при помощи ПЦР, флюоресцентной гибридизации или цитогенетического исследования.
Вопрос о возможности постановки диагноза хронический миелолейкоз при отсутствии филадельфийской хромосомы остается дискутабельным. Многие исследователи считают, что подобные случаи могут объясняться комплексными хромосомными нарушениями, из-за которых выявление данной транслокации становится затруднительным. В ряде случаев филадельфийскую хромосому можно обнаружить при использовании ПЦР с обратной транскрипцией. При отрицательных результатах исследования и нетипичном течении заболевания обычно говорят не о хроническом миелолейкозе, а о недифференцированном миелопролиферативном/миелодиспластическом расстройстве.
Лечение хронического миелолейкоза
Тактику лечения определяют в зависимости от фазы заболевания и выраженности клинических проявлений. В хронической фазе при бессимптомном течении и слабо выраженных лабораторных изменениях ограничиваются общеукрепляющими мероприятиями. Больным хроническим миелолейкозом рекомендуют соблюдать режим труда и отдыха, принимать пищу, богатую витаминами и т. д. Лечение может включать:
Прогноз
Прогноз при хроническом миелолейкозе зависит от множества факторов, определяющим из которых является момент начала лечения (в хронической фазе, фазе активации или в период бластного криза). В качестве неблагоприятных прогностических признаков хронического миелолейкоза рассматривают значительное увеличение печени и селезенки (печень выступает из-под края реберной дуги на 6 и более см, селезенка – на 15 и более см), лейкоцитоз свыше 100×10 9 /л, тромбоцитопению менее 150×10 9 /л, тромбоцитоз более 500х10 9 /л, повышение уровня бластных клеток в периферической крови до 1% и более, повышение суммарного уровня промиелоцитов и бластных клеток в периферической крови до 30% и более.
Вероятность неблагоприятного исхода при хроническом миелолейкозе возрастает по мере увеличения количества признаков. Причиной гибели становятся инфекционные осложнения или тяжелые геморрагии. Средняя продолжительность жизни пациентов с хроническим миелолейкозом составляет 2,5 года, однако при своевременном начале терапии и благоприятном течении заболевания этот показатель может увеличиваться до нескольких десятков лет.
Острый миелоидный лейкоз
Что такое острый миелоидный лейкоз?
Острый миелоидный лейкоз – это поражение костного мозга, из-за которого измененные белые кровяные клетки размножаются слишком быстро.
Заболевание, которое обыватели называют «раком крови», может возникнуть у людей любого пола и возраста, но чаще всего встречается у мужчин от 65 лет и старше.
Как развивается острый миелоидный лейкоз?
Острый миелоидный лейкоз (ОМЛ) начинается в костном мозге – мягкой внутренней части костей, состоящей из жировых и кроветворных клеток, включая стволовые, которые становятся:
Лейкоз начинается с изменения ДНК – содержащейся в каждой клетке нашего тела молекулы, в которой зашифрована вся информация об организме. Такие «поломки» возникают из-за воздействия химикатов, радиации, различных заболеваний или случайных сбоев, и приводят к производству слишком большого количества бластов – быстро растущих незрелых, то есть не работающих белых кровяных телец.
Нормальные бласты со временем превращаются в полезные клетки крови, а при лейкозе они становятся опухолевыми, активно размножаются и постепенно вытесняют нормальные, что приводит к ряду тяжелых последствий. У здорового человека их не много – они составляют 5% или меньше от костного мозга, а в крови не обнаруживаются. Для того, чтобы врач поставил диагноз «острый миелоидный лейкоз», их должно быть не менее 20%.
Такие клетки не просто циркулируют по организму – они распространяются в различные органы, включая лимфатические узлы, печень, селезенку, яички, головной и спинной мозг, скапливаются и повреждают их.
Врачи выделяют две основных формы миелоидного лейкоза:
— острый – развивающийся внезапно и быстро;
— и хронический – при данном типе заболевания бласты вытесняют здоровые клетки крови гораздо медленнее, чем при остром.
Причины возникновения острого миелоидного лейкоза
Точные причины развития данного заболевания врачам до сих пор не известны – они знают лишь о факторах, которые могут спровоцировать его возникновение:
Симптомы острого миелоидного лейкоза
Признаки лейкоза проявляются примерно одинаково как у детей, так и у взрослых, и могут выглядеть следующим образом:
Диагностика острого миелоидного лейкоза
Тщательная диагностика крайне важна, поскольку в ее ходе доктор может не только установить сам факт наличия заболевания, но и понять, какое именно лечение подходит конкретному пациенту.
Диагностика начинается с обычного медицинского осмотра и поисков синяков, кровоподтеков или возможных признаков инфекции, после чего назначается целый ряд процедур:
Лечение острого миелоидного лейкоза
Борьба с лейкозом – задача сложная и требует участия сразу нескольких врачей – не только гематолога, но и онколога, химиотерапевта и других.
В Онкоцентре «Лапино-2» есть целая команда отличных специалистов, которые не просто быстро выявят заболевание, но и проведут любые необходимые лечебные процедуры.
Вам не придется задаваться вопросом «что делать?» и «к кому обращаться?» – у нас вы получите четкий план действий, следуя которому пройдете терапию без очередей, задержек и нервов.
При лечении миелоидного лейкоза врачи применяют несколько методов.
Статус острого миелоидного лейкоза после лечения
Долгосрочные прогнозы каждого пациента в немалой степени зависят от того, насколько хорошо и быстро заболевание поддается лечению: чем лучше первая реакция организма, тем оптимистичнее перспективы.
Активное заболевание: после лечения в костном мозге есть больше 5% бластов, либо после проведенной терапии произошел рецидив – возвращение болезни.
Прогнозы и выживаемость при остром миелоидном лейкозе
Перспективы каждого человека индивидуальны и зависят от большого количества факторов.
Для каждого вида заболевания есть своя статистика.
После индукции – первого же курса химиотерапии выходят в ремиссию, то есть нормализуют количество клеток крови, около 90% обладателей острого промиелоцитарного лейкоза. Для всех остальных типов эта цифра составляет примерно 67%.
Кроме того, многие люди 60+ не реагируют на лечение, и всего лишь у половины из них после индукции наступает ремиссия.
У детей статистика своя: от 85% до 90% из них выходят в ремиссию после индукции, а их пятилетняя выживаемость составляет от 60% до 70%.
Острый миелоидный лейкоз
Острый миелоидный лейкоз – злокачественное заболевание системы крови, сопровождающееся неконтролируемым размножением измененных лейкоцитов, снижением количества эритроцитов, тромбоцитов и нормальных лейкоцитов. Проявляется повышенной склонностью к развитию инфекций, лихорадкой, быстрой утомляемостью, потерей веса, анемией, кровоточивостью, образованием петехий и гематом, болями в костях и суставах. Иногда выявляются изменения кожи и припухлость десен. Диагноз устанавливается на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, трансплантация костного мозга.
МКБ-10
Общие сведения
Острый миелоидный лейкоз (ОМЛ) – злокачественное поражение миелоидного ростка крови. Неконтролируемая пролиферация лейкозных клеток в костном мозге влечет за собой подавление остальных ростков крови. В результате количество нормальных клеток в периферической крови уменьшается, возникают анемия и тромбоцитопения. Острый миелоидный лейкоз является самым распространенным острым лейкозом у взрослых. Вероятность развития болезни резко увеличивается после 50 лет. Средний возраст пациентов составляет 63 года. Мужчины и женщины молодого и среднего возраста страдают одинаково часто. В старшей возрастной группе наблюдается преобладание лиц мужского пола. Прогноз зависит от вида острого миелоидного лейкоза, пятилетняя выживаемость колеблется от 15 до 70%. Лечение осуществляют специалисты в области онкологии и гематологии.
Причины острого миелоидного лейкоза
Непосредственной причиной развития ОМЛ являются различные хромосомные нарушения. В числе факторов риска, способствующих развитию таких нарушений, указывают неблагоприятную наследственность, ионизирующее излучение, контакт с некоторыми токсическими веществами, прием ряда лекарственных препаратов, курение и болезни крови. Вероятность возникновения острого миелоидного лейкоза увеличивается при синдроме Блума (низкий рост, высокий голос, характерные черты лица и разнообразные кожные проявления, в том числе гипо- или гиперпигментация, кожная сыпь, ихтиоз, гипертрихоз) и анемии Фанкони (низкий рост, дефекты пигментации, неврологические расстройства, аномалии скелета, сердца, почек и половых органов).
Острый миелоидный лейкоз достаточно часто развивается у больных с синдромом Дауна. Прослеживается также наследственная предрасположенность при отсутствии генетических заболеваний. При ОМЛ у близких родственников вероятность возникновения болезни повышается в 5 раз по сравнению со средними показателями по популяции. Самый высокий уровень корреляции выявляется у однояйцевых близнецов. Если острый миелоидный лейкоз диагностируется у одного близнеца, риск у второго составляет 25%. Одним из важнейших факторов, провоцирующих ОМЛ, являются заболевания крови. Хронический миелоидный лейкоз в 80% случаев трансформируется в острую форму болезни. Кроме того, ОМЛ нередко становится исходом миелодиспластического синдрома.
Ионизирующее излучение вызывает острые миелоидные лейкозы при превышении дозы 1 Гр. Заболеваемость увеличивается пропорционально дозе облучения. На практике имеет значение пребывание в зонах атомных взрывов и аварий на атомных электростанциях, работа с источниками излучения без соответствующих защитных средств и радиотерапия, применяемая при лечении некоторых онкологических заболеваний. Причиной развития острого миелоидного лейкоза при контакте с токсическими веществами является аплазия костного мозга в результате мутаций и поражения стволовых клеток. Доказано негативное влияние толуола и бензола. Обычно ОМЛ и другие острые лейкозы диагностируются спустя 1-5 лет после контакта с мутагеном.
В числе лекарственных средств, способных провоцировать острые миелоидные лейкозы, специалисты называют некоторые препараты для химиотерапии, в том числе ингибиторы ДНК-топоизомеразы II (тенипозид, этопозид, доксорубицин и другие антрациклины) и алкилирующие средства (тиофосфамид, эмбихин, циклофосфамид, хлорамбуцил, кармустин, бусульфан). ОМЛ также может возникать после приема хлорамфеникола, фенилбутазона и препаратов мышьяка. Доля лекарственных острых миелоидных лейкозов составляет 10-20% от общего количества случаев заболевания. Курение не только повышает вероятность развития ОМЛ, но и ухудшает прогноз. Средняя пятилетняя выживаемость и продолжительность полных ремиссий у курильщиков ниже, чем у некурящих.
Классификация острого миелоидного лейкоза
Классификация острого миелоидного лейкоза по версии ВОЗ очень сложна и включает в себя несколько десятков разновидностей заболевания, разделенных на следующие группы:
Тактика лечения, прогноз и продолжительность ремиссий при разных видах ОМЛ могут существенно различаться.
Симптомы острого миелоидного лейкоза
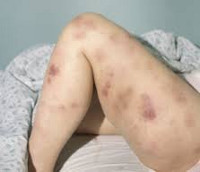
Клиническая картина включает в себя токсический, геморрагический, анемический синдромы и синдром инфекционных осложнений. На ранних стадиях проявления острого миелоидного лейкоза неспецифичны. Отмечается повышение температуры без признаков катарального воспаления, слабость, утомляемость, потеря веса и аппетита. При анемии присоединяются головокружения, обморочные состояния и бледность кожных покровов. При тромбоцитопении наблюдаются повышенная кровоточивость и петехиальные кровоизлияния. Возможно образование гематом при незначительных ушибах. При лейкопении возникают инфекционные осложнения: частые нагноения ран и царапин, упорные повторные воспаления носоглотки и т. д.
В отличие от острого лимфобластного лейкоза при остром миелоидном лейкозе отсутствуют выраженные изменения со стороны периферических лимфатических узлов. Лимфоузлы небольшие, подвижные, безболезненные. Иногда выявляется увеличение лимфатических узлов в шейно-надключичной области. Печень и селезенка в пределах нормы или незначительно увеличены. Характерны признаки поражения костно-суставного аппарата. Многие больные острым миелоидным лейкозом предъявляют жалобы на боли различной степени интенсивности в области позвоночника и нижних конечностей. Возможны ограничения движений и изменения походки.
В числе экстрамедуллярных проявлений острого миелоидного лейкоза – гингивит и экзофтальм. В отдельных случаях наблюдаются припухлость десен и увеличение небных миндалин в результате инфильтрации лейкозными клетками. При миелоидной саркоме (составляет около 10% от общего количества случаев острого миелоидного лейкоза) на коже пациентов появляются зеленоватые, реже – розовые, серые, белые или коричневые опухолевидные образования (хлоромы, кожные лейкемиды). Иногда при поражениях кожи обнаруживается паранеопластический синдром (синдром Свита), который проявляется воспалением кожных покровов вокруг лейкемидов.
В развитии острого миелоидного лейкоза выделяют пять периодов: начальный или доклинический, разгара, ремиссии, рецидива и терминальный. В начальном периоде острый миелоидный лейкоз протекает бессимптомно или проявляется неспецифической симптоматикой. В периоде разгара токсический синдром становится более выраженным, выявляются анемический, геморрагический и инфекционный синдромы. В период ремиссии проявления острого миелоидного лейкоза исчезают. Рецидивы протекают аналогично периоду разгара. Терминальный период сопровождается прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика и лечение острого миелоидного лейкоза
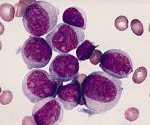
Решающую роль в процессе диагностики играют лабораторные анализы. Используют анализ периферической крови, миелограмму, микроскопические и цитогенетические исследования. Для получения образца тканей выполняют аспирационную биопсию костного мозга (стернальную пункцию). В анализе периферической крови больного острым миелоидным лейкозом обнаруживается снижение количества эритроцитов и тромбоцитов. Количество лейкоцитов может быть как повышенным, так и (реже) пониженным. В мазках могут выявляться бласты. Основанием для постановки диагноза «острый миелоидный лейкоз» становится обнаружение более 20% бластных клеток в крови либо в костном мозге.
Основой лечения острого миелоидного лейкоза является химиотерапия. Выделяют два этапа лечения: индукцию и консолидацию (постремиссионную терапию). На этапе индукции выполняют лечебные мероприятия, направленные на уменьшение количества лейкозных клеток и достижение состояния ремиссии. На этапе консолидации устраняют остаточные явления болезни и предотвращают рецидивы. Лечебную тактику определяют в зависимости от вида острого миелоидного лейкоза, общего состояния больного и некоторых других факторов.
Наиболее популярная схема индукционного лечения – «7+3», предусматривающая непрерывное внутривенное введение цитарабина в течение 7 дней в сочетании с одновременным быстрым периодическим введением антрациклинового антибиотика в течение первых 3 дней. Наряду с этой схемой в процессе лечения острого миелоидного лейкоза могут применяться другие лечебные программы. При наличии тяжелых соматических заболеваний и высоком риске развития инфекционных осложнений в результате подавления миелоидного ростка (обычно – у больных старческого возраста) используют менее интенсивную паллиативную терапию.
Программы индукции позволяет добиться ремиссии у 50-70% пациентов с острым миелоидным лейкозом. Однако без дальнейшей консолидации у большинства больных наступает рецидив, поэтому второй этап лечения рассматривается, как обязательная часть терапии. План консолидационного лечения острого миелоидного лейкоза составляется индивидуально и включает в себя 3-5 курсов химиотерапии. При высоком риске рецидивирования и уже развившихся рецидивах показана трансплантация костного мозга. Другие методы лечения рецидивных ОМЛ пока находятся в стадии клинических испытаний.
Прогноз острого миелоидного лейкоза
Прогноз определятся разновидностью острого миелоидного лейкоза, возрастом больного, наличием или отсутствием миелодиспластического синдрома в анамнезе. Средняя пятилетняя выживаемость при разных формах ОМЛ колеблется от 15 до 70%, вероятность развития рецидивов – от 33 до 78%. У пожилых людей прогноз хуже, чем у молодых, что объясняется наличием сопутствующих соматических заболеваний, являющихся противопоказанием для проведения интенсивной химиотерапии. При миелодиспластическом синдроме прогноз хуже, чем при первичном остром миелоидном лейкозе и ОМЛ, возникшем на фоне фармакотерапии по поводу других онкологических заболеваний.
Острый миелобластный лейкоз
Острым миелобластным лейкозом (наиболее часто используемая аббревиатура — ОМЛ) называют злокачественную патологию крови и костного мозга, характеризующуюся бесконтрольным продуцированием незрелых (бластных) миелоцитарных клеток — эритроцитов, гранулоцитов, нейтрофильных лейкоцитов, тромбоцитов. Заболевание диагностируется в случаях, когда в миелограмме обнаруживается свыше 20% незрелых клеток. Его характерной особенностью является быстрое течение: в течение нескольких месяцев незрелые клетки начинают преобладать в составе крови, из-за чего она перестаёт выполнять свои основные функции. Состояние больного резко ухудшается, и при отсутствии лечения прогноз крайне неблагоприятен.
Онкогематологи различают несколько десятков разновидностей острого миелоидного лейкоза, которые группируются по сходным признакам:
В зависимости от формы заболевания врач выбирает тактику лечения, так как продолжительность ремиссий и общий прогноз для разных видов имеют серьёзные отличия.
Симптомы
В начальной стадии острого миелобластного лейкоза симптомы практически отсутствуют, с развитием болезни у пациента развиваются:
Причины и факторы риска
В настоящее время неизвестно, какие именно воздействия побуждают ростки крови к злокачественным мутациям, однако онкологи хорошо изучили факторы, способствующие развитию острого миелобластного лейкоза.
Диагностика
Лабораторные анализы крови и образцов костного мозга являются основными способами диагностики острого миелобластного лейкоза. Это:
Кроме того, пациенту назначают инструментальные исследования внутренних органов для оценки их состояния: УЗИ брюшной полости, ЭКГ, рентген грудной клетки. Впоследствии могут быть назначены другие анализы и исследования.
Лечение
Основным методом лечения острого миелобластного лейкоза является химиотерапия, которая проводится в два этапа:
Интенсивная терапия, применяемая на этапе индукции, позволяет достигнуть ремиссии примерно в 70% клинических случаев. Но заканчивать на этом лечение категорически не следует, так как без программы консолидации у пациентов практически всегда спустя некоторое время наступает рецидив.
Консолидационный этап, в зависимости от состояния больного, включает до пяти курсов химиотерапии. Если риск рецидива достаточно высок, проводится пересадка костного мозга и/или стволовых клеток кроветворения. Лучшими донорами считаются родные братья и сёстры, особенно однояйцевые близнецы.
Кроме того, пациентам часто назначают введение эритроцитарной массы, трансфузионную терапию (переливания крови и её препаратов). Тактика лечения обычно выбирается в соответствии с возрастом пациента. Ремиссия считается достигнутой, если количество миелобластных клеток в костном мозге удаётся снизить до 20% и менее.
Прогнозы
При остром миелоидном лейкозе прогноз жизни зависит от возраста больного — после 60 лет шансы на выздоровление составляют 20-25%, тогда как у более молодых пациентов они достигают 70, а в некоторых клиниках и 90%. Ухудшают перспективы выздоровления генетические заболевания (болезнь Дауна и др.). В случае, если рак крови носит вторичный характер, возможно только паллиативное лечение.
Профилактика
Специфических способов предупреждения острого миелоцитарного лейкоза не существует. Чтобы вовремя начать лечение, необходимо регулярно проходить профилактические обследования, сдавать анализы. Пациентам, завершившим курс лечения, не рекомендуется менять климатическую зону постоянного проживания. Кроме того, им следует отказаться от физиотерапевтических процедур.
Реабилитация
Химиотерапия и особенно пересадка костного мозга создают огромную нагрузку на организм, поэтому пациент должен строго соблюдать все клинические рекомендации при остром миелобластном лейкозе, чтобы достигнуть выздоровления. Они включают процедуры выведения токсинов из крови, строгое соблюдение правил антисептики, меры по повышению иммунитета и восстановлению микрофлоры кишечника. Большое значение придаётся антистрессовой терапии и профилактике депрессии, улучшению качества сна.
Диагностика и лечение острого миелобластного лейкоза в Москве
Клиника Института ядерной медицины проводит диагностические исследования для выявления острого миелобластного лейкоза. В случае подтверждения диагноза вы можете пройти лечение у квалифицированных онкогематологов, врачей высшей категории. Регулярное участие в международных конференциях и семинарах, стажировки в зарубежных клиниках позволяют нашим специалистам овладевать самыми передовыми медицинскими методиками для успешного лечения пациентов.
Вопросы и ответы
Почему при лечении острого миелобластного лейкоза возникают побочные эффекты?
Воздействие химиопрепаратов убивает не только бластные онкоклетки, но и здоровые клетки крови, что приводит к развитию интоксикации организма, проявляющейся в тошноте, слабости, повышенной подверженности инфекциям. Чтобы минимизировать этот эффект, используют различные поддерживающие меры — переливание препаратов крови, лейкаферез и другие процедуры.
Сколько живут с острым миелобластным лейкозом?
Возможность прожить более пяти лет у пациентов с острым миелоидным лейкозом зависит от формы заболевания и возраста. В некоторых случаях выживаемость составляет менее 20%, при других формах болезни превышает 70%. Шансы на выздоровление существуют всегда, а повысить их можно, обратившись в хорошую клинику с современным медицинским оборудованием и опытными онкогематологами.
Когда проводят трансплантацию при остром миелобластном лейкозе?
Оптимальный период для трансплантации — после достижения первой ремиссии. Она показана при высоком риске рецидива, при обнаружении цитогенетических изменений в поражённых клетках, а также при наличии других заболеваний крови. Как правило, в случае успешного восстановления после пересадки рецидивов болезни не происходит.