Миелолейкоза что это такое
Хронический миелолейкоз
Хронический миелолейкоз – это злокачественное миелопролиферативное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка. Может долгое время протекать бессимптомно. Проявляется склонностью к субфебрилитету, ощущением полноты в животе, частыми инфекциями и увеличением селезенки. Наблюдаются анемия и изменение уровня тромбоцитов, сопровождающиеся слабостью, бледностью и повышенной кровоточивостью. На заключительной стадии развиваются лихорадка, лимфоаденопатия и кожная сыпь. Диагноз устанавливается с учетом анамнеза, клинической картины и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10
Общие сведения
Хронический миелолейкоз – онкологическое заболевание, возникающее в результате хромосомной мутации с поражением полипотентных стволовых клеток и последующей неконтролируемой пролиферацией зрелых гранулоцитов. Составляет 15% от общего количества гемобластозов у взрослых и 9% от общего числа лейкозов во всех возрастных группах. Обычно развивается после 30 лет, пик заболеваемости хроническим миелолейкозом приходится на возраст 45-55 лет. Дети до 10 лет страдают исключительно редко.
Хронический миелолейкоз одинаково распространен у женщин и у мужчин. Из-за бессимптомного или малосимптомного течения может становиться случайной находкой при исследовании анализа крови, взятого в связи с другим заболеванием или во время профилактического осмотра. У части больных хронический миелолейкоз выявляется на заключительных стадиях, что ограничивает возможности терапии и ухудшает показатели выживаемости. Лечение проводят специалисты в области онкологии и гематологии.
Причины
Хронический миелолейкоз считается первым заболеванием, при котором достоверно установлена связь между развитием патологии и определенным генетическим нарушением. В 95% случаев подтвержденной причиной хронического миелолейкоза является хромосомная транслокация, известная как «филадельфийская хромосома». Суть транслокации заключается во взаимной замене участков 9 и 22 хромосом. В результате такой замены формируется устойчивая открытая рамка считывания. Образование рамки вызывает ускорение деления клеток и подавляет механизм восстановления ДНК, что увеличивает вероятность возникновения других генетических аномалий.
В числе возможных факторов, способствующих появлению филадельфийской хромосомы у больных хроническим миелолейкозом, называют ионизирующее облучение и контакт с некоторыми химическими соединениями.
Патогенез
Итогом мутации становится усиленная пролиферация полипотентных стволовых клеток. При хроническом миелолейкозе пролиферируют преимущественно зрелые гранулоциты, но аномальный клон включает в себя и другие клетки крови: эритроциты, моноциты, мегакариоциты, реже – В- и Т-лифоциты. Обычные гемопоэтические клетки при этом не исчезают и после подавления аномального клона могут служить основой для нормальной пролиферации кровяных клеток. Для хронического миелолейкоза характерно стадийное течение.
Источником бластов становятся лимфатические узлы, кости, кожа, ЦНС и т. д. В фазе бластного криза состояние больного хроническим миелолейкозом резко ухудшается, развиваются тяжелые осложнения, завершающиеся гибелью больного. У некоторых пациентов фаза акселерации отсутствует, хроническая фаза сразу сменяется бластным кризом.
Симптомы хронического миелолейкоза
Клиническая картина определяется стадией заболевания. Хроническая фаза в среднем продолжается 2-3 года, в некоторых случаях – до 10 лет. Для этой фазы хронического миелолейкоза характерно бессимптомное течение или постепенное появление «легких» симптомов: слабости, некоторого недомогания, снижения трудоспособности и чувства переполнения живота. При объективном осмотре больного хроническим миелолейкозом может обнаруживаться увеличение селезенки. По анализам крови выявляется повышение количества гранулоцитов до 50-200 тыс./мкл при бессимптомном течении заболевания и до 200-1000 тыс./мкл при «легких» признаках.
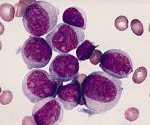
На начальных стадиях хронического миелолейкоза возможно некоторое снижение уровня гемоглобина. В последующем развивается нормохромная нормоцитарная анемия. При исследовании мазка крови пациентов с хроническим миелолейкозом отмечается преобладание молодых форм гранулоцитов: миелоцитов, промиелоцитов, миелобластов. Наблюдаются отклонения от нормального уровня зернистости в ту или иную сторону (обильная или очень скудная). Цитоплазма клеток незрелая, базофильная. Определяется анизоцитоз. При отсутствии лечения хроническая фаза переходит в фазу акселерации.
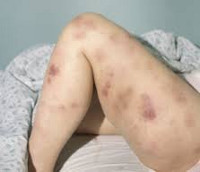
О начале фазы акселерации может свидетельствовать как изменение лабораторных показателей, так и ухудшение состояния пациентов. Возможно нарастание слабости, увеличение печени и прогрессирующее увеличение селезенки. У больных хроническим миелолейкозом выявляются клинические признаки анемии и тромбоцитопении или тробоцитоза: бледность, быстрая утомляемость, головокружения, петехии, кровоизлияния, повышенная кровоточивость. Несмотря на проводимое лечение, в крови пациентов с хроническим миелолейкозом постепенно увеличивается количество лейкоцитов. При этом отмечается возрастание уровня метамиелоцитов и миелоцитов, возможно появление единичных бластных клеток.
Бластный криз сопровождается резким ухудшением состояния больного хроническим миелолейкозом. Возникают новые хромосомные аномалии, моноклоновое новообразование трансформируется в поликлоновое. Отмечается нарастание клеточного атипизма при угнетении нормальных ростков кроветворения. Наблюдаются ярко выраженные анемия и тромбоцитопения. Суммарное количество бластов и промиелоцитов в периферической крови составляет более 30%, в костном мозге – более 50%. Пациенты с хроническим миелолейкозом теряют вес и аппетит. Возникают экстрамедуллярные очаги незрелых клеток (хлоромы). Развиваются кровотечения и тяжелые инфекционные осложнения.
Диагностика
Диагноз устанавливается на основании клинической картины и результатов лабораторных исследований. Первое подозрение на хронический миелолейкоз часто возникает при повышении уровня гранулоцитов в общем анализе крови, назначенном в порядке профилактического осмотра или обследования в связи с другим заболеванием. Для уточнения диагноза могут использоваться данные гистологического исследования материала, полученного при стернальной пункции костного мозга, однако окончательный диагноз «хронический миелолейкоз» выставляется при выявлении филадельфийской хромосомы при помощи ПЦР, флюоресцентной гибридизации или цитогенетического исследования.
Вопрос о возможности постановки диагноза хронический миелолейкоз при отсутствии филадельфийской хромосомы остается дискутабельным. Многие исследователи считают, что подобные случаи могут объясняться комплексными хромосомными нарушениями, из-за которых выявление данной транслокации становится затруднительным. В ряде случаев филадельфийскую хромосому можно обнаружить при использовании ПЦР с обратной транскрипцией. При отрицательных результатах исследования и нетипичном течении заболевания обычно говорят не о хроническом миелолейкозе, а о недифференцированном миелопролиферативном/миелодиспластическом расстройстве.
Лечение хронического миелолейкоза
Тактику лечения определяют в зависимости от фазы заболевания и выраженности клинических проявлений. В хронической фазе при бессимптомном течении и слабо выраженных лабораторных изменениях ограничиваются общеукрепляющими мероприятиями. Больным хроническим миелолейкозом рекомендуют соблюдать режим труда и отдыха, принимать пищу, богатую витаминами и т. д. Лечение может включать:
Прогноз
Прогноз при хроническом миелолейкозе зависит от множества факторов, определяющим из которых является момент начала лечения (в хронической фазе, фазе активации или в период бластного криза). В качестве неблагоприятных прогностических признаков хронического миелолейкоза рассматривают значительное увеличение печени и селезенки (печень выступает из-под края реберной дуги на 6 и более см, селезенка – на 15 и более см), лейкоцитоз свыше 100×10 9 /л, тромбоцитопению менее 150×10 9 /л, тромбоцитоз более 500х10 9 /л, повышение уровня бластных клеток в периферической крови до 1% и более, повышение суммарного уровня промиелоцитов и бластных клеток в периферической крови до 30% и более.
Вероятность неблагоприятного исхода при хроническом миелолейкозе возрастает по мере увеличения количества признаков. Причиной гибели становятся инфекционные осложнения или тяжелые геморрагии. Средняя продолжительность жизни пациентов с хроническим миелолейкозом составляет 2,5 года, однако при своевременном начале терапии и благоприятном течении заболевания этот показатель может увеличиваться до нескольких десятков лет.
Острый миелоидный лейкоз
Что такое острый миелоидный лейкоз?
Острый миелоидный лейкоз – это поражение костного мозга, из-за которого измененные белые кровяные клетки размножаются слишком быстро.
Заболевание, которое обыватели называют «раком крови», может возникнуть у людей любого пола и возраста, но чаще всего встречается у мужчин от 65 лет и старше.
Как развивается острый миелоидный лейкоз?
Острый миелоидный лейкоз (ОМЛ) начинается в костном мозге – мягкой внутренней части костей, состоящей из жировых и кроветворных клеток, включая стволовые, которые становятся:
Лейкоз начинается с изменения ДНК – содержащейся в каждой клетке нашего тела молекулы, в которой зашифрована вся информация об организме. Такие «поломки» возникают из-за воздействия химикатов, радиации, различных заболеваний или случайных сбоев, и приводят к производству слишком большого количества бластов – быстро растущих незрелых, то есть не работающих белых кровяных телец.
Нормальные бласты со временем превращаются в полезные клетки крови, а при лейкозе они становятся опухолевыми, активно размножаются и постепенно вытесняют нормальные, что приводит к ряду тяжелых последствий. У здорового человека их не много – они составляют 5% или меньше от костного мозга, а в крови не обнаруживаются. Для того, чтобы врач поставил диагноз «острый миелоидный лейкоз», их должно быть не менее 20%.
Такие клетки не просто циркулируют по организму – они распространяются в различные органы, включая лимфатические узлы, печень, селезенку, яички, головной и спинной мозг, скапливаются и повреждают их.
Врачи выделяют две основных формы миелоидного лейкоза:
— острый – развивающийся внезапно и быстро;
— и хронический – при данном типе заболевания бласты вытесняют здоровые клетки крови гораздо медленнее, чем при остром.
Причины возникновения острого миелоидного лейкоза
Точные причины развития данного заболевания врачам до сих пор не известны – они знают лишь о факторах, которые могут спровоцировать его возникновение:
Симптомы острого миелоидного лейкоза
Признаки лейкоза проявляются примерно одинаково как у детей, так и у взрослых, и могут выглядеть следующим образом:
Диагностика острого миелоидного лейкоза
Тщательная диагностика крайне важна, поскольку в ее ходе доктор может не только установить сам факт наличия заболевания, но и понять, какое именно лечение подходит конкретному пациенту.
Диагностика начинается с обычного медицинского осмотра и поисков синяков, кровоподтеков или возможных признаков инфекции, после чего назначается целый ряд процедур:
Лечение острого миелоидного лейкоза
Борьба с лейкозом – задача сложная и требует участия сразу нескольких врачей – не только гематолога, но и онколога, химиотерапевта и других.
В Онкоцентре «Лапино-2» есть целая команда отличных специалистов, которые не просто быстро выявят заболевание, но и проведут любые необходимые лечебные процедуры.
Вам не придется задаваться вопросом «что делать?» и «к кому обращаться?» – у нас вы получите четкий план действий, следуя которому пройдете терапию без очередей, задержек и нервов.
При лечении миелоидного лейкоза врачи применяют несколько методов.
Статус острого миелоидного лейкоза после лечения
Долгосрочные прогнозы каждого пациента в немалой степени зависят от того, насколько хорошо и быстро заболевание поддается лечению: чем лучше первая реакция организма, тем оптимистичнее перспективы.
Активное заболевание: после лечения в костном мозге есть больше 5% бластов, либо после проведенной терапии произошел рецидив – возвращение болезни.
Прогнозы и выживаемость при остром миелоидном лейкозе
Перспективы каждого человека индивидуальны и зависят от большого количества факторов.
Для каждого вида заболевания есть своя статистика.
После индукции – первого же курса химиотерапии выходят в ремиссию, то есть нормализуют количество клеток крови, около 90% обладателей острого промиелоцитарного лейкоза. Для всех остальных типов эта цифра составляет примерно 67%.
Кроме того, многие люди 60+ не реагируют на лечение, и всего лишь у половины из них после индукции наступает ремиссия.
У детей статистика своя: от 85% до 90% из них выходят в ремиссию после индукции, а их пятилетняя выживаемость составляет от 60% до 70%.
Острый миелоидный лейкоз
Острый миелоидный лейкоз – злокачественное заболевание системы крови, сопровождающееся неконтролируемым размножением измененных лейкоцитов, снижением количества эритроцитов, тромбоцитов и нормальных лейкоцитов. Проявляется повышенной склонностью к развитию инфекций, лихорадкой, быстрой утомляемостью, потерей веса, анемией, кровоточивостью, образованием петехий и гематом, болями в костях и суставах. Иногда выявляются изменения кожи и припухлость десен. Диагноз устанавливается на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, трансплантация костного мозга.
МКБ-10
Общие сведения
Острый миелоидный лейкоз (ОМЛ) – злокачественное поражение миелоидного ростка крови. Неконтролируемая пролиферация лейкозных клеток в костном мозге влечет за собой подавление остальных ростков крови. В результате количество нормальных клеток в периферической крови уменьшается, возникают анемия и тромбоцитопения. Острый миелоидный лейкоз является самым распространенным острым лейкозом у взрослых. Вероятность развития болезни резко увеличивается после 50 лет. Средний возраст пациентов составляет 63 года. Мужчины и женщины молодого и среднего возраста страдают одинаково часто. В старшей возрастной группе наблюдается преобладание лиц мужского пола. Прогноз зависит от вида острого миелоидного лейкоза, пятилетняя выживаемость колеблется от 15 до 70%. Лечение осуществляют специалисты в области онкологии и гематологии.
Причины острого миелоидного лейкоза
Непосредственной причиной развития ОМЛ являются различные хромосомные нарушения. В числе факторов риска, способствующих развитию таких нарушений, указывают неблагоприятную наследственность, ионизирующее излучение, контакт с некоторыми токсическими веществами, прием ряда лекарственных препаратов, курение и болезни крови. Вероятность возникновения острого миелоидного лейкоза увеличивается при синдроме Блума (низкий рост, высокий голос, характерные черты лица и разнообразные кожные проявления, в том числе гипо- или гиперпигментация, кожная сыпь, ихтиоз, гипертрихоз) и анемии Фанкони (низкий рост, дефекты пигментации, неврологические расстройства, аномалии скелета, сердца, почек и половых органов).
Острый миелоидный лейкоз достаточно часто развивается у больных с синдромом Дауна. Прослеживается также наследственная предрасположенность при отсутствии генетических заболеваний. При ОМЛ у близких родственников вероятность возникновения болезни повышается в 5 раз по сравнению со средними показателями по популяции. Самый высокий уровень корреляции выявляется у однояйцевых близнецов. Если острый миелоидный лейкоз диагностируется у одного близнеца, риск у второго составляет 25%. Одним из важнейших факторов, провоцирующих ОМЛ, являются заболевания крови. Хронический миелоидный лейкоз в 80% случаев трансформируется в острую форму болезни. Кроме того, ОМЛ нередко становится исходом миелодиспластического синдрома.
Ионизирующее излучение вызывает острые миелоидные лейкозы при превышении дозы 1 Гр. Заболеваемость увеличивается пропорционально дозе облучения. На практике имеет значение пребывание в зонах атомных взрывов и аварий на атомных электростанциях, работа с источниками излучения без соответствующих защитных средств и радиотерапия, применяемая при лечении некоторых онкологических заболеваний. Причиной развития острого миелоидного лейкоза при контакте с токсическими веществами является аплазия костного мозга в результате мутаций и поражения стволовых клеток. Доказано негативное влияние толуола и бензола. Обычно ОМЛ и другие острые лейкозы диагностируются спустя 1-5 лет после контакта с мутагеном.
В числе лекарственных средств, способных провоцировать острые миелоидные лейкозы, специалисты называют некоторые препараты для химиотерапии, в том числе ингибиторы ДНК-топоизомеразы II (тенипозид, этопозид, доксорубицин и другие антрациклины) и алкилирующие средства (тиофосфамид, эмбихин, циклофосфамид, хлорамбуцил, кармустин, бусульфан). ОМЛ также может возникать после приема хлорамфеникола, фенилбутазона и препаратов мышьяка. Доля лекарственных острых миелоидных лейкозов составляет 10-20% от общего количества случаев заболевания. Курение не только повышает вероятность развития ОМЛ, но и ухудшает прогноз. Средняя пятилетняя выживаемость и продолжительность полных ремиссий у курильщиков ниже, чем у некурящих.
Классификация острого миелоидного лейкоза
Классификация острого миелоидного лейкоза по версии ВОЗ очень сложна и включает в себя несколько десятков разновидностей заболевания, разделенных на следующие группы:
Тактика лечения, прогноз и продолжительность ремиссий при разных видах ОМЛ могут существенно различаться.
Симптомы острого миелоидного лейкоза
Клиническая картина включает в себя токсический, геморрагический, анемический синдромы и синдром инфекционных осложнений. На ранних стадиях проявления острого миелоидного лейкоза неспецифичны. Отмечается повышение температуры без признаков катарального воспаления, слабость, утомляемость, потеря веса и аппетита. При анемии присоединяются головокружения, обморочные состояния и бледность кожных покровов. При тромбоцитопении наблюдаются повышенная кровоточивость и петехиальные кровоизлияния. Возможно образование гематом при незначительных ушибах. При лейкопении возникают инфекционные осложнения: частые нагноения ран и царапин, упорные повторные воспаления носоглотки и т. д.
В отличие от острого лимфобластного лейкоза при остром миелоидном лейкозе отсутствуют выраженные изменения со стороны периферических лимфатических узлов. Лимфоузлы небольшие, подвижные, безболезненные. Иногда выявляется увеличение лимфатических узлов в шейно-надключичной области. Печень и селезенка в пределах нормы или незначительно увеличены. Характерны признаки поражения костно-суставного аппарата. Многие больные острым миелоидным лейкозом предъявляют жалобы на боли различной степени интенсивности в области позвоночника и нижних конечностей. Возможны ограничения движений и изменения походки.
В числе экстрамедуллярных проявлений острого миелоидного лейкоза – гингивит и экзофтальм. В отдельных случаях наблюдаются припухлость десен и увеличение небных миндалин в результате инфильтрации лейкозными клетками. При миелоидной саркоме (составляет около 10% от общего количества случаев острого миелоидного лейкоза) на коже пациентов появляются зеленоватые, реже – розовые, серые, белые или коричневые опухолевидные образования (хлоромы, кожные лейкемиды). Иногда при поражениях кожи обнаруживается паранеопластический синдром (синдром Свита), который проявляется воспалением кожных покровов вокруг лейкемидов.
В развитии острого миелоидного лейкоза выделяют пять периодов: начальный или доклинический, разгара, ремиссии, рецидива и терминальный. В начальном периоде острый миелоидный лейкоз протекает бессимптомно или проявляется неспецифической симптоматикой. В периоде разгара токсический синдром становится более выраженным, выявляются анемический, геморрагический и инфекционный синдромы. В период ремиссии проявления острого миелоидного лейкоза исчезают. Рецидивы протекают аналогично периоду разгара. Терминальный период сопровождается прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика и лечение острого миелоидного лейкоза
Решающую роль в процессе диагностики играют лабораторные анализы. Используют анализ периферической крови, миелограмму, микроскопические и цитогенетические исследования. Для получения образца тканей выполняют аспирационную биопсию костного мозга (стернальную пункцию). В анализе периферической крови больного острым миелоидным лейкозом обнаруживается снижение количества эритроцитов и тромбоцитов. Количество лейкоцитов может быть как повышенным, так и (реже) пониженным. В мазках могут выявляться бласты. Основанием для постановки диагноза «острый миелоидный лейкоз» становится обнаружение более 20% бластных клеток в крови либо в костном мозге.
Основой лечения острого миелоидного лейкоза является химиотерапия. Выделяют два этапа лечения: индукцию и консолидацию (постремиссионную терапию). На этапе индукции выполняют лечебные мероприятия, направленные на уменьшение количества лейкозных клеток и достижение состояния ремиссии. На этапе консолидации устраняют остаточные явления болезни и предотвращают рецидивы. Лечебную тактику определяют в зависимости от вида острого миелоидного лейкоза, общего состояния больного и некоторых других факторов.
Наиболее популярная схема индукционного лечения – «7+3», предусматривающая непрерывное внутривенное введение цитарабина в течение 7 дней в сочетании с одновременным быстрым периодическим введением антрациклинового антибиотика в течение первых 3 дней. Наряду с этой схемой в процессе лечения острого миелоидного лейкоза могут применяться другие лечебные программы. При наличии тяжелых соматических заболеваний и высоком риске развития инфекционных осложнений в результате подавления миелоидного ростка (обычно – у больных старческого возраста) используют менее интенсивную паллиативную терапию.
Программы индукции позволяет добиться ремиссии у 50-70% пациентов с острым миелоидным лейкозом. Однако без дальнейшей консолидации у большинства больных наступает рецидив, поэтому второй этап лечения рассматривается, как обязательная часть терапии. План консолидационного лечения острого миелоидного лейкоза составляется индивидуально и включает в себя 3-5 курсов химиотерапии. При высоком риске рецидивирования и уже развившихся рецидивах показана трансплантация костного мозга. Другие методы лечения рецидивных ОМЛ пока находятся в стадии клинических испытаний.
Прогноз острого миелоидного лейкоза
Прогноз определятся разновидностью острого миелоидного лейкоза, возрастом больного, наличием или отсутствием миелодиспластического синдрома в анамнезе. Средняя пятилетняя выживаемость при разных формах ОМЛ колеблется от 15 до 70%, вероятность развития рецидивов – от 33 до 78%. У пожилых людей прогноз хуже, чем у молодых, что объясняется наличием сопутствующих соматических заболеваний, являющихся противопоказанием для проведения интенсивной химиотерапии. При миелодиспластическом синдроме прогноз хуже, чем при первичном остром миелоидном лейкозе и ОМЛ, возникшем на фоне фармакотерапии по поводу других онкологических заболеваний.
Хронический миелолейкоз
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «3» октября 2019 года
Протокол №74
Хронический миелолейкоз (ХМЛ) – клональное миелопролиферативное заболевание, развивающийся в результате злокачественной трансформации в ранних гемопоэтических предшественниках. Цитогенетическим маркером ХМЛ является приобретенная хромосомная транслокация t(9;22), которая получила название филадельфийской хромосомы (Ph+). Выявление Ph`-хромосомы происходит в результате обмена генетическим материалом между хромосомами 9 и 22 t (9;22). В результате переноса генетического материала с 9 на 22 хромосому на ней образуется слитный ген BCR—ABL1.
Хронический миелоидный лейкоз (ХМЛ) составляет 15% от общего числа лейкозов у взрослых. Средний возраст начала заболевания составляет 67 лет; однако ХМЛ встречается во всех возрастных группах (статистика SEER).
Код(ы) по МКБ-10:
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2018 г.)
Сокращения, используемые в протоколе:
| АЛТ | – | аланинаминотрансфераза |
| АСТ | – | аспартатаминотрансфераза |
| аллоТКМ | – | аллогенная трансплантация костного мозга |
| БФ | – | бластная фаза |
| БМО | – | большой молекулярный ответ |
| ГСК | – | гемопоэтические стволовые клетки |
| ГГТП | – | гаммаглютамилтранспептидаза |
| Ед | – | единица измерения |
| ИТК | – | ингибиторы тирозинкиназ |
| ИФА | – | иммунноферментный анализ |
| ИФТ | – | иммуннофенотипирование |
| КП | – | клинический протокол |
| КТ | – | компьютерная томография |
| ЛДГ | – | лактатдегидрогеназа |
| Мл | – | миллилитр |
| МЕ | – | международная единица |
| Мг | – | миллиграмм |
| МКБ | – | международная классификация болезней |
| ОАК | – | общий анализ крови |
| ОБП | – | органы брюшной полости |
| ПХТ | – | полихимиотерапия |
| ПЦР | – | полимеразная цепная реакция |
| ПГО | – | полный гематологический ответ |
| ПМО | – | полный молекулярный ответ |
| РКИ | – | рандомизированное клиническое исследование |
| СЦИ | – | стандартное цитогенетическое исследование |
| ТКМ | – | трансплантация костного мозга |
| УД | – | уровень доказательности |
| УЗИ | – | ультразвуковое исследование |
| ЭКГ | – | электрокардиограмма |
| ФА | – | фаза акселерации |
| ХФ | – | хроническая фаза |
| ХМЛ | – | хронический миелолейкоз |
| ЦО | – | цитогенетический ответ |
| BCR/ABL | – | белок с повышенной тирозинкиназногй активностью, продукт гена BCR/ABL |
| EBMT | – | European Group for blood and Marrow |
| ELN | – | Европейская организация по лечению лейкозов |
| ESMO | – | Европейское общество медицинской онкологии |
| NCCN | – | Национальная онкологическая сеть США |
| Ph+ | – | клетки, содержащие филадельфийскую хромосому |
| FISH | – | флуоресцентная гибридизация |
Пользователи протокола: врачи общей практики, терапевты, онкологи, гематологи.
Категория пациентов: взрослые, беременные.
Шкала уровня доказательности [1]:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GCP | Наилучшая клиническая практика. |
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Классификация 7
В течении ХМЛ выделяют 3 фазы: хроническую, переходную (фазу акселерации) и терминальную фазу (бластной трансформации или бластный криз). 2 Критерии фаз акселерации и бластного криза представлены в таблице.
Фазы ХМЛ по классификации ELN [6]:
| Фаза ХМЛ | Классификация ELN |
| Хроническая | Отсутствие признаков фазы акселерации и бластного криза |
| Акселерации | 15-29% бластных клеток в периферической крови и/или костном мозге; сумма бластов и промиелоцитов ≥30% (при этом бластов |
| Бластный криз | Наличие в периферической крови или костном мозге ≥30% бластных клеток появление экстрамедулярных инфильтратов бластных клеток |
Стратификация пациентов по группам риска ELN 2017.
Группа риска ХМЛ – понятие, применимое только для хронической фазы (ХФ) ХМЛ. Группа риска с этой фазе оценивается только на момент диагностики заболевания, до начала терапии. Она рассчитывается на основании прогностически значимых характеристик: низкий, промежуточный, высокий риск (УД – А).
Таблица 3.
| Шкала | Формула расчета | Группа риска | Конечная точка |
| Eutos | 7 × число базофилов (%) + 4 ×размеры селезенки* (см) | Низкий ( | Полный цитогенетический ответ |
| Euro | 0,6666 × возраст (0-при 50 лет/) +0,0420 × размеры селезенки- (см) +0,0584 × бластных клеток (%) +0,0413 ×число эозинофилов (%) +0,2039 × чило базофилов (0- при 3) +1,0956 × число тромбоцитов (0 – при 1500×109/л) × 1000 | Низкий (≤ 87) Промежуточный (781-1480) Высокий (≥1481) | Выживаемость |
| ELTS | 0,0025 × (возраст/10)3 +0,0615 × размеры селезенки* (см) +0,1052 × число бластных клеток (%) + 0,4104 × число тромбоцитов × 109/л /1000-0,5 | Низкий (≤ 1,5680) Промежуточный(>1,5680, но ≤ 2,2185 ) Высокий (>2,218) | ХМЛ-специфическая выживаемость |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ 11
Диагностические критерии
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований:
Диагноз хронического миелолейкоза в классических случаях не представляет затруднений. Трудности обычно возникают в начальном периоде заболевания, когда еще нет четких лейкемических изменений со стороны крови и выраженных признаков системной метаплазии в органах.
Основным патогномоничным признаком заболевания является обнаружение при цитогенетическом исследовании филадельфийской хромосомы (t(9;22)) и химерного гена BCR-ABL1.
Таблица 6.
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ [13-15,21,22]
Принципы выбора ИТК
При использовании препаратов ИТК улучшились показатели общей выживаемости, достижение хорошего качества жизни, восстановления нормального кроветворения, путем подавления лейкозного клона.
Эффективность иматиниба доказана положительным опытом применения в клинических исследованиях (IRIS, CML IV). Однако, резистентные к лечению иматинибом и подобными препаратами больные ХМЛ нуждаются в раннем переводе на другую терапию.
Необходимо отметить, что абсолютных противопоказаний к использованию ИТК у пациентов с ХМЛ нет. При выборе конкретного препарата в первую и последующие линии лечения необходимо учитывать фазу ХМЛ, сопутствующие заболевания и риск развития побочных эффектов в процессе терапии, а также мутационный спектр.
Выбор терапии ИТК первой линии у пациента должен основываться на оценке риска, профиле токсичности ИТК, возрасте пациента, способности переносить терапию и наличии сопутствующих заболеваний.
Терапия ИТК первой и второй линии должна быть выбрана с учетом наибольшей эффективности и наименьшего риска побочных явлений. Аллогенная трансплантация гемопоэтических стволовых клеток должна быть обязательно рассмотрена для ХМЛ ХФ с высокой группой риска прогрессии, у больных с неудачей терапии первой линии, а также в продвинутых фазах ХМЛ, но в гематологической ремиссии. Ранняя оценка ответа на лечение, предупреждение развития резистентности и быстрое переключение на максимально эффективную терапию при отсутствии оптимального ответа должны быть основаны принципами современной терапии ХМЛ (УД – А).
Нилотиниб (150 мг, 200мг, таблетка/капсула).
Противоопухолевый препарат, ингибитор протеин-тирозинкиназы. Нилотиниб мощно ингибирует тирозинкиназную активность BCR-ABL1 онкопротеина клеточных линий и первично положительных по филадельфийской хромосоме (Ph-положительных) лейкозных клеток. Оказывает выраженное ингибирующее влияние на BCR-ABL1 онкопротеин дикого типа, а также демонстрирует активность в отношении 32 и 33 основных иматинибрезистентных мутантных форм BCR-ABL1-тирозинкиназы, за исключением Т3151 мутации.
В первой линии терапии показан больным ХФ ХМЛ в начальной дозе 600 мг/сут и в ФА ХМЛ в дозе 800 мг/сут. Во второй линии терапии назначается в дозе 800 мг/сут в ХФ и ФА. Независимо от фазы ХМЛ принимается 2 раза в сутки в равных дозах с интервалом 12 часов. Прием рекомендуется осуществлять натощак или не ранее чем через 2 часа после еды, после приема нилотиниба пищу следует принимать не ранее чем через 1 час. Капсулы запивать достаточным количеством воды. При развитии токсических проявлений доза может быть снижена до 400 мг 1 раз в сутки. При недостаточной эффективности препарата возможно повышение дозы до 800 мг в сутки больным в ХФ.
С осторожностью применять при панкреатите в анамнезе, сахарном диабете, атеросклерозе сосудов, окклюзионной болезни периферических артерий.
Дазатиниб (20 мг, 50 мг, 70 мг, 100 мг, таблетка/капсула).
Противоопухолевое средство, многоцелевой препарат, ингибитор протеинтирозинкиназ: BCR-ABL1, семейство SRC (SRC, LCK, YES, FYN), c-KIT, EPHA2 и PDGFR бета. Связывается со многими формами ABL киназы, активен в лейкозных клеточных линиях, как чувствительных, так и резистентных к иматинибу. Дазатиниб подавляет активность не только ABL-тирозинкиназы, c-Kit- и PDGFR-киназ, но и активность около 30 других различных киназ: семейства SRC (SRC, LCK, YES, FIN), семейства TYR и SER/THR (GAK, MAPK14, MAP3K, MAP3K4), DDR1, EPHA, ZAK и др., может связываться как с активной, так и неактивной конформацией киназного домена ABL. Активен в отношении мутантных форм BCR-ABL-тирозинкиназы, за исключением T315I. Рекомендуемая доза дазатиниба для ХФ составляет 100 мг/сут, а для ФА и БК – 140 мг/сут. При явлениях токсичности доза дазатиниба больным в ХФ может быть снижена до 80 мг 1 раз в сутки, больным в ФА и БК – до 100 мг 1 раз в сутки, при повторных эпизодах токсичности – до 80 мг/сут. При недостаточной эффективности препарата возможно повышение дозы до 140 мг 1 раз в сутки больным в ХФ. С учетом фармакокинетики Дазатиниб характеризуется приемом, вне зависимости от приема пищи. Показана возможность Дазатиниба проникать через гематоэнцефалический барьер.
С осторожностью применять при хронических сердечно-сосудистых заболеваниях, хронических обструктивных заболеваниях легких, бронхиальной астме, пневмонии, травма грудной клетки, хронических заболеваниях ЖКТ с высоким риском развития кровотечений.
Рекомендации по лечению ХМЛ.
| Фаза акселерации | ||
| 2-я другая линия | Отсутствие ответа | Нилотиниб или Дазатиниб Обсудить аллоТКМ |
| Бластный криз | ||
| Лимфоидный вариант | Терапия по программе лечения Ph+ ОЛЛ Дазатиниб 140 мг/сут как этап подготовки к алло-ТГСК Алло-ТГСК (если достигнута 2-я хроническая фаза) с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа). Паллиативная терапия | |
| Миелоидный вариант | Терапия по программе лечения ОМЛ Дазатиниб 140 мг/сут как этап подготовки к алло-ТГСК с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа). Паллиативная терапия | |
4Пациентам с высоким риском в хронической фазе ХМЛ возможно использование нилотиниба и дазатиниба в первой линии терапии (при сумме баллов >1480 по EURO, >87 по EUTOS.
Терапия при неудаче лечения первой и второй линии:
Возможности терапии при неудаче первой и второй линии лечения, а также при прогрессии ХМЛ до продвинутых фаз ограничены. При получении клинико-гематологической ремиссии, достижении редукции опухолевого клона (клинико-гематологического, цитогенетического ответа) при третьей линии терапии вопрос о выполнении аллоТКМ необходимо решать незамедлительно, так как этот метод является единственным, способным в этой ситуации дать шанс на длительную безрецидивную выживаемость (УД – А).
| Мутация | Рекомендации по лечению |
| Y253H, E255K / V или F359V/C/I | Дазатиниб |
| F317L / V / I / C, T315A или V299L | Нилотиниб |
| E255K / V, F317L / V / I / C, F359V / C / I, T315A или Y253H | Бозутиниб |
| T315I | Понатиниб, Омацетаксин, аллогенная ТКМ или клиническое испытание |
Для оценки эффективности терапии необходимо проводить своевременный мониторинг гематологических, цитогенетических и молекулярно-генетических показателей (таб.5)
При выявлении мутации T315I показано прекращение терапии ИТК, рекомендуется проведение HLA- типирования и выполнения аллоТКМ при наличии донора. При невозможности ее проведения в качестве альтернативного лечения назначается гидроксимочевина, курсы малых доз цитарабина, курсы полихимиотерапии, интерферонотерапия при возможности начинать следует с понатиниба или омацетаксина. Препаратом, при применении которого показана возможность получения цитогенетических и молекулярных ремиссий у пациентов с ХМЛ с мутацией T315I, является недавно одобренный к применению в США понатиниб [21], однако в настоящее время препарат не доступен в Казахстане (нет регистрации).
В зависимости от степени подавления опухолевого клона выделяют различные варианты ответа (уровень доказательности А) [20]. Эффект терапии первой линии может быть расценен как оптимальный ответ, предупреждение и неудача (УД – А).
Варианты ответа на терапию при хроническом миелолейкозе.
Таблица 9.
| Вариант ответа | Определение | |
| Гематологический | ||
| Полный | Лейкоциты | |
| Цитогенетический | ||
| Полный* Частичный** Малый Минимальный Отсутствие ответа | Ph-хромосома в метафазах не определяется Ph-хромосома в 1–35 % метафаз Ph-хромосома в 36–65 % метафаз Ph-хромосома в 66–95 % метафаз Ph-хромосома в > 95 % метафаз | |
| Молекулярный*** | ||
| Большой (МО3.0) | Соотношение BCR-ABL1/ABL ≤ 0,1 и > 0,01 % по шкале IS | |
| Глубокий | МО4.0 | |
| МО 4 | МО 4.5 | МО 5 |
| Минимальная сумма эталонных транскриптов гена независимо от того, обнаружен ли BCR-ABL1 или нет 1 |
уровень BCR-ABL1 для положительных образцов 2
1Количество транскриптов референсного гена в том же объеме кДНК, который тестируется на BCR / ABL1. Минимальное количество в каждом отдельном экземпляре должно быть 10 000 ABL1 или 24000 GUSB
2Минимальные референсные генные копии в строке выше выполнены
Рекомендации по оценке ответа в хронической фазе ХМЛ в зависимости от длительности и характера ответа на предшествующую терапию ИТК в первой линии [21].
Таблица 11.
терапии
аномалии в клетках Ph+
Ph+ ≤ 35 % (ЧЦО)
BCR-ABL1
Факторы риска неудачи:
Ph+ > 65 % (менее МЦО) и BCR-ABL1 ≥ 10 %*
BCR-ABL1
BCR-ABL1 1–10 %
BCR-ABL1 ≥ 10 %
BCR-ABL1 ≤ 0,1 % (БМО)
BCR-ABL1 0,1–1,0 %
BCR-ABL1 ≥ 1 %
Мутации BCR-ABL1
ДХА в клетках Ph+
ДХА — дополнительные хромосомные аномалии; МЦО — малый цитогенетический ответ; ЧЦО — частичный цитогенетический ответ.
* При выполнении только молекулярного анализа рекомендуется повторное исследование в течение 1–2 мес. для подтверждения результата.
** Подтвержденная потеря БМО (уровень BCR-ABL1 > 0,1 % в двух и более последовательных анализах, в одном из которых BCR-ABL1 > 1 %).
Эффект терапии первой линии может быть расценены как оптимальный, неудача терапии, предупреждение (УД – А) [20].
Оптимальный ответ свидетельствует о благоприятном прогнозе, ожидаемой высокой безрецидивной выживаемости и возможности достичь более глубокого ответа вплоть до выздоровления. При оптимальном ответе продолжают лечение тем же препаратом ИТК.
Предупреждение указывает на необходимость тщательного мониторинга и готовность к смене терапии с учетом биологических признаков более агрессивного течения с анализом результатов мутационного статуса.
Неудача терапии служит показанием к смене препарата на следующую линию препарата ИТК. Потеря достигнутой ранее ремиссии, новые мутации, появление ДХА в Ph-позитивных клетках при терапии ИТК также свидетельствуют о неудаче лечения. При констатации неудачи терапии необходимо подтверждение приверженности пациента к ней и возможного лекарственного взаимодействия, целесообразен анализ на мутации BCR-ABL1.
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Таблица 12
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | Уровень доказательности |
| Антинеопластические и иммуносупрессивные лекарственные средства | Иматиниб | Внутрь | A |
| Нилотиниб | Внутрь | A | |
| Дазатиниб | Внутрь | A | |
| Гидроксимочевина | Внутрь | В |
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | Уровень доказательности |
| Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов | Аллопуринол | Внутрь | — |
| Антибактериальные средства | Офлоксацин | Внутривенное введение | С |
| Метронидазол | Внутривенное введение Внутрь | А | |
| Левофлоксацин | Внутривенное введение Внутрь | — | |
| Ципрофлоксацин | Внутривенное введение Внутрь | С | |
| Сульфаметоксазол /триметоприм | Внутривенное введение Внутрь | А | |
| Противогрибковые лекарственные средства | Вориконазол | Внутривенное введение Внутрь | В |
| Итраконазол | Внутрь | В | |
| Флуконазол | Внутривенное введение Внутрь | С | |
| Позаконазол | Внутрь | В | |
| Противовирусные лекарственные средства | Ацикловир | Внутривенное введение Внутрь | А |
| Лекарственные средства, влияющие на свертывающую систему крови | Надропарин | Подкожное введение | С |
| Эноксапарин | Подкожное введение | С | |
| Другие лекарственные средства | Бупивакаин, Лидокаин, Прокаин | Местное применение | D |
| Омепразол | Внутривенное введение Внутрь | А | |
| Фамотидин | Внутривенное введение | А | |
| Амлодипин | Внутрь | В | |
| Каптоприл | Внутрь | В | |
| Лизиноприл | Внутрь | В | |
| Лактулоза | Внутрь | В | |
| Спиронолактон | Внутрь | В | |
| Повидон – йод | Наружное применение | — | |
| Тобрамицин | Внутривенное введение | — | |
| Торасемид | Внутрь | — | |
| Фолиевая кислота | Внутрь | — | |
| Фуросемид | Внутривенное введение Внутрь | А | |
| Хлоргексидин | Наружное применение | — |
Хирургическое вмешательство: нет.
Дальнейшее введение: перспективой лечения ХМЛ представляется переход от пожизненного приема ИТК к возможности прекращения терапии под динамическим наблюдением. В связи с этим одной из задач терапии ХМЛ можно считать получение глубоких молекулярных ответов (М04 и М04.5). Такая стратегия вполне обоснована, учитывая ожидаемую долгую продолжительность жизни больных ХМЛ и многолетний прием лекарственных средств.
Индикаторы эффективности лечения: см. таб. 8,9.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ [21,22,24,25]
Рекомендации по лечению ХМЛ
| Фаза акселерации | ||
| 2-я другая линия | Отсутствие ответа | Нилотиниб или Дазатиниб Обсудить аллоТКМ |
| Бластный криз | ||
| Лимфоидный вариант | Терапия по программе лечения Ph+ ОЛЛ Дазатиниб 140 мг/сут как этап подготовки к алло-ТГСК Алло-ТГСК (если достигнута 2-я хроническая фаза) с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа). Паллиативная терапия. | |
| Миелоидный вариант | Терапия по программе лечения ОМЛ Дазатиниб 140 мг/сут как этап подготовки к алло-ТГСК с последующим продолжением ИТК (выбор ИТК в зависимости от предшествующего лечения, переносимости, мутационного анализа). Паллиативная терапия. | |
| Мутация | Рекомендации по лечению |
| Y253H, E255K / V или F359V/C/I | Дазатиниб |
| F317L / V / I / C, T315A или V299L | Нилотиниб |
| E255K / V, F317L / V / I / C, F359V / C / I, T315A или Y253H | Бозутиниб |
| T315I | Понатиниб, Омацетаксин, аллогенная ТКМ или клиническое испытание |
Для оценки эффективности терапии необходимо проводить своевременный мониторинг гематологических, цитогенетических и молекулярно-генетических показателей (таб.5)
При выявлении мутации T315I показано прекращение терапии ИТК, рекомендуется проведение HLA- типирования и выполнения аллоТКМ при наличии донора. При невозможности ее проведения в качестве альтернативного лечения назначается гидроксимочевина, курсы малых доз цитарабина, курсы полихимиотерапии, интерферонотерапия при возможности начинать следует с понатиниба или омацетаксина [21].
В зависимости от степени подавления опухолевого клона выделяют различные варианты ответа (УД – А) [22]. Эффект терапии первой линии может быть расценен как оптимальный ответ, предупреждение и неудача (УД – А).
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Таблица 12.
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | Уровень доказательности |
| Антинеопластические и иммуносупрессивные лекарственные средства | Иматиниб | Внутрь | A |
| Нилотиниб | Внутрь | A | |
| Дазатиниб | Внутрь | A | |
| Гидроксимочевина | Внутрь | В |
| Фармакотерапевтическая группа | МНН ЛС | Способ применения | Уровень доказательности |
| Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов | Аллопуринол | Внутрь | — |
| Антибактериальные средства | Офлоксацин | Внутривенное введение | С |
| Метронидазол | Внутривенное введение Внутрь | А | |
| Левофлоксацин | Внутривенное введение Внутрь | — | |
| Ципрофлоксацин | Внутривенное введение Внутрь | С | |
| Сульфаметоксазол /триметоприм | Внутривенное введение Внутрь | А | |
| Противогрибковые лекарственные средства | Вориконазол | Внутривенное введение Внутрь | В |
| Итраконазол | Внутрь | В | |
| Флуконазол | Внутривенное введение Внутрь | С | |
| Позаконазол | Внутрь | В | |
| Противовирусные лекарственные средства | Ацикловир | Внутривенное введение Внутрь | А |
| Лекарственные средства, влияющие на свертывающую систему крови | Надропарин | Подкожное введение | С |
| Эноксапарин | Подкожное введение | С | |
| Другие лекарственные средства | Бупивакаин, Лидокаин, Прокаин | Местное применение | D |
| Омепразол | Внутривенное введение Внутрь | А | |
| Фамотидин | Внутривенное введение | А | |
| Амлодипин | Внутрь | В | |
| Каптоприл | Внутрь | В | |
| Лизиноприл | Внутрь | В | |
| Лактулоза | Внутрь | В | |
| Спиронолактон | Внутрь | В | |
| Повидон – йод | Наружное применение | — | |
| Тобрамицин | Внутривенное введение | — | |
| Торасемид | Внутрь | — | |
| Фолиевая кислота | Внутрь | — | |
| Фуросемид | Внутривенное введение Внутрь | А | |
| Хлоргексидин | Наружное применение | — |
Тактика проведения аллоТКМ при ХМЛ.
Таблица 14.
| Фаза ХМЛ | Клиническая ситуация | Линия ИТК | HLA- типирование доноров | Проведение аллоТКМ |
| Хроническая фаза | Неудача ИТК-1 Имматинибом, высокий риск | Вторая линия ИТК | Да | Нет |
| Неудача терапией Нилотинибом или Дазатинибом | Вторая линия ИТК | Да | Да | |
| Неудача 2-х линий ИТК | Третья линия ИТК | Да | Да | |
| Мутация Т315I | Понатиниб или Омацетаксин | Да | Да | |
| Фаза акселерации | ИТК1 | Вторая линия ИТК ± химиотерапия | Да | Да |
| ИТК 1, без достижения оптимального ответа | Вторая линия ИТК ± химиотерапия | Да | Да | |
| Предлеченность ИТК | Вторая линия ИТК ± химиотерапия | Да | Да | |
| Бластный криз | ИТК1 или предлеченность | Индукционная ХТ + ИТК | Да | Да |
Особенности лечения у беременных.
Основная цель — предотвратить прогрессирование заболевания у матери при минимизации воздействия проводимой терапии на плод.
Учитывая, что до 15-й недели беременности превалирует риск развития внутриутробных аномалий при применении ИТК, до этого срока предусмотрено наблюдение без терапии. Применение ИТК должно быть исключено в I триместре в период органогенеза в связи с тератогенным риском. При этом возможны зачатие на фоне приема ИТК и ранняя отмена ИТК сразу же после подтверждения беременности. После 15 нед. беременности органогенез в основном завершен, плацентарный барьер ограничивает воздействие препаратов на плод. При быстром нарастании уровня BCR-ABL1 следует обсудить вопрос о целесообразности начала терапии.
Планирование беременности у женщин с ХФ ХМЛ целесообразно после терапии длительностью 3 года и более при полной клинико-гематологической ремиссии и подтверждении стабильного глубокого МО (МО4–МО4.5) в течение минимум 2 лет наблюдения.
У женщин с ФА ХМЛ в дебюте заболевания, полной клинико-гематологической ремиссией и стабильным глубоким МО длительностью 3 года и более во время терапии планирование беременности возможно с осторожностью, т. к. нет данных по прерыванию терапии ИТК и безопасному наблюдению без лечения при ФА ХМЛ; данный подход является спорным. При бластном кризе (БК) ХМЛ планирование беременности нецелесообразно, учитывая ожидаемую низкую выживаемость, необходимость проведения курсов химиотерапии в сочетании с ИТК или трансплантации аллогенных гемопоэтических стволовых клеток после достижения ремиссии заболевания.
Диагностированный на ранних сроках беременности БК ХМЛ считается показанием к прерыванию беременности, на поздних сроках беременности это показание к досрочному родоразрешению и немедленному началу терапии.
До получения стабильного глубокого МО всем пациенткам, получающим ИТК, рекомендована контрацепция.
Отсутствие воздействия ИТК в период органогенеза в I триместре — наиболее важный фактор благоприятного исхода беременности.
После 15 нед. беременности, в период, когда уже сформирован плацентарный барьер, ограничивающий проникновение препаратов к плоду, возобновление терапии ИТК целесообразно при значительной опухолевой массе с целью предупредить прогрессирование заболевания.
Уровень BCR/ABL1 > 1 % (потеря МО2) считается оптимальным показанием к возобновлению приема ИТК в интересах матери, поскольку при таком объеме опухолевой массы, соответствующем потере полного цитогенетического ответа, возрастает риск развития гематологического рецидива и появления резистентных клонов. Потеря гематологической ремиссии во время беременности служит показанием к терапии ИТК.
Трансфузионная поддержка.
Показания к проведению трансфузионной терапии определяются в первую очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения.
Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходимости профилактичесиких трансфузий концентрата тромбоцитов.
Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней (в фазе бластного криза).
| | Возраст (лет) | | Триггерный уровень Hb (г/л) |
| | | 35-45 | |
| | 25-50 | | 40-50 |
| | 50-70 | | 55 |
| | >70 | | 60 |
Хирургическое вмешательство: при развитии инфекционных осложнений пациентам могут также проводиться вмешательства, направленные на дренирование/устранение инфекционного очага.
Дальнейшее ведение см. Амбулаторный уровень.
Индикаторы эффективности лечения: см. Амбулаторный уровень.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации: