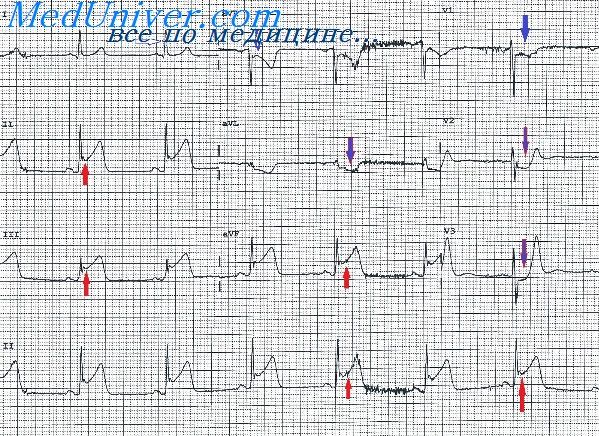
Миграция суправентрикулярного водителя ритма что это на экг у ребенка
Миграция водителя ритма у детей
Миграция водителя ритма — это вид аритмии (любой ритм сердца, отличный от нормального, — ритма здорового человека), характеризующийся постоянным перемещением импульса возбуждения, вызывающего сокращение сердца, в пределах правого предсердия. При этом источник возбуждения сердца постепенно перемещается от синусового узла (участок сердца, производящий импульс, регулирующий нормальную работу сердца) по предсердиям к атриовентрикулярному узлу (участок сердца, замедляющий проведение электрического импульса от предсердия к желудочкам). Миграция водителя ритма может возникать как при наличии у человека заболеваний сердца, так и у здоровых людей.
Симптомы миграции водителя ритма у ребенка
Причины миграции водителя ритма у ребенка
Наиболее частой причиной возникновения миграции источника ритма у детей является вегетососудистая дистония (комплекс нарушений, связанный с нарушением функционирования вегетативной нервной системы (автономная нервная система, регулирующая работу внутренних органов).
Кроме того, она может наблюдаться при кардите (воспаление внутренней оболочки сердца), а также у детей с патологическим спортивным сердцем (изменение структуры сердца (стенок, перегородок, сосудов) при тяжелых спортивных нагрузках).
Врач кардиолог поможет при лечении заболевания
Диагностика миграции водителя ритма у ребенка
Лечение миграции водителя ритма у ребенка
Лечение миграции водителя ритма сводится к лечению основного заболевания, которое стало причиной возникновения миграции источника ритма. Существуют общие рекомендации, включающие в себя:
Осложнения и последствия миграции водителя ритма у ребенка
Профилактика миграции водителя ритма у ребенка
ИНФОРМАЦИЯ ДЛЯ ОЗНАКОМЛЕНИЯ
Необходима консультация с врачом
Певцова Анастасия Владимировна, врач-методист, акушер-гинеколог, медицинский редактор.
Ельчанинова Ольга Николаевна, редактор.
Что делать при миграции водителя ритма?
Миграция суправентрикулярного водителя ритма что это на экг у ребенка
Автоматизм атриовентрикулярного соединения и предсердий может выражаться в виде отдельных выскакивающих импульсов на фоне синусового ритма. Эти импульсы появляются в тех случаях, когда имеются длинные паузы между циклами. Это может быть при синусовой брадикардни, резкой брадикардии, при синоаурикулярной и атриовентрикулярной блокаде, в компенсаторных паузах после экстрасистол и т. п. Место возникновения выскакивающего импульса в предсердиях или атриовентрикулярном соединении распознается по наличию измененного по форме или отрицательного зубца Р и его соотношению с комплексом QRS. Этому импульсу из предсердий или атриовентрикулярного соединения обычно предшествует длинная пауза, чем они отличаются от предсердных и атриовентрикулярных экстрасистол, которым предшествует укороченная пауза.
Атриовентрикулярный ритм иногда наблюдается у здоровых людей с повышенным влиянием блуждающего нерва на сердце. Такое нарушение ритма может возникнуть при давлении на коротидныи синус. Чаще всего этот ритм встречается при острых миокардитах (ревматизме), коронарной недостаточности, нарушении кровообращения, воздействии некоторых лекарственных препаратов (хинидин, дигиталис).
Миграция суправентрикулярного (источника) водителя ритма. Под миграцией суправентрикулярного водителя ритма («блуждающий ритм») понимают периодическую смечу водителя ритма: синусовый ритм сменяется предсердным или ритмом из атриовентрикулярного соединения и обратно. Автоматизм синуснопредсердного узла при этом периодически подавляется более выраженной автоматической активностью предсердных центров или атриовентрикулярного соединения а затем автоматическая активность этого узла вновь преобладает, и он опять становится водителем ритма сердца. Миграция водителя ритма наблюдается при ревматизме, острых инфекционных заболеваниях, ишемической болезни сердца, иногда обусловлена подавляюшим действием блуждающего нерва на автоматизм синусно-предсердкого узла.
Для миграции водителя ритма характерны следующие признаки: различная форма или полярность волн Р, различная продолжительность интервалов Р—Q, Р—Р.
Атриовентрикулярная диссоциация с интерференцией (неполная атриовентрикулярная диссоциация) — одна из сложных разновидностей атриовентрикулярного ритма. Ее также называют «узловым ритмом II типах (В. Е. Незлин, С. Е. Карпай, 1959). Впервые этот тип атриовентрикулярного ритма описал Cushg в 1897 году (в эксперименте на собаках при интоксикации дигиталисом). В большинстве случаев диссоциация с интер ференцией обусловлена поражением синусно-предсерд ного узла с урежением частоты импульсов, исходящих из него. Но иногда наряду с понижением автоматизме этого узла отмечается повышение автоматизма атриовентрикулярного соединения.
Сущность атриовентрикулярной диссоциации с интерференцией заключается в одновременном, почти одинаковом по частоте функционировании двух центров автоматизма: синусового и атриовентрикулярного. При этом атриовентрикулярный центр работает с несколько большей частотой, чем синусовый. Второй особенностью этой формы атриовентрикулярного ритма является то, что импульсы в атриовентрикулярной соединении возбуждают только желудочки, так как ретроградная проводимость по предсердио-желудочковому узлу замедлена или блокирована. Поэтому предсердия возбуждаются импульсами из синусно-предсердного узла. Возникает диссоциация в деятельности предсердий и желудочков. Но нормальное (ортоградное) проведение импульса из синусно-предсердного узла не нарушено.
Однако вследствие несколько более высокого автоматизма атриовентрикулярного соединения большая часть синусовых импульсов не может охватить желудочки, так как они достигают атриовентрикулярной границы в тот момент, когда предсердно-желудочковый узел и предсердно-желудочковый пучок находятся в состоянии возбуждения (в рефрактерном периоде). Периодически отдельные синусовые импульсы застают атриовентрикулярную систему вне рефрактерного периода, и тогда они проскакивают в желудочки. Происходит сцепление ритмов, или интерференция, — отдельный синусовый импульс возбуждает и предсердия, и желудочки. Таким образом, для атриовентрикулярной диссоциации с интерференцией (интерферирующей диссоциации) характерно то обстоятельство, что почти правильный атриовентрикулярный ритм сокращений желудочков время от времени прерывается как бы «преждевременным» синусовым сокращением предсердий и желудочков, напоминающим предсердную экстрасистолу.
Миграция суправентрикулярного водителя ритма что это на экг у ребенка
Синусовая аритмия является нормой у детей и выявляется как циклическое изменение сердечного ритма, связанное с дыханием. В процессе вдоха происходит ускорение и в процессе выдоха происходит замедление (колебание сердечного ритма составляет вплоть до 30 в минуту).
Суправентрикулярная тахикардия наиболее распространённый вид аритмии в детском возрасте. Сердечный ритм очень частый, между 250 и 300 в минуту. Это может приводить к низкому сердечному выбросу и отёку лёгких. Обычно она проявляется симптомами сердечной недостаточности в неонатальном периоде или в начале младенческого периода. Она является причиной водянки плода и внутриутробной гибели.
Термин «возвратная аритмия (аритмия re-entry)» используется в связи с тем, что устанавливается круговое проведение с недоразвитой активацией предсердий через дополнительные пути. Она редко становится структурной проблемой, однако необходимо провести ЭхоКГ.
Методы исследования детей с суправентрикулярной тахикардией
На ЭКГ в большинстве случаев выявляется тахикардия с узкими комплексами с частотой 250-300 в минуту. Можно различить зубец Р после комплекса QRS в связи с ретроградной активацией предсердий через дополнительные пути. Если сердечная недостаточность выраженная, могут быть изменения, свидетельствующие об ишемии миокарда, с инверсией зубца Т в латеральных околосердечных отведениях.
Если сохраняется синусовый ритм, можно отметить короткие R-R-интервалы. При синдроме Вольфа-Паркинсона-Уайта (WPW) ранняя антеградная активация желудочков через пути приводит к укорочению R-R-интервалов и появлению дельта-волн.
Ведение детей с суправентрикулярной тахикардией
У ребёнка с тяжёлым заболеванием ключевым подходом к улучшению состояния является восстановление синусового ритма. Этого можно достичь различными путями.
• Циркуляторной и респираторной поддержкой — корригируется тканевой ацидоз, проводится вентиляция с положительным давлением, если есть необходимость.
• Манипуляцией, стимулирующей блуждающий нерв, например массажем каротид или прикладыванием льда к лицу, — эффективны приблизительно у 80%.
• Внутривенным введением аденозина (препарат выбора). Он безопасен и эффективен, в том числе и при атриовентрикулярной блокаде после быстрой болюсной инъекции. Он останавливает тахикардию путём блокады цикла re-entry, который устанавливается между атриовентрикулярным узлом и дополнительными путями. Он вводится по нарастающей в увеличивающихся дозировках.
• Электрической кардиоверсией с синхронизированным DC (0,5-2 Дж/кг массы тела), если аденозин неэффективен.
После восстановления синусового ритма требуется поддерживающая терапия, например флекаинид или соталолом. Дигоксин может применяться самостоятельно, когда отсутствуют явные волны предвозбуждения (дельта-волны) на ЭКГ в покое, однако может быть дополнительно введён пропранолол при наличии предвозбуждения.
Даже если на ЭКГ в покое сохраняются патологические изменения, у 90% детей в дальнейшем больше не будет атак после младенческого периода. Поэтому лечение прекращается в возрасте 1 года. Тем, у кого впоследствии наступает рецидив, обычно проводятся перкутанная радиочастотная аблация или криоаблация дополнительных проводящих путей.
Очевидно, эти антитела предотвращают нормальное развитие системы электрического проведения в развивающемся сердце с атрофией и фиброзом атриовентрикулярного узла. Они могут вызывать водянку плода, внутриутробную гибель плода и сердечную недостаточность в неонатальном периоде. У большинства симптомы отсутствуют на протяжении многих лет, однако у некоторых появляются симптомы в форме пресинкопального или синкопального (обморочного) состояния. Всем детям с симптомами требуется установление эндокардиального пейсмейкера (водителя ритма).
Наследование происходит по аутосомно-доминантному типу, имеются различные фенотипы. Удлинение интервала P-Q. Ha ЭКГ могло быть связано с препаратом цизапридом, который использовался для лечения ГЭР, и с применением антибиотика эритромицина. Фибрилляция предсердий, трепетание предсердий, эктопическая предсердная тахикардия, желудочковая тахикардия и фибрилляция желудочков редко встречаются у детей. Чаще всего они наблюдаются у детей, которые перенесли хирургическую коррекцию сложного врождённого порока сердца.
Видео ЭКГ при суправентрикулярной тахикардии (синусовой тахикардии, фибрилляции предсердий, трепетании предсердий)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Нарушения ритма сердца при недифференцированной дисплазии соединительной ткани
Нарушения ритма и проводимости сердца при дисплазиях соединительной ткани (ДСТ) регистрируются достаточно часто. Так, по данным Перетолчиной Т. Ф. (2000) при электрокардиографическом (ЭКГ) исследовании у 2/3 пациентов с недифференцированной дисплази
Нарушения ритма и проводимости сердца при дисплазиях соединительной ткани (ДСТ) регистрируются достаточно часто (табл. 1). Так, по данным Перетолчиной Т. Ф. (2000) при электрокардиографическом (ЭКГ) исследовании у 2/3 пациентов с недифференцированной дисплазией соединительной ткани (НДСТ) выявляются те или иные отклонения, при Холтер-мониторировании (ХМ) — у 95%. По нашим наблюдениям в группе больных с различной степенью выраженности НДСТ нарушения ритма и проводимости регистрируются в 64,4% случаев.
Клиническое значение аритмий различно: у одних пациентов нарушения ритма, вызывая кардиальный дискомфорт, могут сказываться на качестве жизни, существенно не влияя на прогноз; у других — зачастую вне четкой связи с субъективной переносимостью — могут носить потенциально жизнеугрожающий характер; в части случаев нарушения ритма и проводимости могут манифестировать внезапной сердечной смертью. Результаты имеющихся на сегодняшний день исследований позволяют высказать предположение, что у пациентов с НДСТ патогенез аритмий сердца имеет мультифакторный характер, что и определяет их широкий спектр, различное прогностическое значение и различные лечебно-профилактические подходы.
Нарушения функции автоматизма синусового узла. Как отражение избыточных симпатических влияний наиболее часто регистрируется синусовая тахикардия.
При ХМ у пациентов фиксируются суточные колебания сердечного ритма от 54 до 120–130 уд/мин, в то время как на ЭКГ покоя частота сердечных сокращений (ЧСС) в половине случаев не превышает нормальных величин. Количество эпизодов синусовой тахикардии может варьировать от 10 до 416 в течение суток, максимальный объем в большинстве случаев приходится на период активной физической деятельности [10]. Часто выявляется синусовая аритмия (RRmax–RRmin > 0,15 c): в 10,0–43,2% случаев [4]. У 15–20% пациентов с НДСТ в основном в ночные часы во время сна могут регистрироваться кратковременные эпизоды синусовой брадикардии — от 1 до 427 с, по данным О. В. Тихоновой (2006), продолжительность максимального эпизода 2 минуты 11 секунд. Автор отмечает увеличение количества и продолжительности эпизодов у пациентов с выраженной формой НДСТ [10]. Синусовая брадикардия и аритмия чаще отмечаются у пациентов с исходной ваготонией.
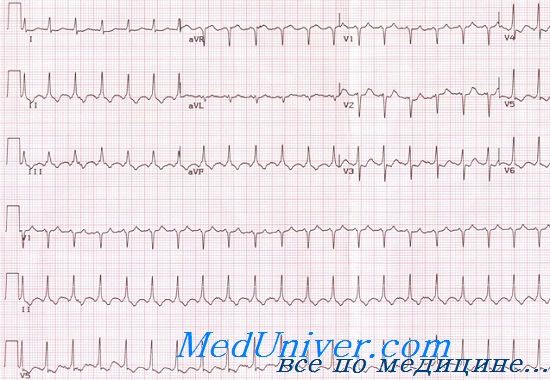
Миграция водителя ритма. Данный вариант аритмий выявляется у 5,0–34,0% пациентов [5, 8, 10]. Частота выявления данного нарушения ритма увеличивается почти в два раза при проведении электрофизиологического исследования [11]. Чаще бывает миграция водителя ритма между синусовым и атриовентрикулярным узлом: сердце возбуждается под влиянием импульсов, исходящих последовательно из синусового узла, предсердий, атриовентрикулярного соединения и снова синусового узла [6]. При миграции водителя ритма ведущая роль синусового узла подавляется эктопическими водителями ритма временно. Несмотря на факт миграции водителя ритма по предсердиям и перинодальной зоне при проведении чреспищеводной электростимуляции сердца (ЧПЭС), независимо от степени НДСТ, время восстановления функции синусового узла и коррегированное время восстановления функции синусового узла обычно не превышают физиологическую норму [4]. Данное наблюдение позволяет говорить о сохраненной автоматической активности синусового узла и появлении эктопических комплексов вследствие изменения скорости диастолической спонтанной деполяризации латентных очагов автоматии с повышением автоматизма конкурирующих центров на фоне несбалансированных нейрогенных влияний. В. М. Яковлев с соавт. (2001) предполагает роль в формировании данного электрофизиологического феномена различной чувствительности мембран клеток синусового узла к ацетилхолину, катехоламинам. По данным Перетолчиной Т. Ф. (2000) частота выявления миграции водителя ритма увеличивается в 3 раза при нарастании тяжести синдрома вегетативной дисфункции и выраженности НДСТ.
Экстрасистолия. Предсердная и желудочковая экстрасистолия является наиболее распространенным нарушением ритма сердца среди пациентов с НДСТ. Появление активных эктопических комплексов может быть связано с изменением автоматической активности синусового узла, особенностями иннервации, формированием зон асинхронной деполяризации, активацией предсердных латентных очагов автоматии вследствие различия скорости реполяризации волокон миокарда и нарушения электрической гомогенности предсердий, реализующихся в условиях нарушения обмена в миокарде пациентов с НДСТ [4].
Частота предсердной экстрасистолии колеблется у больных с НДСТ при наличии пролапса митрального клапана (ПМК) от 4 до 90% [3]. Предсердная экстрасистолия у пациентов с НДСТ регистрируется с различными вариантами эктопических комплексов: чаще — с одним или несколькими отрицательными спайками в середине комплекса (II тип); несколько реже — с начальным положительным отклонением (I тип); редко — с начальным и конечным отрицательным отклонением (III тип) [4]. Возникновение наджелудочковых экстрасистол может быть связано с увеличением и изменением электрической активности клеток левого предсердия, подвергающегося раздражению в период систолы пролабирующей миксоматозно измененной створкой митрального клапана и/или струей митральной регургитации [11]. Так, по некоторым наблюдениям значимая наджелудочковая экстрасистолия (более 100 экстрасистол в минуту) регистрировалась только у пациентов с миксоматозной дегенерацией пролабирующих створок [11]. По нашим наблюдениям у пациентов с выраженными проявлениями НДСТ предсердная экстрасистолия покоя возрастает при физической нагрузке от 10–12 до 18–25 за 1 час [4].
Желудочковая экстрасистолия по данным различных авторов отмечается в 14–89% [3]. По некоторым данным у пациентов с эхокардиографическими признаками миксоматозной дегенерации митрального клапана среднее количество желудочковых экстрасистол в сутки и в час было достоверно большим, чем при отсутствии такового [11]. Эктопическая желудочковая активность у пациентов с НДСТ преимущественно представлена желудочковыми экстрасистолами I категории (I, II класс по Lown) и совпадает с периодами максимальных физических нагрузок [4]. Развитие желудочковой экстрасистолии помимо вегетативной дисфункции, гиперсимпатикотонии [4, 5, 12] может быть связано с аномальной тракцией папиллярных мышц при ПМК [11], механическим раздражением эндокарда, миксоматозно измененными хордами [3, 9]. В генезе желудочковых экстрасистолий может играть роль присутствие малой аномалии развития сердца — аномальных хорд (механическое раздражение эндокарда в месте прикрепления аномальных хорд, наличие в тканях аномальных хорд клеток Пуркинье) [3]. При расположении точек прикрепления хорд в области межжелудочковой перегородки или папиллярных мышц риск потенциально возможных нарушений ритма возрастает [8]. Существуют наблюдения о большей частоте регистрации желудочковых экстрасистол при снижении тканевого содержания магния [10].
У небольшой части пациентов отмечается сочетание предсердных и желудочковых экстрасистол. «Угрожающие» экстрасистолы в основном выявляются у лиц с яркими проявлениями ДСТ воронкообразной деформацией II–III степени, килевидной деформацией грудной клетки II степени [4, 10].
Синдром Вольфа–Паркинсона–Уайта. У определенной части больных с НДСТ может выявляться феномен преждевременного возбуждения желудочков (6,5–8,7–25%), обусловленный функционированием дополнительных путей проведения импульса [5, 8, 10]. У этих больных в большинстве случаев определяются пароксизмальные нарушения сердечного ритма в виде атриовентрикулярных пароксизмальных тахикардий.
Пароксизмальная тахикардия. В реализации патофизиологических механизмов пароксизмальной тахикардии у лиц с НДСТ предполагается участие дисфункции вегетативной нервной системы с преобладанием вагусных влияний, дополнительных проводящих путей, миксоматозного изменения атриовентрикулярной зоны [11]. Пароксизмальные нарушения ритма по данным большинства исследователей выявляются значительно чаще при проведении Холтер-ЭКГ, ЧПЭС в сравнении с регистрацией ЭКГ покоя. Так, при проведении ЧПЭС у больных с НДСТ провоцируются пароксизмы тахикардии в 72,9% случаев, по клиническим проявлениям и конфигурации ЭКГ аналогичные спонтанным ранее возникшим пароксизмам выявляются впервые в 27% случаев. По наблюдению Перетолчиной Т. Ф. (2000) пароксизмальные тахикардии у пациентов с НДСТ на ЭКГ покоя регистрируются в 5,8% случаев, при проведении Холтер-ЭКГ — в 32,5% наблюдений.
Совокупность дополнительных путей и дискретного проведения по АВ-соединению способствует развитию пароксизмальных суправентрикулярных тахикардий двух типов — ортодромной и антидромной. В первом случае, при наличии синусового ритма и признаков предвозбуждения желудочков, учащение стимуляции до порогового значения приводит к возвратному ходу волны возбуждения через добавочный пучок Кента и ретроградному возбуждению предсердий. В другом случае антеградное распространение импульса происходит через добавочный пучок, а ретроградное — через АВ-соединение, что на ЭКГ отражается появлением уширенного деформированного комплекса QRS за счет дельта-волны. Зубцы Р в том и другом случае имеют инвертированную форму, что свидетельствует о ретроградном распространении возбуждения на предсердия. Частота пароксизмов по нашим наблюдениям варьирует от 1 раза в 6 месяцев до 3–4 раз в неделю. При этом приступы возникают как при физической нагрузке, так и в покое или во время сна, характерна плохая субъективная переносимость аритмии. Антидромная реципрокная тахикардия регистрируется реже и имеет место у пациентов с синдромом Вольфа–Паркинсона–Уайта.
Пароксизмы желудочковой тахикардии регистрируются при НДСТ редко — 0,97–2,5% случаев по разным данным, при этом во всех случаях имели место выраженные проявления НДСТ с наличием деформаций грудной клетки II–III степеней [5, 10].
Регистрируемые при НДСТ пароксизмальная суправентрикулярная тахикардия, желудочковая экстрасистолия высоких градаций и пароксизмальная желудочковая тахикардия составляют угрожающую основу для возникновения фатальных нарушений ритма и внезапной смерти.
Фибрилляция/трепетания предсердий. Данные нарушения ритма в целом регистрируются редко — в 3,9–6,2% случаев при ХМ [5, 8]. Морфологическим субстратом электрогенеза фибрилляции/трепетания предсердий при НДСТ может служить генетически детерминированное несовершенство развития соединительной ткани в эмбрио- и онтогенезе и обусловленное ими нарушение межтканевых (миокардиальных и соединительнотканных структур) взаимодействий, проявляющееся электромеханической нестабильностью; наследственное соединительнотканное и гемодинамическое ремоделирование левого (значительно чаще) и правого предсердий; асимметрия клеточных структур правого и левого предсердий; трансформация импульса от синусового узла к АВ-соединению по цитологическим и функциональным (электрофизиологическим) структурам мышцы правого предсердия [11].
Нарушения проводимости. У большинства пациентов величина комплекса QRS не превышает пределов физиологической нормы (0,10 с). Изменение этого структурного показателя ЭКГ у лиц с НДСТ, не имеющих органического поражения сердечной мышцы, является отражением биоэлектрической неоднородности миокарда либо повышенной нагрузки на выходной тракт правого желудочка. Нарушения внутрижелудочковой проводимости различной локализации регистрируются не часто (табл. 2), имея как транзиторный, так и постоянный характер.
Чаще эти изменения выявляются на фоне физической нагрузки, реже — в покое [4]. По данным О. Д. Остроумовой (1995) все пациенты с блокадой правой ножки пучка Гиса имеют эхокардиографические признаки миксоматозной дегенерации септальной створки трикуспидального клапана. Как известно, именно в этой области начинается правая ножка пучка Гиса, располагаясь субэндокардиально.
Синоатриальные и атриовентрикулярные блокады у пациентов с НДСТ регистрируются не часто (табл. 2).
Синдром удлиненного интервала QT. Данный синдром как возможный прогностический критерий внезапной смерти описан во многих исследованиях у пациентов с ПМК. Частота его выявления варьирует в широких пределах в зависимости от метода диагностики: при регистрации ЭКГ-покоя — 2,5–26,5%, при Холтер-ЭКГ — до 35,7%, при ЧПЭС — до 42,6% [11].
Несмотря на сложный многокомпонентный аритмогенез в каждом конкретном клиническом наблюдении, по результатам многочисленных исследований отмечены некоторые общие особенности аритмического синдрома НДСТ:
Учитывая, что по данным многочисленных исследований несбалансированный вегетативный фон, снижение тканевого пула магния имеют место у большинства пациентов с НДСТ, коррекция аритмического синдрома, имея особенности, связанные с вариантом нарушений электрогенеза, должна включать препараты с вегетотропным действием, содержащие значимые макроэлементы (магний). На сегодняшний день известно, что ионы магния участвуют в процессах метаболизма соединительной ткани, контролируют нормальное функционирование кардиомиоцита на всех уровнях субклеточных структур, принимают участие в регуляции сократительной функции миокарда. В то же время внутриклеточный дефицит магния увеличивает активность синусового узла, которая укорачивает время атриовентрикулярного проведения, снижает абсолютную рефрактерность и удлиняет рефрактерность относительную, следствием чего может быть развитие разнообразных нарушений ритма. При этом антиаритмический эффект препаратов магния обусловлен не только ликвидацией внеклеточного электролитного дисбаланса и повышением внутриклеточной концентрации магния и калия, но и активирующим воздействием катионов органических остатков на обменные процессы в миокарде [1].
Мы наблюдали 120 пациентов в возрасте от 18 до 42 лет (средний возраст 30,30 ± 2,12 года, мужчин — 66, женщин — 54) с НДСТ различной степенью выраженности, имеющих деформации грудной клетки (воронкообразную деформацию I степени — 27 человек, 22,5%; II степени — 13 человек, 10,8%; III степени — 6 человек, 5%; килевидную (манубриокостальный тип — 18 пациентов, 15%; корпорокостальный тип — 19 человек, 15,8%; костальный тип — 12 пациентов, 10,0%), астеническую форму грудной клетки (7 пациентов, 5,8%), комбинированные изменения позвоночного столба — 103 пациента, 85,8%); клапанный синдром (ПМК I степени — 96 человек, 80,0%; II степени — 24 человека, 20,0%) с регургитацией (110 пациентов, 91,7%) или без таковой); малая аномалия развития сердца — аномальные хорды левого желудочка (89 пациентов, 74,2%); расширение корня и восходящего отдела аорты — 8 человек (6,7%).
При расспросе большинство пациентов (104 человека, 86,7%) предъявляли жалобы общего характера: на слабость, повышенную утомляемость, снижение работоспособности, ухудшение памяти, снижение концентрации внимания, головокружение, обморочные состояния, головные боли, апатичность, нарушения засыпания и/или чуткий сон, беспокойство, раздражительность, чувство внутреннего напряжения и/или тревогу. Выраженность указанных жалоб, как правило, увеличивалась в периоды интенсивных психоментальных нагрузок, существенно сказываясь на эффективность работы. В субъективном статусе доминирующими по частоте возникновения и выраженности были жалобы со стороны сердечно-сосудистой системы: кардиалгии (76,7%), ощущения «сердечного дискомфорта» (23,3%), сердцебиение (28,3%), перебои в работе сердца (16,7%), головокружение, общая слабость при резком снижении артериального давления в положении ортопное (35,0%). Боли в области сердца, как правило, были колющего характера с локализацией в области верхушки, либо пациенты отмечали неопределенные ощущения «сердечного дискомфорта». Реже пациенты отмечали кратковременные эпизоды сердцебиения, перебоев в работе сердца, проявления ортостатической гипотензии. Достаточно часто указанные жалобы сопровождались чувством нехватки воздуха либо ощущениями затрудненного вдоха.
При обследовании (общеклиническое обследование, эхокардиография, ЭКГ, Холтер-ЭКГ, определение уровня магния в слюне и сыворотке, исследование исходного вегетативного тонуса на основании клинических тестов (А. М. Вейн, 1998), оценки шкалы вегетативных нарушений опросника для выявления и оценки невротических состояний [3]) выявлялся синдром вегето-сосудистой дистонии с преобладанием симпатических влияний (100 человек, 83,3%) или ваготонией (5,8%), метаболическая кардиомиопатия, аритмический синдром, достоверно более низкое содержание магния в ротовой жидкости в сравнении с обследованными практически здоровыми добровольцами (0,561 ммоль/л).
По данным ЭКГ у всех пациентов выявлялись изменения конечной части желудочкового комплекса, которые мы трактовали в аспекте нарушений метаболических процессов в миокарде в рамках метаболической кардиомиопатии: I степень нарушения реполяризации (увеличение амплитуды зубца T V2–4, синдром «TV2 > TV6» и укорочение сегмента ST) выявлялась у 59 пациентов (49,2%); II степень нарушения реполяризации (инверсия зубца Т, смещение сегмента ST V2–V3 вниз от 0,5 до 1,0 мм) — у 48 пациентов (40,0%), III степень нарушений реполяризации определялась реже — в 10,8%.
Нарушения ритма и проводимости, выявляемые при проведении Холтер-ЭКГ, у пациентов были представлены: синусовой тахикардией (76,7%), синусовой аритмией (23,3%), предсердной, желудочковой экстрасистолией (72,5%), АV-блокадой I–II степени (28,3%), эпизодами наджелудочковой тахикардии (6,7%), миграцией водителя ритма (4,2%). Показатели вариабельности сердечного ритма у 41 человека (34,2%) были повышены, у 12 пациентов (10,0%) — снижены, у 67 человек (55,8%) были в пределах нормы. Ригидный ритм наблюдается у 7 (5,8%) пациентов.
Всем пациентам назначался Магнерот по следующей схеме: 2 таблетки 3 раза в день первые 7 дней, затем по 1 таблетке 3 раза в день в течение 7 недель.
После завершения курса лечения было отмечено статистически достоверное повышение содержания магния как в сыворотке крови (с 0,867 ммоль/л до 0,955 ммоль/л), так и в ротовой жидкости (с 0,561 ммоль/л до 0,903 ммоль/л). Следует отметить, что быстрее повышалось содержание магния в сыворотке крови (через 4 недели лечения), в то время как динамика содержания магния в ротовой жидкости достоверно обнаружилась после завершения полного курса приема препарата «Магнерот». Вероятно, именно уровень магния в ротовой жидкости, как показатель, наиболее надежно отражающий содержание магния в тканях, и следует оценить у пациентов с ДСТ исходно, а также мониторировать в ходе лечебных воздействий.
В целом на фоне лечения выявлялась выраженная положительная динамика по таким характеристикам физической составляющей качества жизни, как утомляемость (частота выявления симптома до и после лечения, соответственно — 87,5% (105/120) и 28,3% (34/120), McNemar r 2 6,61; р = 0,01) снижение работоспособности (соответственно 48,3% (58/120) и 6,7% (8/120), McNemar χ 2 39,19; р = 0,000), потеря интереса к жизни (соответственно 27,5% (33/120) и 5,0% (6/120) McNemar r 2 66,86; р = 0,000). Показатели вариабельности сердечного ритма после лечения оказались в пределах нормы у 66,7% (80/120) пациентов (исходно — 44,2%; McNemar χ 2 5,90; р = 0,015). Было отмечено достоверное изменение показателя шкалы вегетативных нарушений (-2,35 и 1,28, соответственно до и после лечения), отражающее снижение вегетативной напряженности.
Позитивная динамика ЭКГ-изменений проявилась в снижении частоты встречаемости метаболических нарушений процессов реполяризации I степени (McNemar χ 2 14,27; р = 0,0002) и II степени (McNemar χ 2 10,09; р = 0,002), синусовой тахикардии (McNemar r 2 12,69; р = 0,000), синусовой аритмии (McNemar χ 2 4,22; р = 0,04), экстрасистолии (McNemar r 2 9,60; р = 0,002) (табл. 3).
В ходе исследования среди пациентов не было отмечено каких-либо жалоб, связанных с проводимой терапией.
Следует отметить, что снижение частоты выявления наиболее часто регистрируемых нарушений ритма, связанных как с нарушением автоматизма синусового узла, так и с активацией латентных очагов, наблюдалось на фоне коррекции вегетативных нарушений, улучшения электрофизиологических характеристик метаболизма миокарда и повышения содержания магния в тканях.
Таким образом, препарат «Магнерот» при НДСТ хорошо переносится, уменьшает вегетативную дисрегуляцию, клинические проявления метаболической кардиомиопатии, корректирует синусовые нарушения ритма, снижает частоту регистрации активных эктопических комплексов, а также позитивно влияет на физическую трудоспособность. Применение комплексных программ реабилитации с включением препаратов магния (Магнерот) для коррекции клинических проявлений аритмического синдрома на фоне метаболической кардиомиопатии и вегетативного дисбаланса патогенетически оправдано и эффективно.