Миксоматоз стромы гистология что это
МИКСОМА
М. встречается чаще в пожилом возрасте, располагается обычно в межмышечной клетчатке, по ходу фасций, апоневрозов и нервов, гл. обр. на конечностях, реже в передней брюшной стенке и мочевом пузыре.
Макроскопически М. имеет вид округлого инкапсулированного эластичной студневидной консистенции желтовато-белого цвета образования величиной до 12 см и более в диаметре, а также нескольких располагающихся рядом или сливающихся друг с другом узлов. Иногда отмечается инфильтрирующий рост опухоли. При микроскопическом исследовании в гомогенном межуточном веществе, к-рое при окраске срезов гематоксилин-эозином имеет вид базофильной мелкозернистой массы, обнаруживаются звездчатые, паукообразные, перстневидные и веретеновидные клетки, связанные между собой. В ряде случаев клетки опухоли напоминают фиброциты; встречается также большое количество тучных клеток (см.). В опухоли, как правило, видны многочисленные сосуды капиллярного и росткового типа в виде эндотелиальных почек или сплошных тяжей эндотелиальных клеток. Небольшое количество аргирофильных и коллагеновых волокон располагается, как правило, вблизи клеток и в одном с ними направлении. В составе межуточного вещества преобладают сульфатированные мукополисахариды.
Клин, картина М. зависит от ее локализации. Рост опухоли медленный, в течение длительного времени она может не изменять своей величины. Метастазирование при М. не наблюдается.
Диагноз устанавливают по результатам морфол, исследования. Лечение оперативное.
Прогноз благоприятный, однако после операции часто возникают рецидивы.
Библиография: Клиническая онкология, под ред. H. Н. Блохина и Б. Е. Петерсона, т. 1, с. 399, М., 1979; Руководство по патологоанатомической диагностике опухолей человека, под ред. Н. А. Краевского и А. В. Смольянникова, с. 50, 83, М., 1976; Рас k G. Т. a. Ariel J. М. Tumors of the soft somatic tissues, N. Y., 1958; Stout A. P. Tumors of the soft tissues, Washington, 1953, bibliogr.
Миксоматоз стромы гистология что это
При детальном исследовании опухолей, которые все еще расценивают по формальным признакам как миксомы, некоторым авторам удалось с помощью современных гистологических и гистохимических методик уловить признаки фибробластической дифференцировки, соответствующей тому или иному этапу эмбриогенеза волокнистой соединительной ткани. Вытянутые и звездчатые клетки, составляющие основу этих опухолей, по морфофункциональным характеристикам близки к эмбриональным фибробластам. Они активно секретируют гликозаминогликаны, главным образом гиалуроновую кислоту, выделяемые затем в промежуточную субстанцию. Волокна в этих опухолях представлены аргирофильными с той или иной примесью коллагеновых, причем располагаются преимущественно вблизи клеток. В опухоли много сосудов капиллярного типа, а также ростковых, которые представлены эндотелиальными почками или сплошными тяжами клеток, еще не имеющими просвета.
В части опухолей отмечают черты, соответствующие более зрелой структуре эмбриональной волокнистой соединительной тканн клетки в них напоминают фиброциты, встречают большое количество гранулированных базофилов, среди волокон преобладают коллагеновые, количество сосудов невелико и большая их часть является пропульсивными, в промежуточной субстанции преобладают полисахариды типа сульфатированных. Эти данные свидетельствуют о генетической близости миксом к эмбриональной волокнистой соединительной тканн, вследствие чего их можно называть эмбриональными фибромами и рассматривать как особую онконозологическую единицу.
М.Ф. Глазунов и Ю. Г. Пучков (1960) при исследовании нескольких мышечных миксом описали своеобразную динамику их развития с чередованием дистрофических и пролиферативных процессов. Клетки миксом они определили как фибробласты и обнаружили в последних внутриядерные включения, напоминающие таковые в вирусиндуцированных опухолях типа фибром Шоупа.
Представление о ложных (вторичных) миксомах также должно подвергнуться пересмотру. Этим термином обозначают различные опухоли мезенхимного происхождения фибромы, липомы и др, подвергшиеся слизистой дегенерации. В них обычно преобладают структуры исходной ткани, а миксоматоз отмечается в виде очагов. Он характеризуется тем, что в строме опухоли, раздвигая ее клетки и волокна, накапливается аморфная масса, содержащая главным образом белки плазмы. Клетки опухоли в зоне мнксоматоза с явлениями дистрофии (пикноз, кариорексис, отечное набухание, лизис). Лизису подвергаются и волокнистые структуры стромы. В исходе в опухоли могут образоваться очаги размягчения и кисты.
Суммируя все изложенное, необходимо подчеркнуть дискуссионность понятия миксомы, особенно в гистогенетическом плане, и необходимость гистогенетической верификации каждой опухоли с явлениями миксоматоза. Следует также иметь в виду, что происхождение и значение этого морфологического феномена в опухачях мезенхимного генеза различны. В одних случаях речь идет о миксоидной дегенерации, относящейся к дистрофическим процессам, сопровождающимся некробиотическими изменениями клеток, что может закончиться аутолизом данного участка опухоли. В других случаях миксоматоз расценивают как проявление катаплазии клеток опухоли, приобретающих свойства мезенхимы. В этих случаях в ядрах клеток опухоли повышается количество ДНК, появляются фигуры деления, а в миксоматозной субстанции — гликозаминогликаны типа гиалуроновой кислоты, хондроитин- и гепаритинсульфатов. Многие считают, что такой миксоматоз сочетается с инвазивным ростом опухоли, ее склонностью к рецидивам, и расценивают такие опухоли как местнодеструирующие.
Все изложенное о миксомах относится и к злокачественным опухолям, обозначаемым термином «миксосаркома». По мнению многих авторов, при углубленном исследовании опухолей, верифицированных как миксосаркома, выясняется, что они являются низкодифференцированными фибросаркомами, десмоидами с явлениями ослизнення. мезенхимомами, эмбриональными рабдомиосаркомами или миксоидными липосаркомами и т. п., вследствие чего понятие «миксосаркома» должно быть исключено из обихода.
Меланотическая прогонома (опухоль закладки ретины, меланотическая амелобластома, меланотическая эктодермальиая опухать, младенческая меланотическая нейроэктодермальная опухоль) редкая доброкачественная опухоль из пигментной, меланинсодержащей ткани с кубовидными клетками, заключенными в густую волокнистую коллагеновую строму, образующую альвеолоподобные структуры с заключенными в ней темноокрашенными лимфоцитоподобными клетками. Может локализоваться на голове, в средостении, на плече, в мошонке, в верхней челюсти, чаще у детей в возрасте около 1 года. Новообразование гистогенетически связано с клетками нервного гребешка и к одоитогениому эпителию отношения не имеет. Один из синонимов опухоли «меланоамелобластома» не отражает сущности процесса; располагаясь в челюсти, опухоль смещает развивающиеся зубы, в мягких тканях растет по типу пигментного или беспигментного эпулиса. Течение доброкачественное, опухоль из пигментной, меланинсодержащей ткани с кубовидными клетками, заключенными в густую волокнистую коллагеновую строму, образующую альвеолоподобные структуры с заключенными в ней темноокрашенными лимфоцитоподобными клетками. Может локализоваться на голове, в средостении, на плече, в мошонке, в верхней челюсти, чаще у детей в возрасте около 1 года. Новообразование гистогенетически связано с клетками нервного гребешка и к одоитогениому эпителию отношения не имеет. Один из синонимов опухоли «меланоамелобластома» не отражает сущности процесса; располагаясь в челюсти, опухоль смещает развивающиеся зубы, в мягких тканях растет по типу пигментного или беспигментного эпулиса. Течение доброкачественное.
Альвеолярная саркома мягких тканей (злокачественная органоидная зернисто-клеточиая опухоль). Как самостоятельная опухоль мышц описана W M Chiistopheson (1952). Высказывают предположение о ее отношении к другим мезенхимиым опухолям, особенно исходящим из иехромаффинных параганглиев, а также дизгенезии. Встречается чаще у женщин, обычно во втором десятилетии жизни, поражает скелетные мышцы бедер, ягодицы, передней брюшной стенки, может встречаться и во внутренних органах; в части случаев инкапсулирована или же обладает инфильтрирующим ростом.
Клинико-гистологическая характеристика доброкачественных образований яичников
На сегодняшний день частота выявления доброкачественных образований яичников не снижается, что объясняется широким применением в гинекологии современных информативных методов исследований.
На сегодняшний день частота выявления доброкачественных образований яичников не снижается, что объясняется широким применением в гинекологии современных информативных методов исследований. В течение нескольких десятилетий для дифференциации опухолей матки и придатков с успехом применяется ультразвуковая диагностика [1]. Однако не всегда при трансвагинальной эхографии можно определить характер опухоли, особенно на ранних стадиях развития опухоли яичника [2]. Возможность дифференциации доброкачественных и злокачественных образований яичников появилась с применением цветного доплеровского картирования [1, 3].
Длительность существования доброкачественной опухоли яичника и ее способность к малигнизации имеют самый различный диапазон и частоту. Так, известно, что малигнизации подвергается каждая третья серозная кистома яичника [2, 3, 4, 5]. Вместе с тем не исключено и длительное существование этих опухолей без каких-либо пролиферативных изменений в капсуле.
Известно, что образования яичников небольших размеров часто принимаются за опухолевидные образования и подвергаются консервативной противовоспалительной терапии. Отсутствие же эффекта от лечения рассматривают как показание для оперативного вмешательства. Однако распознать грань перехода пролиферации эпителия капсулы в атипический эпителий и своевременно предотвратить опасное для жизни заболевание является довольно сложной задачей. Окончательный диагноз о характере образования яичника устанавливается путем гистологического исследования удаленной капсулы.
Целью исследования явилось изучение клинических проявлений и морфологических особенностей доброкачественных опухолей яичников для своевременного решения вопроса о необходимости их оперативного лечения. Материал и методы исследования. Нами изучено клиническое течение доброкачественных образований яичников у 170 больных, поступивших в гинекологическое отделение акушерского комплекса № 9 г. Ташкента по поводу объемного образования яичника на оперативное лечение.
Возраст обследованных женщин колебался от 25 до 45 лет. Наиболее частым возрастом выявления опухолей яичников у наших пациенток является 20–29 лет (около половины), затем возрастная группа 30–39 лет. Меньше всего среди больных было пациенток в возрасте до 20 лет (около 5%).
Дооперационное обследование включало ультразвуковое исследование с цветовым доплеровским картированием сосудов яичника и определение в крови онкомаркера СА-125. Онкомаркер СА-125 является антигеном, определяемым с помощью моноклональных антител к клеткам рака яичников, и наиболее специфичным маркером при опухолях яичников, особенно в постклимактерическом периоде [5, 6]. Интерпретация результатов определения величины онкомаркера СА-125 проводилась в соответствии с результатами гистологического исследования.
При резко повышенных показателях проводилось повторное исследование в послеоперационном периоде и после реабилитационного лечения. Верификация диагноза проводилась в послеоперационном периоде гистологическим исследованием капсулы кистомы.
Для гистологического исследования из резецированных стенок кист готовили гистологические препараты по общепринятой методике. Результаты исследования и их обсуждение. Наиболее частой жалобой пациенток было бесплодие. Из 77 (45,3%) больных с нарушением репродуктивной функции у 46 (60,0%) пациенток наблюдалось первичное бесплодие длительностью от двух до шести лет, у 31 (40%) — вторичное бесплодие длительностью от двух до четырех лет.
Второй по частоте жалобой были ноющие боли внизу живота и альгоменорея (у 71 больной — 41,8%). Около одной трети больных (55 пациенток — 32,4%) до поступления в стационар получали консервативную противовоспалительную терапию без особого успеха.
Нарушения менструаций были отмечены чаще у больных с опухолевидными образованиями воспалительного характера, что было подтверждено результатами гистологического анализа удаленной капсулы образования. Из нарушений менструально-овариального цикла, кроме альгоменореи, были выявлены гиперменорея (12,3%), гипоолигоменорея (16,8%), в некоторых случаях — дисфункциональные кровотечения в анамнезе (у 9,2%).
Доплерометрические исследования кровотока характеризовались низкой скоростью кровотока в маточных и яичниковых сосудах и повышенными значениями индекса резистентности. Определение онкомаркера СА-125, проведенное до операции, показало, что, несмотря на разброс цифр (от 8,3 до 60,3), средняя цифра не превышала принятую норму 35 Ед/мл. Оперативное лечение проведено практически всем женщинам путем лапароскопии. Послеоперационное реабилитационное лечение зависело от результатов гистологического исследования и величины онкомаркера.
Интерес представляет также полиморфизм гистологических изменений в капсуле удаленных образований. Большую часть (33%) составили опухолевидные образования (фолликулярные и лютеиновые кисты). Доброкачественные эпителиальные опухоли составили 25% случаев, из них в 11,7% случаев — серозные и в 13,3% случаев — эндометриоидные. В 5% случаев наблюдали герминогенную опухоль в виде зрелой тератомы. Вместе с тем в двух случаях гистологическое исследование выявило аденокарциному яичника. Значительная часть кистозных образований (31,7%) не имела эпителиальной выстилки, что затрудняло установление гистогенеза и характера новообразования яичника.
Фолликулярные кисты были представлены чаще как одностороннее однокамерное и тонкостенное образование с гладкой внутренней стенкой. Гистологически соединительнотканная стенка была выстлана многорядным фолликулярным эпителием, под которым располагаются клетки theca interna, в некоторых случаях наблюдалась ее гиперплазия и лютеинизация.
Лютеиновые кисты чаще выявлялись в виде двусторонних и одиночных образований. Внутренняя поверхность стенки кисты выстлана слоем текалютеиновых клеток, под которыми расположена гранулеза без лютеинизации.
Среди эпителиальных опухолей чаще встречались серозные и муцинозные. Серозные опухоли были представлены серозной цистоаденомой, обычно крупных размеров. Капсула опухоли в основном была грубоволокнистой, выстилающий стенку эпителий был однорядным кубическим или уплощенным, в некоторых случаях обнаруживался цилиндрический эпителий.
Муцинозные опухоли были представлены муцинозной цистоаденомой (или сецернирующая муцинозная кистома), обычно многокамерной и крупных размеров. Внутренняя поверхность стенки выстлана однорядным высоким призматическим эпителием, цитоплазма которых содержала слизь.
Эндометриоидные опухоли яичников были схожи с опухолями эндометрия и характеризовались выстилкой стенки кисты однорядным низким цилиндрическим эпителием эндометриального типа. Вокруг стенки часто наблюдались кровоизлияния и накопление гемосидерина.
Зрелая кистозная тератома (или дермоидная киста) яичника была обычно однокамерной и заполнена салом и волосами. Гистологически обнаруживались кожа, волосяные фолликулы, сальные и потовые железы, редко — хрящ.
Аденокарциномы яичников были представлены серозной папиллярной цистоаденокарциномой. Нами выявлены две больные с аденокарциномой, у которых онкомаркер СА-125 был соответственно в 11 и 15 раз выше нормы.
Таким образом, исследования показали, что доброкачественные опухоли и опухолевидные образования яичников чаще встречаются среди женщин активного репродуктивного возраста — от 20 до 39 лет, что несколько отличается от данных литературы [4, 5]. Клиническая картина доброкачественных опухолей неспецифична и проявляется в некоторых случаях нарушениями менструального цикла, бесплодием. Наши исследования показали, что определение онкомаркера СА-125 позволяет в предоперационном периоде с высокой степенью вероятности прогнозировать характер образования яичника и определить хирургическую тактику, что подтверждается результатами других исследователей [6].
Выводы:
Литература
Л. М. Абдуллаева, кандидат медицинских наук Ташкентская медицинская академия, Ташкент
Миксоматоз стромы гистология что это
Миксома сердца является редкой доброкачественной опухолью сердца мезенхимального происхождения, которая встречается у 0,5–1 на 1 млн у взрослого населения. Большой интерес в изучении данных новообразований обусловлен их уникальной локализацией (левая часть межпредсердной перегородки рядом с fossa ovalis), различными клиническими проявлениями и неустановленным гистогенезом [1–4].
Клинические проявления миксом сердца разнообразны и могут быть обусловлены размерами самой опухоли с нарушением ритма сердца, присоединением и прогрессированием тромбоза, тромбоэмболическими осложнениями в бассейне артерий большого круга кровообращения. Данные опухоли не всегда поддаются полноценной и адекватной прижизненной визуализации (ультразвуковое исследование, компьютерная томография), что в ряде случаев связано с различной плотностью структуры миксомы, наличием вторичного тромбоза в полости предсердий сердца [5, 6].
Макроскопическая оценка миксомы сердца порой бывает затруднительной из-за схожести ее с пристеночным тромбозом, так как она может иметь вид плоского или полиповидного образования [2, 7–9].
В последние годы в литературе активно обсуждаются вопросы гистогенеза, биологических свойств, клеточной активности миксом сердца. Различные морфо-иммуногистохимические исследования, посвященные оценке белков CD31, CD34, CD44 в структуре опухоли, указывают лишь на наличие сосудистого компонента, другие же, наоборот, акцентируют свое внимание на клеточном составе опухоли без оценки ее гистогенеза [4, 10–12].
Цель исследования – уточнить гистогенез миксомы сердца с помощью морфологического и иммуногистохимического методов исследований на примере секционного наблюдения.
Материалы и методы исследования. Было произведено собственное секционное наблюдение больной 71 года, получавшей лечение на базе клиники РостГМУ. Из истории болезни известно, что больная поступила по скорой помощи в тяжелом состоянии, обусловленном развитием инсульта. В течение ряда лет больная страдала постоянной формой мерцательной аритмии, артериальной гипертензией, в связи с чем постоянно принимала антиаритмические, антигипертензивные препараты.
СКТ выявила ишемические изменения в бассейне левой средней мозговой артерии, территориальный ишемический инсульт в бассейне правой средней мозговой артерии, правосторонний полушарный отек ткани головного мозга. ЭХО-КС выявило гипертрофию левого желудочка сердца, диастолическую дисфункцию левого желудочка 1-го типа, регургитацию на митральном клапане 1-й степени.
Морфологический этап исследования включал фиксацию ткани опухоли сердца и кусочков внутренних органов забуференным 10%-ным раствором формалина в течение 24 ч с последующей автоматизированной изопропиловой проводкой в гистопроцессоре Miele (производство Италия). После проводки кусочки тканей заливались в парафин и после микротомии толщиной срезов не более 3 мкм на микротомах фирмы Leica (производства ФРГ) окрашивались гематоксилином-эозином по Массону для выявления эластических и коллагеновых волокон соединительной ткани. Проводилось иммуногистохимическое исследование к антителу альфа-актин (ready to use, фирма DAKO) в иммуностейнере фирмы BOND (производство ФРГ). Микроскопический этап исследования выполнялся с помощью микроскопа фирмы Leica модель DM 1000 с цифровой фото-видеокамерой разрешением не менее 8,5 мегапикселей с увеличением 200, 400.
Результаты исследования и их обсуждение. На вскрытии наибольшие изменения были обнаружены со стороны сердечно-сосудистой системы. В полости ушка левого предсердия сердца, в проекции fossa ovalis, имелось три образования размерами 1,5х1,5 см, 1х0,5 см, 1х0,5 см, плотно прикрепленных к пристеночному эндокарду, серовато-розового цвета, дряблой консистенции, два из которых были покрыты плотными сухими кровяными свертками темно-красного цвета. Кроме того, в сердце имелись гипертрофия преимущественно левых отделов, диффузный мелкоочаговый кардиосклероз, рубцовые изменения в передней стенке левого желудочка.
В просвете интракраниального отдела правой внутренней сонной артерии имелся обтурирующий плотный сухой темно-красный свободно извлекающийся кровяной сверток (тромбоэмбол). Правое полушарие головного мозга было представлено дряблой кашицеобразной бесструктурной массой, что указывало на наличие полушарного ишемического инфаркта головного мозга. В остальных органах отмечались острое венозное полнокровие, дистрофические изменения.
Гистологическое исследование образований полости сердца выявило особенности их строения. Пристеночный эндокард левого предсердия был утолщен за счет развития миксоматоза, с формированием опухоли, представленной клеточным и экстрацеллюлярным компонентами.
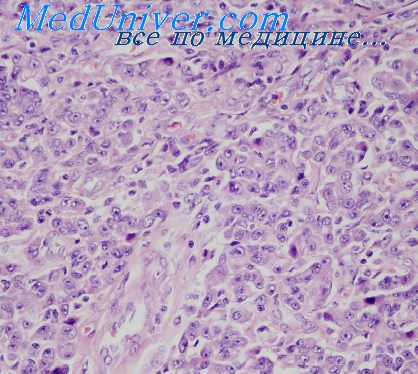
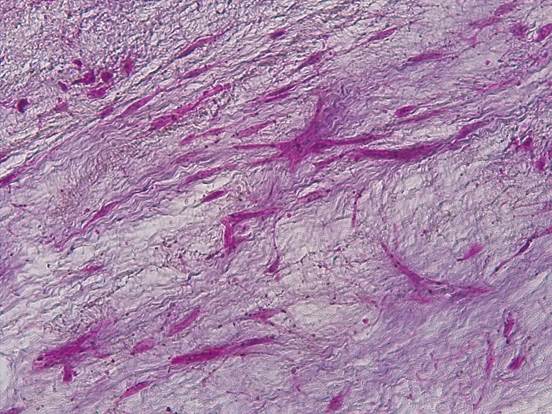
Клеточный компонент опухоли был представлен вытянутыми, паукообразными, звездчатыми светлыми элементами, то строящими отдельные мозаичные и причудливые структуры, то расположенными поодиночке (рис. 1).
Рис. 1. Клеточный компонент миксомы представлен скоплением вытянутых, звездчатых элементов со светлой цитоплазмой среди миксоидной стромы. Окраска гематоксилином-эозином. Ув.х200
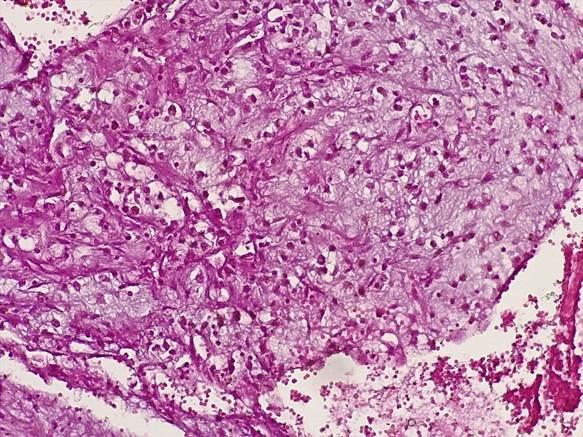
Экстрацеллюлярный компонент опухоли был представлен отечной эозинофильной стромой с признаками гиалиноза, содержащей тонкостенные кровеносные сосуды капиллярного типа, окруженные глыбками гемосидерина, светлыми и звездчатыми клеточными элементами (рис. 2). Обращало внимание, что светлые клеточные элементы опухоли содержали в цитоплазме гранулы гемосидерина (рис. 3).
Рис. 2. Миксома содержит мелкие тонкостенные сосуды капиллярного типа, окруженные глыбками гемосидерина, светлыми и звездчатыми клеточными элементами. Окраска гематоксилином-эозином. Ув.х200
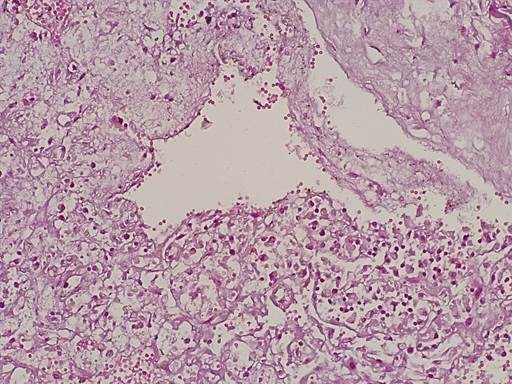
Рис. 3. Гемосидерин откладывается в светлых клетках миксомы.
Окраска гематоксилином-эозином. Ув.х400
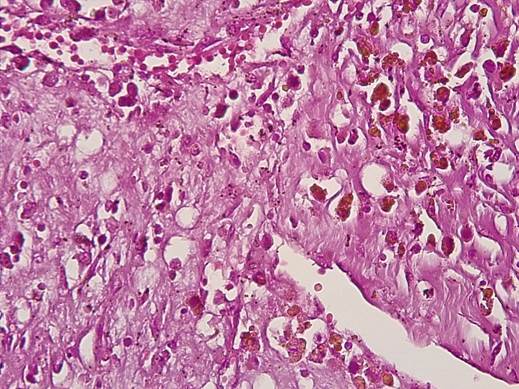
Рис. 4. Клетки миксомы представлены звездчатыми клеточными элементами, дающими позитивную реакцию в реакции Массона с докраской альфа-актином (ИГХ-реакция). Ув.х400
Для уточнения гистогенеза данных клеточных элементов опухоли была проведена комплексная гистохимическая и иммуногистохимическая окраска (реакция по Массону для выявления коллагеновых волокон, гладких миоцитов, иммуногистохимическая реакция с альфа-актином для выявления экспрессии гладких миоцитов).
Как видно на рисунке 4, клеточные элементы звездчатой формы давали положительную реакцию в окраске по Массону на альфа-актин, что указывало на то, что они являются трансформированными гладкими миоцитами, а окружающее их межклеточное вещество с обилием гликопротеинов может быть результатом их секреторной активности.
Данные морфологические, гистохимические признаки указывали на наличие доброкачественной опухоли сердца сложного строения – миксомы, а содержащиеся в ней новообразованные тонкостенные сосуды, признаки гемосидероза указывали на наличие рецидивирующих кровоизлияний в опухоли.
Можно полагать, что обилие кровоснабжения и клеточный состав миксомы могли способствовать формированию пристеночных тромбов в предсердии с развитием тромбоэмболического синдрома (тромбоэмболии интракраниального отдела правой внутренней сонной артерии с развитием правостороннего ишемического инфаркта головного мозга).
Таким образом, миксома сердца представляет собой редкую доброкачественную мезенхимальную опухоль, основным клеточным компонентом которой являются гладкие миоциты, которые совместно с гликопротеинами межуточного вещества опухоли могут являться ангиогенными факторами и способны принимать участие в развитии и прогрессировании тромбоза опухоли [13–15]. Данные факты следует принимать во внимание при разработке тактики ведения таких больных с использованием таргетных антиангиогенных (ингибиторов ангиогенеза) препаратов.
Миксоматоз стромы гистология что это
ФГБУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» РАМН, Москва; Отделение нейрохирургии Нижегородского научно-исследовательского института травматологии и ортопедии
Первый МГМУ им. И.М. Сеченова, Москва
ООО Клиника спинальной нейрохирургии «Аксис»; НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
ФГБНУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко», Москва, Россия
ООО Клиника спинальной нейрохирургии «Аксис»; НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
ФГБУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» РАМН, Москва
ФГБУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» РАМН, Москва
ООО Клиника спинальной нейрохирургии «Аксис»; НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Интрадуральная экстрамедуллярная миксома на уровне L1 позвонка
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2014;78(6): 55-59
Оноприенко Р. А., Тимонин С. Ю., Коновалов Н. А., Шишкина Л. В., Назаренко А. Г., Асютин Д. С., Мартынова М. А., Королишин В. А. Интрадуральная экстрамедуллярная миксома на уровне L1 позвонка. Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2014;78(6):55-59.
Onoprienko R A, Timonin S Iu, Konovalov N A, Shishkina L V, Nazarenko A G, Asiutin D S, Martynova M A, Korolishin V A. Intradural extramedullary myxoma at the L1 level. Zhurnal Voprosy Neirokhirurgii Imeni N.N. Burdenko. 2014;78(6):55-59.
ФГБУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» РАМН, Москва; Отделение нейрохирургии Нижегородского научно-исследовательского института травматологии и ортопедии
Миксома оболочек периферических нервов является редкой доброкачественной опухолью с преимущественной локализацией в верхних конечностях, голове, шее и грудной клетке. Приведен клинический случай интрадуральной миксомы на уровне LI позвонка. Большое внимание уделено гистологической характеристике опухоли и проведению дифференциальной диагностики между гистологическими типами доброкачественных экстрамедуллярных образований. В результате работы был сделан вывод о необходимости тщательного дополнительного обследования пациентов в случае выявления миксомы, так как возможна генерализация процесса.
ФГБУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» РАМН, Москва; Отделение нейрохирургии Нижегородского научно-исследовательского института травматологии и ортопедии
Первый МГМУ им. И.М. Сеченова, Москва
ООО Клиника спинальной нейрохирургии «Аксис»; НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
ФГБНУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко», Москва, Россия
ООО Клиника спинальной нейрохирургии «Аксис»; НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
ФГБУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» РАМН, Москва
ФГБУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» РАМН, Москва
ООО Клиника спинальной нейрохирургии «Аксис»; НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Миксома оболочек периферических нервов является редкой доброкачественной опухолью с преимущественной локализацией в верхних конечностях, голове, шее и грудной клетке. Источник роста чаще всего локализуется в дермальном слое кожи. Впервые в мировой литературе данная опухоль была описана в 1969 г. J. Harkin и R. Reed [1] назвали обнаруженную ими опухоль миксомой оболочек периферических нервов, однако позже R. Gallager и E. Helwig [2] открыли похожий на миксому гистологический тип опухоли, который получил название нейротекомы. В настоящей работе мы приводим достаточно редкий случай интрадуральной локализации опухоли в области корешков конского хвоста спинного мозга.
Клинический пример
Пациентка Е., 52 лет, поступила в НИИ нейрохирургии им. акад. Н.Н. Бурденко 06.02.14 с жалобами на выраженные боли в области поясничного отдела позвоночника, боли распространялись по передней поверхности обеих ног. Из анамнеза заболевания известно, что вышеуказанные жалобы беспокоили пациентку в течение последних 2 лет. За последний год боль усилилась, стала носить постоянный характер, что послужило причиной выполнения магнитно-резонансной томографии (МРТ) поясничного отдела позвоночника в мае 2013 г. При исследовании были выявлены две интрадуральные опухоли, располагавшиеся на уровне LI позвонка в области корешков конского хвоста и конуса спинного мозга. Образования достаточно интенсивно накапливали контрастное вещество (рис. 1, б, в).

Гистологический диагноз: миксома.
В послеоперационном периоде отмечен регресс болевого синдрома, имевшего место до операции, нарастание силы в ногах. Пациентка активизирована в 1-е сутки после операции, после чего прошла курс восстановительного лечения. Через 8 дней после операции в удовлетворительном состоянии пациентка была выписана домой.
В послеоперационном периоде через 3 мес после операции пациентке выполнена МРТ, по результатам которой подтверждено радикальное удаление опухоли (рис. 3).
Обсуждение
Миксома оболочек периферических нервов, как правило, является многоузловой доброкачественной опухолью с различной выраженностью миксоматоза стромы. По данным литературы [1], характерной локализацией являются верхние конечности, голова, шея, а также грудная клетка. Пик заболеваемости приходится на четвертую декаду жизни. В мировой практике локализация в ЦНС представляет собой редкое явление. При этом необходимо четко дифференцировать данный гистологический тип опухоли от невриномы и нейротекомы.
При гистологическом исследовании обращал на себя внимание крайне выраженный миксоматоз стромы, опухоль на большем протяжении имела тонкую фиброзную капсулу. Клетки вытянутой веретенообразной формы с эозинофильной цитоплазмой и мелкими ядрами располагались относительно редко в миксоматозном внеклеточном матриксе, ядра с четким хроматином, фигур митотического деления не отмечалось. Типичных для невриномы структур в виде телец Verocay, паттернов Antony A и B также не обнаружено. При иммуногистохимическом исследовании выявлена экспрессия протеина S100, коллагена IV типа и Vim в клетках опухоли, СD34 преимущественно в сосудах. Экспрессия гладкомышечного актина, Des, EMA была отрицательной (рис. 4, 5).


В результате проведения исследования морфологическая картина была расценена как миксома оболочек нерва.
M. Yamato и соавт. [3] использовали многоклональные антитела Schwann/2E. Особенностью данных антител является способность взаимодействовать с цитоплазмой и ядрами шванновских клеток и миелина периферической нервной системы, при этом оставаясь интактными при взаимодействии с клетками центральной нервной системы. Таким образом, авторы при выявлении в опухоли фокусов взаимодействия антител с мишенями считали, что опухоль исходит из периферических нервов. Данный факт, помимо гистологического и имуногистохимического исследований, подтверждал, что опухоль является миксомой периферических нервов [3].
Несмотря на то что миксома является опухолью дермального происхождения, в мировой практике известны случаи локализации данной опухоли в спинномозговом канале [3, 4]. Компрессия корешков спинного мозга была обусловлена капсулой опухоли. Клиническая картина зависела от топографоанатомического расположения опухоли. Так, опухоль чаще манифестировала с болевого синдрома, чувствительных и двигательных расстройств [5]. Дифференциальная диагностика, по данным МРТ, затруднительна ввиду того, что рентгенологическая картина сходна с менингиомами, невриномами, нейрофибромами и нейротекомами [6]. Поэтому формирование окончательного диагноза возможно только после получения результатов биопсии.
Заключение
Пациенты с верифицированным диагнозом «миксома» нуждаются в тщательном дополнительном обследовании, так как для данной опухоли характерна генерализация процесса с образованием узлов иной локализации, а также рецидивирующее течение.
Комментарий
В статье авторы описывают клинический случай лечения миксомы интрадуральной локализации. Стоит отметить, что подобных публикаций в мировой литературе очень мало, что, безусловно, подчеркивает уникальность и ценность этой публикации. Подробно изложены анамнез заболевания, данные клинико-инструментальных исследований, особенности оперативного вмешательства с иллюстрациями. Далее представлены данные литературы по особенностям течения миксом центральной нервной системы. Авторами совместно с патоморфологами проведен гистологический и иммуногистохимический анализ материала, обсуждены вопросы дифференциального диагноза. В работе авторы продемонстрировали успешный пример хирургического лечения миксомы редкой локализации с хорошим отдаленным результатом. Хочется отметить, что данная статья вводит миксомы центральной нервной системы, достаточно редкую патологию, в круг дифференциальной диагностики экстрамедуллярных опухолей спинного мозга и рекомендует план дальнейших действий нейрохирурга при обнаружении данной патологии.