Миофиброз что это такое
Миелофиброз – это хроническое гематологическое заболевание, характеризующееся опухолевой пролиферацией гемопоэтических стволовых клеток и фиброзом костного мозга. Основные клинические проявления включают симптомы опухолевой интоксикации и анемического синдрома (прогрессирующую слабость, бледность кожи и слизистых оболочек, потерю веса), а также увеличение селезенки (спленомегалию). Диагноз устанавливается на основании молекулярно-генетических исследований, изучения гистологической картины костного мозга. Лечение проводится с помощью химиотерапевтических препаратов. Хирургические методы лечения подразумевают трансплантацию костного мозга и удаление селезенки.
МКБ-10
Общие сведения
Миелофиброз (агногенная миелоидная метаплазия, сублейкемический миелоз) – злокачественное заболевание, при котором происходит постепенное замещение костного мозга опухолевыми стволовыми клетками и разрастающейся соединительной тканью. Впервые эту патологию описал немецкий врач Г. Хойк в 1879 году. А в 1951 году американским гематологом Уильямом Дамешеком миелофиброз был выделен в самостоятельную нозологическую единицу. При неблагоприятном течении миелофиброз способен трансформироваться в более тяжелую болезнь ‒ острый лейкоз. Распространенность миелофиброза составляет от 0,3 до 0,7 случаев на 100 тыс. населения. Пик заболеваемости приходится на возраст от 50 до 70 лет, но встречаются и молодые пациенты. Чаще страдают мужчины.
Причины миелофиброза
Существует первичный и вторичный сублейкемический миелоз. Точная причина первичного миелофиброза до сих пор не установлена. Наибольшей популярностью среди специалистов в области гематологии пользуется теория влияния генетической мутации. У большинства пациентов выявляются мутации гена тирозинкиназы (JAK2V617F), кальретикулина (CALR), тромбопоэтина (MPL), регулирующих экспрессию белков JAK-STAT сигнального пути. Гены локализуются в локусе хромосомы del3p24.
В качестве этиологического фактора изучается действие большой дозы радиоактивного излучения. Также рассматривается роль персистирующих вирусных инфекций (вируса простого герпеса, Эпштейна-Барра, цитомегаловируса), длительного приема оральных контрацептивов, миелосупрессивных лекарственных препаратов, контакта с различными органическими и неорганическими соединениями (бензолом, мышьяком). Вторичный миелофиброз развивается как исход других хронических миелопролиферативных заболеваний – истинной полицитемии, эссенциальной тромбоцитемии, хронического миелолейкоза.
Патогенез
В результате повышенной экспрессии сигнальных белков в одной из стволовых костномозговых клеток запускается активная пролиферация (опухолевая трансформация). Этот процесс сопровождается вторичным воспалением с выделением цитокинов и факторов роста. Факторы роста фибробластов и эндотелия сосудов индуцируют выработку стромальными клетками костного мозга большого количества коллагена и разрастание соединительной ткани (собственно фиброз). Постепенно нормальная ткань костного мозга замещается опухолью и соединительной тканью.
При массивном поражении опухолью костного мозга клетки крови, не достигнув стадии полного созревания, попадают в системный кровоток. Это приводит к образованию очагов экстрамедуллярного (внекостномозгового) кроветворения, главным образом в печени и селезенке. Распад опухоли ведет к высвобождению мочевой кислоты, которая откладывается в тканях суставов и почечных канальцах.
Симптомы миелофиброза
Длительное время пациент чувствует себя удовлетворительно. Через несколько лет от начала заболевания постепенно появляется опухолевая интоксикация в виде общей слабости, повышения температуры до субфебрильных цифр, потливости, усиливающейся по ночам. У больного снижается аппетит, он стремительно теряет в весе. Присоединяется анемический синдром (бледность кожных покровов, головокружение, учащение сердцебиения). Характерны носовые, десневые кровотечения, геморрагические высыпания на коже. Возникают боли в суставах, кожный зуд, боли в костях.
Пациент ощущает тяжесть и боли в левом подреберье вследствие выраженного увеличения селезенки. На фоне спленомегалии развивается синдром гиперспленизма, который заключается в массивном разрушении клеток крови (в основном эритроцитов) в синусоидах селезенки. В этом случае встречаются признаки гемолиза (желтушность кожи, слизистых оболочек, потемнение мочи).
Редкие симптомы связаны с необычной локализацией очагов экстрамедуллярного кроветворения – в легких (кашель, затруднение дыхания, кровохарканье), желудочно-кишечном тракте (боли в животе, кровавая диарея). При расположении очагов в центральной и периферической нервной системе наблюдаются эпилептические судороги, нарушения чувствительности, слабость движений в конечностях, вплоть до полного паралича.
Осложнения
При миелофиброзе часто образуются тромбы, которые приводят к острому нарушению мозгового кровообращения, инфаркту миокарда, тромбоэмболии легочной артерии. Стойкое снижение уровня лейкоцитов нередко сопряжено с различными инфекциями, приобретающими тяжелое течение. Наиболее неблагоприятным осложнением считается трансформация миелофиброза в миелолейкоз (бластный криз), трудно поддающийся терапии. К нетипичным осложнениям следует отнести патологические переломы из-за деструкции трубчатых костей и портальную гипертензию, причиной которой служит длительная обструкция микротромбами внутрипеченочных вен.
Диагностика
Курацией пациентов с миелофиброзом занимаются врачи-гематологи. При общем осмотре обращает на себя внимание изменение цвета кожных покровов, слизистых (бледность или желтушность), спленомегалия при пальпации и перкуссии селезенки, иногда достигающей гигантских размеров (до лобкового симфиза). Дополнительные методы диагностики включают:
Для достоверной постановки диагноза гематологическим сообществом разработаны специальные критерии. Большие критерии включают повышенную клеточность костного мозга с ретикулярным и коллагеновым фиброзом, наличие мутаций генов JAK2V617F, MPL, CALR. К малым критериям относятся анемия, спленомегалия, лейкоэритробластоз (присутствие в крови незрелых форм лейкоцитов, эритроцитов), а также повышение лактатдегидрогеназы. Диагноз считается подтвержденным, если имеются 2 больших критерия или 1 большой и 3 малых критерия.
Миелофиброз следует дифференцировать в первую очередь с гематологическими заболеваниями, такими как аутоиммунные гемолитические анемии, гемобластозы (лейкозы, лимфомы). Сочетание спленомегалии с симптомами интоксикации (слабостью, субфебрилитетом, ночной потливостью) требует исключения туберкулеза, подострого инфекционного эндокардита.
Лечение миелофиброза
Прогноз и профилактика
Патология мягких тканей области плечевого и тазобедренного суставов — диагностика и лечение
Рассмотрены нозологические формы периартикулярных заболеваний плечевого и тазобедренного суставов, диагностика и подходы к лечению околосуставной патологии мягких тканей с применением нестероидных противовоспалительных средств, глюкокортикостероидов.
Nosologic forms of para-articular diseases of hip and shoulder joints are analyzed, together with diagnostics and approaches to treatments peribursal soft tissues pathology with application of nonsteroidal antiinflammatory agents, glycocorticosteroids.
Периартикулярная патология широко распространена и включает в себя огромный спектр изменений от синдромов, выделенных в отдельные нозологические единицы, до симптомов, сопутствующих ревматологическим заболеваниям.
При описании мягкотканой патологии обычно используют следующие понятия:
Периартикулярные заболевания плечевого сустава представлены несколькими нозологическими формами:
1) изолированным поражением сухожилий мышц, окружающих сустав:
2) диффузным невоспалительным поражением капсулы плечевого сустава (ретрактильный капсулит);
3) субакромиальным синдромом (комплексное поражение структур, окружающих субакромиальную сумку).
Шаровидное строение плечевого сустава позволяет производить в нем разнообразные движения: сгибание, разгибание, отведение, приведение и ротацию. Следует помнить, что угол движения в плечевом суставе без участия лопатки характеризует истинный объем движений в нем, а с участием их — полный объем. При тестировании отведения плеча боль в суставе может появляться лишь в момент, когда оно достигает 70–90°. При этом большой бугорок плечевой кости поднимается вплотную к акромиальному отростку и может сдавливать проходящие здесь структуры (сухожилие надостной мышцы и субакромиальную сумку). При продолжении подъема руки большой бугорок отходит от акромиального отростка и боли значительно уменьшаются. Такая болезненная дуга характерна для тендинита надостной мышцы или субакромиального бурсита. Появление боли в момент максимального отведения руки в плечевом суставе (до 160–180°) указывает на поражение ключично-акромиального сустава. При переднем вывихе отмечается смещение головки плечевой кости кпереди и книзу, что ведет к характерному изменению контуров плеча и резкому ограничению подвижности из-за болезненности (табл. 1).
При тендинитах мышц плеча рекомендуется следующее:
Лечение кальцифицирующего тендинита сухожилий вращательной манжеты плеча соответствует тем же принципам, что и при обычном тендините. Однако кальцифицирующий тендинит редко излечивается полностью и часто рецидивирует. Имеются данные об эффективности в ряде случаев экстракорпоральной ударноволновой терапии в отношении как болевого синдрома, так и самих кальцификатов.
Ретрактильный капсулит следует рассматривать как один из вариантов синдрома рефлекторной симпатической дистрофии (изолированно или в рамках синдрома «плечо–кисть»), который отличается от тендинитов отсутствием дегенеративного компонента в патогенезе, диффузностью поражения капсулы плечевого сустава, проявляющегося фиброзом, вовлечением костных структур в виде регионарного остеопороза.
Лечение ретрактильного капсулита направлено на физическую реабилитацию с восстановлением первоначального объема движений в плечевом суставе, подчиняется принципам лечения рефлекторной симпатической дистрофии.
Субакромиальный синдром (субакромиальный синдром столкновения) развивается вследствие нарушения баланса между мышцами — стабилизаторами и депрессорами головки плечевой кости (надостной, подостной, подлопаточной и двуглавой мышцы плеча), что приводит к уменьшению пространства между головкой плечевой кости и акромионом, к хронической травматизации сухожилий мышц вращательной манжеты плеча при движениях.
Выделяют стадии субакромиального синдрома.
I. Отек и кровоизлияния в сухожилиях.
II. Фиброз, утолщение сухожилий, появление в них частичных надрывов.
III. Полные разрывы сухожилий, дегенеративные костные изменения, вовлекающие нижнюю поверхность акромиона и большой бугорок плечевой кости.
Лечение субакромиального синдрома зависит от степени выраженности клинических проявлений и стадии процесса. При I стадии — избегать подъема руки над головой, пробная терапия полными дозами НПВС в течение двух недель, подакромиальное введение глюкокортикостероидов (ГКС) (повторная инъекция не ранее чем через 6 недель), физиотерапевтическое лечение при наличии слабости мышц плечевого пояса (через 1–2 недели). При II стадии — медикаментозное лечение (см. выше), при неэффективности в течение года — субакромиальная декомпрессия (пересечение клювовидно-акромиальной связки с передней акромионопластикой), при III стадии — артроскопическая ревизия субакромиального пространства, удаление остеофитов, восстановление целостности сухожилий.
Поражение периартикулярных тканей области тазобедренного сустава
Тазобедренный сустав — крупный шаровидный сустав, который обладает значительным объемом движений: сгибание/разгибание, отведение/приведение, пронация/супинация. Подвижность тазобедренного сустава обусловливается удлиненной шейкой бедренной кости, которая образует с осью конечности угол 130°. Наиболее частыми причинами болей в тазобедренных суставах служат травмы, артриты (остеоартроз (ОА), ревматоидный артрит), асептический некроз головки бедренной кости, рассекающий остеохондрит (болезнь Пертеса), инфекции (например, остеомиелит, туберкулезный коксит). Однако нередко встречается и патология мягких тканей, окружающих сустав (табл. 2).
Наиболее трудная диагностическая ситуация возникает тогда, когда пациент жалуется на боли в области тазобедренного сустава, но при рентгенологическом исследовании изменений не обнаруживается. В этих случаях имеет значение:
Наиболее частой причиной боли становятся бурситы в области больших вертелов, для которых характерны:
Лечение околосуставной патологии области тазобедренного сустава должно учитывать основное заболевание (например, ОА — назначение «хондропротективных» средств, контроль массы тела; серонегативный спондилоартрит — назначение болезнь-модифицирующих препаратов (сульфасалазин, метотрексат и др.), туберкулезный коксит — противотуберкулезных специфических средств и т. д.). Нередко основными методами лечения становятся локальное введение ГК, проведение электрофореза и ионофореза, назначение миорелаксантов.
Одно из основных направлений в лечении околосуставной патологии мягких тканей — это назначение различных форм НПВС. Противовоспалительная и анальгетическая активность НПВС связана с уменьшением продукции простагландинов. Противовоспалительное действие НПВС обусловлено подавлением активности циклооксигеназы (ЦОГ) — основного фермента метаболизма арахидоновой кислоты на пути превращения ее в простагландины. Механизмы действия НПВС достаточно хорошо изучены, описаны также основные побочные эффекты данной группы лекарственных средств, ограничивающие их применение у пациентов в группах риска. Альтернативой пероральному и парентеральному использованию НПВС, а также важным вспомогательным компонентом комплексного лечения болевого синдрома при периартикулярной патологии является локальная терапия с применением НПВС. В настоящее время сформулированы основные требования к локальной терапии: препарат должен быть высокоэффективен, не должен вызывать местных токсических и аллергических реакций, а также обладать способностью к проникновению через кожу, достигая ткани-мишени, концентрация препаратов в сыворотке крови не должна достигать уровня, приводящего к побочным эффектам. Наиболее удачной формой для локальной терапии является использование геля, в составе которого спирт в качестве растворителя обеспечивает быстрое всасывание действующего вещества в поверхностно расположенные структуры сустава. Поэтому применение геля является оправданным по сравнению с мазями или кремами и более экономичным. Всем этим требованиям отвечает Дип Рилиф — двухкомпонентный гель для наружного применения на основе ибупрофена 5,0% и ментола 3,0% природного происхождения, в котором анальгетический и противовоспалительный эффекты ибупрофена дополняются и усиливаются терапевтическими свойствами левоментола (оптического изомера ментола) за счет рефлекторной реакции, связанной с раздражением нервных окончаний кожи, стимуляцией ноцицепторов. Благодаря компонентам основы геля молекулы ибупрофена в связанном состоянии проникают сквозь поверхностный слой кожи. Ментол обуславливает освобождение сосудорасширяющих пептидов, что приводит к дополнительному отвлекающему, обезболивающему эффектам, вызывая ощущение легкой прохлады. Для усиления локального противовоспалительного эффекта средство должно наноситься многократно в течение дня. Клинические исследования последних лет показали, что минимальным является 4-кратное нанесение локального средства в течение суток. При активном воспалении с максимально выраженными болями нанесение препарата следует увеличить до 6 раз в день.
Литература
Н. А. Шостак, доктор медицинских наук, профессор
Н. Г. Правдюк, кандидат медицинских наук
А. А. Клименко, кандидат медицинских наук, доцент
ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздравсоцразвития, Москва
Что такое миофасциальный синдром? Причины возникновения, диагностику и методы лечения разберем в статье доктора Коршуновой Юлии Витальевны, невролога со стажем в 31 год.
Определение болезни. Причины заболевания
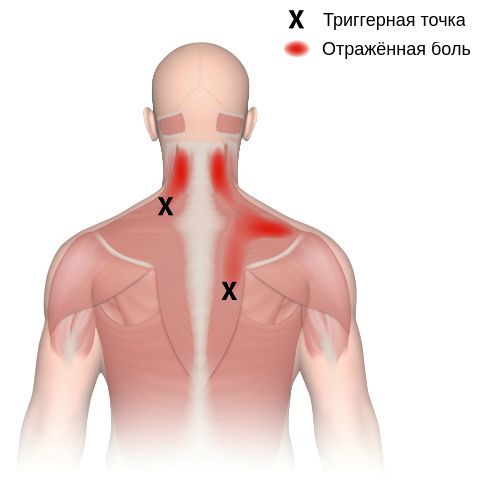
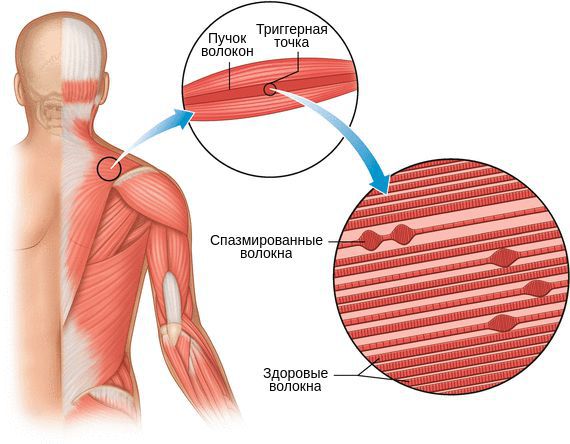
Миофасциальный синдром — это болезненное состояние, для которого характерна боль в любой части тела и болезненные мышечные напряжения с локальными уплотнениями — триггерными точками. Источником такой боли становятся мышцы и фасции — соединительная ткань, покрывающая мышцы.
Миофасциальная боль — одно из проявлений миофасциального синдрома. Она развивается при хронической скелетно-мышечной боли и может возникать в любых скелетных мышцах.
Триггерные точки, как и миофасциальная боль, могут располагаться в любой мышце. Их появление не зависит от расы и пола, однако с возрастом риск образования увеличивается.
Развитию миофасциальной боли способствуют многие факторы:
Боль в поражённых внутренних органах и суставах приводит к защитному напряжению мышц. Это позволяет разгрузить сустав и создать мышечный корсет вокруг внутреннего органа. Например, при некоторых болезнях желудка тонус сгибателей шеи снижается, а тонус разгибателей повышается. Это приводит к боли в области затылка.
Эмоциональный стресс также сопровождается мышечным напряжением, чем может активировать триггерные точки. При этом мышцы могут оставаться в спазмированном состоянии даже после прекращения стресса.
Другими причинами миофасциального синдрома могут стать длительное статическое напряжение мышц и стереотипные движения, особенно в условиях низкой температуры. К таким факторам относят частые повороты и наклоны туловища, однообразный тяжёлый физический труд, длительную сидячую работу в офисе или долгие поездки за рулём.
Спровоцировать появление триггерных точек может сдавление мышц ремнями, лямками рюкзака, узкими бретельками, тугими джинсами или тяжёлой шубой.
Ещё одна причина — длительная неподвижность мышцы, например сон в одной и той же позе или ношение гипса после перелома.
Свой вклад в формирование миофасциального синдрома также вносят:
Симптомы миофасциального синдрома
Классическими признаками миофасциальной боли являются:
Пациенты с миофасциальной болью обычно жалуются на местные ноющие и плохо локализуемые боли в мышцах и суставах, которые часто не дают им уснуть. Боль может быть очень сильной и отдавать в конечность. Такое состояние пациенты часто трактуют, как ущемление нерва.
Миофасциальная боль может вызывать напряжение, мышечную слабость, треск и щелчки в суставах, а также вегетативные явления, например потливость, ощущение «ползания мурашек» и изменения температуры кожи.
Спазмированная мышца, сдавившая проходящий рядом кровеносный/лимфатический сосуд или нерв, может вызвать дополнительные симптомы, такие как онемение и отёк части тела. При спазмировании мышц шеи может возникнуть головокружение, заложенность и шум в ухе.
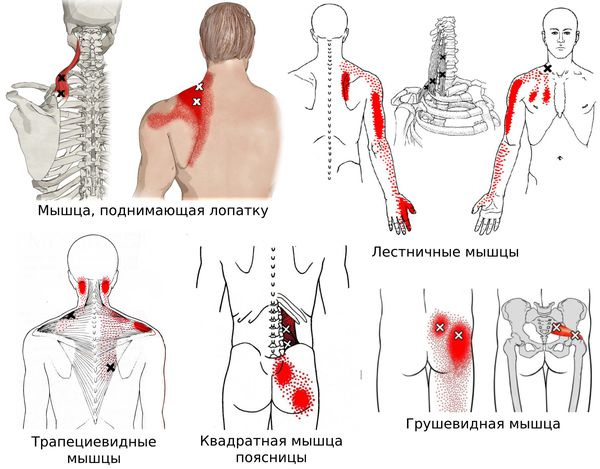
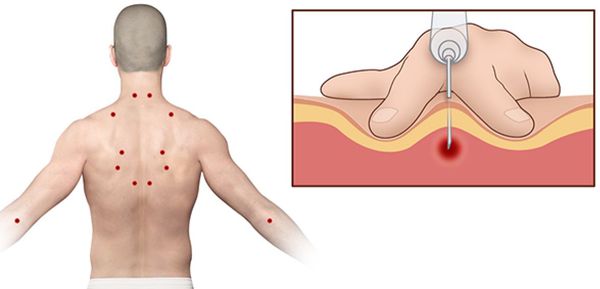
Согласно наблюдениям, чаще спазм возникает в мышце, поднимающей лопатку, грушевидной, трапециевидной, лестничной мышцах и квадратной мышце поясницы.
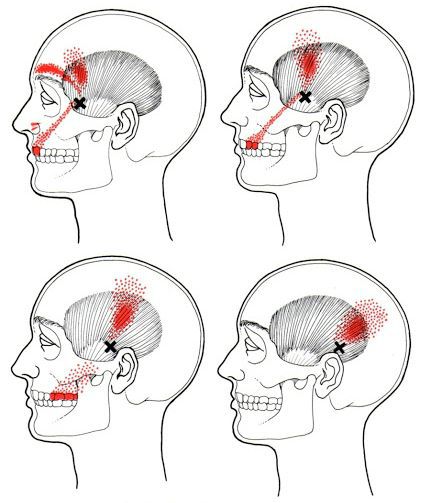
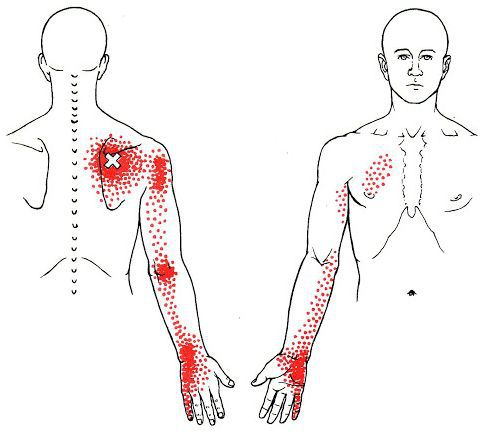
Каждой точке характерны свои зоны иррадиации. Например:
Активные триггерные точки являются непосредственным источником боли. После их стимуляции боль распространяется в отдалённые, но строго определённые зоны, как на картинках выше.
Уплотнение участка мышцы может предшествовать формированию триггерной точки, поэтому его появление не всегда сопровождается болью.
Патогенез миофасциального синдрома
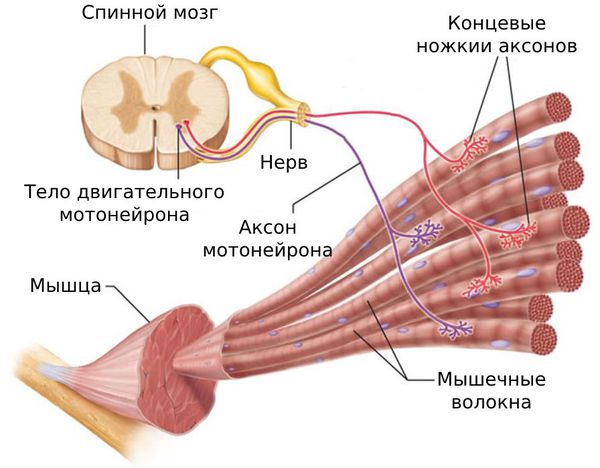
Патофизиология миофасциальной боли не совсем понятна. Считается, что в основе этой патологии лежит нарушение сократимости мышц и уменьшение их способности к расслаблению.
Длительный спазм приводит к рубцеванию мышцы и формированию триггерных точек. Мышца становиться менее растяжимой, что ведёт к ограничению движений.
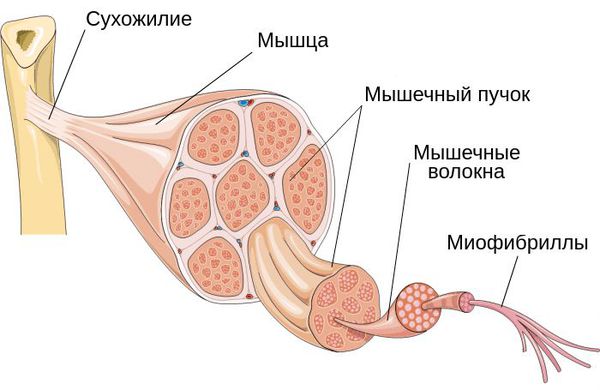
Поражение может локализоваться как в пределах нескольких миофибрилл — микроструктурной части мышцы, так и в мышечных группах.
Один из показателей изменения тонуса мышц — наличие локальных уплотнений. Они могут образоваться в вялой (гипотоничной) мышце в виде малоактивных образований или как триггерный феномен в виде уплотнённого участка мышцы с выраженной местной и отражённой болью и локальным судорожным ответом.
Классификация и стадии развития миофасциального синдрома
В Международной классификации болезней (МКБ-10) нет отдельного кода для миофасциального синдрома. Он относится сразу к нескольким рубрикам:
Первичный синдром связан с первоначальной дисфункцией мышцы, например перерастяжением, повторной микротравмой, переохлаждением мышцы и работой за компьютером в неправильной позе.
Течение миофасциальной боли разделяют на три фазы:
Осложнения миофасциального синдрома
Лечение триггерных точек временно облегчает боль, иррадиирующую из внутренних органов. Б ез лечения миофасциальный синдром может усугубить симптомы остеохондроза, сколиоза или другого основного заболевания, тем самым формируя порочный круг.
В качестве осложнений также можно отметить сдавление сосудов и нервов спазмированной мышцей. Это состояние приводит к радикулиту и вазомоторным нарушениям: приливам, повышенной потливости и побледнению кожи.
Диагностика миофасциального синдрома
Чтобы поставить диагноз «миофасциальный синдром», необходимо выявить у пациента пять больших критериев и один из трёх малых.
Физикальное обследование
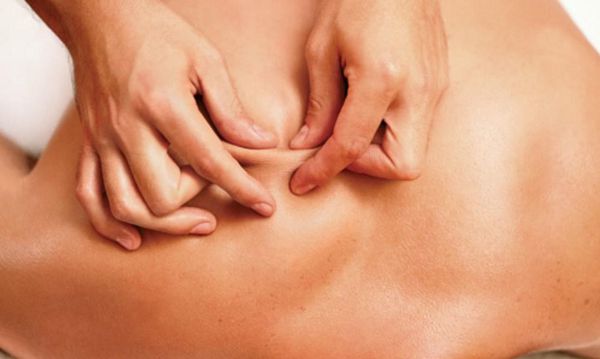
Поиск триггерных точек — наиболее важная часть осмотра при подозрении на миофасциальный синдром. Как правило, они находятся в определённых участках мышц. При давлении на такие точки пациент подпрыгивает или вздрагивает от боли и дискомфорта. Причём боль возникает в характерной для каждой мышцы области.
Пальпируя мышцу перпендикулярно мышечным волокнам, можно обнаружить узел или тугой тяж — веревкообразное утолщение. Это и есть триггерная точка. Пальпация данной зоны очень болезненна.
В области активных и латентных триггерных точек пальпируемой мышцы могут отмечаться подёргивания, местные вегетативные реакции и сенсорные нарушения, такие как парестезии и дизестезии.
Парестезии — это ощущения, которые возникают без каких-либо раздражителей, например ползание мурашек.
Дизестезии — это ощущения, которые не соответствуют силе раздражителя. В таких случаях лёгкое прикосновение к коже может вызывать неприятные ощущения или даже сильную боль.
Часто сенсорные нарушения соответствуют зоне распространения боли.
Лабораторные исследования
Лабораторных тестов, выявляющих миофасциальный синдром, не существует. Однако они полезны в поиске предрасполагающих факторов, таких как гипотиреоз, гипогликемия и дефицит витаминов.
Перечень анализов включает общий анализ крови, скорость оседания эритроцитов (СОЭ), биохимический профиль и определение уровня витаминов C, B1, B6, B12 и фолиевой кислоты. На причину миофасциальной боли могут указать любые отклонения в результатах данных тестов.
Анализ на тиреотропин, или тиреотропный гормон (ТТГ), может быть полезным при наличии клинических признаков заболевания щитовидной железы. Допустимые значения тиреотропина для взрослых составляют 0,3-4,2 мкме/мл.
Дополнительные методы исследования
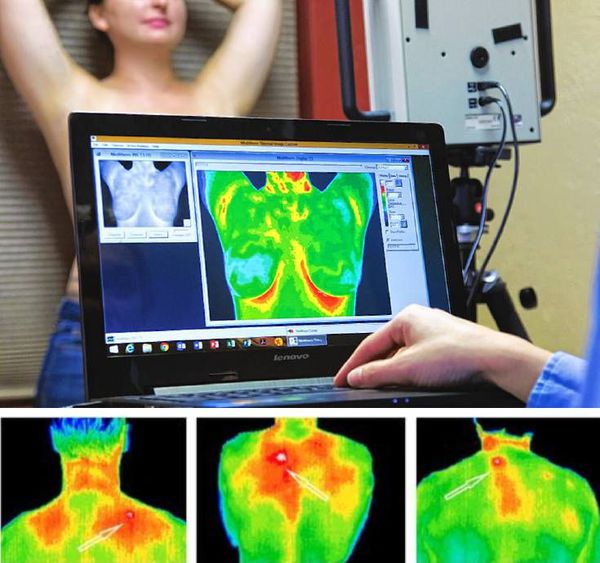
Инфракрасная или жидкокристаллическая термография позволяют визуализировать усиление кровотока, которое иногда отмечается в триггерных точках. Но данные методики применяются редко, так как они не являются стандартизированными.
Дифференциальная диагностика
В ходе обследования важно исключить другие причины боли: фибромиалгию, радикулопатию, дискогенную боль, спондилогенную боль, заболевания суставов (артрозы, артриты ) и болезни внутренних органов.
Лечение миофасциального синдрома
В лечении миофасциальной боли применяют комплексный подход. Он предполагает устранение патологического мышечного напряжения и триггерных точек.
При первичном синдроме проводится местное воздействие на поражённые структуры:
При вторичном синдроме на первый план выходит лечение основного заболевания.
К медикаментозным методам лечения миофасциальной боли относят:
НПВП снимают боль, воспаление и понижают температуру тела. Механизм их действия основан на подавлении активности веществ, которые участвуют в каскаде воспалительных реакций.
При выраженном болевом синдроме назначают низкие дозы трициклических антидепрессантов. Они уменьшают мышечную боль и обладают седативным эффектом.
Ишемическая компрессия триггерных точек направлена на прекращение или значительное снижение мышечного напряжения и уменьшение боли. Триггерная точка сдавливается кончиками пальцев и удерживается 60-90 секунд с постепенным увеличением силы давления.
Одновременно со сдавливанием триггерной точки производится растяжение поражённой мышцы. Это позволяет сократить время процедуры: чем больше мышца растягивается, тем сильнее она расслабляется, снимается гипертонус, быстрее происходит обезболивание.
Пациенты, принимавшие участие в эксперименте, были разделены на три группы по 20 человек: первую группу лечили в течение 4-х дней с помощью лидокаинового пластыря, приклеенного на триггерную точку; второй группе назначался пластырь с плацебо; а третья группа получала инъекции 0,5 % гидрохлорида бупивакаина.
Исследователи обнаружили, что в первой и третьей группах значительно уменьшились субъективные симптомы и увеличился порог болевой чувствительности. Причём эффективность терапии оказалась выше у пациентов третьей группы, которая получала инъекции анестетика, но они испытывали больший дискомфорт от проводимого лечения, чем пациенты из первой группы.
Пластырь используют только один раз в сутки. Его приклеивают на сухую неповреждённую кожу в области боли не больше чем на полдня, после чего делают перерыв не менее 12 часов. Перед приклеиванием пластыря волосы на коже нужно состричь ножницами, не сбривать.
Одновременно можно использовать не больше трёх пластырей. Если потребуется, пластырь можно разрезать на части, но только перед удалением защитной плёнки. Повторно использовать снятый пластырь не следует.
Важно регулярно оценивать эффективность такой местной терапии. Это позволит определить оптимальное количество пластырей, которые можно использовать одновременно, чтобы покрыть область боли или увеличить время между аппликациями.
Через 2-4 недели от начала лечения эффективность аппликаций нужно оценить повторно. Если за это время ответ на терапию был недостаточным или терапевтический эффект определяется только защитными свойствами пластыря, лечение следует прекратить.
В лечебный комплекс должны быть включены упражнения по перестройке неоптимального двигательного стереотипа. Они корректируют позы и движения, выполняемые в быту и во время работы.
В университете штата Мичиган проводилось изучение различных методик массажа и мануальной терапии, в результате которого был разработан специальный метод воздействия на миофасциальные структуры — » миофасциальный релиз «. Данная техника предполагает самостоятельное выполнение упражнений, без помощи врача или массажиста, что даёт возможность регулировать степень нажатия на мышцы и их растяжение, руководствуясь своими ощущениями.
Миофасциальный релиз можно выполнять с помощью различных инструментов: пенопластовых и ручных роликов, латексных шариков или других вспомогательных устройств. Они позволяют снять излишнее напряжение в триггерных точках, расслабить мышцы и связочный аппарат путём воздействия на фасцию. В результате наступает полное расслабление одной или группы мышц.
Механизмы, лежащие в основе миофасциального релиза, изучены недостаточно. Исследования, пытающиеся проиллюстрировать эффективность данной техники, часто плохо спланированы и не дают ответа на вопросы о том, как долго должна проводиться эта процедура, какой должна быть сила давления на поражённую мышцу и какое приспособление лучше подходит для упражнений.
Программа реабилитации предполагает использование ортезов: корсетов, бандажей, специальной обуви, стелек и пр. Ортопедические стельки, специальная ортопедическая обувь и подпяточники, к примеру, могут быть полезны для коррекции длины ног.
Прогноз. Профилактика
Миофасциальный синдром — не опасное для жизни состояние, но оно может значительно снизить качество жизни и стать основной при чиной временной нетрудоспособности.
Всем людям, старше 18 лет, Всемирная организация здравоохранения рекомендует:
Если мышцы будут крепкими, упругими, эластичными, с хорошим кровоснабжением, то в условиях перегрузок они либо не пострадают, либо пострадают минимально и быстро восстановятся.
Помимо ведения активного образа жизни важно избегать провоцирующих факторов и не заниматься самолечением при появлении боли, независимо от её локализации.

_550.gif)
_550.gif)