Миопатия дюшенна дистрофия мышц что это такое
Лечится ли миодистрофия Дюшенна?
Время чтения: 5 мин.
Лечится ли миодистрофия Дюшенна?
Миодистрофия Дюшенна встречается так же часто, как СМА (спинальная мышечная атрофия), но болеют практически только мальчики. Согласно статистике, один из 3500-5000 мальчиков в мире рождается с мышечной дистрофией Дюшенна.
Терапия СМА и Дюшенна: в чем разница?
При всей катастрофичности СМА молекулярная и клеточная основа этого заболевания проще и понятнее, чем у миодистрофии Дюшенна.
Лекарство можно ввести в спинной мозг, оно не размывается по всему организму, не метаболизируется печенью и не выводится почками. Создается его локальная высокая концентрация. Одной инъекции хватает на несколько месяцев. А если это генотерапия, то полноценный замещающий генетический материал, однажды попав в больную нервную клетку, вылечивает ее, остается там надолго, если не на всю жизнь.
В случае миодистрофии Дюшенна все сложнее: ген дистрофина — один из самых больших. Он больше гена СМА почти в полторы тысячи раз, и в нем тысячи разных мутаций (делеции, дупликации, нонсенс и т.д.) в разных местах.
Ген не помещается целиком в вирус, поэтому используют только кусочки гена — мини- и микродистрофин, которые могут ограниченно восстановить функциональность мышечных клеток, перевести «Дюшенн в Беккер» — более легкую форму миодистрофии, при которой человек может прожить до 60 лет, сохранять дееспособность, работать.
Мышечные клетки составляют 40% от всех клеток тела, они активно работают и постоянно заменяются. Доставить лекарство в мышечные клетки – трудная задача: оно должно с кровью попасть во все клетки, а раз с кровью, то с лекарством борется печень, и оно выводится через почки. Итог – низкая концентрация и ограниченное время действия.
Генотерапия мини- и микродистрофином – подводные камни на каждом этапе. У ребенка может быть имеющийся иммунитет к вирусу-переносчику гена, таких детей примерно 30%. Компании сейчас работают над тем, как убрать антитела к вирусу из крови. И пока пациентам доступна только одна попытка генотерапии в жизни, потому что после инфузии уже точно будет выраженный противовирусный иммунитет.
Но результат стоит того, тем более с осложнениями врачи научились бороться. И, конечно, будут другие технологии, лучше и безопаснее, которые смогут преодолеть существующие проблемы.
Больные МДД как снежинки: все разные
Сделать лекарство для МДД сложно, один препарат не вылечит всех, как при СМА.
Больные МДД как снежинки: все разные, нет одинаковых, уже описано около десяти тысяч мутаций гена. Имеет значение и вся генетика ребенка. Поэтому болезнь проявляется по-разному, даже в одной семье у двух братьев с одной мутацией.
| Препарат | Одобрено международными регуляторами | Ожидаемая дата регистрации в РФ | Возраст начала терапии |
|---|---|---|---|
| Аталурен | EMA 2012 | 24.11.2020 | 2 года |
| Экзондис 51 | FDA 2016 | 2021-22 | С момента постановки диагноза |
| Вайондис, Вилтепсо 53 | FDA 2020, Япония | 2021-22 | 4(NS) 0 (S) |
| Амондис | FDA 2021 | 2022 | С момента постановки диагноза |
| Мини/микродистрофин AAV вектор (4) | 2021-22 | 2 года | |
| Гивиностат | 2021-22 | ||
| Ваморолон | 2021-22 | 2 года | |
| Тамоксифен | Off-label | 2022 | |
| ГКСФ (гранулоцитарный колониестимулирующий фактор) | Off-label | 2022 |
Мы живем во время орфанной революции, когда многие редкие генетические неизлечимые заболевания получают патогенетической лечение, и больные обретают возможность жить долгой полноценной жизнью. Новые лекарства могут превратить фатальную болезнь в хроническую, хоть и тяжелую, как, например, диабет.
Как получить лекарства?
Если у вашего ребенка выявили миодистрофию Дюшенна, и вы хотите получить терапию для него, нужно прежде всего иметь подтвержденный генетический диагноз с определением мутации, которая вызвала заболевание. Примерно в 1% случаев не удается выяснить тип мутации. В таком случае делают биопсию мышцы и определяют количество синтезируемого мышцами дистрофина.
Как участвовать в клинических исследованиях?
Сейчас активно проводятся клинические исследования нескольких лекарственных препаратов. О том, какие из них исследуются в России, можно узнать на сайте Минздрава РФ. Заполнив форму, введя название препарата (Аталурен), можно узнать, в каком учреждении проводится исследование. Родителям необходимо самостоятельно связаться с учреждением, чтобы попробовать попасть в число участников.
Информацию о новых препаратах и клинических исследований в области миодистрофии Дюшенна можно найти и в пациентских сообществах, например, ProДюшенн.
Материал подготовлен с использованиюем гранта Президента Российской Федерации, предоставленного Фондом президентских грантов.
Использовано стоковое изображение от Depositphotos.
«Ты особенный малыш»: что делать, если у ребенка миодистрофия Дюшенна
Мышечная дистрофия Дюшенна (МДД) – редкое генетическое заболевание, которое обычно поражает мальчиков (примерно одного из 3500–5000). Болезнь развивается из-за мутаций в гене дистрофина и разрушает мышцы: сначала ребенок перестает ходить, а со временем и дышать. Пока заболевание остается неизлечимым.
Эту болезнь врачи в России часто диагностируют поздно. Ольга Гремякова, мама семилетнего Гордея, сама догадалась, что у ее сына миодистрофия Дюшенна: заметила симптомы, нашла информацию и отвезла сына к врачам, которые подтвердили ее опасения.
Ольга и ее семья создали благотворительный фонд «Гордей», чтобы улучшать качество медицинской, социальной и психологической помощи пациентам с МДД и их семьям. В декабре фонд провел первую в России конференцию для родителей и врачей, посвященную миодистрофии Дюшенна.
Поговорили с Ольгой о том, как распознать болезнь и с чем сталкиваются пациенты с МДД и их семьи после постановки диагноза.
От первых симптомов до диагноза
Прислушиваться к себе
Я видела, что Гордей отличается от других ребят, но не понимала, почему. До трех лет он не разговаривал. Был немного неуклюжий, не умел прыгать и бегать. Мне говорили, что причина в тяжелых родах, поэтому нужно немного подождать, и он перерастет эту неуклюжесть. Либо мягко намекали на то, что я просто тревожная мама, которая беспокоится за своего первого малыша. Когда мы проходили обследования перед детским садом, все специалисты в очередной раз сказали, что сын здоров. Не насторожился никто – ни врачи, ни моя мама, доктор медицинских наук.
Кроме того, Гордей был и остается очень требовательным и чувствительным ребенком, с ним сложно взаимодействовать. Родные говорили, что это я воспитала его таким: он капризный и просится на ручки не из-за усталости, а потому что манипулирует. Ну что скажешь в этот момент? Я действительно думала, что сама виновата. Тогда я не знала, что эти особенности тоже связаны с его болезнью.
Заметить симптомы
Я услышала о миодистрофии Дюшенна за пару лет до того, как ее диагностировали у Гордея. Это была история Ольги и Петра Свешниковых – учредителей фонда «Мой Мио», которые усыновили ребенка с МДД. Этот поступок вызвал у меня бесконечные уважение и восхищение. Но тогда я просто прочла об этом и продолжила жить дальше. Спустя какое-то время я увидела в фейсбуке историю папы и сына с МДД. После фразы «я смотрел на его икры, они были такие мускулистые, а сил-то в них не было» картинка в голове полностью сложилась. Я погуглила симптомы и поняла, что с моим ребенком.
Главный признак мышечной дистрофии – прогрессирующая мышечная слабость. Специфические симптомы появляются в разном возрасте и в разных группах мышц, в зависимости от типа мышечной дистрофии. Обычно первые признаки МДД проявляются к двум-трем годам. Ребенок может часто падать, медленно бегать, ходить на цыпочках или вразвалочку. Ему может быть сложно вставать с пола и подниматься по лестнице. Часто у ребенка с МДД непропорционально большие икры. Сначала слабость более выражена в мышцах бедер, но со временем она распространяется и на другие, включая мышцы, участвующие в дыхании. У ребенка может быть задержка двигательного и речевого развития, трудности в обучении. МДД также влияет на память, манеру общения и эмоциональное состояние.
Уже через пару часов Гордей сдал кровь. Как мы дожили до конца дня, я не помню. Ночью проснулась, проверила почту и нашла письмо от лаборатории: уровень креатинкиназы – 23076 при норме у мальчиков до 200!
На следующий вечер я укладывала сына спать и сказала ему: «Гордей, я теперь все про тебя знаю. Знаю, что ты устаешь, что у тебя не очень сильные мышцы, что ты такой вот особенный малыш». Гордюше тогда было четыре с половиной года. Он ничего не сказал, а просто тихонечко заплакал. Наверное, для него было важно, что его наконец понимают.
При подозрении на МДД берут анализ крови на креатинкиназу (КК) – фермент, который мышцы выделяют при повреждении. Высокий уровень КК – характерный признак миодистрофии Дюшенна. Для подтверждения диагноза используют генетические тесты – они находят крупные мутации в гене дистрофина. Если крупных мутаций не нашли, врачи сделают секвенирование (расшифровку последовательности) гена, чтобы найти мелкие точечные мутации.
Если обращать внимание на характерные симптомы, то диагностировать МДД можно рано – например, с года до двух. Но для этого врачи должны заметить признаки миодистрофии Дюшенна в потоке пациентов. По мнению Ольги, идеальным диагностическим решением было бы добавить к неонатальному скринингу тест на креатинкиназу – он простой и стоит около 400 рублей.
К сожалению, примерно половина мальчиков с МДД исходно получает неверный диагноз. Чаще всего гепатит, потому что из-за распада мышц растет уровень ферментов трансаминаз, что обычно соотносят с болезнью печени. Также мальчикам ставят перинатальное поражение ЦНС, аутизм, задержки двигательного и речевого развития и даже ДЦП. Иногда МДД диагностируют очень поздно – в возрасте от 8 до 12 лет, когда симптоматика становится заметной и папы начинают носить мальчиков на руках.
 |
Ольга с детьми. Фото из личного архива
Делать все возможное
Первое изменение в жизни моей семьи – это зашкаливающий уровень боли. Боли от диагноза нашего любимого малыша, которого еще пару дней назад мы считали здоровым. Вскоре у меня развилось состояние предвосхищающего горя: ты знаешь, что ребенок жив, но думая о его диагнозе, понимаешь – все предопределено. Рухнуло все: представление о счастливом материнстве, где я – мама двух прекрасных здоровых малышей, о будущем, где сын будет катать меня на машине и мы вместе будем делать всякие штуки. Рухнула моя идентичность – как мамы и как женщины.
Я плохо помню первые два года жизни после постановки диагноза. Через полгода у меня началась депрессия: не было сил даже на самые обычные дела, я чувствовала себя разбитой, ничто меня не радовало… Мое состояние заметила мама и настояла на обращении к врачу – сама я, несмотря на психологическое образование, депрессии у себя не заметила. Врачи помогли. Все же я не могла пару месяцев лежать лицом к стене – нужно было заниматься детьми.
Мы решили, что будем пользоваться каждым днем и делать для Гордея все возможное, чтобы он чувствовал себя лучше. Да, волшебной таблетки у нас нет, но мы в силах снизить риск контрактур (ограничение подвижности сустава – прим. авт.) голеностопа и других осложнений, которые усаживают мальчиков в коляску раньше.
Физические упражнения, растяжка и низкоинтенсивные аэробные нагрузки (ходьба и плавание) помогают пациентам с МДД сохранить мышечную силу и диапазон движений в суставах. Специальные изделия – туторы – могут поддерживать голеностопный сустав и стопы в правильном положении, замедлять прогрессирование контрактур. Чем дольше ребенок ходит и чем позднее понадобится коляска, тем лучше для сердца и дыхательной системы и тем ниже риск развития сколиоза, требующего оперативного вмешательства.
Чтобы вернуть себе ресурс и сражаться за ребенка, с первого дня учитесь делать ему растяжки ахиллового сухожилия, голеней и бедер – по 20–30 минут ежедневно. Благодаря таким занятиям мальчик сможет ходить дольше. Когда родитель «своими руками» продлевает ребенку активные годы, это очень важно для обоих.
От непонимания до взаимной поддержки
Совершенствовать систему
Со временем мы узнали, как устроена помощь пациентам с миодистрофией Дюшенна. Помимо небольших выплат государство предлагает мальчикам санаторно-курортное лечение. Но пока система плохо понимает, что именно нужно детям с МДД. На опыте Гордея могу сказать, что предлагают обычно не то и не там – хоть и очень стараются. Два раза в год мальчикам и юношам с миодистрофией положена реабилитация – и это не массажи и грязи. Она конечно есть, но далеко не везде соответствует международным стандартам. Более того, не везде она человечная. Иногда мамы с сыновьями сбегают с реабилитации, потому что еда плохая, обращение еще хуже, занятий нет.
Также существует ИПРА – индивидуальный план реабилитации (абилитации). В него вписывают технические устройства, предлагаемые государством, например коляски и туторы. Но часто эти устройства не подходят ребенку, и родители вынуждены покупать другие за свой счет – при этом стоимость компенсируют не всегда. Это очень чувствительный вопрос для семьи, и самые большие трудности возникают именно со средствами передвижения для неходячих мальчиков.
Получается, что государство помогает, но сами механизмы негибкие и нуждаются в пересмотре. По международным стандартам реабилитации ребятам с МДД нужны теплый бассейн, правильные растяжки, полный медицинский чекап и сильная мультидисциплинарная команда. Еще год назад в России не было центров, где могут все это предложить. Сейчас самый современный вариант – реабилитация в Центральной клинической больнице, программу которой разработали эксперты ЦКБ в сотрудничестве с нашим фондом. Она соответствует лучшим международным практикам и в этом смысле уникальна для России.
Но такой центр один, а мальчики с МДД рождаются по всей стране. Их примерно четыре тысячи, при этом для системы здравоохранения видны не более полутора тысяч. В любом случае, наших мальчиков слишком много для того, чтобы всех отправлять в Москву. Ребятам нужна реабилитация в региональных центрах, ведь многим из них сложно передвигаться. Поэтому наша задача – создавать такие центры и обучать специалистов на местах. Для этого нам нужно сильное пациентское сообщество и некоммерческие организации, которые будут влиять на неповоротливую государственную систему и улучшать ее работу.
Отстаивать интересы
Мы стремимся к тому, чтобы в России приняли клинические рекомендации по ведению пациентов с МДД. Хотим, чтобы мальчики и их семьи получали все виды помощи – медицинскую, социальную и психологическую, и чтобы эта помощь соответствовала международным стандартам.
Есть и другие организации, занимающиеся миодистрофией Дюшенна – фонд «Мой Мио» (6 лет) и Родительский проект (3 года). У каждой из них более 500 подопечных. Они реализуют медицинские и образовательные программы для пациентов с МДД, оказывают информационную, консультативную и адресную помощь семьям.
После постановки диагноза семьи сталкиваются с дефицитом информации в отношении препаратов, физической терапии, пищевых добавок и приема стероидов. Именно потребность узнать больше помогает родителям разобраться в разных аспектах заболевания, а значит – принимать лучшие решения в интересах своего ребенка и сохранять чувство контроля.
Еще один способ вернуть контроль – присоединиться к родительскому сообществу. Помимо информации в нем можно найти опору, общаясь с другими родителями. У фонда есть сообщество «ProДюшенн», в котором более четырехсот участников, среди которых родители и врачи. Все наши семьи разные: у одних маленькие мальчики с МДД, у других юноши, а есть семьи, где сыновья уже ушли. Но цель у всех одна – поддерживать друг друга и отстаивать интересы пациентов с Дюшенном при взаимодействии с государством.
Также для нас важно, чтобы мамы мальчиков с МДД и их дочери могли выбирать свое репродуктивное будущее и знали об этом. Болезнь развивается из-за мутаций, которые в 70% случаев возникают в Х-хромосоме матери и передаются сыновьям. Если в семье уже есть мальчик с МДД, другие дети также могут унаследовать мутацию. Но предимплантационная диагностика и ЭКО позволяют планировать рождение здоровых детей после появления малыша с МДД. И если я решусь на третьего ребенка, то, скорее всего, обращусь к этим методам. Девочкам, чьи мамы – носительницы мутаций в гене дистрофина, можно сделать анализ ДНК и проверить, передалась ли мутация.
 |
Команда фонда «Гордей». Фото из личного архива
Справиться с кризисом
При МДД родители сталкиваются со множеством кризисных ситуаций. Часто травматичной становится сама постановка диагноза, когда результат генетического теста присылают по почте, а врачи отвечают на звонки без особого желания. Мальчик может столкнуться с переломом и потом долго восстанавливаться, либо теряет способность ходить. Он может оказаться в кресле и без перелома, когда происходит срыв компенсации – снижение мышечной силы. Молодому человеку может потребоваться респираторная поддержка, и это тоже может быть кризисным моментом – как и любое изменение в жизни, указывающее на переход болезни в более тяжелую стадию. И конечно, в таких ситуациях лучше работать с психологом индивидуально.
Еще есть переходный возраст. Это сложное время для любой семьи, но особенно для родителей мальчиков с МДД. Если ребенок принимает кортикостероиды, он не очень сильно растет – а расти ему важно. Для этого придется снизить дозу гормонов, но тогда он начнет слабеть. И этот момент пересмотра лечения, отношений с ребенком и его личных границ тоже бывает очень непростым.
У ребенка с МДД могут быть трудности с учебой, агрессивное поведение, тревожное расстройство или депрессия. Если знать об этом и вовремя обратить внимание, многие вещи можно скорректировать и улучшить качество жизни ребенка и родителей.
Недавно фонд запустил проект психологической поддержки родителей «Передышка». Мы провели уже три встречи, в начале следующего года надеемся параллельно запустить «Передышку» для пап, где будет психолог-мужчина, а также индивидуальную психологическую поддержку.
Искать лечение
Создать универсальное лекарство для МДД сложно. Во-первых, ген дистрофина огромный, и в нем может быть очень много разных мутаций – известно уже около 10 тысяч. Во-вторых, лекарства доставляют в клетки с помощью вирусных векторов (генетических конструкций – прим.авт.), у которых есть определенная емкость. Можно поместить в вирус только фрагмент гена дистрофина. Кроме того, у части пациентов имеется предсуществующий иммунитет к самим вирусам. В-третьих, чтобы лекарство проникло в мышцы, оно должно попасть в общий кровоток – а значит, пройти через печень, которая постарается удалить его из организма. Возникает конфликт: врачи пытаются доставить лекарство в мышцы, а тело сопротивляется и пытается его вывести.
Но таргетные препараты уже появились – и это большая подвижка. Со временем должно появится лекарство, которое подойдет многим пациентам с МДД. Значит нам нужно выявлять болезнь как можно раньше, чтобы быстрее начинать лечение.
24 ноября 2020 года в России зарегистрировали первый таргетный препарат для лечения МДД – аталурен. Он подходит 13% пациентов с МДД, имеющим нонсенс-мутации – точечные замены в гене дистрофина. По словам производителя, лекарство помогает восстанавливать уровень дистрофина и замедлять прогрессирование болезни. Существуют и другие препараты – вайондис, вилтепсо и экзондис, но они также предназначены для пациентов с определенными мутациями.
Традиционное лечение МДД направлено на устранение симптомов. Для повышения мышечной силы и продления двигательной активности врачи назначают пациенту кортикостероиды, но они увеличивают риск переломов и со временем могут привести к набору веса и повышению давления. Для сохранения функций сердечной мышцы применяют ингибиторы ангиотензинпревращающего фермента (АПФ) или бета-блокаторы.
Найти общий язык
Сейчас Гордей учится в нулевом классе. Он чувствует, что справляется, и совершенно счастлив. У него есть друзья, его хвалят учителя. Гордей учится играть в шахматы, с удовольствием изучает испанский и осваивает скетчинг. Для него и других ребят с МДД очень важны вопросы образования, социальной среды и общения.
Так же важна реакция врача на ребенка с миодистрофией. Если врач общается с ним тепло, уважительно и без страха – это одна история. Но когда врачи боятся диагноза, избегают общения с ребенком и ведут себя скованно – и родители, и сами дети это чувствуют. И то, как реагируют на ребенка врачи, учителя, чиновники на комиссиях по инвалидности – это вовсе не «сходил и забыл». Чувствуется негласная стигма «идите умирайте дома, лекарства нет» – и мы должны с ней бороться. Во-первых, лекарства появляются, их будет больше, они будут лучше. Во-вторых, в современном обществе никто не должен быть оставлен без помощи. Для этого нужно учиться делать все вместе – жить, работать, решать гражданские дела. И в этом смысле не может быть и речи о том, чтобы закрыться и угасать дома.
Сохранить веру
Нам всем нужна вера, и ее очень сложно сохранить. Особенно уязвимы родители взрослых сыновей. Ведь Дюшенн – одно из самых травмирующих заболеваний, причем травмируется вся семья, но особенно – мама, которая, как правило, осуществляет основной уход за сыном. Мамы сильно изранены, многим нужна психологическая поддержка и помощь в уходе за ребенком.
Бывает, что родители молодых людей говорят родителям мальчиков помладше: посмотрим, что вы скажете через 10 лет. Да, они испытали то, через что пока не прошла я. И тогда я думаю – действительно, а что я скажу через 10 лет? Я не знаю, я ли это буду или уже не я. Смогу ли сохранить себя, свою любовь, своего ребенка? Я делаю все, что могу, как и моя семья. Боюсь ли я будущего? Я надеюсь, что справлюсь. Ну а там – посмотрим, что я скажу через 10 лет.
Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик
Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик
Принцип генной терапии миодистрофии Дюшенна/Беккера. Миодистрофию Дюшенна (МДД) вызывают мутации гена дистрофина (DMD), приводящие к сдвигу рамки считывания, а более мягкую миодистрофию Беккера (МДБ) — мутации без смещения рамки считывания. Лечения этой болезни пока нет. Генная терапия поможет улучшить или даже восстановить функции мышц.
Автор
Редакторы
Мышечная дистрофия Дюшенна — тяжелейшее Х-связанное заболевание, эффективного лечения которого до сих пор нет. В одном из последних номеров Science вышли целых три статьи об успешном тестировании на мышиных моделях технологии CRISPR/Cas9 для лечения этой болезни. Может быть, у этого подхода есть шанс добраться и до клиник?
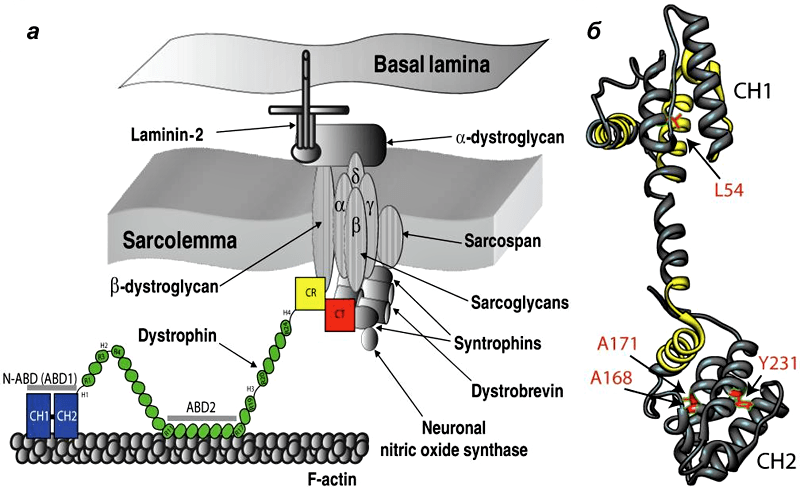
Дистрофин находится на внутриклеточной поверхности сарколеммы вдоль всей длины мышечных волокон и входит в состав дистрофин-ассоциированного гликопротеинового комплекса (ДАГК, DGC). Он связывается одним концом с F-актином цитоскелета, а другим — с β-дистрогликаном, что стабилизирует волокна во время сокращения. Ген дистрофина — один из самых длинных у человека.
Излечивать мышечную дистрофию Дюшенна пока не умеют, а сегодняшняя терапия направлена на замедление прогрессирования болезни и лечение осложнений [4], [5]. «Золотой стандарт» — это кортикостероиды, которые были предложены в качестве лечения еще несколько десятилетий назад. Однако их применение вызывает множество побочных эффектов.
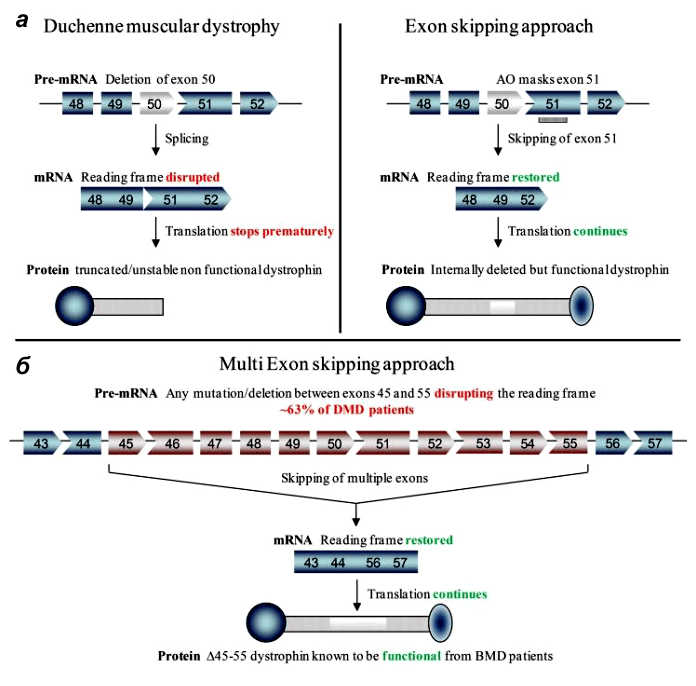
Неудивительно, что многие группы генетиков и молекулярщиков занимаются разработкой пре- и постнатального лечения миодистрофии Дюшенна. Болезнь в основном изучают на различных линиях мышей. В одном из последних номеров Science опубликовали сразу три независимых работы по методам лечения мышечной дистрофии Дюшенна [6–8]. Исследовательские группы возглавили Эрик Олсон (Eric Olson) из Техасского университета, Эми Уаджерс (Amy Wagers) из Гарвардского университета и Чарльз Герсбах (Charles Gersbach) из Университета Дьюка. Все группы для восстановления функции мышц использовали методику пропуска экзонов, при которой один или несколько экзонов удаляются из мРНК (рис. 2). В таком случае белок получается короче, но всё же может выполнять свою поддерживающую и заякоривающую функции в мышечном волокне, а «досадное обстоятельство» — лишний стоп-кодон — тоже оказывается «пропущенным».
Рисунок 2. Пропуск экзонов в гене дистрофина при миодистрофии Дюшенна. а — У пациентов с МДД в гене DMD присутствуют мутации, нарушающие рамку считывания при синтезе белка. Например, при делеции экзона 50 появляется «внерамочная» мРНК, что приводит к синтезу усеченного нефункционального или нестабильного дистрофина (слева). В одном из терапевтических подходов антисмысловой олигонуклеотид «маскирует» экзон 51, и он «пропускается» при сплайсинге, рамка считывания восстанавливается. В результате получается более короткий, но частично функциональный дистрофин (справа). В новых работах «лишние» экзоны просто вырезают из генома с помощью CRISPR/Cas9. б — Мультиэкзонный пропуск в терапии МДД. Если осуществить пропуск экзонов 45–55, мутации которых встречаются примерно у 63% пациентов, то образовавшийся короткий дистрофин приведёт к трансформации стандартного МДД-фенотипа в бессимптомный или более мягкий МДБ-фенотип.
У стратегии удаления экзонов есть даже преимущества перед воссозданием полной длины гена: ее проще разработать, чем восстановить индивидуальные делеции каждого пациента [7].
Для вырезания «лишних» нуклеотидных последовательностей исследователи воспользовались технологией редактирования генома CRISPR (clustered regularly interspaced short palindromic repeats) / Cas9 (CRISPR-associated protein 9) [9], которую, между прочим, только что разрешили применить в опытах на эмбрионах одному лондонскому институту [10].
Конкурирующие лаборатории: кто первым воплотит технологию в терапию для человека?
Ученые трех лабораторий успешно применили технологию пропуска экзонов in vivo на стандартном объекте — мышах — и показали, что их метод помогает восстановить рамку считывания и частично восстановить синтез дистрофина. Поскольку даже невысокий его уровень (3–15% от нормального) приносит терапевтическую пользу, результаты работ можно назвать успешными.
Группа Эрика Олсона уже не в первый раз использует метод CRISPR/Cas9 в своих работах по мышечной дистрофии Дюшенна. В 2014 году ученые исправили мутацию в зародышевой линии мышей и предотвратили развитие болезни. Однако, поскольку пренатальное редактирование генома на человеческих эмбрионах (пока?) запрещено, исследователям пришлось придумать способ постнатального применения технологии.
В их последней работе для доставки необходимых для редактирования компонентов в ткани использовался аденоассоциированный вирус-9 (AAV9, adeno-associated virus-9) [6]. Исследователи испытали несколько способов введения AAV9 в различные дни после рождения мышат. Во всех случаях экспрессия гена дистрофина в сердечной и скелетных мышцах восстановилась, но в разной степени. Более того, продукция белка увеличивалась с 3 до 12 недель после инъекций, а через 4 недели после инъекций улучшилась функция скелетных мышц. «Сейчас задача для исследователей из центра Уэллстоун заключается в том, чтобы перенести открытия с мышиной модели на пациентов с миодистрофией», — говорит Прадип Маммен (Pradeep Mammen), содиректор центра Уэллстоун.
Группа Эми Уаджерс провела во многом похожий эксперимент [8]. После множества подготовительных этапов работы по редактированию генома и пропуску экзона на клетках и животных их опыт тоже увенчался успехом: программируемые CRISPR-комплексы в составе аденоассоциированного вируса (AAV) были доставлены с помощью локального и системного введения к дифференцированным скелетным волокнам, кардиомиоцитам и сателлитным мышечным клеткам новорожденных и взрослых мышей. Если редактирование направлено только на мышечные волокна, то эффект со временем может сойти на нет. Однако, как отмечает Уаджерс, редактирование генов в сателлитных клетках может обеспечить гораздо более длительный результат. Оно способно привести к созданию пула регенеративных клеток, несущих отредактированный ген дистрофина, и в результате обычной репарации мышц отредактированный ген окажется и в мышечных волокнах.
Наконец, как все уже догадались, ученые под руководством Чарльза Герсбаха тоже обнаружили терапевтический эффект применения AAV-CRISPR/Cas9 в мышиной модели [7]. Внутрибрюшинное введение вирусного вектора новорожденным мышам привело к восстановлению синтеза дистрофина в абдоминальных мышцах (мышцах живота), диафрагме и сердце через семь недель после инъекции. Как отмечают авторы, терапия сердечной и легочной мышц крайне важна, поскольку именно их отказ зачастую приводит к смерти пациентов с болезнью Дюшенна. Внутривенное введение AAV-векторов шестинедельным мышам тоже привело к значительному восстановлению продукции дистрофина в сердечной мышце. «Остается еще много работы по переделке [технологии] в терапию для человека и подтверждения ее безопасности, — говорит Герсбах. — Но результаты наших первых экспериментов уже весьма воодушевляющие». Группа собирается оптимизировать систему доставки и оценивать эффективность и безопасность стратегии на более крупных животных (рис. 3). Какая же из трех лабораторий обгонит других и первой сможет провести испытания на человеке?
Терапия миодистрофии Дюшенна: старые и новые подходы
По словам Олсона, главное отличие новой стратегии с использованием вектора, вмещающего в себя компоненты для редактирования генома, от других терапевтических методов в том, что она устраняет причину болезни. А какие еще подходы разрабатывают ученые?
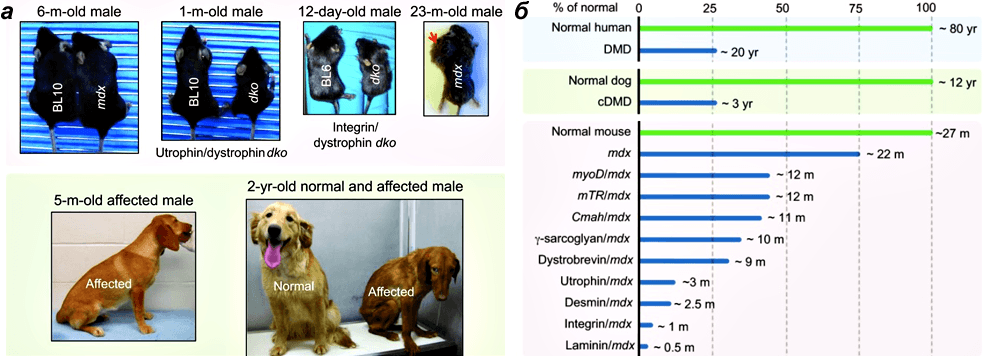
Рисунок 3. Животные модели миодистрофии Дюшенна. а — Проявления миодистрофии Дюшенна у мышей и собак. Вверху: у мышей mdx симптомы проявляются только в старости, и они склонны к образованию рабдомиосарком — опухолей мышечного происхождения. Размер мышей с нокаутами генов атрофина/дистрофина и интегрина/дистрофина значительно меньше, чем их ровесников дикого типа (BL10 и BL6). Внизу: проявления болезни у пятимесячной больной собаки. Различия между здоровой и больной двухлетними собаками. б — Сравнение продолжительности жизни здоровых и больных людей, собак и различных линий мышей.
Один из многообещающих подходов — это клеточная терапия. Хотя опыты с внутримышечной инъекцией миобластов от здоровых доноров провалились, технологии с использованием стволовых клеток и индуцированных плюрипотентных стволовых клеток (ИПСК) пока успешно испытываются на моделях не только миодистрофии Дюшенна, но и болезни Альцгеймера, Паркинсона, Хантингтона, спинальной мышечной атрофии, бокового амиотрофического склероза, аутизма и шизофрении [14–16]. Например, в 2013 году исследователи из Бостонской детской больницы (Boston Children’s Hospital’s Stem Cell Program) с помощью смеси трех малых молекул (форсколина, основного фактора роста фибробластов bFGF и ингибитора гликогенсинтазы киназы-3) перепрограммировали ИПСК из кожи пациентов с миодистрофией Дюшенна в мышечные клетки, которые затем успешно прижились у мышей. Сейчас из ИПСК получены кардиомиобласты и нейроны [2].
Другие исследования показывают, что восстановление нормального уровня синтеза оксида азота (NO), который снижается у больных из-за нарушения активности NO-синтазы (nNOS), ослабляет воспаление, повышает активность собственных стволовых клеток и реконструирует морфологию и функции скелетных мышц [3].
Уже в фазе II клинических испытаний находится препарат Givinostat — ингибитор гистондеацетилаз, который замедляет прогрессирование болезни в мышиной модели.