Митохондрии что это простыми словами
Как раскрыть секреты цитохрома с
Как раскрыть секреты цитохрома с
Автор
Редактор
Статья на конкурс «био/мол/текст»: «Только ленивый не занимался митохондриями!» — сказал один профессор. И действительно, митохондрии — очень популярный объект исследования, ведь в них происходит множество сложнейших биохимических и биофизических процессов, обусловливающих широкий набор функций данных органелл. Но, несмотря на активность исследователей, многие механизмы этих процессов и свойства отдельных компонентов митохондрий остаются загадкой. Это связано в первую очередь с отсутствием подходящих неинвазивных методик. В ходе междисциплинарного проекта, проводимого группой биофизики клетки Биологического ф-та МГУ и лабораторией неорганического материаловедения химического ф-та МГУ совместно с коллегами из Германии и Дании, удалось создать методику на основе спектроскопии гигантского комбинационного рассеяния для селективного исследования цитохрома с непосредственно в живых митохондриях. Статья опубликована в журнале Scientific reports.
Обратите внимание!
Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
О, эти спектры! О, эти пики!
В тайны молекул можем мы заглянуть.
Так и работаем мы в этом ЛИКе*,
И не напрасно избрали свой путь!
* — Лаборатория искусственного климата (ЛИК)
— прежнее название корпуса каф. Биофизики биофака МГУ.
Жалюзи опущены. Выключен свет. Мы погружены во мрак. Капля мутной жидкости падает на серебряную подложку. Вспышка зелёного света. 30 секунд. Спектр. Так начинается наш длинный день. А теперь обо всём по порядку.
Эти важные органеллы
Как вы уже (наверное) догадались, капля мутной жидкости — не что иное, как суспензия митохондрий. Митохондрии — это клеточные органеллы* размером около 1 микрона. Основная функция митохондрий — это окисление питательных веществ и производство молекул АТФ — универсального источника энергии для большинства биологических процессов в клетках. Кроме того, митохондрии участвуют в инициации апоптоза, старении клеток, продукции активных форм кислорода (АФК) [1], метаболизме лекарств, выработке тепла, запасают в себе ионы кальция, синтезируют некоторые гормоны и т.д. [2]. Митохондрии обладают столь широким спектром функций, что нарушение их работы является причиной многих заболеваний: различных видов миопатий, сердечно-сосудистых заболеваний, диабета и многих других [3]. Большинство из них связаны с мутациями в генах, кодирующих белки митохондрий**. Но может быть и наоборот: некоторые заболевания или неправильный образ жизни могут привести к нарушению работы митохондрий, например ожирение [4] или употребление наркотиков [5]. С другой стороны, митохондрии как преобразователи энергии и, фактически, белковый электропровод представляют большой интерес для физиков — биоников [6].
* — Органеллами митохондрии стали не сразу: согласно теории симбиогенеза, они появились в эукариотических клетках как бактерии-симбионты. И за миллиарды лет обросли множеством функций [7].
** — Т.к. митохондрии передаются по наследству от матери, то потомство получает все генетические нарушения, которые присутствовали в материнских митохондриях, но в перспективе эту проблему можно будет решить с помощью донорских митохондрий [8].
Митохондрии: как всё устроено
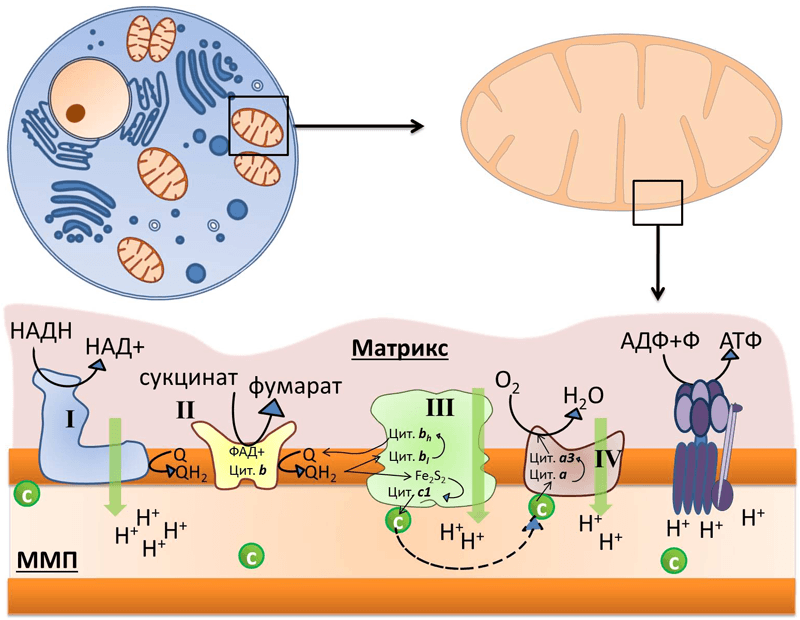
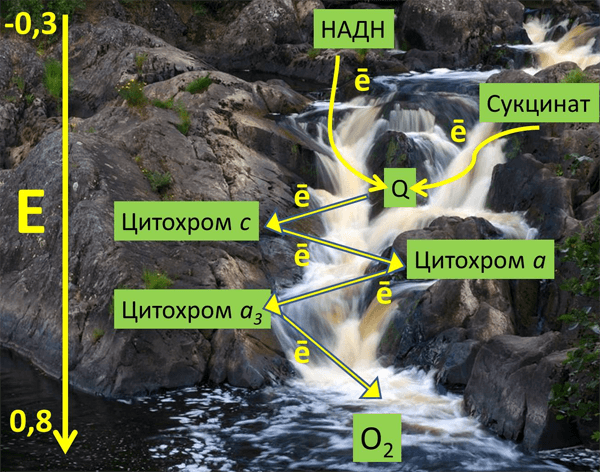
Митохондрии состоят из двух мембран: внешней, проницаемой для ионов и некоторых белков, и внутренней, ограничивающей внутреннее пространство митохондрий — матрикс. Пространство между мембранами так и называется — межмембранное пространство (ММП). Внутренняя мембрана образует множество инвагинаций (так называемых крист). В матриксе митохондрий расположены ферменты цикла Кребса, а во внутренней мембране митохондрий находится четыре белковых комплекса дыхательной цепи (электрон-транспортной цепи, ЭТЦ) и АТФ-синтаза (рис. 1). Также в митохондриях есть подвижные элементы дыхательной цепи: убихинон во внутренней мембране и цитохром с в ММП. Принцип работы дыхательной цепи — окисление субстратов, поступающих из цикла Кребса, и перенос электронов от этих субстратов по кофакторам ЭТЦ на конечный акцептор — кислород. Есть определенная закономерность в последовательности переноса электрона: электроны поступают от донора с более отрицательным редокс-потенциалом* (Еred/ox) к акцептору с более положительным Еred/ox. Таким образом, электрон как будто движется вниз по течению (рис. 2). Во время переноса электронов некоторые комплексы дыхательной цепи закачивают протоны из матрикса в ММП, тем самым создавая электрохимический потенциал на внутренней мембране митохондрий, который используется для синтеза АТФ (рис. 1) [2].
* — Окислительно-восстановительный потенциал — синоним редокс-потенциала (от англ. reduction — восстановление, oxidation — окисление).
Рисунок 1. Во внутренней мембране митохондрий локализованы комплексы дыхательной цепи: I — НАДН-дегидрогеназа, II — сукцинат-дегидрогеназа, III — цитохром b–c1-комплекс, или цитохром с-редуктаза, IV — цитохром а–а3, или цитохромоксидаза, и фермент АТФ-синтаза. Q — убихинон, «с» в зелёном кружке — цитохром с. Чёрными стрелками показан транспорт электрона, пунктирной стрелкой — диффузия цитохрома с от комплекса III к IV, зелеными стрелками — перенос протона.
Рисунок 2. Метафорическое изображение среднеточечных редокс-потенциалов различных переносчиков ЭТЦ митохондрий в энергетической шкале (вольт) на фоне реки Тохмайоки в Карелии.
Несмотря на то, что с митохондриями работали корифеи науки, такие как Кребс, Митчелл, Ленинджер, Чанс, Скулачёв и многие другие, благодаря которым мы столько знаем об этих органеллах, всё же многие митохондриальные процессы и свойства переносчиков электронов до сих пор не изучены. Это связано в первую очередь с отсутствием подходящих неинвазивных методик. В этом году нашей лабораторией в сотрудничестве с коллегами из других факультетов МГУ, а также из Дании и Германии, удалось создать методику для селективного исследования конформации гема цитохрома с непосредственно в живых митохондриях [9].
Что такое конформация гема и почему она важна?
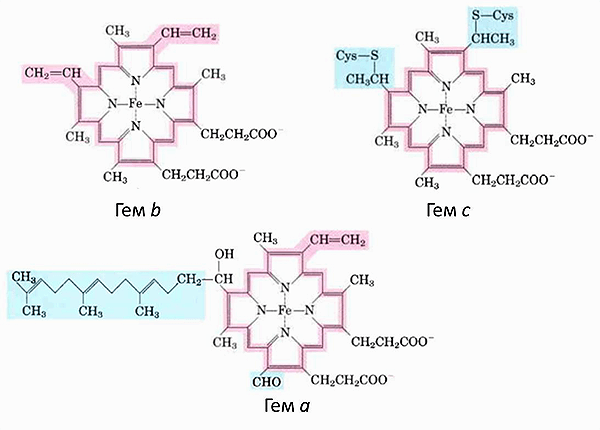
Если приглядеться к комплексам дыхательной цепи (рис. 1), то в трёх из них можно увидеть цитохромы — гем-содержащие белки, которые являются кофакторами, участвующими в переносе электронов. А ещё один цитохром диффундирует в ММП. Всего в митохондриях имеется три типа цитохромов: а, b и с. Они очень похожи и отличаются только боковыми радикалами (рис. 3).
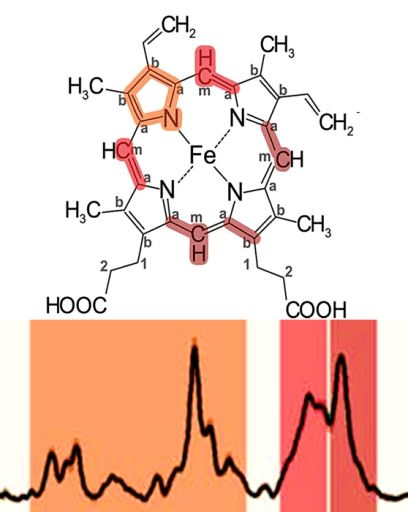
Рисунок 3. Гемы цитохромов разных типов. Каждый гем состоит из четырех пятичленных азотосодержащих циклов, связанных между собой. Это т.н. порфирины. Атомы азота координируют атом железа (Fe). Гемы отличаются боковыми группами, и только гем типа с связан с белком ковалентно. Рисунок из [2].
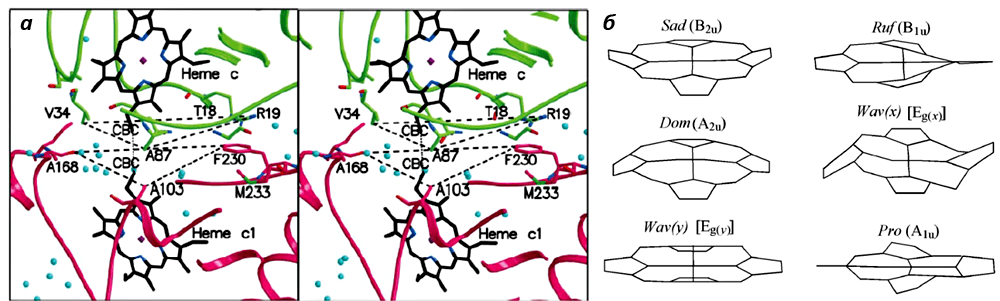
Рисунок 4. а. Расположение гемов цитохромов с и с1 при переносе электрона. б. Различные конформация гема цитохромов. Рисунки из [12] и [13].
Наиболее интересен в этом отношении цитохром с, так как это единственный мобильный переносчик электронов, курсирующий в ММП (все остальные цитохромы заякорены в комплексах ЭТЦ), поэтому он наиболее подвержен изменениям, которые могут происходить в митохондриях. Помимо этого выход цитохрома с запускает каскад реакций, ведущих к апоптозу, и в этом процессе тоже важен его редокс-потенциал [14].
Возникает вопрос, как понять, в какой конформации и в каком редокс-состоянии находится гем цитохрома с в митохондриях?
Как увидеть конформацию гема и оценить Еred/ox?
Рисунок 5. Сверху показан гем типа b, который содержится в эритроцитах, снизу — спектр КР эритроцита. Различные группы атомов и соответствующие им пики обозначены одним цветом. Рисунок из [20].
Численно можно определить Еred/ox с помощью электрохимических методов. Однако для этого нужные комплексы дыхательной цепи изолируют и помещают в совершенно иные условия среды, что может само по себе изменить их свойства. Благодаря таким мощным методам как ЯМР и рентгеноструктурный анализ, мы знаем, в какой конформации находятся белки и кофакторы дыхательной цепи в окисленной и восстановленной форме. Но нас интересует их состояние в максимально естественных условиях, а также соотношение этих состояний при работе дыхательной цепи. Есть несколько неинвазивных методов для определения окислительно-восстановительного состояния цитохромов. Например, абсорбционная спектроскопия. Спектр поглощения митохондрий — это суммарный спектр всех имеющихся цитохромов в митохондриях, а также ФАД. Но из-за того, что все типы цитохромов очень похожи и, соответственно, обладают схожими спектрами поглощения, а их окислительно-восстановительное состояние всё время меняется при нормальной работе дыхательной цепи, становится сложно оценить вклад различных цитохромов в спектр [15].
По спектрам флуоресценции НАДН и ФАД + можно примерно оценить редокс-состояние только комплексов I и II. А по потенциалу на внутренней мембране митохондрий можно судить только о работе митохондрии в целом [16].
Напрямую получение информации о конформации и редокс-состоянии цитохрома с в интактной (целой и функционирующей) митохондрии — это крайне сложная задача, ведь его конформация постоянно меняется при работе ЭТЦ, он диффундирует и взаимодействует с мембранными комплексами. Наличие метода, который бы позволял это сделать, значительно расширило бы наши знания о влиянии цитохрома с на активность дыхательной цепи и его вкладе в развитие митохондриальных патологий.
К митохондриям от чистого сердца
Несколько лет назад в работах нашей группы вопрос о неинвазивном методе исследования цитохромов митохондрий в клетках уже поднимался. На тот момент сотрудники лаборатории исследовали влияние окислительного стресса на кардиомиоциты (клетки сердечной мышцы), методом комбинационного рассеяния света (КР, Raman spectroscopy) [17]. Подробно об этом рассказывается в статье «Спектроскопия КР: новые возможности старого метода» [18].
Спектр комбинационного рассеяния молекулы представляет собой колебательный спектр, пики которого характеризуют нормальные частоты колебаний молекулы. Отдельные группы атомов вносят свой вклад в различные колебания молекулы, поэтому можно сказать, что каждый пик на спектре КР характеризует колебания определённой группы атомов (рис. 5) [19, 20]. Таким образом, спектр КР — нечто вроде «отпечатков пальцев» молекулы. И так же, как по отпечаткам пальцев можно отличить родных братьев, по спектрам КР можно отличить схожие по строению молекулы. Кроме того, спектры КР чувствительны к изменениям конформации молекул, ведь если конформация меняется, то меняются и нормальные частоты колебаний.
В ходе работы с кардиомиоцитами было показано, что спектры КР разных типов цитохромов и миоглобина (который, как и гемоглобин, содержит гем типа b) можно различать по спектрам КР интактных клеток и даже определять их окислительно-восстановительное состояние. Позже Н.А. Браже с другими сотрудниками успешно провели подобное исследование на целом сердце, т.е. in situ (рис. 6) [21].
Рисунок 6. Регистрация спектра КР целого сердца. Рисунок из [21].
Однако у цитохромов есть одна особенность — спектр КР интенсивен только для восстановленных их форм, тогда как спектр окисленных состояний обладает очень низкой интенсивностью. Поэтому основным критерием определения восстановленности цитохромов является интенсивность сигнала. Но если мы ориентируемся только на интенсивность, то можем потерять важную информацию об изменениях в исследуемой системе! Ведь интенсивность зависит и от количества молекул, и от выраженности тех или иных колебаний, и от других параметров. К тому же, для определения точного положения пиков большинство исследователей, имеющих дело с цитохромами, вынуждены искусственно восстанавливать образцы, что заведомо нарушает их нативность.
Отчасти проблему решили японские учёные. Они определили, какие пики на спектре КР характерны только для восстановленных, а какие — только для окисленных цитохромов [22]. Однако проблема интенсивности спектров по-прежнему сохранялась. Нужно было её решать!
Усиливая сигнал
Один из способов усилить сигнал КР — это поместить исследуемую молекулу вблизи наночастицы благородного металла, например, золота или серебра. Эти металлы обладают свободными поверхностными электронами, а квант коллективных колебаний таких электронов называется плазмон. Если частота падающего света входит в резонанс с частотой колебаний поверхностных электронов металла, то возникает эффект плазмонного резонанса, который приводит к многократному усилению электромагнитного излучения вблизи наночастицы. Этот эффект используют в методе поверхностного плазмонного резонанса (surface plasmon resonance, SPR), в абсорбционной и флуоресцентной спектроскопии [23]. Но нас интересует способ усилить именно сигнал КР. И для этого существует спектроскопия гигантского комбинационного рассеяния (ГКР, англ. Surface enhanced Raman spectroscopy, SERS)*.
Спектры КР и ГКР цитохрома с хорошо известны [24, 25]. И что самое замечательное, в отличие от спектров КР, спектры ГКР окисленного и восстановленного цитохрома с практически не отличаются по интенсивности. Так почему бы не зарегистрировать спектр ГКР митохондрий?
Идея пришла от О.В. Сосновцевой, профессора Копенгагенского университета, с которой наша лаборатория сотрудничает не первый год. Она даже предложила «подсобить» с митохондриями, так как с ними работали в соседней лаборатории, и они готовы были поделиться.
На тот момент было только две работы по изучению митохондрий методом ГКР и его разновидностью TERS (когда плазмонная частица находится на острие иглы кантилевера атомно-силового микроскопа, и сигнал ГКР регистрируют при сканировании поверхности образца). В первой работе [26] исследователи регистрировали спектр ГКР только от белков и липидов митохондрий, но не от цитохромов. А во второй работе [27] использовали не нативные, а высушенные митохондрии. Но как применить метод ГКР для изучения цитохромов живых митохондрий? Прежде чем ответить на этот вопрос, следует слегка переместиться в прошлое.
Междисциплинарность — залог успеха
В 2010 году, когда интерес к нанотехнологиям был на высоте, академик Юрий Дмитриевич Третьяков, в то время декан факультета наук о материалах (ФНМ) МГУ, решил начать межфакультетское сотрудничество с биологами для проведения совместных исследований методом ГКР. В итоге сотрудничество было установлено с лабораторией биофизики клетки под руководством Г.В. Максимова. Так наша лаборатория познакомилась с заместителем декана ФНМ химиком-материаловедом член-корр. Е.А. Гудилиным. Совместно с группой Гудилина начались активные исследования по применению ГКР в биологии.
Дело в том, что ГКР — метод непростой и требует исключительно междисциплинарного подхода. Каждый биообъект уникален, и чтобы регистрировать от него сигнал ГКР, нужно разрабатывать уникальные наноструктуры, которые бы усиливали сигнал от нужного объекта, не повреждали его и выдерживали «атаку» физиологических многокомпонентных буферов.
Большинство работ, связанных с ГКР, предполагают адсорбцию молекул на поверхности наноструктур, пусть даже введённых внутрь клетки [28]. Это связано с тем, что усиление сигнала КР наблюдается только на очень небольшом расстоянии от поверхности металла [29]. Однако такой подход не всегда удовлетворяет запросам биологов. В идеале усиление сигнала должно распространяться на достаточно большое расстояние, чтобы можно было работать с целыми клетками и органеллами, при этом не повреждая их, и желательно не вводить ничего внутрь. Для этой цели нужно разрабатывать специфический дизайн наноструктур и придумывать методы их синтеза, чем и занималась группа под руководством Гудилина.
Наконец, длительные и упорные попытки разработать такие структуры для исследования живых клеток увенчались успехом. В 2012-м году дебютировали наноструктурированные подложки для усиления сигнала от примембранного гемоглобина в интактных эритроцитах [20]. За счёт определённой морфологии наноструктур удалось получить усиление сигнала на расстоянии более 10 нм, т.е. больше толщины мембраны эритроцита.
Раз это удалось сделать для эритроцитов, то можно сделать и для митохондрий!
Долгожданный спектр ГКР митохондрий
Жалюзи опущены. Выключен свет. Комната погружена во мрак. Капля суспензии падает на серебряную подложку. Вспышка зелёного света. 30 секунд. Спектр. Тот самый долгожданный спектр ГКР от изолированных сердечных митохондрий был получен! Оставалось только понять, от каких именно структур в митохондриях исходит сигнал.
С учётом размеров компонентов митохондрий (рис. 7) и того, что усиление наблюдается на расстоянии нескольких нанометров от наноструктур, можно было предположить, что спектр ГКР митохондрий будет преимущественно спектром цитохрома с, так как этот цитохром наиболее близко подходит ко внешней мембране митохондрий и, соответственно, к наноструктурам. В то же время остальные цитохромы закреплены в комплексах внутренней мембраны.
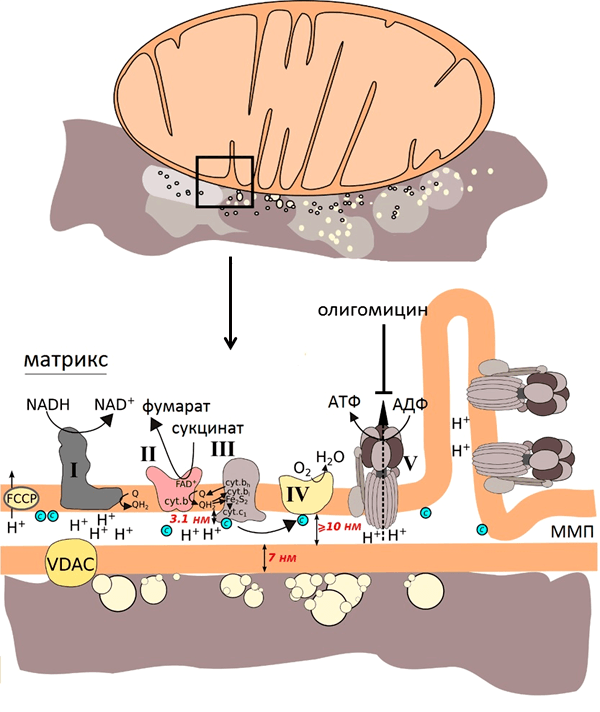
Рисунок 7. Схема эксперимента: изолированные сердечные митохондрии помещают на серебряную наноструктурированную поверхность и облучают зелёным лазером. На рисунке показаны размеры мембраны, межмембранного пространства (ММП) и участков комплексов ЭТЦ. VDAC — потенциал зависимый анионный канал, FCCP — протонофор, разобщающий электронный транспорт и синтез АТФ, олигомицин — ингибитор АТФ-синтазы, с в синем кружке — цитохром с. Рисунок из [9].
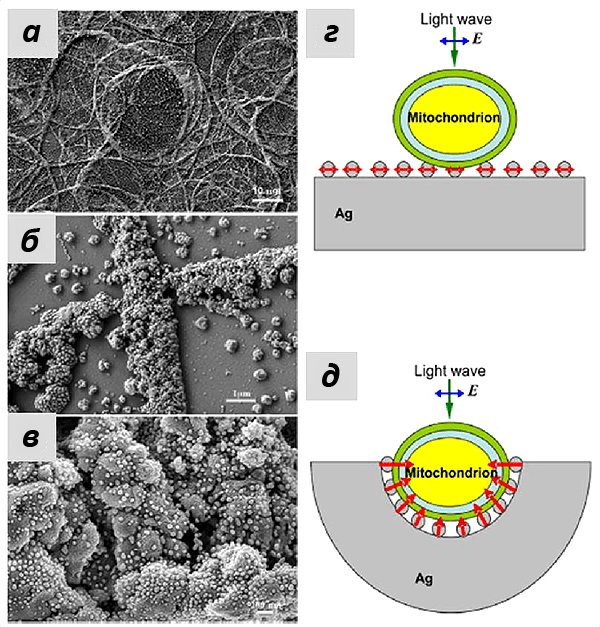
Это утверждение также подтверждалось при моделировании эффектов усиления КР серебряными наноструктурами, которые были использованы в работе. Группа наших коллег из лазерного центра Ганновера показала, что сложная морфология подложки со множеством углублений, в которые могут попадать митохондрии, позволило получать усиление на большом расстоянии (более 10 нм). А иерархическое устройство самих наноструктур увеличивало число мест контакта с мембраной митохондрий и, следовательно, число молекул цитохрома с, от которых можно было зарегистрировать сигнал ГКР. Если использовать те же наночастицы серебра, просто присоединенные к плоской подложке, то особого усиления не произойдет, что и подтверждалось в эксперименте (рис. 8).
Рисунок 8. а—в — Изображения наноструктур, полученные на сканирующем электронном микроскопе. а — масштаб 10 мкм; б — 1 мкм, в — 0,2 мкм. На изображениях хорошо видна иерархическая морфология серебряных наноструктур. г—д — две модели, которые использовались для математического моделирования эффекта усиления электрического поля наноструктурами. г — в случае, когда митохондрии помещают на плоскую поверхность с наночастицами серебра, не происходит значительного усиления сигнала. д — при использовании структур, образующих полости, покрытые наночастицами серебра, число мест контакта между митохондрией и наночастицами увеличивается, а усиление электрического поля направлено перпендикулярно поверхности, т.е. внутрь митохондрии. За счёт этого достигается многократное усиление сигнала ГКР цитохрома с. Рисунок из [9] с изменениями.
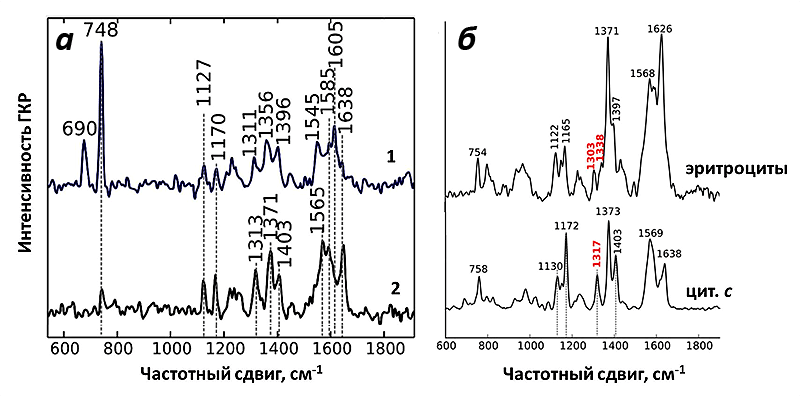
И действительно, полученный спектр ГКР митохондрий соответствовал спектрам цитохрома с! При использовании зелёного лазера в качестве возбуждающего света можно регистрировать сигнал только от цитохромов b и с, но не от цитохрома а, что облегчает задачу расшифровки спектров. Несмотря на схожесть структуры цитохромов типа b и с, они имеют ключевые пики на спектре, благодаря которым их нельзя перепутать (рис. 9). Таким образом, используемые наноструктуры давали усиление на достаточно большом расстоянии, чтобы зарегистрировать спектры от цитохрома с, но недостаточно большом, для того чтобы увидеть пики цитохромов b. И это как раз то, что нужно! Благодаря методу ГКР теперь можно исследовать селективно редокс-состояние и конформацию именно цитохрома с в живых функционирующих митохондриях.
Рисунок 9. а — Спектры ГКР интактных митохондрий, помещенных на серебряную наноструктурированную поверхность. 1 — Спектр искусственно восстановленных цитохромов митохондрий; 2 — спектр активно функционирующих интактных митохондрий. б — Для сравнения приведен спектр ГКР эритроцитов, который соответствует спектру гема типа b, и спектр окисленного изолированного цитохрома с. Красным цветом отмечены пики, по которым можно чётко отличить спектр гема b и с. Рисунок из [9] с изменениями.
Как и ожидалось, спектры ГКР цитохрома с митохондрий оказались очень чувствительны к изменению его окислительно-восстановительного состояния. Для этого было исследовано два воздействия: внесение протонофора FCCP и ингибитора АТФ-синтазы олигомицина.
FCCP встраивается во внутреннюю мембрану митохондрий и начинает переносить протоны из ММП в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается [30]. В этом случае возрастает количество поглощённого кислорода и скорость окисления субстратов, а, следовательно, и количество окисленных молекул цитохрома с, что очень хорошо видно на спектрах ГКР. И наоборот, добавление ингибитора синтеза АТФ — олигомицина, который приводит к увеличению электрохимического градиента на фоне снижения скорости дыхания, увеличивает количество восстановленных молекул цитохрома с, что также выражено на спектрах ГКР митохондрий.
Таким образом, спектры ГКР митохондрий, являясь спектрами исключительно цитохрома с, оказались чувствительны к изменениям его конформации и редокс-состояния в процессе работы митохондрий.

Схема всей работы в одном ролике
Итоги
Спектроскопия гигантского комбинационного рассеяния позволяет многократно усилить сигнал КР от молекул вблизи наночастиц металла. Однако для проведения успешных экспериментов необходимо учитывать свойства как биологического объекта, так и наноструктур. «Ключевым моментом нашего достижения стал междисциплинарный подход к работе, в которую были вовлечены биологи, химики и физики», — поясняет одна из главных авторов проекта к.б.н. Надежда Браже, ставшая осенью 2015 года лауреатом премии L’Oreal Unesco для женщин в науке. — «Результатом такого подхода стало создание уникальной методики селективного определения редокс-состояния и конформации цитохрома с в живых функционирующих митохондриях, помещенных на специальную наноструктурированную поверхность. Разработанная методика поможет восполнить пробелы наших знаний о свойствах и поведении переносчиков электрона в митохондриях, а также может быть использована для разработки диагностических тестов для раннего выявления патологий митохондрий, чем и планируется заниматься в ближайшее время».
Митохондрии: энергостанции нашего организма
На молекулярном уровне наш организм можно рассматривать как своеобразный биологический механизм. Очень сложную, многогранную, но, тем не менее, машину, принципы работы которой мы сегодня начинаем понимать все лучше и лучше. И один из этих принципов является по-настоящему фундаментальным: никакая машина не сможет работать без притока энергии.
Для более простых механизмов этот принцип нам понятен, что называется, на интуитивном уровне. Двигатель автомобиля получает энергию, сжигая топливо в баке, телевизор использует энергию тока в розетке и так далее. Но вот с нашей собственной биологической машиной – нашим телом – все не так очевидно. То есть, наверняка наш читатель знает, что мы берем энергию из пищи (и об этом мы уже рассказывали более подробно). Но вот как именно это происходит? Где и как в нашем теле условные углеводы или жиры превращаются в ту движущую силу, которая необходима для всех без исключения процессов, протекающих в организме?
Клеточные «электростанции»
Основные объемы энергии в человеческом теле вырабатываются внутри отдельных клеток. Можно сказать, что каждая из них самостоятельно отвечает за собственное энергоснабжение. А это значит, что в каждой клетке (как минимум в тех клетках, которые имеют ядра, эритроциты не в счет), должна быть своя «электростанция». И это действительно так! Более того, нередко таких «электростанций» имеется несколько десятков или даже сотен. Зависит их число от того, насколько интенсивно работает клетка, а значит, и от того, насколько много ей требуется энергии в единицу времени. Научное название таких «электростанций» – митохондрии, а их совокупность именуют митохондриальным пулом клетки.
Как появились митохондрии?
Один из важных вопросов, который давно беспокоил научную общественность: а откуда вообще взялись митохондрии в наших клетках? Самая современная и достоверная теория предлагает крайне необычный ответ: митохондрии – это потомки бактерий.
Давным-давно одноклеточные организмы, которым предстояло стать нашими предками, научились поглощать крохотные бактерии, присутствующие в окружающей среде. Если попросту – они ими питались. Но в один прекрасный день такая протобактерия не разрушилась, попав во внутриклеточную среду. И более того, она сохранила не только целостность, но и кое-какие свои функции. В частности, способность вырабатывать энергию с помощью кислорода. Каков до этого был механизм получения энергии у тех одноклеточных, которые впоследствии станут нами, известно плохо. Но с уверенностью можно сказать, что аэробный путь, предложенный им проглоченной бактерией, был однозначно более выгодным и эффективным.
Результатом этого удивительного события стал внутриклеточный симбиоз. Бактерия вырабатывала много энергии, а одноклеточный организм-хозяин снабжал ее достаточным количеством кислорода и других необходимых соединений. Со временем протобактерия упростилась, видоизменилась и стала необходимой клеточной органеллой. Этот союз оказался настолько успешным, что сейчас на нем построено энергоснабжение практически всех эукариотических клеток растений, грибов и животных. В том числе и нас с вами [1].
Как устроены митохондрии?
Многое в строении митохондрий до сих пор напоминает о том, что когда-то они были самостоятельными бактериями. Так, например, они окружены внешней липидной мембраной – такую мембрану имеют и все остальные клетки нашего организма. Основная функция внешней мембраны – защита митохондрии, отграничение ее от окружающей внутриклеточной среды, а также транспортировка необходимых веществ внутрь и выведение результатов ее работы наружу [2].
Внутреннее пространство митохондрии занимает матрикс. Это жидкая среда, состоящая из смеси жирных кислот, белков, рибосом и других соединений. В матриксе проходит первая стадия кислородного дыхания, то есть, выработки энергии. Кроме того, здесь находится и еще одно свидетельство прошлой самостоятельности митохондрий – митохондриальная ДНК. Да, оказывается, не весь наш генетический материал помещен в клеточное ядро! Эти небольшие кольцевые митохондриальные ДНК (мтДНК) кодируют 13 белков, которые нужны для работы самой митохондрии. В основном это ферменты, участвующие в дыхательной цепи окисления водорода [3].
Что еще интересно: люди наследуют мтДНК исключительно по материнской линии, а мтДНК, полученная от сперматозоида, разрушается сразу после оплодотворения [4]. Эта «женская» мтДНК мутирует по очень четким законам и поэтому можно отследить то, как именно она изменялась с течением времени. Ряд исследований последних лет убедительно доказал, что примерно 200 000 лет назад в Африке жила женщина, от которой свою мтДНК получило все современное человечество. Ученые поэтически назвали эту женщину «митохондриальной Евой» [5].
Наконец, между внешней мембраной и матриксом имеется и вторая, внутренняя мембрана. Она очень неровная и образует кристы – длинные складки, направленные к центру митохондрии. Именно их – как темные полосы – видели первые исследователи XIX века. На внутренней мембране как раз и происходит запасание энергии в виде молекул аденозинтрифосфата (АТФ). В процессе этого потребляется более 80% того кислорода, который попадает в нашу кровь при дыхании [6].
Чем еще заняты наши митохондрии?
Основная функция этих органелл – обеспечение энергией всех протекающих в клетке процессов. Однако, помимо этого митохондрии выполняют и еще целый ряд витальных (жизненно важных) функций. В их числе:
Опираясь на данные современных исследований, можно смело утверждать, что митохондрии, во-первых, активно участвуют во внутриклеточных процессах, а во-вторых, влияют и на физиологию всего организма. Такая «широкая специализация» стала причиной того, что нарушения работы митохондрий сегодня рассматривают как одну из важных причин появления множества заболеваний [12].
Что будет при нарушении работы митохондрий?
Очевидно, что самым первым и самым ярким проявлением дисфункции митохондрий будет уменьшение выработки энергии в клетке. На клиническом уровне такое обстоятельство может проявляться по-разному. И больше всего пострадают те ткани, которые работают максимально активно, а значит, требуют наибольшего притока энергии [13]:
Кроме того, учитывая другие функции митохондрий, о которых мы рассказывали выше, их неправильная работа может становиться фактором риска развития многих нарушений [14]:
Как улучшить работу митохондрий?
На настоящий момент предложены две стратегии того, как улучшить функции митохондриального пула. Первая связана с тем, что митохондрии, как органеллы, не статичны. Они могут сливаться, делиться, увеличиваться и уменьшаться в размерах, а также обмениваться своим генетическим материалом [15]. Это тоже своеобразное «наследие» их бактериального прошлого. В ходе таких слияний и делений поврежденные участки митохондрий и мтДНК отсеиваются и распадаются. Итогом становится образование новых, полноценных митохондрий, которые намного лучше выполняют все свои функции. То есть, благодаря этим процессам происходит обновление всего митохондриального пула клетки [16].
Мы имеем возможность ускорить это обновление. В частности, таким действием обладает функциональный продукт здорового питания под названием T8 ERA MIT UP, который недавно выпустила на рынок компания VILAVI INT LTD. В этом продукте содержится концентрат гранатового сока, который богат веществами под названием эллаготаннины [17]. Попадая в наш желудок, они быстро распадаются с образованием эллаговой кислоты, а ее, в свою очередь, перерабатывают кишечные бактерии, производя уролитин А [18]. Это соединение как раз и стимулирует митохондрии активнее обновляться путем слияния и деления. Уже есть исследования, которые показывают, что дефицит уролитина А – важный фактор преждевременного старения [19]. Помимо этого, доказано, что приток этого вещества увеличивает сопротивляемость физическим и умственным нагрузкам как раз за счет улучшения выработки энергии в митохондриях [20].
Вторая стратегия основана на защите митохондрий от разрушающего воздействия оксидативного стресса. Как мы уже говорили, в ходе выработки энергии они также синтезируют активные формы кислорода. Это молекулы-суперокислители (они же – свободные радикалы), которые играют сигнальную роль. Но, помимо этого, они обладают и немалой химической агрессивностью, являясь основной причиной оксидативного клеточного стресса [21]. А еще один действующий компонент активной формулы T8 ERA MIT UP – комплекс SibXP, содержащий полипренолы, клеточный сок пихты и хвойную пасту CGNC. При этом полипренолы – это многоатомные спирты растительного происхождения, которые обладают выраженной антиоксидантной активностью. Именно это их свойство и важно для улучшения функции митохондрий. Полипренолы химически связывают свободные радикалы, не давая им повреждать митохондриальные мембраны и ферменты. Благодаря этому выработка энергии в клетке и поддерживается на необходимом уровне [22].
Источники
1. Evans A., Neuman N. The Mighty Mitochondria. Molecular Cell. 2016, March, 3, 61 (5): 641.
2. André J. Mitochondria. Biology of the Cell. 1994, 80 (2-3): 103-6.
3. Gaston D., Tsaousis A.D., Roger A.J. Predicting proteomes of mitochondria and related organelles from genomic and expressed sequence tag data. Methods in Enzymology. 2009, 457: 21-47.
4. Al Rawi S., Louvet-Vallée S., Djeddi A., Sachse M., Culetto E., Hajjar C., Boyd L., Legouis R., Galy V. Postfertilization autophagy of sperm organelles prevents paternal mitochondrial DNA transmission. Science. 2011, 334: 1144-1147.
5. Fu Q., Mittnik A., Johnson P.L., Bos K., Lari M., Bollongino R., Sun C., Giemsch L., Schmitz R., et al. A revised timescale for human evolution based on ancient mitochondrial genomes. Current Biology. 21 March 2013, 23 (7): 553–59.
6. André J. Mitochondria. Biology of the Cell. 1994, 80 (2-3): 103-6.
7. Bock F.J., Tait S.W.G. Mitochondria as multifaceted regulators of cell death. Nature Reviews Molecular Cell Biology. 2020, February, 21 (2): 85-100.
8. Kornmann B. The endoplasmic reticulum-mitochondria encounter structure: coordinating lipid metabolism across membranes. Journal of Biological Chemistry. 2020, May, 26, 401 (6-7): 811-820.
9. Liu X., Hajnóczky G. Ca2+-dependent regulation of mitochondrial dynamics by the Miro-Milton complex. International Journal of Biochemistry and Cell Biology. 2009, 41: 1972-1976.
10. Murphy M.P. How mitochondria produce reactive oxygen species. Biochemistry Journal. 2009, 417: 1-13.
11. Clark A., Mach N. The crosstalk between the gut microbiota and mitochondria during exercise. Frontiers of Physiology. 2017, May 19, 8: 319.
12. Annesley S.J., Fisher P.R. Mitochondria in Health and Disease. Cells. 2019. July, 5, 8 (7): 680.
13. van der Giezen M., Tovar J. Degenerate mitochondria. Reports of European Molecular Biology Organization. 2005, June, 6, (6): 525-30.
14. Duchen M.R. Mitochondria in health and disease: perspectives on a new mitochondrial biology. Molecular Aspects of Medicine. 2004, August, 25 (4): 365-451.
15. Youle R.J., van der Bliek A.M. Mitochondrial fission, fusion, and stress. Science (New York, N.Y.), 2012, 337(6098), 1062–1065.
16. Ashrafi G., Schwarz T.L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death & Differentiation. 2013, January, 20 (1): 31-42.
17. Johanningsmeier S.D., Harris G.K. Pomegranate as a functional food and nutraceutical source. Annual Review of Food Science and Technology. 2011-02-28, 2 (1): 181–201.
18. Selma M.V., Beltrán D., Luna M.C., Romo-Vaquero M., García-Villalba R., Mira A., et al. Isolation of Human Intestinal Bacteria Capable of Producing the Bioactive Metabolite Isourolithin A from Ellagic Acid. Frontiers in Microbiology. 2017, 8: 1521.
19. D’Amico D., Andreux P.A., Valdés P., Singh A., Rinsch C., Auwerx J. Impact of the Natural Compound Urolithin A on Health, Disease, and Aging. Trends in Molecular Medicine, May 2021, S1471491421001180.
20. Ryu D., Mouchiroud L., Andreux P.A., Katsyuba E., Moullan N., Nicolet-Dit-Félix A.A., et al. «Urolithin A induces mitophagy and prolongs lifespan in C. elegans and increases muscle function in rodents». Nature Medicine. August 2016, 22 (8): 879–88.
21. Lin M.T., Beal M.F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature. 2006, October, 19, 443 (7113): 787-95.
22. Михайлова Е.А., Локошко Д.В., Большакова Е.М. Полипренолы и долихолы, как важный компонент антиоксидантной защиты фосфолипидных мембран. Обзор данных современной научной литературы. Современная Российская наука: актуальные вопросы, достижения и инновации: сборник статей II Всероссийской научно-практической конференции, Пенза, 07 мая 2021 года. С. 97-101.