Митозы в эндометрии что это
Митозы в эндометрии что это
Проблема регулирования рождаемости – одна из самых актуальных проблем современного общества [5, 6, 14, 15]. Нередко обстоятельства складываются так, что женщина временно не может иметь детей по состоянию здоровья или вследствие каких-то иных причин. Кроме того, опыт ВОЗ показывает, что обеспечение интервалов между родами не менее, чем 2-2,5 года, позволяет снизить детскую смертность в родах в 4, а материнскую – в 2 раза. Одним из самых распространенных методов контрацепции в нашей стране считаются внутриматочные противозачаточные средства (ВМС). Интерес авторов вызывают различные аспекты использования ВМС [8, 10, 11, 13].
Данные литературы о влиянии внутриматочных средств на митотический режим эндометрия немногочисленны [2], срок их применения в этих наблюдениях ограничен 6-12 мес.
Целью настоящей работы явилось изучение особенностей митотического режима эндометрия при использовании не гормональных ВМС от 6 мес до 12 лет.
Материалы и методы исследования
Цуги или соскобы эндометрия, брали на 8-10-й или на 19-23-й день менструального цикла при применении ВМС либо сразу после их удаления. Ко времени обследования все женщины были практически здоровы, средний возраст составил 29,5 года. Для изучения отобраны женщины, у которых эндометрий был без патологических изменений.
Эндометрий фиксировали в 10 % растворе нейтрального формалина, срезы толщиной 6-9 мкм окрашивали железным гематоксилином по Гейденгайну. Определяли митотическую активность – МА (число митотически делящихся на 100 полей зрения микроскопа; об.90х, ок. 10х), процентное соотношение фаз митоза. Общее число патологических митозов и различных форм патологии кариокинеза, выраженное в процентах к общему числу митозов. Полученные данные сравнивали с контролем, обрабатывали статистически с использованием критерия достоверности Фишера-Стъюдента.
Результаты исследования и их обсуждение
Исследования показали. что в контрольной группе на 8-10-й день менструального цикла (средняя стадия пролиферации) МА эпителия равнялась 50,+/-2,2, МА клеток стромы ниже – 22,3+/-2,0. Среди нормальных митозов преобладали профазы и метафазы (в эпителии соответственно 42,3 и 32,4 %, в строме 45,3 и 34,4 %). Аналогичные данные о соотношении количества профаз и метафаз в клетках эндометрия получены другими авторами [4]. Патологические митозы составили 1,80+/-0,3 % в эпителии желез, 1,7+/-0,2 % в клетках стромы. Отдельные формы патологии митоза были в основном представлены отставанием хромосом в метакинезе и при расхождении, часто встречались К-митозы. Данные о преобладании этих типов митозов в эндометрии приводятся в литературе [3].
На 19-23-й день менструального цикла (средняя стадия секреции) в контрольной группе МА эпителия равнялась 16,2+/-0,4 в строме – 4,8+/-0,54. Большинство нормальных митозов составляли профазы и метафазы. Количество патологических митозов в эту стадию цикла имело тенденцию к снижению (в эпителии 0,5+0,02 %, в строме 0,40+0,05 %), спектр их был тот же, что и в пролиферативной фазе.
У женщин, применявших ВМС сроком до 1 года, в среднюю стадию пролиферации в эпителии (МА = 36,6+/-3,4) и клетках стромы (МА = 13,1+/-1,4) наблюдалось снижение МА (Р 0,05). Соотношение числа профаз и метафаз оставалось прежним. Из отдельных форм патологии митоза преобладали отставание хромосом и их фрагментов в метакинезе и К-митозы. В среднюю стадию секреции МА эпителия составляла 14,9+0,6 % (Р > 0,05) и была выше. Чем в клетках стромы (3,37+/-0,4). В обоих компонентах преобладали профазы. Количество патологических митозов в эпителии было 0,35+/-0,01 %, в строме – 0,073+/-0,15 % (Р > 0,05), в основном они были представлены отставанием хромосом в метакинезе и К-митозами.
Во 2-й группе на 8-10-й день цикла МА эпителия (52,8+/-1,3) повышалась незначительно (Р > 0,05), МА клеток стромы (22,9+/-3,2) не изменялась по сравнению с контрольной группой. Количество патологических митозов в клетках стромы уменьшилось, в эпителии несколько увеличивалось (1,95+/-0,1; Р > 0,05). В обоих компонентах эндометрия соотношение числа профаз и метафаз было больше 1. В среднюю стадию фазы секреции МА немного снижалась и в эпителии (15,19+/-0,35; Р > 0,05), и в строме (4,2+0,2; Р > 0,05). В эпителиальном компоненте отмечена тенденция к росту метафаз (Р > 0,05), в клетках стромы – числа профаз. Число и спектр патологических митозов не изменялись в сравнении с контролем.
В 3-й группе на 8-10 день цикла МА эпителия (48,5+/-2,0) и стромы (21,6+/-1,2) существенно не менялась. Процент патологических митозов в эпителии не менялся, а в клетках стромы снижался. И в эпителии, и в строме преобладали профазы (соответственно 40,6 и 41,3 %). На 19-23-й день менструального цикла МА эпителия составляла 15,49+/-1,0 и была выше, чем в клетках стромы (5,75+/-0,2). Среди нормальных фаз митоза преобладали профазы. Число патологических митозов возрастало (Р > 0,05), но разнообразия их форм не выявлено.
В средней стадии пролиферации у женщин, применявших ВМС 5-7 лет, МА клеток стромы возрастала (24,1+/-2,3; Р > 0,05), в клетках желез эндометрия оставалась на прежнем уровне (51,6+/-3,7). В обоих компонентах соотношение числа профаз и метафаз примерно равно 1. Общее число патологических митозов в эпителии увеличивалось (2,4+/-0,4; Р > 0,05), а в клетках стромы оставалось на уровне контрольной группы. Патологические митозы представлены К-митозами, отставание хромосом в метакинезе, иногда другими формами. На 19-23-й день цикла митозы наблюдались в эпителиальных и стромальных клетках, МА эпителия равна 15,62+/-0.4, клеток стромы – 5,3+/-0,35. Среди нормальных митозов в обоих компонентах эндометрия несколько возросло число метафаз. Процент патологических митозов значительно не изменялся. Спектр их был примерно тем же, что и в контрольной группе.
В 5-й группе на 8-10-й день цикла МА эпителия и стромы слизистой оболочки тела матки не претерпевала изменений (соответственно 52,3+/-2,1 и 23,4+/-1,9) в сравнении с контролем. Однако в обоих компонентах среди нормальных митозов преобладали метафазы ( в эпителии 48,6 %, в клетках стромы 48,3 %). Количество патологических митозов в эпителии возрастало (4,3+/-0,3 %; Р 0,05). В эпителии преобладали метафазы (47,4 %). И в клетках эпителия, и в клетках стромы увеличивалось количество патологических митозов, которые составили в эпителии 0,71+/-0,14 % (Р > 0,05), в строме – 0,92+/-0,02 % (Р
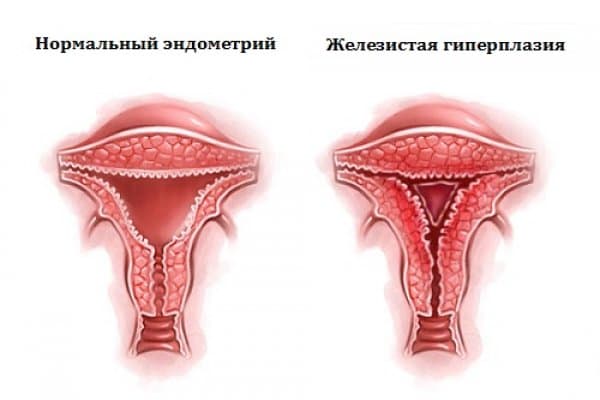
Гиперплазия эндометрия матки
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Эндометрий представляет собой нежную тонкую слизистую ткань, которая выстилает полость матки изнутри. Данная ткань каждый месяц быстро растет и утолщается под действием женских половых гормонов. В случае наступления беременности, эндометрий является «пуховой периной» на которую прикрепляется оплодотворенная яйцеклетка. При отсутствии беременности под действием гормонов эндометрий отторгается, выходит в виде менструальной крови.
Классификация гиперплазии эндометрия по локализации
Классификация гиперплазии эндометрия (по гистологической картине)
Причины гиперплазии эндометрия
В настоящее время основной причиной развития гиперплазии считается нарушение баланса женских половых гормонов, который чаще всего встречается в пубертатном периоде и перименопаузе.
Факторы риска развития гиперплазии эндометрия
Симптомы, которые встречаются при гиперплазии эндометрия
Основные из них при гиперплазии эндометрия могут быть:
Обследования, которые помогут выявить и поставить диагноз гиперплазии эндометрия
Лечение гиперплазии эндометрия
Практически в 100% случаев лечение гиперплазии эндометрия хирургическое.
Методами хирургического лечения гиперплазии эндометрия является гистероскопия и гистерорезектоскопия.
Данная операция проводится под общей анестезией. Продолжительность операции не превышает 30 минут, короткий период нахождения под общей анестезией позволяет врачам в тот же день отпустить пациентку домой.
Осложнения гиперплазии
При отсутствии должного и адекватного лечения гиперплазия эндометрия приводит к тяжелой анемии с значительным снижением уровня гемоглобина, появлению слабости, повышенной усталости, сонливости, что связано с большими потерями крови во время менструации. У молодых женщин гиперплазия эндометрия может быть причиной бесплодия и невынашивания беременности. Отдельные формы гиперплазии эндометрия (железистая и кистозная гиперплазии эндометрия) являются предраковым состоянием и в случае длительного наблюдения, при отсутствии лечения, могут переродиться в рак матки.
Профилактические мероприятия при данном заболевании необходимы для того, чтобы снизить риск развития рака эндометрия и предотвратить рецидив гиперплазии.
Гиперплазия эндометрия. Часто задаваемые вопросы
1. Что это такое? Доброкачественный процесс, который характеризуется чрезмерным разрастанием внутреннего слоя матки.
2. Из-за чего она возникает? Из-за постоянного воздействия полового гормона эстрогена на эндометрий, который вызывает его чрезмерное разрастание. Гиперэстрогения возникает из-за нарушения центральной регулиции менструального цикла, гормонопродуцирующих опухолей яичников, неправильного использования гормональных препаратов, дефицита прогестерона (гормон II фазы менструального цикла), обладающего антипролиферативным действием, так же в результате ановуляторных циклов.
3. Это распространенное заболевание? Частота встречаемости в структуре гинекологической заболеваемости 15-50%. По данным обращаемости пациенток частота встречаемости ГПЭ- 30%. В позднем репродуктивном возрасте и в перименопаузе встречается с частотой- 50%
4. Это заболевание очень опасно? Пристального внимания врачей заслуживают:
При отсутствии должного лечения гиперплазия эндометрия может приводить к серьезным маточным кровотечениям, со снижением гемоглобина крови и вытекающими отсюда последствиями.
5. Возможно ли забеременеть на фоне гиперплазии эндометрия? Ответ – нет. Гиперплазия эндометрия не возникает спонтанно, это следствие нарушений в репродуктивной системе женщины. Нарушение баланса между звеньями регуляции менструального цикла вызывает избыток эстрогенов в организме женщины, нехватку прогестерона, вследствие этого отсутствие овуляции (выхода яйцеклетки из фолликула для оплодотворения). Так же сам эндометрий структурно изменен, поэтому является неблагоприятным для имплантации (прикрепление плодного яйца к стенке матки).
7. Как диагностировать атипическую гиперплазию эндометрия? Большую информацию врач получает при опросе пациентки во время общения (возраст менархе или время наступления менопаузы, все особенности менструального цикла- его длительность, характер выделений и т.д.).
УЗ-исследование в зависимости от периода жизни женщины, а также фазы менструального цикла может дать информацию о состоянии эндометрия. По этим данным можно заподозрить проблему, однако подтвердить или опровергнуть атипию в клетках эндометрия нельзя. Только проведение гистероскопии с последующим гистологическим исследованием материала является золотым стандартом для диагностики этого состояния. Информативность метода более 90%.
8. Обязательно ли проводить выскабливание эндометрия при гиперплазии? Раздельное выскабливание цервикального канала и полости матки несет за собой лечебный и диагностический характер. Механическое удаление измененной патогенной ткани из полости матки предотвращает маточное кровотечение, что составляет лечебный эффект. Полученный соскоб отправляется на гистологическое исследование, после которого будет дано заключение о характере ткани, наличии или отсутствии признаков злокачественного поражения.
9. Возможен ли рецидив гиперплазии эндометрия? Да, возможен. Так как причиной гиперплазии эндометрия является нарушение гормонального баланса в организме женщины, то требуется обследование её гормонального фона. Для профилактики рецидива необходимо соответствующее лечение и исключение факторов риска.
Атипическая гиперплазия эндометрия
Симптомы атипической гиперплазии эндометрия
Симптомы атипической гиперплазии эндометрия имеют место в виде тех или иных проявлений присущих каждому конкретному характеру и типу развития патологического процесса. Основным симптомом данного заболевания являются маточные кровотечения. У большинства пациенток такие кровотечения возникают на фоне задержки менструации сроком на 1-3 месяца. Реже (как правило, при отсутствии ожирения и явной эндокринной патологии) наблюдаются регулярные циклы при продолжительности меноррагии более 7 дней. Примерно у четверти больных с атипической гиперплазией эндометрия выявляются ановуляторные маточные кровотечения. В 5-10% случаев диагностируются метроррагии. Возможны скудные кровянистые выделения в середине менструального цикла либо при отсутствии менструаций. Так при железистой форме заболевания, которое по своей сути является доброкачественным, происходит пролиферация стромы и эндометриодных желез. Отмечается утолщение слизистой оболочки, а железы в строме располагаются неправильным образом. Выраженность процессов железистой гиперплазии обуславливает ее дифференциацию на активную, острую стадию заболевания и находящуюся в состоянии покоя, хроническую его форму. Активная форма характеризуется большим количеством клеточных митозов в строме и эпителии желез, что проявляется как следствие продолжительного чрезмерно высокого уровня эстрогенов. На стадии хронического заболевания митозы образуются редко, что имеет причиной недостаточную гормональную стимуляцию из-за малого количества эстрогенов. Симптомы атипической гиперплазии эндометрия железисто-кистозного типа сходны с проявлениями железистой гиперплазии, с той лишь разницей, что имеют несколько большую степень выраженности. Одним из характерных признаков является кистозное расширение желез.
Лечение атипической гиперплазии эндометрия
Оперативное лечение гиперплазии эндометрия
Для лечения гиперплазии эндометрия применяются следующие группы гормонов:
— гестагены (Дюфастон,Утрожестан) с 16 по 25 день менструального цикла назначают на 3-6 месяцев.Подходят женщинам любого возраста с любыми видами гиперплазий. С успехом применяют гестагенсодержащую контрацептивную внутриматочную спираль ‘Мирена’,которая оказывает местный эффект на эндометрий в отличие гестагенов, применяемых оральным путем,которые имеют системное воздействие. Спираль ставят на 5 лет.Минус спирали в том,что довольно часто возникает побочный эффект в виде межменструальных кровяных выделений в течение 3-6 месяцев после постаковки спирали.К тому же многих пациенток смущают мажущий характер менструальных выделений на фоне Мирены и наличие инородного тела в полости матки;
Пациентки с атипической гиперплазией эндометрия требуют особого динамического наблюдения гинеколога. Контрольное УЗИ следует проводить через 3,6 и 12 месяцев после выскабливания и начала приема гормонов для оценки эффективности лечения. При повторном рецидиве аденоматоза показано удаление матки.
После выскабливания полости матки и/или резекции эндометрия пациентка может быть выписана домой в день операции либо на следующий день. В течение 3-10 дней после манипуляции могут быть необильные кровяные выделения из половых путей. После аблации обычно вместе с выделениями выходят остатки резецированных тканей. Подобные выделения являются нормой и не должны смущать. Параллельно с гормонотерапией для быстрого выздоровления показан прием витаминов: аскорбиновая кислота, витамины группы B, препараты железа при анемии ( Сорбифер, Мальтофер). Назначается седативная терапия (настойки валерианы или пустырника). Полезны физиотерапевтические процедуры (электрофорез) и иглорефлексотерапия. Питание должно быть полноценным, необходимо соблюдать режим труда и отдыха. Также рекомендуется половое воздержание в течение 2-х недель после выскабливания.
Онкологические аспекты гиперпластических процессов эндометрия
Гиперплазия — это увеличение количества клеток без увеличения их размеров. Гиперпластические процессы могут предшествовать развитию онкологического заболевания. Гиперплазия эндометрия — одна из форм патологических пролиферативных изменений эндометрия, с преимущественной пролиферацией железистого компонента по сравнению со стромальным компонентом [1].
Существует гистологическая классификация гиперпластических процессов эндометрия, предложенная ВОЗ (2014) [2]:
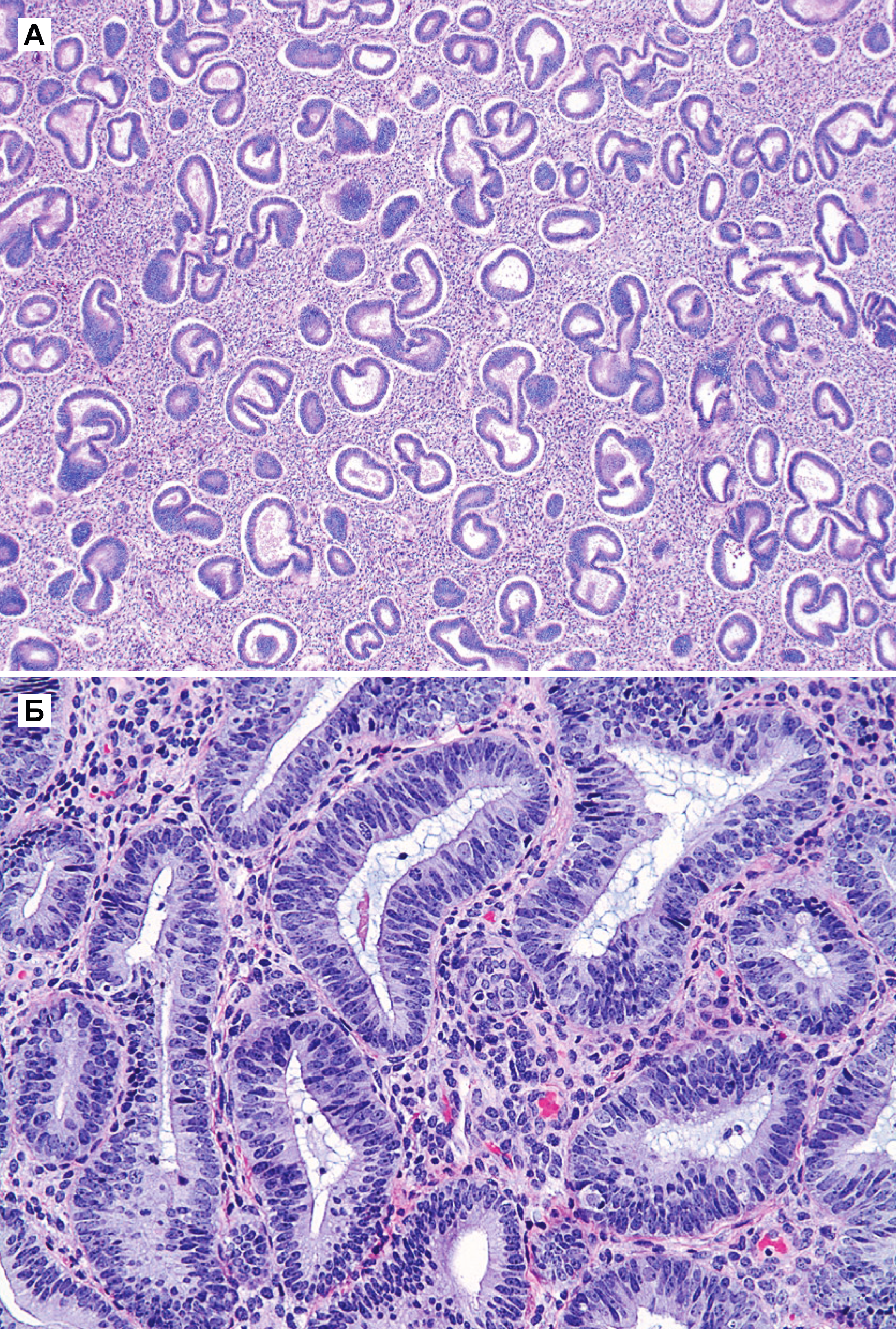
Гиперплазия эндометрия без атипии — это пролиферация с изменением строения желез и клеток, но без клеточной атипии. Изменения в строении обычно видны при малом увеличении, но важной особенностью, которая определяет прогноз и возможность малигнизации — это клеточная атипия. Все типы гиперплазии характеризуются увеличением отношения железы к строме, неравномерностью формы железы и изменением размера железы (рис. 1 а и б). При гиперплазии без атипии железистый эпителий напоминает пролиферирующий эндометрий (рис. 1 б). Клетки столбчатые с амфофильной цитоплазмой и имеют псевдостратифицированные ядра, ориентированы к базальной мембране и имеют овальную форму с гладкими контурами, равномерно распределенный хроматин и небольшие незаметные ядрышки. Митотическая активность может быть переменной и может быть меньше, чем в пролиферирующем эндометрии. Частота митоза не влияет на диагноз [5].
Как правило, гиперплазия диффузная, но может быть очаговой из-за локальных различий в содержании рецепторов эстрогена и прогестерона в эндометрии. При простой гиперплазии присутствует строма в значительном объеме. Строение стромы напоминает нормальное, характерное для пролиферативной фазы, строма состоит из маленьких овальных клеток со скудной цитоплазмой. Как и в железах, в строме отмечена митотическая активность. Когда гиперплазия является полипоидной, строма может содержать артерии с толстой стенкой, подобные тем, которые наблюдаются в полипах. По мере прогрессирования гиперплазии железы располагаются более тесно. Обычно железы плотно прилегают друг к другу, хотя всегда присутствует небольшое количество стромы между ними [5].
К предраковым заболеваниям эндометрия относятся [2]:
Эндометрий — мишень половых гормонов, так как эта ткань имеет специфические рецепторы. Клетки эндометрия обновляются ежемесячно под влиянием гормональной регуляции. Нарушение гормонального статуса женщины может изменять рост и дифференцировку клеток. Поэтому могут возникнуть гиперпластические процессы [2].
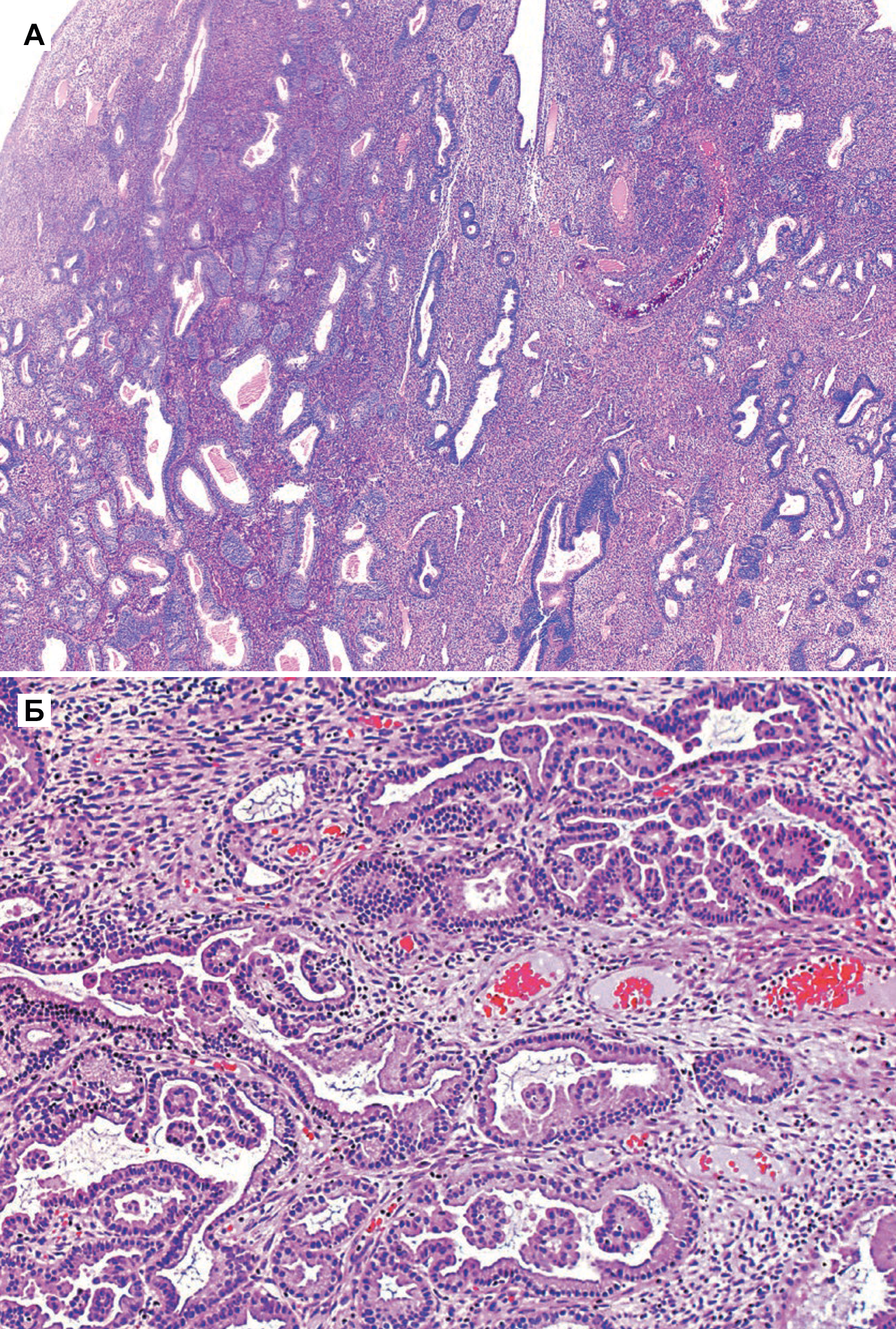
Атипичная гиперплазия отличается наличием ядерной атипии и сложным строением с тесно расположенными железами. Железы обычно неправильной формы и размера. Каждая железа имеет базальную мембрану, окруженную тонким слоем стромы, отделяющей его от соседних желез. Однако в некоторых случаях железы расположены далеко друг от друга. Встречаются как железы без клеточной атипии, так и атипичные [5].
Специфические особенности при атипичной гиперплазии включают: стратификацию, увеличение размера ядер с измененным хроматином и ядрышками. В ядрах отмечена истинная стратификация (2–4 слоя), и потеря ориентирования к базальной мембране [5].
На фоне гиперпластических процессов в эндометрии, возникающих при длительной пролиферации желез эндометрия без перехода их в секреторную фазу, может развиваться рак тела матки (РТМ) — это злокачественная опухоль, происходящая из слизистой оболочки тела матки (эндометрия). Чаще всего РТМ носит спорадический характер, и в 5 % случаев РТМ ассоциирован с наследственными синдромами, например, с синдромом Линча. Среди факторов риска: гиперэстрогения, ранние менархе, отсутствие родов в анамнезе, поздняя менопауза, возраст старше 55 лет, применение тамоксифена [3].
Эпидемиология РТМ
РТМ — самая частая злокачественная опухоль женских половых органов в развитых странах и вторая по частоте после рака шейки матки злокачественная опухоль женских половых органов в мире. В США в 2015 г. зарегистрировано более 54800 новых случаев заболевания РТМ, и более 10150 смертей от этого заболевания. В России ежегодно регистрируется более 21 тысячи больных РТМ. В структуре заболеваемости женского населения в России в 2016 г. РТМ занимал 3-е ранговое место (7,7 %). Средний возраст заболевших РТМ в России составляет 62,6 года [3,4].
Патогенез
Развитие РТМ обусловлено гиперэстрогенией, основной причиной которой является нарушение овуляции. Клиническое изучение метаболических нарушений у больных раком тела матки и морфологические особенности рака эндометрия позволили обосновать концепцию о двух основных патогенетических вариантах заболевания [2].
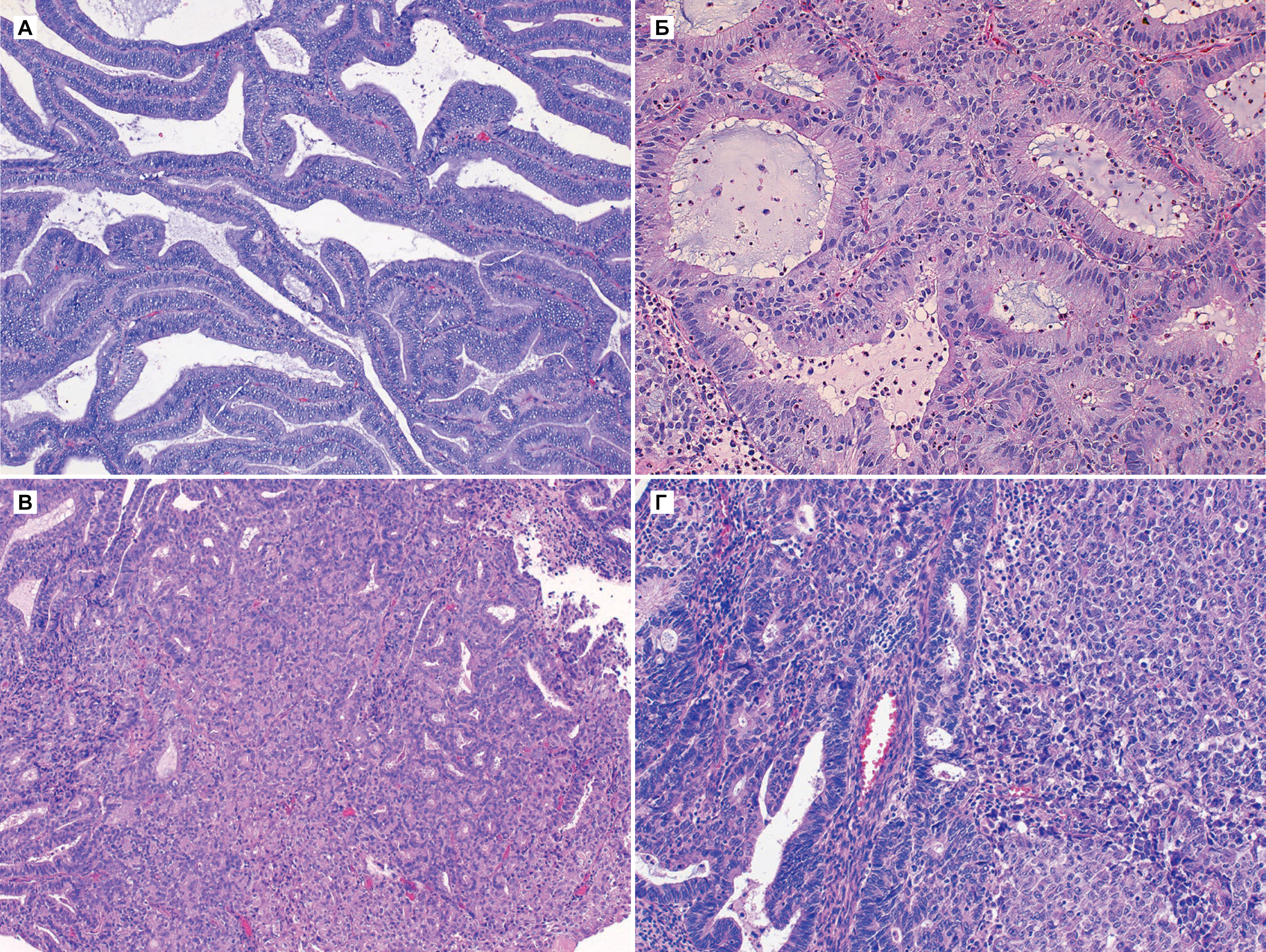
I тип (более частый). Опухоль развивается в более молодом возрасте, в отличие от пациенток II патогенетического варианта, на фоне длительной гиперэстрогении и гиперплазии эндометрия. У больных РТМ I патогенетического типа часто наблюдаются ожирение, сахарный диабет и гипертоническая болезнь, возможны эстрогенсекретирующие опухоли яичников или синдром склерокистозных яичников. Опухоли I патогенетического варианта, как правило, высокодифференцированные, имеют более благоприятный прогноз [2].
II тип. Опухоли эндометрия обычно низкодифференцированные, имеют менее благоприятный прогноз. Опухоли II патогенетического типа возникают в более старшем возрасте, в отсутствие гиперэстрогении, на фоне атрофии эндометрия. Примерно у 80% больных РТМ диагностируют эндометриоидную аденокарциному [2].
Выделяют три степени дифференцировки аденокарциномы эндометрия [2]:
G1 — высоко дифференцированная;
G2 — умеренно дифференцированная;
G3 — низко дифференцированная или недифференцированная.
Клиника
Ранний симптом прогрессирования рака эндометрия — появление жидких водянистых белей, нередко с примесью крови, и зуда наружных половых органов. Кровянистые выделения из половых путей бывают в виде мажущих серозно-кровянистых выделений, которые становятся порой обильными. Кровотечение, как правило, контактное или появляется после физической нагрузки [2].
Возможны боли внизу живота, которые на ранних стадиях рака носят схваткообразный характер. Это связано с сокращениями эндометрия и опорожнением матки от скопившейся в ней крови или гноевидной жидкости (гематометра, пиометра), отток которой в результате обтурации внутреннего зева затруднен. После таких схваткообразных болей появляются обильные выделения из матки — гной и кровь. При поздних стадиях боли постоянные, особенно интенсивные по ночам, связаны со сдавлением раковым инфильтратом нервных сплетений в малом тазу. При переходе процесса на мочевой пузырь и прямую кишку появляются симптомы нарушения функционирования этих органов [2].
Хирургическое вмешательство рекомендуется как наиболее эффективный метод лечения РТМ независимо от стадии как самостоятельно, так и в комбинации с другими методами [6].
Список литературы:
Митозы в эндометрии что это
Одним из наиболее распространенных методов предупреждения нежелательной беременности является внутриматочная контрацепция, которой пользуются более 100млн женщин во всем мире [10, 26, 30, 36].
Установлено, что при внутриматочной контрацепции возможно развитие ряда патологических изменений в эндометрии [17, 19, 24, 27]. Длительно существующий воспалительный процесс [14, 15, 16, 21] неодинаково выраженные очаги пролиферации, очаги и поля метаплазии, возникшие на фоне хронического воспалительного процесса или гормонального дисбаланса, могут послужить основой для развития злокачественных опухолей [4, 39]. Вместе с тем общепринятые морфологические методики не всегда позволяют правильно оценить сущность процесса и установить начальные стадии пролиферации. Многие авторы объясняют это большим разнообразием гистологических структур эндометрия.
Поскольку возникновение патологической пролиферации всегда сопровождается перестройкой генетического аппарата, то при начальной малигнизации регистрируются в первую очередь ранние изменения в виде биометрических нарушений ядра [4, 31].
В норме количество делящихся клеток в железах эндометрия фазы пролиферации не превышает 52 на 100 полей зрения [12], или 8,3–12,9 на 1000 клеток [6, 11]. В фазе секреции [33] митотическая активность равна 22, митотический индекс – 0,33 – 3,32.
Обычно в клетках эндометрия из нормальных митозов преобладают профазы, а встречающиеся патологические митозы не превышают 2–5 % от всех делящихся клеток [3,11]. Патология кариокинеза представлена в основном отставанием хромосом и их фрагментов в метакинезе и при расхождении, К-митозами [11].
Накоплен большой фактический материал, позволяющий считать, что малигнизация сопровождается значительными изменениями всего митотического режима ткани [4,41]. Одной из особенностей патологической пролиферации эндометрия является относительное увеличение количества митозов, находящихся на стадии метафазы [11,13,40]. Так, в эндометрии при нормальном менструальном цикле на стадии метафазы находится 28,3 % от всех делящихся клеток, при гиперпластических процессах – 64 %, а при раке эндометрия – 71 %.
Наиболее характерное проявление предраковой пролиферации эндометрия – увеличение количества патологических митозов до 30 – 40 % от всех делящихся клеток [40]. В решении вопроса о выраженности патологической пролиферации большое значение имеет анализ спектра патологии митоза, в частности выявление таких форм патологии, как ацентрические фрагменты в ана- и телофазе, фрагментация и рассеивание хромосом, многополюсные митозы, ведущие к возникновению хромосомных мутаций [3].
Исследование митотического режима слизистой матки при использовании внутриматочных контрацептивов имеет большое значение [25], так как в литературе сообщается о канцерогенной активности ряда пластмасс, металлов и стекла. В свете этих данных анализ митотического режима в тканях, находящихся в контакте с инородным телом, приобретает особое значение. При изучении митотического режима тканей, расположенных на поверхности стеклянных пластинок, введенных в брюшную полость крыс, Л.Л. Гольцман (1975) обнаружил значительное увеличение числа патологических митозов и считает, что вокруг инородного тела создаются условия для возникновения цитогенетических механизмов изменчивости клеток.
В литературе сообщения о влиянии внутриматочных средств (ВМС) на митотический режим эндометрия единичны. Так, исследуя митотический режим клеток желез и стромы эндометрия после 1 года ношения ВМС, Л.С. Ежова и соавт. [6] отметили статистически достоверное (р 0,05; в среднюю стадию секреции соответственно 16,3±0,5 и 17,11±0,3 %, р>0,05) и увеличение числа клеток с диплоидным набором ДНК (в среднюю стадию пролиферации 88,2±0,1 % против 82,4±1,02 % в контроле, р>0,05; в среднюю стадию секреции соответственно 83,6±1,8 и 82,9±1,3 %, р>0,05), причем по мере увеличения срока ношения ВМС это перераспределение клеток несколько возрастало.
В других наблюдениях при использовании ВМС ИН ДНК в железистом эпителии эндометрия изменялся незначительно [22,24]. Лишь в группе женщин, пользовавшихся ВМС в течение 1 года, была отмечена тенденция к снижению содержания ДНК (в среднюю стадию пролиферации ИН ДНК был равен 2,61±0,04 против 2,72±0,03 в контроле, р>0,05; в среднюю стадию секреции соответственно 2,53±0,05 н 2,6±0,02, р>0,05), что, возможно, является признаком адаптации организма к внутриматочному контрацептиву и обусловлено нарушением утилизации стероидных гормонов в клеточных элементах органов-мишеней. В случаях более длительного ношении ВМС определялось нормальное содержание ДНК (ИН ДНК колебался от 2,69±0,04 до 2,79±0,06 в среднюю стадию пролиферации и от 2,58±0,01 до 2,64±0,03 в среднюю стадию секреции). Некоторые изменения были обнаружены в распределении ядер железистых клеток эндометрия по плоидности на фоне внутриматочной контрацепции. Так, у женщин, использующих внутриматочные контрацептивы продолжительное время (более 5 – 7 лет), отмечена тенденция к уменьшению количества клеток с промежуточным содержанием ДНК (17,2±2,9 % против 25,2±2,8 % в контроле, р>0,05) и увеличению с тетраплоидным набором ДНК (21,0±2,5 % против 13,1±2,1 % в контроле, р>0,05) в пролиферативную стадию цикла. Независимо от длительности использования ВМС в среднюю стадию пролиферации определялось незначительное число клеток (1,5 – 3,6 %) с гиподиплоидным содержанием ДНК, что, по-видимому, обусловлено деструкцией части клеток эндометрия и деградацией в них ДНК под воздействием инородного тела (внутриматочного контрацептива).
Было проведено изучение содержания полового хроматина в эпителии желез эндометрия при использовании ВМС [18,21,23]. Среднее количество хроматинположительных ядер в нормальном пролиферирующем эндометрии контрольной группы женщин составляло 35,9±2,1 %, в секреторно преобразованном – 41,1±1,6 %. При применении ВМС содержание полового хроматина не претерпевало выраженных изменений (от 32,7±1,5 до 36,4±2,1 % в среднюю стадию пролиферации и от 34,5±1,1 до 43,9±2,0 % в среднюю стадию секреции), характерных для пролиферативных процессов слизистой матки, но наблюдалось повышение содержания полового хроматина (49,3±1,1 % в среднюю стадию пролиферация. р