Молекула воды что это
Молекула воды
Все живые организмы на планете Земля состоят из воды. Эта жидкость встречается везде и без нее жизнь невозможна. Большая ценность воды обусловлена уникальными свойствами жидкости и простым составом. Чтобы разобраться во всех особенностях, рекомендуется детально ознакомиться со структурой молекулы воды.
Модель строения воды
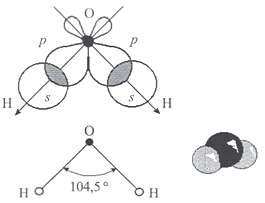
Молекула воды включает два атома водорода (Н) и один атом кислорода (О). Элементы, из которых состоит жидкость, определяют всю функциональность и особенности. Модель молекулы воды имеет форму треугольника. Вершину этой геометрической фигуры представляет крупный элемент кислорода, а внизу находятся небольшие атомы водорода.
Молекула воды обладает двумя положительными и двумя отрицательными полюсами зарядов. Отрицательные заряды формируются из-за излишка электронной плотности у атомов кислорода, а положительные – из-за нехватки электронной плотности у водорода.
Неравномерное распределение электрических зарядов создает диполе, где диполярный момент составляет 1,87 дебай. Вода обладает способностью растворять вещества, поскольку ее молекулы пытаются нейтрализовать электрическое поле. Диполя приводят к тому, что на поверхности погруженных в жидкость веществ становятся слабее межатомные и межмолекулярные связи.
Вода отличает большой устойчивостью при растворении прочих соединений. В обычных условиях из 1 млрд молекул только 2 распадаются, а протон переходит в строение иона гидроксония (образуется при растворении кислот).
Вода не меняет свой состав при взаимодействии с другими веществами и не влияет на структуру этих соединений. Такая жидкость считается инертным растворителем, что особо важно для живых организмов. Полезные вещества поступают к различным органам через водные растворы, поэтому важно, чтобы их состав и свойства оставались неизменными. Вода сохраняет в себе память о растворенных в ней веществах и может применяться многократно.
Каковы особенности пространственной организации молекулы воды:
Атомы водорода соединяются с атомами кислорода и образуют молекулу воды с ковалентной связью. Водородные соединения более сильные, поэтому, когда они разрываются, то молекулы присоединяются к другим веществам, способствуя их растворению.
Это свойство подтверждается и большой теплотой парообразования, что делает жидкость хорошим энергоносителем. Вода – отличный регулятор температуры, способен нормализировать резкие перепады этого показателя. Теплоемкость жидкости повышается, когда ее температура 37 градусов. Минимальные показатели соответствуют температуре человеческого тела.
Относительная молекулярная масса воды составляет 18. Рассчитать этот показатель достаточно легко. Следует заранее ознакомиться с атомной массой кислорода и водорода, которая равна 16 и 1 соответственно. В химических задачах нередко встречается массовая доля воды. Этот показатель измеряется в проценте и зависит от формулы, которую требуется рассчитать.
Строение молекулы в различных агрегатных состояниях воды
В жидком состоянии молекула воды состоит из моногидроля, дигидроля и тригидроля. Количество этих элементов зависит от агрегатного состояния жидкости. Пар включает одну H₂O – гидроль (моногидроль). Две H₂O обозначают жидкое состояние – дигидроль. Три H₂O включает лед.
Агрегатные состояния воды:
При этом существуют переходные состояния жидкости, например, при испарении или замерзании. Для начала требуется разобраться, отличаются ли молекулы воды от молекул льда. Так замерзшая жидкость имеет кристаллическую структуру. Модель льда может иметь форму тетраэдр, тригональной и моноклинной сингонии, куба.
Обычная и замерзшая вода отличаются плотностью. Кристаллическая структура приводит к меньшей плотности и увеличению объема. Основное различие между жидким и твердым состоянием – это количество, сила и разновидность водородных связей.
Состав не меняется ни в одном агрегатном состоянии. Отличается строение и движение составных частей жидкости, сила связей водорода. Обычно молекулы воды слабо притягиваются друг к другу, размещаются хаотично, поэтому жидкость такая текучая. Лед отличается более сильным притяжением, так как создается плотная кристаллическая решетка.
Многих интересует, одинаковы ли объемы и состав молекул холодной и горячей воды. Важно запомнить, что состав жидкости не меняется ни в одном из агрегатных состояний. Молекулы при нагревании или остывании жидкости отличаются расположением. В холодной и горячей воде разные объемы, так как в первом случае структура упорядоченная, а во втором – хаотичная.
Когда лед тает, то его температура не меняется. Только после того, как жидкость меняется свое агрегатное состояние, показатели начинают подниматься. Для таяния требуется определенное количество энергии, которое называется удельной теплотой плавления или лямбда воды. Для льда показатель равен 25000 Дж/кг.
Что такое вода: агрегатные состояния, роль на Земле
Вода — самая удивительная и загадочная из всех жидкостей, существующих на Земле.
Учёные на протяжении многих столетий продолжают проводить исследования, находя новые интересные факты. Каждый человек знает, что без воды жизнь невозможна.
Вода участвует в формировании климата, для многих живых организмов является средой обитания. Её важность сложно недооценить. Не случайно, нашу планету называют голубой, именно вода покрывает 71 % поверхности земного шара.
В статье мы собрали самую важную и интересную информацию про воду: гипотезы её появления на нашей планете, особенности строения молекулы, агрегатные состояния, уникальные и необычные свойства.
Что такое вода, химические названия
Вода — это бинарное неорганическое соединение, химическая формула H2O.
При нормальных условиях представляет собой прозрачную, бесцветную жидкость, которая не имеет вкуса и запаха, текуча (принимает форму сосуда).
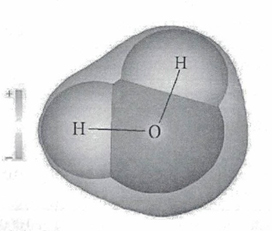
Молекула воды состоит из одного атома кислорода и двух атомов водорода, которые соединены между собой ковалентной связью. Никакие другие элементы таблицы Менделеева при соединении не образуют жидкости. Рассмотрим строение молекулы H2O на изображении.
Вода имеет несколько химических названий:
Агрегатные состояния
Из всех веществ, существующих на Земле, только вода может иметь три принципиально разных агрегатных состояния: жидкое, газообразное и твердое. Благодаря трём агрегатным состояниям происходит круговорот воды в природе и жизнь на Земле. Рассмотрим подробнее каждое агрегатное состояние.
Строение в различных агрегатных состояниях
Жидкая вода, лёд и водяной пар имеют один и тот же состав, но разные состояния.
Рассмотрим строение молекулы на изображении.
Многочисленные исследования ученых подтверждают, что по структуре вода и лед близки друг к другу. Структура льда – это решетчатый каркас. Структура воды зависит от содержания разных веществ, которые в ней растворяются, а также от нерастворимых соединений и некоторых других факторов.
В воде возникают структуры, которые стали называть «кластерами» — группа атомов или молекул, которые представляют собой единую структуру, но внутри имеют свои индивидуальные особенности.
При температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах. При температуре близкой к точке кипения они располагаются более свободно.
Свойства
Вода — уникальный природный компонент, который обладает рядом свойств. Рассмотрим основные:
Существуют необычные свойства. Например, в твердом виде вода легче, чем в жидком. Лёд не тонет в воде. В твёрдом состоянии частички воды располагаются по порядку, между ними остается много свободного пространства. Когда лёд тает, активность частичек повышается, свободное пространство заполняется. Жидкая форма становится более тяжелой, нежели твердая.
Такая уникальная способность даёт возможность любому водоёму не замерзать по всей глубине. Даже при самом сильном морозе температура воды у дна не опускается ниже +4 ᵒС. Все живые существа (рыбы и другие) могут спокойно пережить самую суровую зиму подо льдом.
Когда лёд тает, плотность увеличивается, и становится максимальной при температуре +4 ᵒС. В диапазоне от +4 ᵒС до +40 ᵒС плотность снижается, потом снова увеличивается. При понижении температуры ниже +4 ᵒС плотность уменьшается, т.е. при замерзании вода расширяется.
Горячая вода замерзает быстрее, чем холодная. Это связано с большей скоростью испарения и излучения тепла.
Теплоемкость и некоторые другие физические свойства воды тоже зависят от температуры неодинаково. Другие виды жидкостей не имеют таких особенностей – чтобы какой-то один параметр менялся по-разному на разных порогах температуры.
Круговорот воды в природе
Вода образует водную оболочку нашей планеты – гидросферу.
Её делят на Мировой океан, континентальные поверхностные воды и ледники, а также подземные водоёмы. Переходы H2O из одних частей гидросферы в другие составляют сложный круговорот воды на Земле
Круговорот воды в природе — это непрерывное движение воды в гидросфере Земли. В процессе этого обмена водная масса меняет агрегатное состояние: из жидкой или твердой превращается в газообразную и обратно.
Рассмотрим на примере.
Происхождение воды на планете
Возникновение воды на нашей планете является предметом научных споров. Существует 2 основные гипотезы:
Наука о воде
Изучением природных вод, явлений и процессов занимается наука Гидрология.
Первые упоминания о гидрологии появились на заре истории человечества около 6000 лет назад.
Начало гидрологических наблюдений в России относится к XV–XVI вв.: в записях русских летописцев сохранились сведения о свойствах воды, наводнениях, паводках, замерзании.
Значение на Земле
Каждая клетка живого организма состоит из жидкости и нуждается в регулярном пополнении. Без воды не проживут ни люди, ни растения, ни животные.
Вода формирует климат, участвует в круговороте воды в природе, для многих живых организмов является средой обитания.
Применение
Все люди на планете прекрасно знают, что жизнь без воды невозможна. Любое начало жизни изначально зарождается в воде.
Человек применяет воду:
Сколько жидкости в теле человека
Эмбрион человека состоит из жидкости не менее, чем на 97%. Когда ребенок рождается, вода составляет около 80% его тела. В первые несколько суток после рождения этот показатель существенно снижается.
В дальнейшем содержание воды в организме человека постоянно уменьшается. В пожилом возрасте в теле человека доля воды не превышает 50-60%.
Как определить, сколько воды в теле человека?
Массу тела необходимо разделить на 3 и умножить на 2.
Стоит отметить, что расчет считается приблизительным (может отличаться на 5-10%) Так как количество воды зависит от возраста, пола, физической активности, состояния здоровья.
Основные функции
Вода необходима каждому живому существу. Каждый живой организм состоит из клеток. Ключевую роль выполняет вода. Она составляет около 70 процентов от её массы. Рассмотрим кратко основные функции.
Польза чистой питьевой воды
Врачи, диетологи и другие специалисты часто совершают ошибку, когда слишком много внимания уделяют разным продуктам питания и забывают про воду. Любые вещества, даже самые питательные и полезные, могут оказаться совершенно неэффективными, если нет растворителя, способного доставить их в нужные части тела. На Земле есть только один простой, надежный и распространенный растворитель – вода.
Вода участвует абсолютно во всех обменных процессах. И чтобы они протекали нормально, необходимо пить достаточное количество чистой воды. Именно воды, не чая, не напитков. Содержание разных примесей, консервантов и прочих веществ существенно меняют структуру, нормальное молекулярное состояние воды.
Изначально природой заложено употреблять чистую воду. Когда в организм вносится некая смесь, то пищеварительной системе приходится прикладывать много усилий, растрачивать много энергии, чтобы отделить все лишнее и получить воду. Кроме этого, высокое содержание сахара неизбежно провоцирует нарушение нормального обмена веществ.
Питьевая вода должна быть чистая, свежая, качественная, «живая». Т.е. это должна быть натуральная природная вода, которая при попадании в организм легко проникает во все клетки, служит эффективным растворителем. Она быстро доставляет все питательные вещества к тканям и органам.
Сколько нужно пить воды в день
Рекомендуется употреблять чистую воду без примесей 30-40 мл на 1 кг веса.
для женщины: 1,5 – 2 литра ежедневно;
для мужчины: 2,5 – 5 литров ежедневно.
Количество рекомендуемой нормы зависит от физической активности, климата и веса.
Процентное содержание в органах
Вода в теле человека находится в разных субстанциях и никогда не смешивается в единое целое.
Жидкости больше в тех клетках, в которых обмен веществ протекает более интенсивно. Рассмотрим таблицу № 1.
Таблица № 1. Процент содержания в органах человека
| Органы | Процент содержания |
| Мозг | 90 |
| Лёгкие | 86 |
| Печень | 86 |
| Кровь | 83 |
| Яйцеклетки | 90 |
| Кости | 72 |
| Кожа | 72 |
| Сердце | 75 |
| Желудок | 75 |
| Селезёнка | 77 |
| Почки | 83 |
| Мышцы | 75 |
Признаки обезвоживания
Если содержание воды резко меняется в одну или другую сторону, то это сразу сказывается на общем состоянии здоровья. Чрезмерное количество воды организм переносит намного легче, чем ее нехватку. Рассмотрим основные симптомы проявления нехватки воды в организме человека.
При длительном сохранении такого состояния могут возникнуть проблемы:
Проходя гидрологический цикл, вода может дополняться химическими элементами: ионами, растворенными газами, микроэлементами и т.д.
Воду квалифицируют по следующим признакам:
Рассмотрим некоторые виды на рисунке.
Запасы пресной воды
Несмотря на то, что Земля более, чем на 70% покрыта водой, лишь 1% является пресной (её солёность не превышает 0,5 ‰).
Более 2/3 запасов пресной воды на Земле хранится в ледниках. Крупнейшим водоёмом пресной воды считается озеро Байкал в России.
Показатели качества
В воде, которая течет из кранов современных городских квартир, могут содержаться вредные примеси. Такую воду стали называть словом «техногенная». В ней содержатся металлы, песок, глина, хлор и много чего еще.
Современные нормы очистки водопроводной питьевой воды предполагают использование хлорсодержащих реагентов, которые избавляют воду от инфекций. В дополнение рекомендуется использовать дополнительные методы очистки. Например, фильтры.
Большой популярностью в развитых странах пользуется бутилированная питьевая вода. Она является экологически чистым продуктом. Реализуется в гигиенически чистой ёмкости и соответствует всем установленным требованиям.
25 интересных фактов
Ученые постоянно исследуют оксид водорода, находя интересные факты.
Заключение
Вода – удивительное вещество, обладающее химическими и физическими свойствами. Она формирует климат на планете, для многих живых организмов является средой обитания, необходима для фотосинтеза растений и жизнедеятельности всех живых организмов.
Вода | Строение молекулы и структура воды в жидком, твердом и газообразном виде.
Содержание:
1. Современные представления о составе и структуре воды. Строение молекулы воды. Легкая и тяжелая вода.
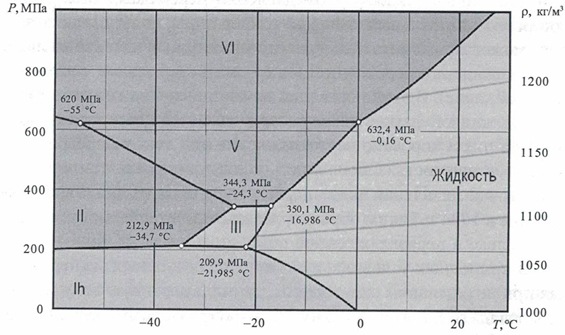
В «тройной» точке на диаграмме может одновременно существовать вода во всех трех агрегатных состояниях.
В «критической» точке все свойства жидкости и пара (энергия, плотность, структура, характер движения частиц и т.п.) становятся равны. При более высоком давлении и/или температуре агрегатное состояние воды называют «сверхкритическим».
В стабильном энергетическом состоянии молекула воды имеет тетраэдрическую пространственную структуру. При изменении агрегатного состояния воды длина сторон и угол между ними меняются. Если бы мы увидели молекулу воды, то обнаружили, что она имеет сфероидальную форму с двумя выпуклостями (рисунок 3).
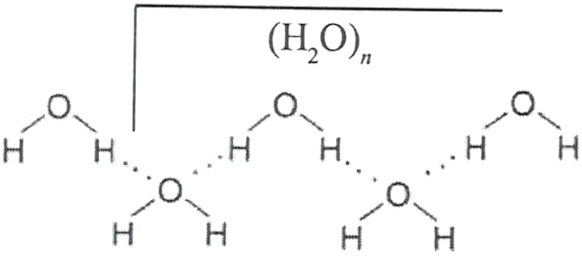
Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар обуславливает возникновение водородных связей, что способствует ассоциации молекул воды в группы.
Обладая значительным дипольным моментом, молекулы воды также сильно взаимодействуют с полярными молекулами других веществ.
Идеально чистую воду практически невозможно получить. По факту, мы всегда будем иметь дело хоть и с очень разбавленными, но растворами.
В природе на 1 000 000 молекул воды в среднем приходится:
— 997 284 молекул легкой воды 1 H2 16 O;
— 311 молекул 1 HD 16 O;
— 390 молекул 1 H2 17 O;
— 2005 молекул 1 H2 18 O.
Если из глубинной океанической воды, отвечающей стандарту SMOW (Standard Mean Ocean Water) удалить все тяжелые изотопы и заменить их на 1 H2 16 O, то масса 1 л такой воды станет меньше на 250 мг, т.е. на четверть.
2. Структура воды. Водородные связи.
В ходе современных физико-химических исследований были выявлены характерные структурные агрегаты воды, формирующиеся с помощью водородных связей.
Для формирования трехмерных структур необходимо, кроме способности молекул создавать водородные связи, выполнение еще двух условий. Этих связей должно быть не менее четырех на одну молекулу и геометрические размеры молекулы не должны противоречить оптимальным направлениям водородных связей. Вода удовлетворяет этим требованиям. Так, нагревая лед мы получаем смесь жидкой воды и кристаллов льда, температура которой останется неизменной до тех пор, пока все кристаллики не расплавятся. Это говорит о том, что подводимое нами тепло будет расходоваться в первую очередь на разрушение водородных связей льда.
3. Структура воды в жидком виде.
Жидкость, как известно, отличается от других агрегатных состояний вещества своей текучестью, т.е. способностью неограниченно менять форму под действием касательных механических напряжений, сохраняя при этом объем. Жидкость способна течь даже под свей неподвижной поверхностью. Молекулы жидкости не имеют своего строго определенного места, но, все же, им недоступна полная свобода перемещения, как в паре.
Структура жидкости есть статистическая закономерность межмолекулярных расстояний и ориентаций, характерных для плотно упакованных систем.
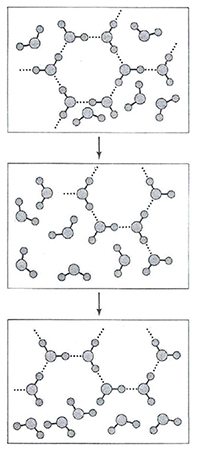
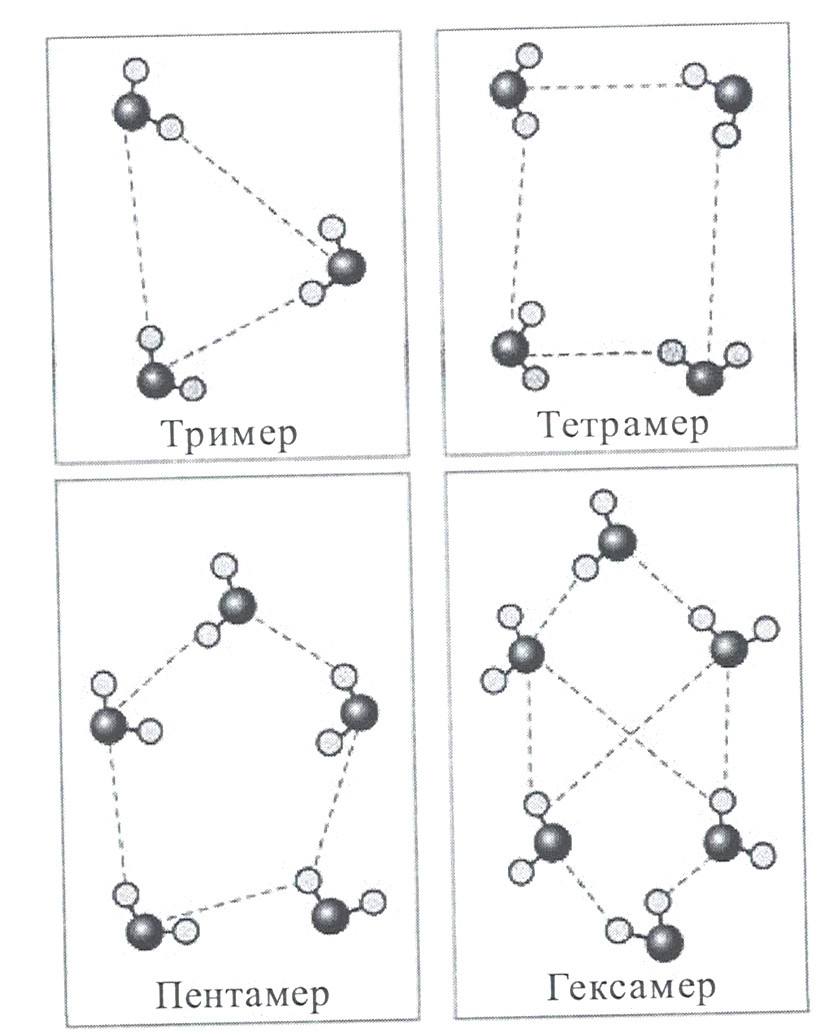
Согласно одной из первых моделей воды Бернала и Фаулера, основанной на рентгеноструктурном анализе, существует три формы расположения молекул в жидкой воде:
В 1951 г. Дж. Попл предложил модель воды в виде непрерывной сетки (рисунок 5), отличной от модели Бернала и Фаулера. Отличия заключались в том, что сетка была случайной, связи в ней искривлены и имеют различную длину.
Попл объяснял уплотнение воды при плавлении искривлением связей. Однако, данная модель не могла объяснить нелинейность зависимости свойств воды от температуры и давления.
Почти одновременно с идеей Попла возникли кластерные и клатратные модели, которые можно обозначить как «смешанные».
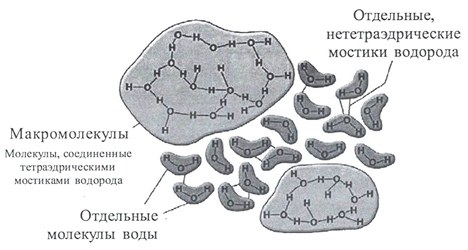
Кластерная модель представляла жидкую воду как кластеры из молекул, связанных водородными связями, плавающих в объеме свободных молекул. В группе кластерных моделей выделяется теория Г.Немети и Х.Шераги (рисунок 6). Отметим, что в данной модели разрушение одной водородной связи приводит к разрушению всего кластера. Разрушение и образование кластеров происходит постоянно.
Кластерная модель не говорит о расположении молекул в гроздьях, но авторы предполагают наличие отдельных «роев». При этом постулируется тот факт, что большинство молекул должно быть тетракоординировано. Состояние молекул будет определяться количеством водородных связей, которые она образует (0-5).
Удар по кластерной теории наносят исследования Г.Стэнли на основе теории перколяции (протекания). Г.Стэнли доказывает невозможность существования в воде изолированных кластеров.
Клатратная модель говорила о воде как о непрерывной сетке-каркасе связанных молекул, внутри которого содержались пустоты со свободными молекулами.
Первую модель клатратного типа предложил О.Я.Самойлов в 1946 году. В ее основе лежало представление о жидкой воде как о испорченной, размытой структуре льда Ih с частичным заполнением полостей мономерами. В процессе движения молекул решетка постоянно перестраивается. Настройкой свойств и концентраций микрофаз, а также параметрами пустот легко можно было объяснить все закономерности свойств воды.
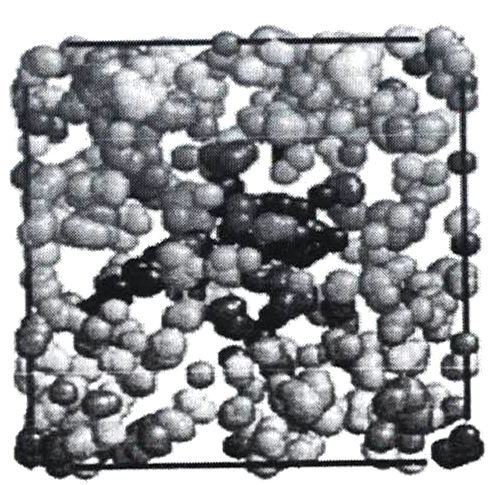
Пустоты в воде по результатам моделирования имеют тенденцию объединяться друг с другом, образуя еще более крупные пустоты, как показано на рисунке 7.
Рассмотрим кластерную и клатратную модели строения жидкой воды подробнее.
3.1 Кластерная модель строения жидкой воды.
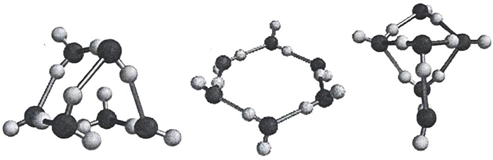
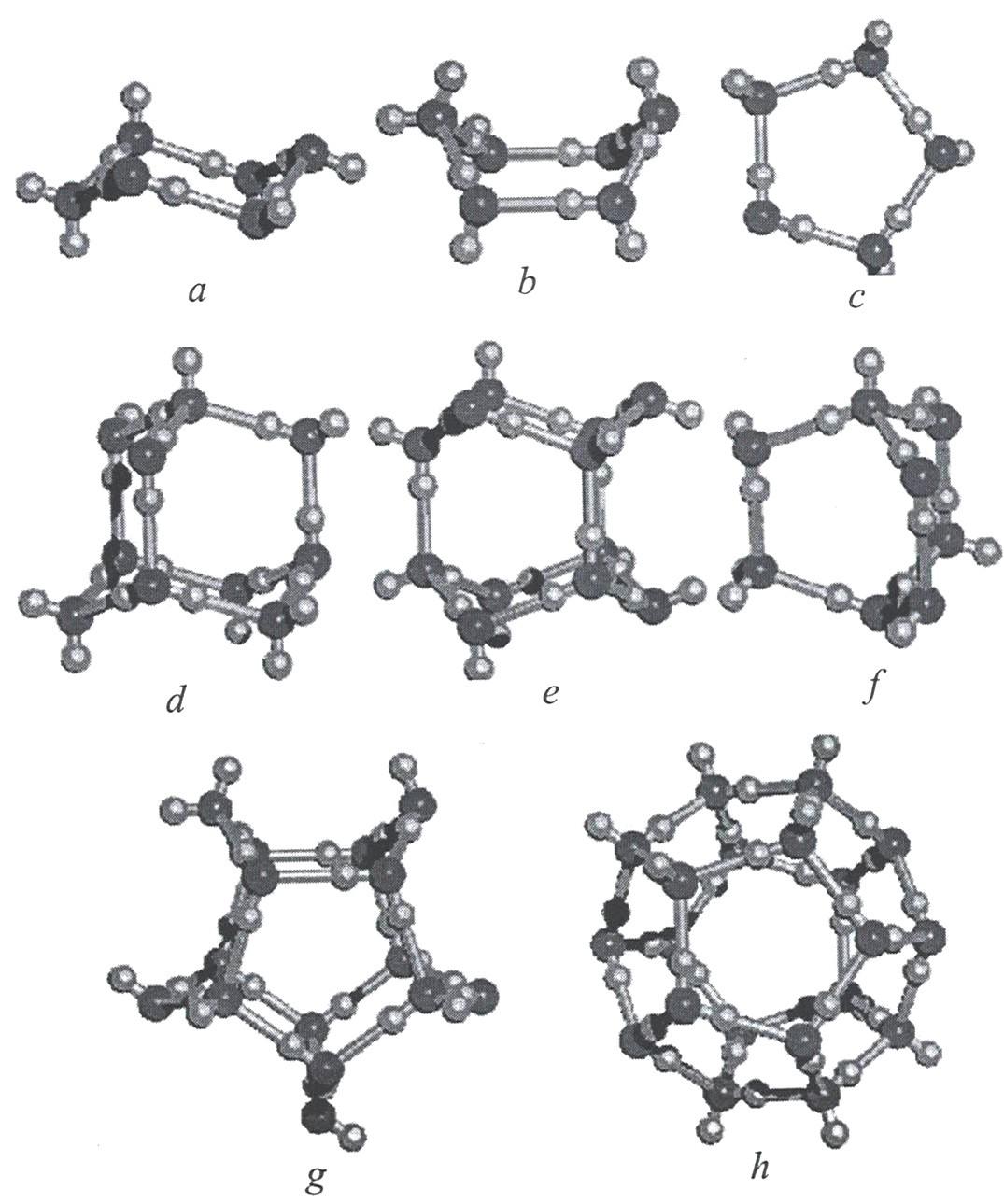
Согласно квантово-химическим расчетам большей устойчивостью обладают линейного «открытого» димера воды, по сравнению с циклическими формами. В случае цикла выгодными являются трех-четырех- и пятичленные образования, в которых водородные связи имеют одинаковое направление. Для шестичленного цикла выгодным становится структура типа «кресло».
Одно из первых изображений формирования циклических кластеров воды приведено на рисунке 9.
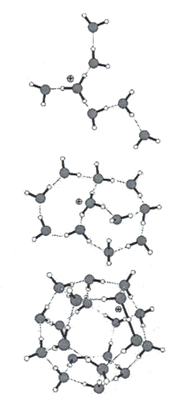
Большой вклад в возможность формирования и устойчивость кластеров воды во времени внесли работы Г.А.Домрачева и Д.А. Селивановского. Они доказывали существование механохимических реакций радикальной диссоциации воды. Доказательство основывалось на том, что вода, по их мнению, представляет собой динамически нестабильную полимероподобную систему и по аналогии с механохимическими реакциями в полимерах при механическом воздействии на воду поглощенная водой энергия используется для разрыва химических связей H-OH. Реакция разрыва связи может выглядеть так:
Рассчитав эффективность механодиссоциации воды, авторы пришли к выводу, что кислород на Земле появился при диссоциации воды.
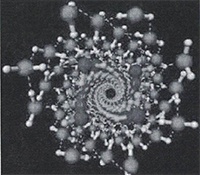
В 1993 г. К.Джордан предложил свои варианты устойчивых «ассоциатов воды», которые состоят из 6 молекул (рисунок 10).
По Джордану кластеры могут объединяться и друг с другом, и со свободными молекулами воды за счет водородных связей, формируя более крупные ассоциаты. Такие кластеры могут объединяться как друг с другом, так и со свободными молекулами воды.
Квантово-химические расчеты нанокластеров с общей формулой (H2O)n с n=6-20 показали, что самые устойчивые структуры образуются посредством взаимодействия тетрамерных и пентамерных кольцевых структур (рисунок 11). На рисунке ниже показаны возможные структуры конформации кластеров воды.
Оригинальной кластерной моделью является теория С.В.Зенина. Согласно модели С.В.Зенина вода представляет собой иерархию геометрически правильных объемных структур «ассоциато». Согласно его теории элементарной структурной ячейкой воды являются тетраэдры, в которых может содержаться 4 (простой тетраэдр) или 5 (объемно-центрированный тетраэдр) молекул воды. При этом у каждой молекулы воды в простых тетраэдрах сохраняется способность образовывать водородные связи, благодаря чему создаются более сложные структуры, как показано на рисунке 13.
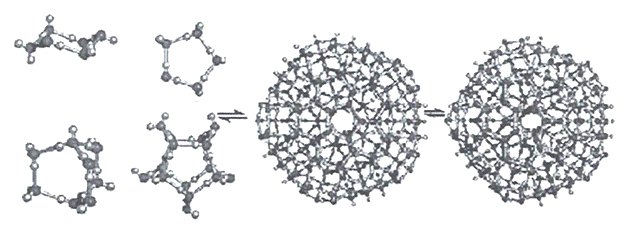
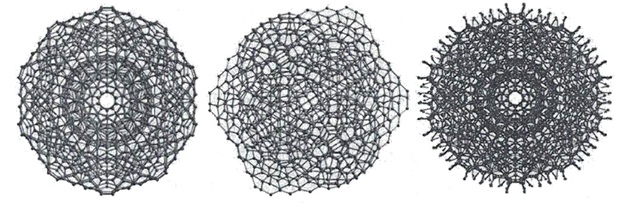
Кластеры, содержащие 20 молекул воды (додэкаэдры) более стабильны. Схема их образования показана на рисунке 14.
Из 57 молекул такого образования 17 составляют гидрофобный каркас с полностью насыщенными связями, а по 10 молекул на поверхности каждого додекаэдра формируют центры образования водородных связей.
Методами жидкостной хроматографии было подтверждено существование пяти- и шестиквантовых структур типа «четырехконечной звезды» и «шестилучевой снежинки».
На уровне 24 центров связывание по водородным связям практически прекращается ввиду того, что поверхность образований становится насыщенной (нейтральной).
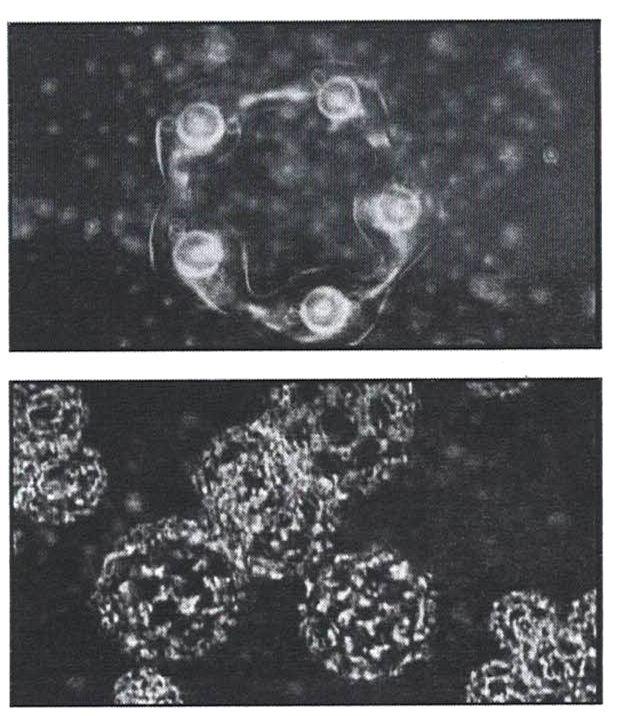
Кластеры почти не взаимодействуют между собой, а скользят друг по другу, поэтому вода не отличается высокой вязкостью. В таком «режиме» из кластеров формируются метастабильные структуры, пример которых показан на рисунке 17 (микроизображение в режиме фазового контраста).
Теория Зенина хорошо объясняет электропроводные свойства воды, уменьшение плотности при плавлении, но плохо согласуется с большими значениями коэффициента самодиффузии и малым временем диэлектрической релаксации.
Однако практически существование регулярных матриц в воде маловероятно. Кластеры из 280 молекул также могут формировать цепочки, но с более напряженными водородными связями.
Кластеры могут разрастаться в суперкластеры (гигантские икосаэдры), примеры которых приведены на рисунке 19.
В 2002 Беркли методом рентгеноструктурного анализа показала, что молекулы воды действительно способны образовывать структуры, представляющие собой топологические цепочки и кольца из множества молекул.
А.Н.Смирновым в бидистиллированной воде и некоторых растворах методами акустической эмиссии, лазерной интерферометрии и термического анализа удалось визуализировать надмолекулярные образования с размерами частиц от 1 до 100 мкм, распределенных в водной среде (рисунок 20). Свойства таких частиц были сходны со свойствами частиц, образующих эмульсию, поэтому они были названы «эмулонами».
Размеры и пространственная организация эмулонов зависят от состава водного раствора, температуры и предыстории раствора. Наибольшее число фракций имеют размеры 30, 70 и 100 мкм.
Температурная динамика структуры эмулонов имеет следующие отсечки:
3.2 Клатратная модель строения жидкой воды.
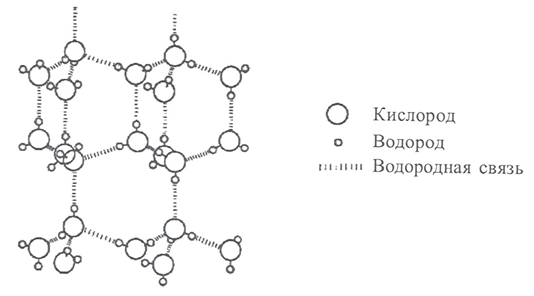
Клатраты в целом (не только вода) делятся на два класса, зависящие от соединения-хозяина. Молекулярные клатраты образуются «хозяевами», имеющими внутримолекуярные полости. Такие клатраты могут существовать как в растворе, так и в кристаллическом состоянии. Если «хозяин» способен образовывать только межмолекулярные или кристаллические полости, то из него получаются решетчатые клатраты (рисунок 21), устойчивые лишь в твердом состоянии.
В поздних модификациях клатратной модели воды допускается образование водородных связей между молекулами в каркасе и молекулами в пустотах. При этом сами молекулы в обеих микрофазах соединены водородными связями.
В заключение отметим, что существует целый ряд воздействий, которые могут приводить к определенному структурированию воды:
Более подробно структурирование воды под воздействием внешних сил будет рассмотрено в отдельной статье.
4. Особенности строения воды в твердом виде. Лед.
• Всего насчитывается около 15 структурных модификаций льда (рисунок 22).
1922 г. У.Г.Брэгг в статье «Кристаллическая структура льда» пытается выяснить причины возможных ошибок при расшифровке положений ядер кислорода. Он убежден, что ни Джон, ни Деннисон не смогли найти истинного расположения ядер кислорода в структуре льда. Брэгг сделал важное замечание: каждый атом кислорода в структуре льда должен быть окружен четырьмя другими. Атом же водорода располагается между двумя кислородами как бусинки на нитке. При этом, что важно, бусинки сдвинуты, смещены, относительно центра льда. Т.е. ядра водорода расположены асимметрично.
Кристаллическая решетка льда называется ажурной (рисунок 23). Паутина связей между молекулами воды во льду содержит много крупных пустот, больших по размеру, чем сами молекулы. Именно поэтому лед более легкий, чем жидкая вода. При плавлении льда водородные связи начинают разрушаться и в пустотах оставшихся ассоциатов поместиться освободившиеся молекулы воды.
• При давлении в 2 ГПа можно получить лед со структурой VI (горячий лед), который не будет плавиться даже при 80 о С.
• При очень высоких давлениях внутри нанотрубок с диаметром от 1,35 до 1,90 нм вода может кристаллизоваться в форме двойных спиралей (рисунок 24).
• Современные представления о структуре льда говорят о наличии кластерного строения. Чем ниже температура, тем крупнее кластеры. Наиболее устойчивы кластеры из 8, 12, 24, 36 молекул.
5. Особенности строения воды в газообразном виде. Пар.
В паре водородные связи на 99% разорваны. При этом в нем сохраняется до 1% димеров. Полностью разорвать все связи в паре можно лишь при температура 600 о С.
Расстояние между молекулами во много раз больше самих молекул. При этом сами молекулы хаотично двигаются, сталкиваются со стенками сосуда, в котором заключены, и между собой. Скорость их тем выше, чем выше температура системы.
Вода может длительное время находиться и в перегретом состоянии до 200 о С. При введении пузырька воздуха в такую перегретую воду она мгновенно вскипает и ее температура падает до 100 о С.